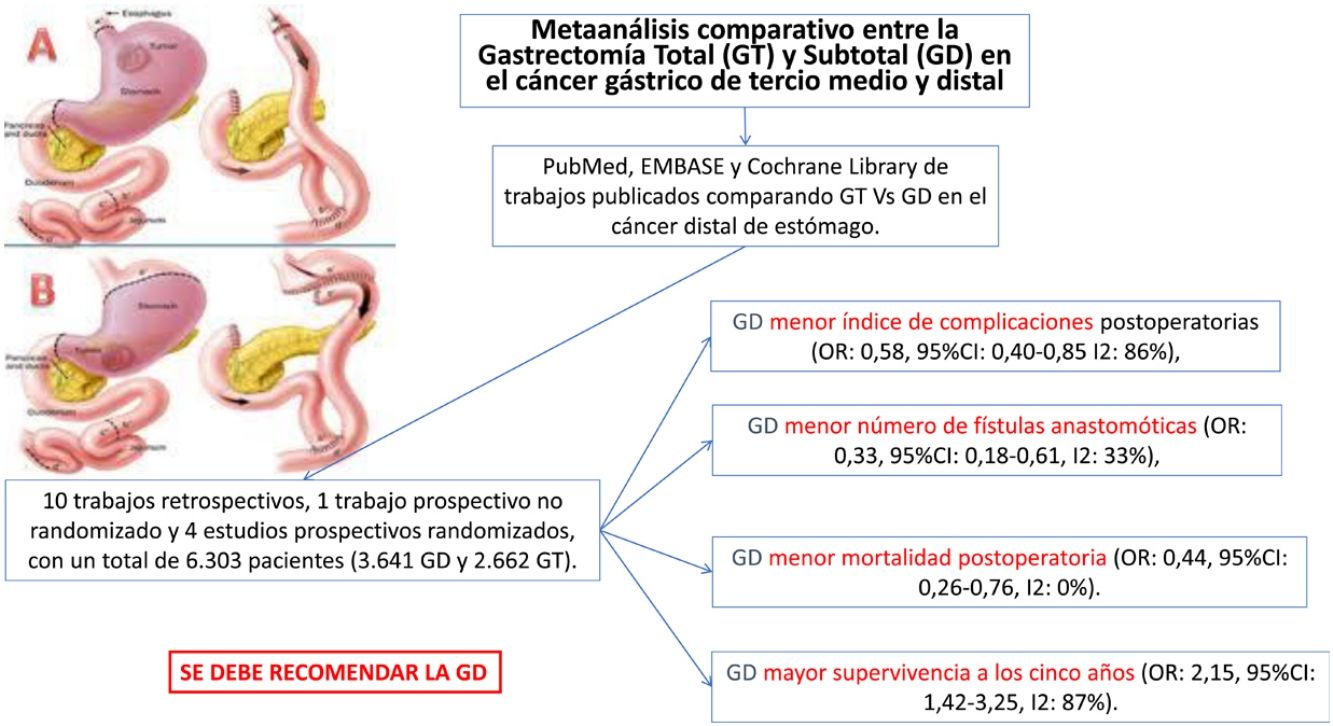
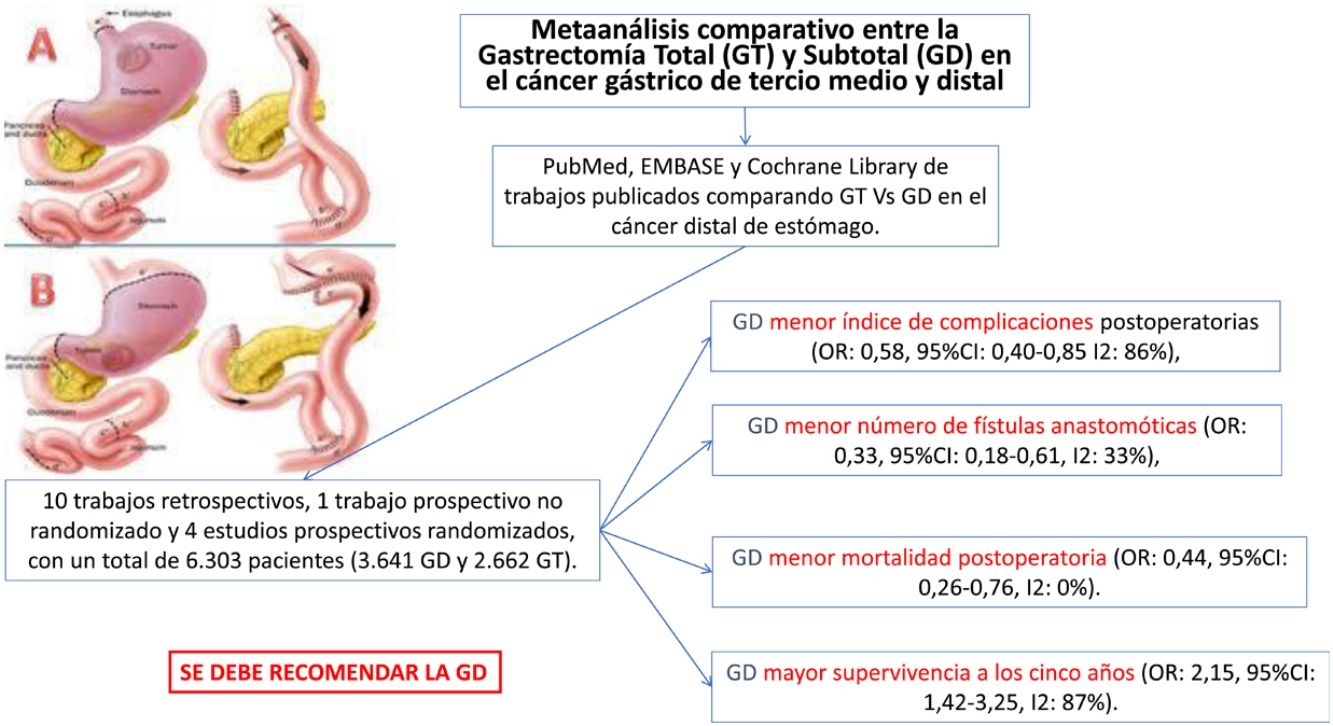
El tipo de gastrectomía, total (GT) o distal (GD), en el cáncer gástrico medio o distal no está claramente consensuada, sobre todo cuando es indiferenciado o difuso de Lauren. Pretendemos en este metaanálisis definir en términos de supervivencia y morbimortalidad cuál de las 2técnicas debiera ser recomendada. Se han incluido trabajos prospectivos y retrospectivos que comparen ambas técnicas hasta un total de 6.303 pacientes (3.641 GD y 2.662 GT). La GD se asoció de forma significativa con menos complicaciones, menos fístulas anastomóticas y menos mortalidad peroperatoria. El número de ganglios en la GD fue significativamente menor, pero siempre por encima de 15. Por último, la supervivencia a 5años de la GD fue también superior. Por tanto, la GD, siempre que se obtenga un margen de seguridad e independientemente del tipo histológico, debe efectuarse en la cirugía de cáncer distal de estómago.
There is no clear agreement on the type of gastrectomy to be used (either total [TG] or distal [DG]) in middle or distal gastric cancer, especially when it is undifferentiated or Lauren diffuse type. In this meta-analysis, we intend to define which of the 2techniques should be recommended, based on survival, morbidity and mortality rates. Prospective and retrospective studies comparing both techniques have been included for a total of 6303 patients (3,641 DG and 2,662 TG). DG was significantly associated with fewer complications, fewer anastomotic fistulae, and less perioperative mortality. The number of lymph nodes in DG was significantly lower, but always above 15. Finally, even the 5-year survival of DG was also higher. Therefore, DG, as long as a safety margin is obtained and regardless of the histological type, should be performed in surgery for distal stomach cancer.
El cáncer de estómago es el quinto en frecuencia. A lo largo del 2018 se diagnosticaron más de un millón de casos en todo el mundo. Tiene un pronóstico incierto; de hecho, de los casi 10 millones de muertes relacionadas con el cáncer en el mundo, 782.685 (8,2%) fueron secundarias a uno de estómago1,2.
La cirugía es un pilar esencial en el tratamiento multidisciplinario de esta enfermedad. A pesar de haber transcurrido más de un siglo desde que Billroth y Schlatter realizaran, respectivamente, la primera gastrectomía subtotal (gastrectomía subtotal distal, en adelante GD) y la primera gastrectomía total (GT) en un cáncer de estómago3,4, la mejor opción quirúrgica en el cáncer de estómago distal y medio no está ampliamente consensuada.
La mejor cirugía en el adenocarcinoma gástrico debiera contemplar la extirpación completa locorregional de la enfermedad con márgenes negativos de resección, pero sin olvidar tampoco cuestiones primordiales como la morbimortalidad de la cirugía y la calidad de vida del paciente operado.
La extensión de la linfadenectomía ha sido en el pasado objeto de debate. En la actualidad, la mayoría de los cirujanos se inclinan hacia una linfadenectomía D2 porque garantiza menor índice de recaída local y por los mejores resultados de supervivencia, y reservan la D1 para pacientes añosos o con comorbilidades debido a la mayor morbimortalidad de la D2. Ahora bien, cuando se trata de un cáncer localizado en el sector medio o distal del estómago, no hay tanto consenso respecto a la extensión de la resección dentro del propio estómago. Algunos autores entienden que la resección debe ser una GT, independientemente de la localización del tumor, más aún cuando estamos ante adenocarcinomas mal diferenciados o adenocarcinomas del tipo difuso, según la clasificación de Lauren, debido a la posibilidad de que existan lesiones neoplásicas o preneoplásicas sincrónicas o metacrónicas en otros puntos de la mucosa gástrica. Por el contrario, otros autores, abundando en la menor morbimortalidad de la GD, preconizan este procedimiento siempre que se pueda garantizar un margen de seguridad mínimo de 3-5cm, con independencia de su diferenciación o del tipo de la clasificación de Lauren.
Esta falta de criterio único es evidente en la literatura científica. El 44% de los cirujanos se decantaban por una GT en un cáncer localizado en el antro e histológicamente definido como difuso siguiendo la clasificación de Lauren, según una revisión que interesaba a 62 hospitales enmarcados en Europa5. En Estados Unidos, casi un 20% de los cirujanos practicarían una GT o casi total en pacientes con cáncer de estómago distal6. Más recientemente, 2estudios que toman como referencia el registro americano de la National Cancer Data Base7,8 arrojan cifras inferiores, próximas al 12%, aunque en proporciones mayores, alrededor del 40%, si en la resección se incluyen órganos distintos al estómago.
Es evidente que en los cánceres distales de estómago la GT sigue siendo un recurso empleado para muchos pacientes, a pesar de que la GD sea más sencilla desde una perspectiva técnica, tenga menos morbimortalidad y, lo que es más importante, sus resultados oncológicos no parezcan ser peores9-14.
El presente metaanálisis pretende analizar los resultados en términos de eficacia en seguridad oncológica y morbimortalidad de la GD frente a la GT en el cáncer medio y distal de estómago. La falta de consenso entre ambas técnicas justifica la necesidad de este estudio.
Material y métodosEstrategia de búsquedaLas bases de datos incluidas para la búsqueda de artículos fueron PubMed, Cochrane y EMBASE, usando como términos de búsqueda «total gastrectomy», «subtotal gastrectomy», «distal gastrectomy», «gastric cancer» y «partial gastrectomy».
Todos los artículos fueron leídos por 2revisores independientes. Ante la falta de acuerdo entre ambos revisores, una tercera persona era consultada antes de rechazar o considerar un artículo para la base de datos.
Criterios de inclusión y objetivos del estudioLos criterios de selección fueron: 1) idioma del artículo inglés, francés o español; 2) estudios que comparen la GT y la GD en el cáncer medio y distal del estómago llevadas a cabo con fines curativos y no paliativos y 3) estudios de naturaleza retrospectiva y prospectiva.
Los objetivos primarios de nuestro metaanálisis fueron: supervivencia a los 5años y mortalidad peroperatoria. Los objetivos secundarios fueron: ganglios linfáticos obtenidos, complicaciones postoperatorias (abscesos intraabdominales, íleo paralítico, hemorragia postoperatoria) y fístula anastomótica.
Extracción de datosLa extracción de datos y su posterior valoración las llevaron a cabo 2investigadores independientes. De cada estudio se incluyeron las siguientes variables: nombre de los autores, año de publicación, tipo de estudio. De cada uno de los grupos a estudio se extrajeron las siguientes variables: número de pacientes, mortalidad postoperatoria, fístula anastomótica, complicaciones postoperatorias (íleo paralítico, hemorragia postoperatoria, absceso intraabdominal), número de ganglios extraídos y supervivencia a los 5años.
Análisis estadísticoLos datos comparativos de los estudios fueron expresados como una odds ratio (OR) con un 95% de intervalo de confianza (IC). Valoramos la heterogeneidad de los estudios con el índice de I cuadrado (I2) y la prueba Q de Cochrane (p). Cuando la heterogeneidad era significativa, usamos el modelo de efectos aleatorios. Se consideraron diferencias estadísticamente significativas en la heterogeneidad cuando p < 0,1 o I2> 35%. Para valorar la existencia de un sesgo de publicación se hizo un funnel plot.
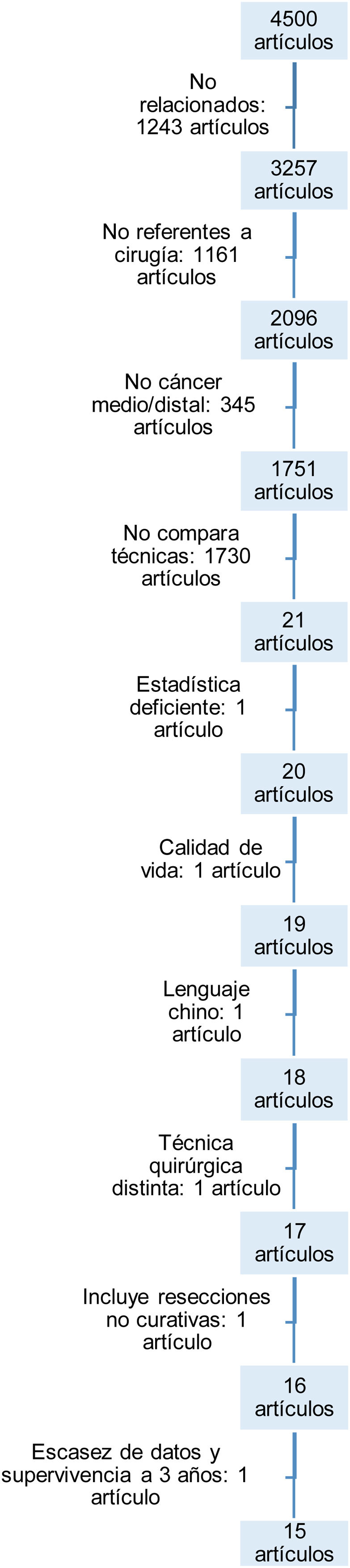
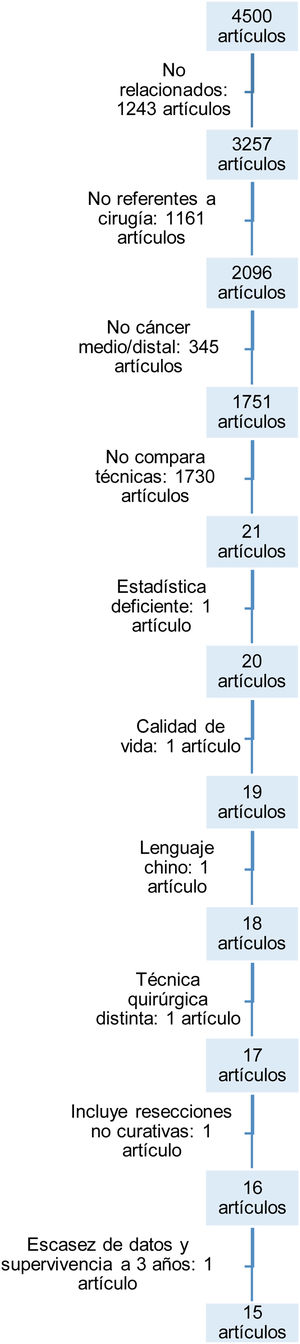
ResultadosBúsqueda y selección de artículosLa primera búsqueda con las palabras clave extrajo un total de 4.500 artículos.
En el flujograma (fig. 1) se ilustran los motivos del descarte de los artículos hasta llegar a los 15 finales seleccionados. Fueron descartados por no guardar relación alguna o no versar sobre la cirugía en el cáncer gástrico, por no estudiar selectivamente el cáncer medio o distal gástrico, por no comparar ambas técnicas, por carecer de adecuada metodología estadística, por versar sobre la calidad de vida tras ambas técnicas sin incluir las complicaciones tras las intervenciones, por estar escritos en idiomas diferentes a los designados en los criterios de inclusión, por incluir pacientes con técnicas quirúrgicas diferentes o cirugías no curativas y, por último, por no incluir datos ciertos de mortalidad postoperatoria o de supervivencia a medio plazo.
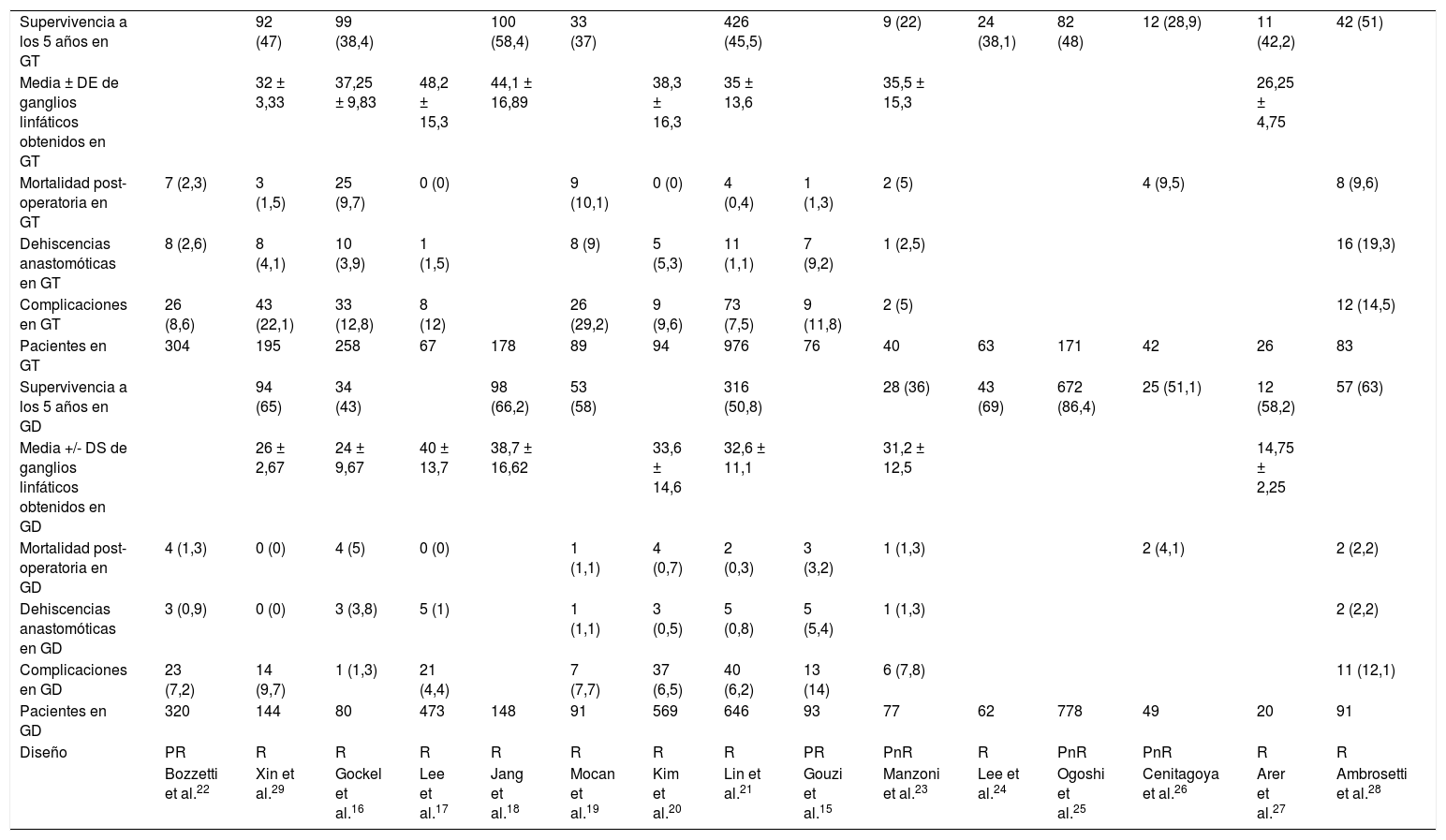
Las características y variables de los 15 estudios15-29 incluidos se recogen en la tabla 1.
Características de los artículos incluidos en el metaanálisis
| Supervivencia a los 5 años en GT | 92 (47) | 99 (38,4) | 100 (58,4) | 33 (37) | 426 (45,5) | 9 (22) | 24 (38,1) | 82 (48) | 12 (28,9) | 11 (42,2) | 42 (51) | ||||
| Media ± DE de ganglios linfáticos obtenidos en GT | 32 ± 3,33 | 37,25 ± 9,83 | 48,2 ± 15,3 | 44,1 ± 16,89 | 38,3 ± 16,3 | 35 ± 13,6 | 35,5 ± 15,3 | 26,25 ± 4,75 | |||||||
| Mortalidad post-operatoria en GT | 7 (2,3) | 3 (1,5) | 25 (9,7) | 0 (0) | 9 (10,1) | 0 (0) | 4 (0,4) | 1 (1,3) | 2 (5) | 4 (9,5) | 8 (9,6) | ||||
| Dehiscencias anastomóticas en GT | 8 (2,6) | 8 (4,1) | 10 (3,9) | 1 (1,5) | 8 (9) | 5 (5,3) | 11 (1,1) | 7 (9,2) | 1 (2,5) | 16 (19,3) | |||||
| Complicaciones en GT | 26 (8,6) | 43 (22,1) | 33 (12,8) | 8 (12) | 26 (29,2) | 9 (9,6) | 73 (7,5) | 9 (11,8) | 2 (5) | 12 (14,5) | |||||
| Pacientes en GT | 304 | 195 | 258 | 67 | 178 | 89 | 94 | 976 | 76 | 40 | 63 | 171 | 42 | 26 | 83 |
| Supervivencia a los 5 años en GD | 94 (65) | 34 (43) | 98 (66,2) | 53 (58) | 316 (50,8) | 28 (36) | 43 (69) | 672 (86,4) | 25 (51,1) | 12 (58,2) | 57 (63) | ||||
| Media +/- DS de ganglios linfáticos obtenidos en GD | 26 ± 2,67 | 24 ± 9,67 | 40 ± 13,7 | 38,7 ± 16,62 | 33,6 ± 14,6 | 32,6 ± 11,1 | 31,2 ± 12,5 | 14,75 ± 2,25 | |||||||
| Mortalidad post-operatoria en GD | 4 (1,3) | 0 (0) | 4 (5) | 0 (0) | 1 (1,1) | 4 (0,7) | 2 (0,3) | 3 (3,2) | 1 (1,3) | 2 (4,1) | 2 (2,2) | ||||
| Dehiscencias anastomóticas en GD | 3 (0,9) | 0 (0) | 3 (3,8) | 5 (1) | 1 (1,1) | 3 (0,5) | 5 (0,8) | 5 (5,4) | 1 (1,3) | 2 (2,2) | |||||
| Complicaciones en GD | 23 (7,2) | 14 (9,7) | 1 (1,3) | 21 (4,4) | 7 (7,7) | 37 (6,5) | 40 (6,2) | 13 (14) | 6 (7,8) | 11 (12,1) | |||||
| Pacientes en GD | 320 | 144 | 80 | 473 | 148 | 91 | 569 | 646 | 93 | 77 | 62 | 778 | 49 | 20 | 91 |
| Diseño | PR | R | R | R | R | R | R | R | PR | PnR | R | PnR | PnR | R | R |
| Bozzetti et al.22 | Xin et al.29 | Gockel et al.16 | Lee et al.17 | Jang et al.18 | Mocan et al.19 | Kim et al.20 | Lin et al.21 | Gouzi et al.15 | Manzoni et al.23 | Lee et al.24 | Ogoshi et al.25 | Cenitagoya et al.26 | Arer et al.27 | Ambrosetti et al.28 |
Entre paréntesis se muestran los porcentajes de cada una de las variables respecto al total de pacientes.
PnR: prospectivo no aleatorizado; PR: prospectivo aleatorizado; R: retrospectivo.
Fueron estudiados 15 artículos con un total de 6.303 pacientes (GT = 2.662, GD = 3.641).
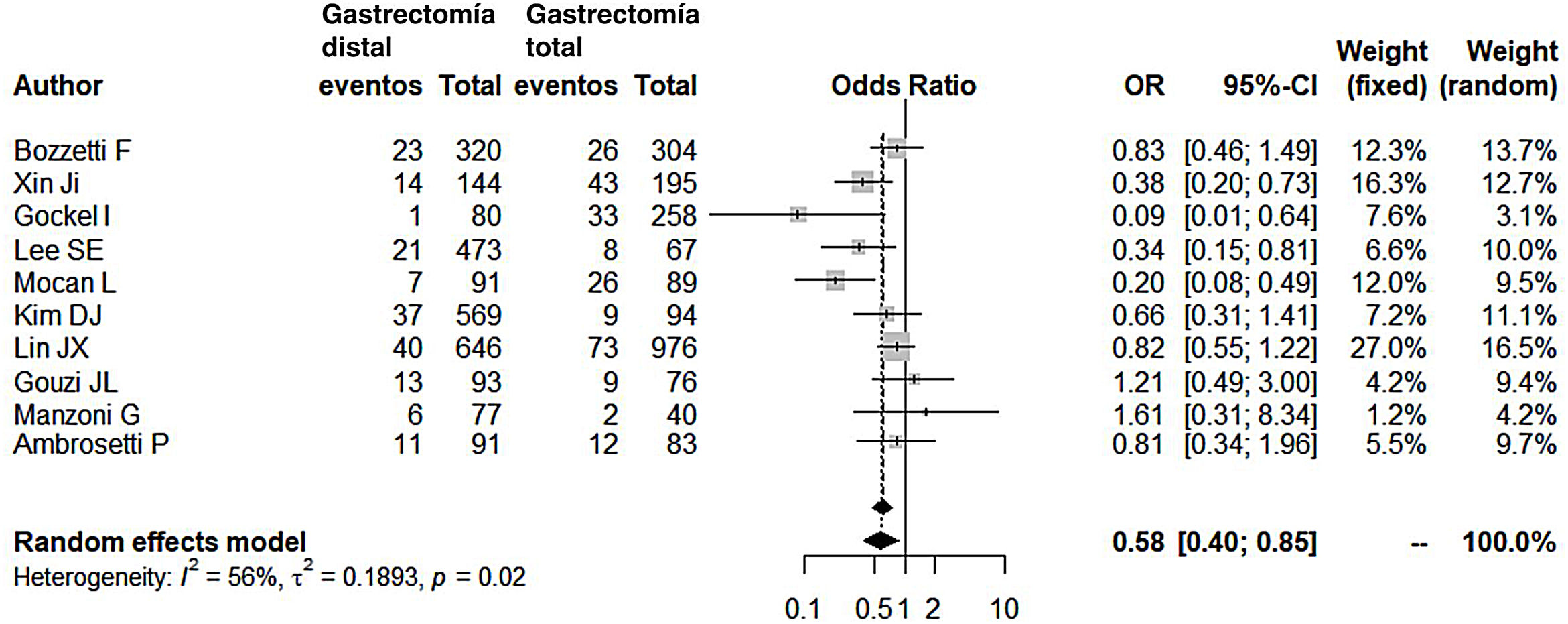
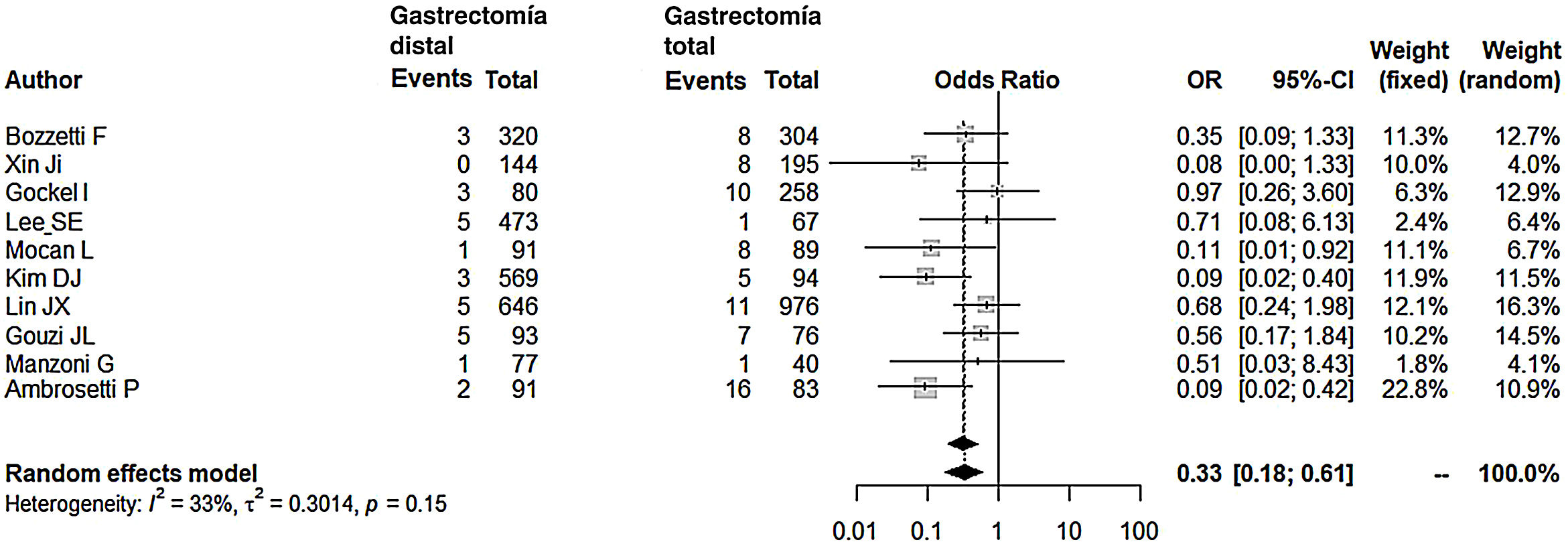
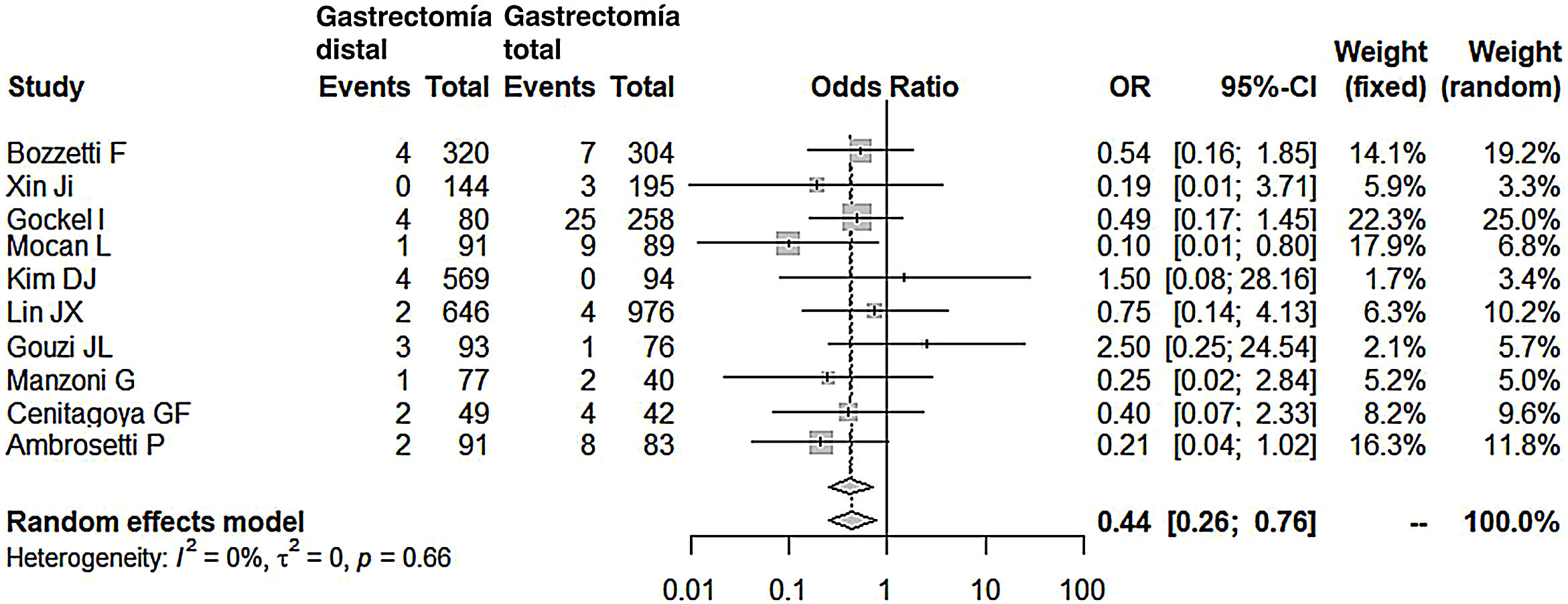
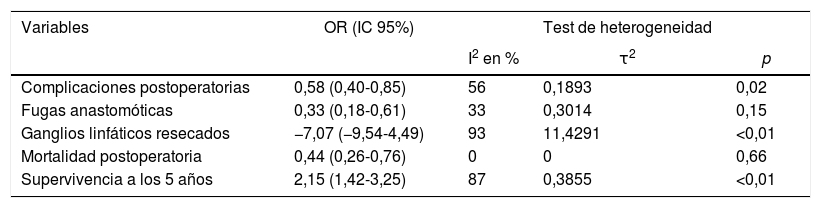
Comparados con los pacientes del grupo GT, los pacientes del grupo GD presentaron menor número de complicaciones (OR: 0,58; IC 95%: 0,40-0,85; I2: 86%) (fig. 2). De manera pareja, la aparición de una fístula anastomótica fue significativamente menor en el grupo GD (OR: 0,33; IC 95%: 0,18-0,61; I2: 33%) (fig. 3). Con estos 2datos, el resultado en relación con la mortalidad postoperatoria fue el esperado, con menor mortalidad en el grupo de la GD (OR: 0,44; IC 95%: 0,26-0,76; I2: 0%) (fig. 4).
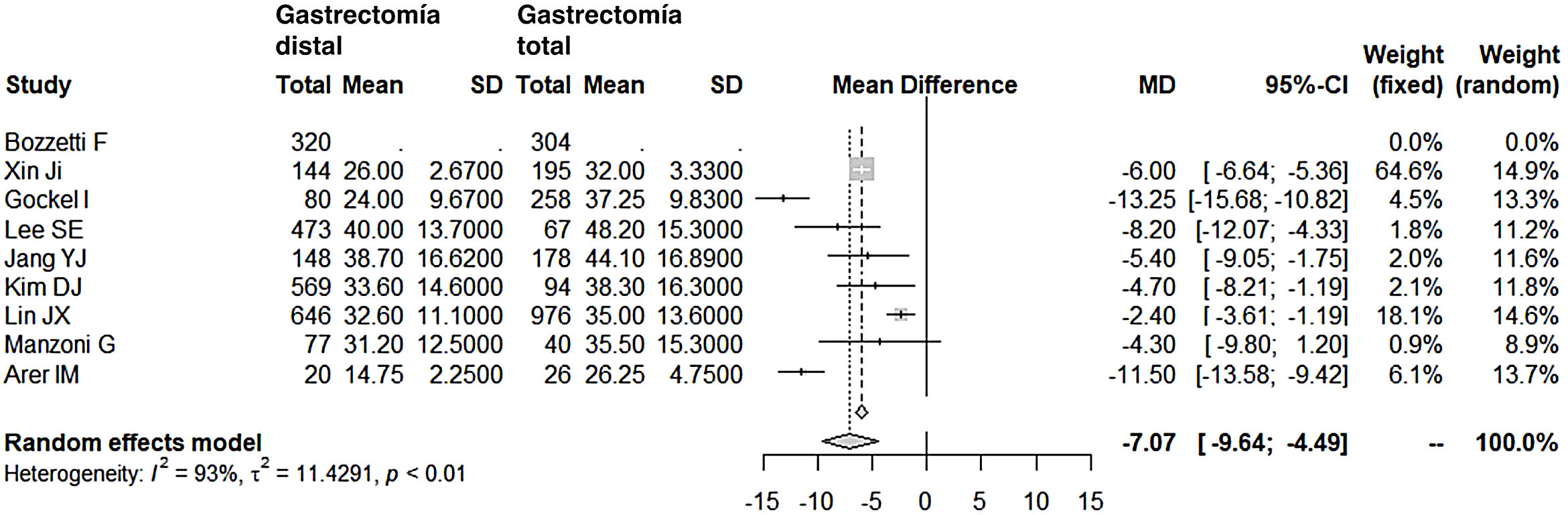
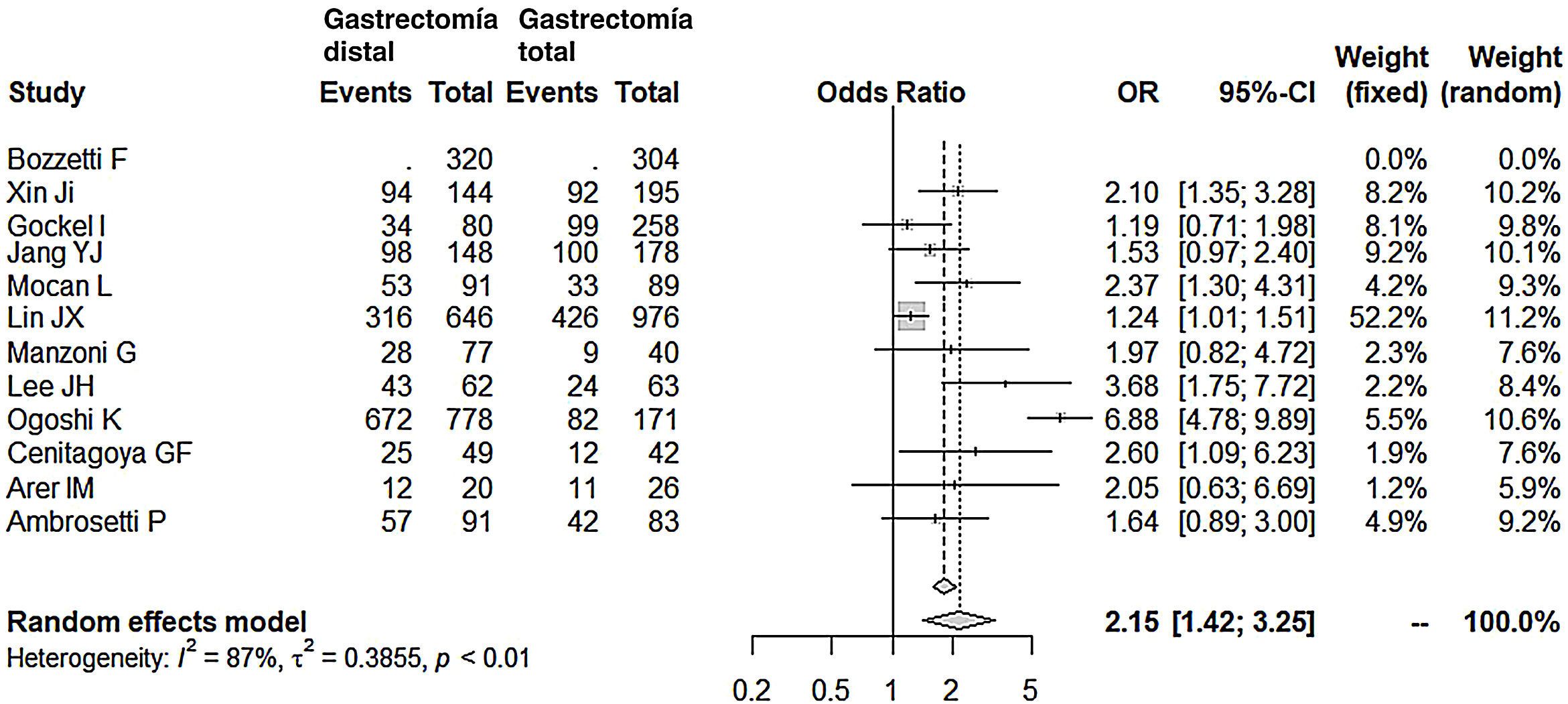
La linfadenectomía en el grupo GD (rango 15-40) obtuvo un menor número de ganglios que el grupo GT (rango 26-48), con 7 ganglios menos de media (OR: −7,07; IC 95%: [−9,54]-[−4,49]; I2: 93%) (fig. 5). Sin embargo, la exéresis de un menor número de ganglios no mermó la supervivencia media a los 5años en este grupo; de hecho, los pacientes intervenidos mediante una GD presentaron índices de supervivencia mayores en relación con el grupo GT (OR: 2,15; IC 95%: 1,42-3,25; I2: 87%) (fig. 6).
El resumen de las estadísticas comparativas entre ambos grupos se muestra en la tabla 2.
Resumen de las estadísticas obtenidas de la comparación entre la GD y la GT
| Variables | OR (IC 95%) | Test de heterogeneidad | ||
|---|---|---|---|---|
| I2 en % | τ2 | p | ||
| Complicaciones postoperatorias | 0,58 (0,40-0,85) | 56 | 0,1893 | 0,02 |
| Fugas anastomóticas | 0,33 (0,18-0,61) | 33 | 0,3014 | 0,15 |
| Ganglios linfáticos resecados | −7,07 (−9,54-4,49) | 93 | 11,4291 | <0,01 |
| Mortalidad postoperatoria | 0,44 (0,26-0,76) | 0 | 0 | 0,66 |
| Supervivencia a los 5 años | 2,15 (1,42-3,25) | 87 | 0,3855 | <0,01 |
Hasta la fecha, y según nuestro conocimiento, no hay publicado por autores occidentales ningún metaanálisis que compare qué gastrectomía debe ser planificada para un cáncer de estómago medio y distal en términos de complicaciones postoperatorias y de mortalidad, aunque sin olvidar su seguridad en eficacia oncológica (supervivencia a los 5años).
Desde un punto de vista estrictamente quirúrgico, el tipo de gastrectomía ante un cáncer de estómago medio o distal es motivo de divergencia de opiniones, y esa es la luz que queremos encender con este metaanálisis en este panorama tan poco definido. Hay cirujanos que practican de forma rutinaria una GT porque entienden que no conlleva una mayor morbimortalidad y porque consideran que la supervivencia del paciente será mayor30. En esta línea asocian la GD con un índice mayor de recaídas y, por tanto, de reoperaciones. Otros cirujanos, por el contrario, están más familiarizados con una GD, ya que la GT se asociaría con un índice de morbimortalidad netamente superior, cercano al doble31,32. De acuerdo con estos últimos, la Asociación Japonesa del Cáncer Gástrico define la gastrectomía estándar como aquella que tiene un fin curativo, lo que implicaría una linfadenectomía D2 y, al menos, la resección de 2/3 partes del estómago siempre que pueda ser garantizado un margen suficiente (3cm en los tumores de crecimiento expansivo y 5cm en los de crecimiento infiltrativo)33.
Características de los estudios incluidosEn este trabajo se han incluido un total de 2 estudios prospectivos aleatorizados, 3 prospectivos no aleatorizados y 10 retrospectivos, con un total de 6.303 pacientes (3.641 GD y 2.662 GT).
De forma genérica, se ha afirmado siempre que un cáncer de estómago indiferenciado o difuso en la clasificación de Lauren, sin importar su localización, debía ser siempre tratado con una GT. Con sorpresa comprobamos que en todas las series que comportan este metaanálisis excepto una, la de Gockel et al.16, los cánceres indiferenciados o difusos de Lauren no han sido motivo de exclusión para una GD. Incluso en algunas series, como la de Lin et al.21, hasta el 84% de las GD eran en pacientes con cánceres indiferenciados o difusos. Si bien todas las series consideran como criterio de inclusión que el margen quirúrgico sea adecuado, solo en 5 series16,18,19,22,29 se define como válida una horquilla de márgenes entre 3 y 6cm.
La cirugía laparoscópica del cáncer gástrico va ganando presencia. Se obtienen los mismos resultados en cuanto a radicalidad oncológica y supervivencia con parámetros de estancia hospitalaria mejores34. No obstante, son técnicas complejas y, por ello, pocos grupos la incorporan en su quehacer rutinario en el cáncer gástrico. No es de extrañar que solo 3de los estudios incluidos hayan llevado a cabo sus resecciones por laparoscopia17,20,21.
Complicaciones postoperatoriasNuestro metaanálisis refrenda que tras una GD el paciente tiene 1,72 veces menos de probabilidad de presentar complicaciones en el postoperatorio. Este dato no sorprende al comprobar que en todas las series menos una, la de Gouzi et al.15, las complicaciones fueron menores en el grupo GD.
Debemos reseñar que Gouzi et al. (14% de complicaciones en la GD y 12% de complicaciones en la GT, casi similares) definen unos criterios de inclusión para sus pacientes muy restrictivos: rechazan a los pacientes con insuficiencia renal o cardíaca crónica, diabetes mal controlada, arteritis, peso corporal mayor al 20% del peso medio ajustado a la edad y al sexo, y con cirrosis hepática. En definitiva, incluir pacientes técnicamente más sencillos (no obesos) o con mayor reserva funcional (sin comorbilidades) podría justificar un rango de complicaciones similar, incluso en procedimientos técnicos más laboriosos y complejos como la GT (en esta misma serie, aunque no se recoge el dato, sí se especifica que en el grupo de las GT hubo mayor número de esplenectomías de necesidad).
Fístula anastomóticaLos datos revisados de nuestro metaanálisis reflejan que las posibilidades de tener una fístula anastomótica son 3veces menores tras una GD. La mayor probabilidad de la dehiscencia tras la anastomosis esófago-yeyunal no es de extrañar, ya que siempre se ha aducido que esta anastomosis tiene mayor riesgo de dehiscencia por estar relacionada con isquemia o tensión en la anastomosis. Cuando ocurre de forma precoz, se atribuye a errores técnicos, en especial, por la sutura de la pared esofágica en torno al vástago del cabezal. Puede prevenirse mediante una adecuada minuciosidad en los gestos técnicos durante la cirugía. Una mayor y mejor suplencia vascular del estómago remanente frente al esófago terminal involucrados en la anastomosis es, según Gouzi et al.15 (incidencia de fístula anastomótica próxima al 10%), la causa determinante de la menor incidencia de fístula en los pacientes con GD. Ambrosetti et al.28, que registran una incidencia de fístula próxima al 20% en el grupo GT, consideran fundamental que la gastrectomía total sea referida a un cirujano con un número amplio de casos por año, aduciendo que la fístula obedece en gran parte a errores de la técnica.
Mortalidad postoperatoriaLa mortalidad postoperatoria en nuestro metaanálisis fue 2,27 veces menor en el grupo GD. De entre las seleccionadas, resaltan 2series en las que la mortalidad fue claramente menor en el grupo GD19,28. Ambas registraron el mayor índice de fístulas anastomóticas en el grupo GT (9 y 19%). Es evidente que en estas 2series la mortalidad tuvo una relación directa con la fístula anastomótica. Sin embargo, en la serie de Gouzi et al.15, a pesar de una incidencia alta de fístula anastomótica en el grupo GT, próxima al 10%, la mortalidad en ambos grupos fue similar (del 2,4%). El motivo de esta disparidad aparente es que más del 50% de las fístulas fueron subclínicas, diagnosticadas en el control radiológico, y todas fueron manejadas médicamente con éxito y sin mortalidad. En efecto, no siempre la fístula anastomótica tras una gastrectomía total implica el fallecimiento del enfermo. De hecho, en 4series de las consultadas15,19,20,28 el número de muertes en el postoperatorio de las GT fue significativamente menor al número de fístulas ocurridas. De algún modo se subraya la importancia del tratamiento precoz y multidisciplinar de esta complicación para evitar el fallecimiento del enfermo.
La radicalidad en la cirugía oncológica tras una GT ha sido relacionada con mayores índices de mortalidad y es uno de los motivos por los que grupos europeos han desaconsejado las linfadenectomías amplias D2, tantas veces recomendadas entre los cirujanos japoneses33. En este sentido, la serie de Gockel et al.16, con una mortalidad del 10% en el grupo GT, mostraba que la fístula pancreática (8,8%) fue la causa principal de fallecimiento, por encima de la fístula anastomótica (3,8%). En su serie, de forma rutinaria la linfadenectomía era D2 y se realizó una esplenectomía y una pancreatectomía izquierda en el 63,7% y en el 3,7% de sus pacientes, respectivamente.
Ganglios resecadosEn la actualidad, la mayoría de los cirujanos se inclinan hacia una linfadenectomía D2, aunque sin el entusiasmo propio del cirujano japonés, al que se le atribuyen las disecciones ganglionares más amplias. Es posible que también en esta radicalidad influya mucho el fenotipo del paciente japonés, obeso con menor frecuencia y, por tanto, más sencillo desde un punto de vista técnico. En pacientes con sobrepeso o por otra causa técnicamente más complejos, el estándar de calidad mínimo exigido para alcanzar una correcta estadificación del tumor supone resecar un número de ganglios no inferior a 15. Además, los últimos regímenes de quimioterapia y de radioterapia han permitido tratamientos adicionales a la cirugía, que complementan y apuntalan esas disecciones, quizá insuficientes en el número de ganglios, según el criterio de la escuela japonesa. En las series consultadas, el grupo GD obtuvo de forma significativa menor número de ganglios (OR: −7,07; IC 95%: [−9,54]-[−4,49]; I2: 93%), si bien su rango de ganglios (15-40) en el metaanálisis se puede considerar adecuado y, de hecho, hemos visto que no ha afectado a la supervivencia a largo plazo de este grupo.
Supervivencia a largo plazoEl 75% de las series consultadas (8/12) en este metaanálisis no muestran diferencias en la supervivencia a largo plazo entre los 2grupos, GD y GT. En efecto, casi todas ellas establecen como factores predictivos fundamentales de mala supervivencia en el análisis multivariante el estadio N15,16,19,22,23,25-29, estadio T15,16,22,25, estadio TNM18,19,24,26-28 y, en solo una serie, la extensión de la linfadenectomía18 o la neoadyuvancia29, sin mencionar el tipo de gastrectomía realizada. En ninguna de las series, el tipo difuso de Lauren o el adenocarcinoma indiferenciado se mostró como variable predictiva de mal pronóstico. Ahora bien, el resultado final del metaanálisis, incluyendo las 4series restantes, concluye que se da una supervivencia a 5 años 2 veces superior en el grupo GD.
Analizaremos estas 4series de forma individual. En la serie de Ogoshi et al.25, la supervivencia a los 5años es favorable a la GD (86,4 vs. 48%): entienden que el mayor margen obtenido tras una GT e incluso el mayor número de ganglios resecados no tendría relevancia sobre la supervivencia. Por el contrario, consideran que preservar el duodeno, con el consiguiente paso del alimento por él, tras una GD (75% Billroth 1) estaría asociado a mejores condiciones inmunológicas, menor pérdida de peso y una mejor regulación de las hormonas gastrointestinales, parámetros todos ellos asociados a una mejora de la calidad de vida y una mayor supervivencia. En la serie de Lee et al.24, las diferencias en favor de la GD fueron también amplias (69 vs. 38%), aunque sin significado estadístico tras el análisis multivariante. No obstante, también incidían en la mejor calidad de vida nutricional de estos pacientes y por ello recomendaban una GD siempre que el margen fuera el adecuado. Cenitagoya et al.26 aducen como única razón para explicar la mejor supervivencia en la GD (51 vs. 29%) la localización del tumor. Se limitan a describir que los tumores del tercio medio son de peor pronóstico, aunque sin relacionar esta localización con las otras 2variables, solo significativas en su serie de mal pronóstico tras el análisis multivariante: afectación ganglionar y estadio TNM. Por último, la cifra de supervivencia, ampliamente favorable para la GD en la serie de Mocan19 (58 vs. 37%), solo era significativa en el estadio IB de la clasificación TNM. En el análisis multivariante de la serie global, el tipo de gastrectomía no era significativo, en favor de la afectación ganglionar y el estadio TNM.
Limitaciones del metaanálisisAunque este metaanálisis se ha llevado a cabo siguiendo las indicaciones de calidad, encontramos una serie de limitaciones.
En primer lugar, solo 2de los estudios son ensayos clínicos controlados aleatorizados y, curiosamente, son los 2más antiguos de los incluidos en el metaanálisis. Además, solo 3han sido publicados en los últimos 5años, por lo que el impacto en la supervivencia de la neoadyuvancia ha sido analizado en una única serie. En segundo lugar, los estudios se han llevado a cabo en hospitales de países como Italia, Alemania, Corea o China, pero existen muchos otros centros que no se han incluido en el estudio. Por otra parte, solo se han incluido artículos escritos en inglés, francés y español, lo que puede haber dejado fuera artículos sobre este tema que no cumplieran ese criterio. En tercer lugar, el tamaño muestral de 15 series es pequeño y, además, en 5de ellas no se incluían entre sus variables de estudio la morbilidad, la mortalidad quirúrgica o la supervivencia a los 5años. Por ello, consideramos que son necesarios en el futuro más ensayos clínicos controlados y aleatorizados y con una mayor muestra de pacientes para precisar las ventajas o los inconvenientes que puedan presentar la GD y la GT en el tratamiento del cáncer de estómago distal.
ConclusionesNuestro metaanálisis concluye que la GD es la técnica ideal en el cáncer de estómago medio y distal, no importa que sea indiferenciado o difuso según la clasificación de Lauren, siempre que se pueda obtener un margen suficiente, por estar asociada a menor morbimortalidad postoperatoria. A pesar de extirpar un número menor de ganglios, se alcanza el estándar de calidad de 15 ganglios en una linfadenectomía e incluso también se asocia con una mayor supervivencia a los 5años. Desafortunadamente, la escasez de estudios prospectivos aleatorizados de este metaanálisis le resta evidencia a sus resultados y, por ello, estas conclusiones han de tomarse con cautela.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.