El trasplante auxiliar heterotópico hepático con arterialización de la vena porta (TAHH-AVP) es un modelo poco estudiado a pesar de su potencial terapéutico. El objetivo del estudio es valorar la respuesta hemodinámica y bioquímica durante el implante y analizar la repercusión de la arterialización portal en la funcionalidad y morfología hepática.
MétodosSe realizó un estudio hemodinámico y bioquímico durante el implante auxiliar en un modelo porcino (n=15 TAHH-AVP). Además, se analizaron las consecuencias de la arterialización portal sobre la arquitectura hepática mediante un estudio ultraestructural.
ResultadosLa reperfusión del injerto arterializado aumentó la frecuencia cardiaca (FC) respecto a los valores basales (p=0,004) y a la fase del pinzamiento de la vena cava (p=0,004) y disminuyó las resistencias vasculares sistémicas respecto a la fase del pinzamiento de la vena cava (p=0,021). Al final del implante, el gasto cardiaco permaneció elevado (p=0,001), al igual que la FC respecto a la fase basal (p=0,002). La presión arterial media disminuyó con el pinzamiento venoso, pero no se vio afectada ni por la reperfusión del injerto ni por el cierre de la piel. Todas las muestras histológicas obtenidas a los 3, 10 y 21 días conservaron su morfología y arquitectura hepáticas. Si bien se observaron algunos focos de necrosis perilobular el día 3 (p=0,049) y proliferación conectiva perilobular el día 10 (p=0,007), respecto al hígado nativo.
ConclusionesEl trasplante del injerto hepático arterializado descrito minimiza el número de anastomosis vasculares respecto a los modelos previamente publicados, presenta una buena tolerancia hemodinámica y metabólica, y la arterialización portal del injerto no produce cambios significativos en la histología hepática.
Auxiliary heterotopic liver transplantation with portal vein arterialization (AHLT-PVA) is a model that has been hardly studied, despite its therapeutic potential.
MethodsHemodynamic and biochemical characterization was carried out during graft implantation, in a pig-to-pig model (n=15 AHLT-PVA). Furthermore a histopathological study was performed to establish microscopic alterations due to PVA.
ResultsReperfusion of the arterialized graft produced an increase in heart rate (HR) vs. baseline (P=.004) and vs. inferior vena cava clamping phase (P=.004); and a decrease in systemic vascular resistance vs. cava clamping phase (P=.021). At the end of implantation, cardiac output remained elevated (P=.001), likewise HR remained increased vs. baseline phase (P=.002). Mean arterial pressure decreased with cava clamping, but was not affected by the reperfusion of the graft, nor the skin closure. The histopathological study at 3, 10, and 21 days post-PVA revealed that functional liver structure was maintained although it is common to find foci of perilobular necrosis on day 3 (P=.049), and perilobular connective tissue proliferation at day 10 (P=.007), vs. native liver.
ConclusionsThe described arterialized liver graft model minimizes the number of vascular anastomoses vs. previously described models. It is hemodynamically and metabolically well tolerated and the double arterial vascularization of the graft does not cause significant changes in liver histology.
El trasplante ortotópico hepático (TOH) es el tratamiento de elección para enfermedades hepáticas crónicas en estadio terminal1–3. El trasplante auxiliar hepático (TAH) tiene unas indicaciones más limitadas, aunque puede ser una alternativa al TOH en determinadas situaciones como: a) hepatopatías metabólicas no cirróticas, o fallo hepático fulminante potencialmente reversible en el que se contempla la recuperación del hígado nativo4–9; b) injertos hepáticos extremadamente pequeños10,11 y c) incluso en el xenotrasplante, como situación puente hasta la disponibilidad de un injerto humano compatible para TOH12.
La arterialización de la vena porta (AVP) es una variante técnica, que asociada al trasplante auxiliar heterotópico hepático (TAHH) permite conservar el hilio hepático nativo intacto, evitando el fenómeno de competencia por el flujo portal entre los 2 hígados y proporcionando al hígado nativo unas condiciones óptimas para su potencial regeneración13–18. Si bien la arterialización portal va a someter al territorio portal hepático a un hiperaflujo arterial a alta presión.
El objetivo es analizar las alteraciones hemodinámicas, electrolíticas y del equilibrio ácido base que se producen en un modelo porción de TAHH-AVP durante el implante en el receptor, y analizar los cambios histopatológicos que se generan en el injerto.
MétodoAnimalesSe realizaron 15 TAHH-AVP para los que se emplearon cerdos hembras cruce de las razas Large White y Landrace, de 12kg los donantes y 25kg los receptores y los utilizados para la obtención de recursos hemoterápicos. Para determinar la compatibilidad donante-receptor se realizaron pruebas cruzadas de aglutinación19.
Todos los protocolos experimentales fueron aprobados por el Comité Ético de nuestra universidad, responsable de la aplicación de la Directiva 2010/63/UE. Los animales fueron anestesiados con isofluorano (1,5-2%) y fentanilo (0,03- 0,05mg/kg/h).
Técnica quirúrgicaEn el donante se realizó una hepatectomía estándar con la salvedad de la disección retrogástrica de la arteria hepática18.
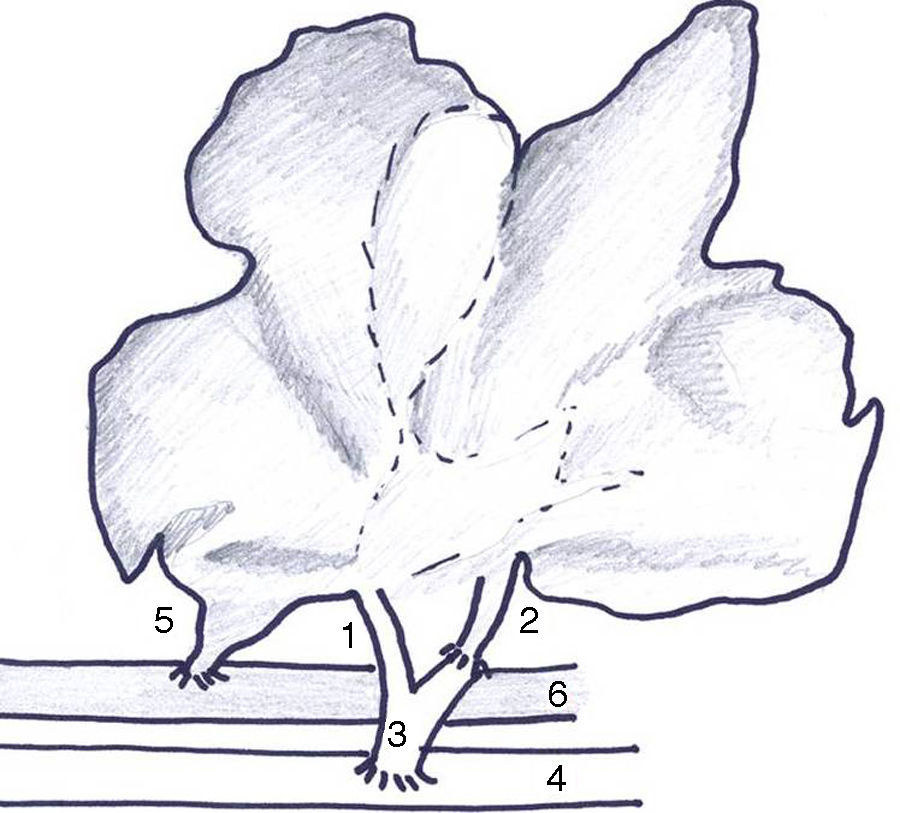
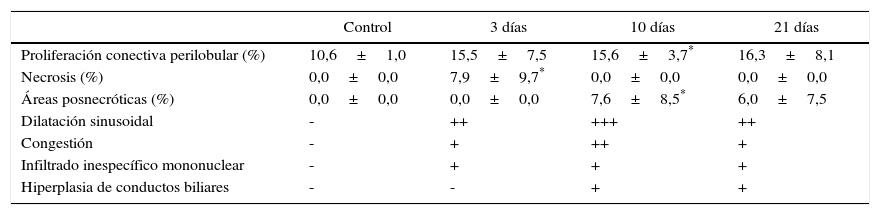
El modelo de AHLT-PVA previamente descrito por nuestro grupo18 sufrió 3 modificaciones: 1) anastomosis arterial a la aorta infrarrenal del receptor por la alta incidencia de trombosis (fig. 1); 2) sección de la vena cava infrahepática a nivel del lóbulo caudado para evitar acodamientos; 3) trasplante auxiliar completo por frecuencia de sangrado desde la superficie de resección y 4) drenaje del conducto biliar común al exterior para valorar la producción biliar.
Análisis hemodinámicoPara el estudio hemodinámico se empleó un catéter venoso central en la vena yugular interna y un catéter en arteria femoral conectado al monitor Picco® (Pusion Medical Systems, Feldkirchen, Alemania)20, que mide el gasto cardiaco (GC) usando la termodilución transpulmonar y la onda de pulso arterial.
Las variables hemodinámicas analizadas fueron la presión arterial media, la presión venosa central, el GC, las resistencias vasculares sistémicas (RVS), el volumen telediastólico global, el volumen sanguíneo intratorácico, el volumen pulmonar extravascular y la frecuencia cardiaca (FC). Las mediciones se realizaron en 4 momentos del implante: A) tras la incisión de la piel (basal), B) tras el pinzamiento de la vena cava caudal infrahepática, C) tras la reperfusión y D) al cierre de la piel21. Se utilizaron como control los valores basales.
Análisis bioquímico y de gases en sangreComo líquido de mantenimiento y tras la reperfusión, se empleó suero salino fisiológico. Se transfundió sangre total anticoagulada con citrato sódico si la hemoglobina era <10g/dl.
Las gasometrías se realizaron en el analizador de gases Irma® (Diametrics Medical, Minnesota, EE. UU.), midiéndose pH arterial, presión parcial de oxígeno (pO2), presión parcial de dióxido de carbono (pCO2), bicarbonato estándar (HCO3), exceso de bases, potasio (K+), sodio (Na+), calcio ionizado (Ca++) y hemoglobina (Hb).
Los parámetros bioquímicos y de gases se analizaron en las mismas fases en las que se determinaron las variables hemodinámicas, utilizando como control los valores basales.
Protocolo inmunosupresorEl protocolo inmunosupresor seguido fue el previamente descrito22.
Protocolo de seguimientoSe midió diariamente la producción biliar, y se realizaron analíticas sanguíneas diarias (hemograma, coagulación y perfil hepático) hasta el día 4 post-TAHH y, posteriormente, con una periodicidad semanal y siempre que se presentó alguna complicación.
Como técnicas diagnósticas se realizaron:
- 1.
Controles ecográficos con un ecodoppler color bidimensional ECCO-CEE® (Toshiba Corporation Medical Systems Division, Tokio, Japón) a los 3 y 10 días, y ante sospecha de disfunción del injerto.
- 2.
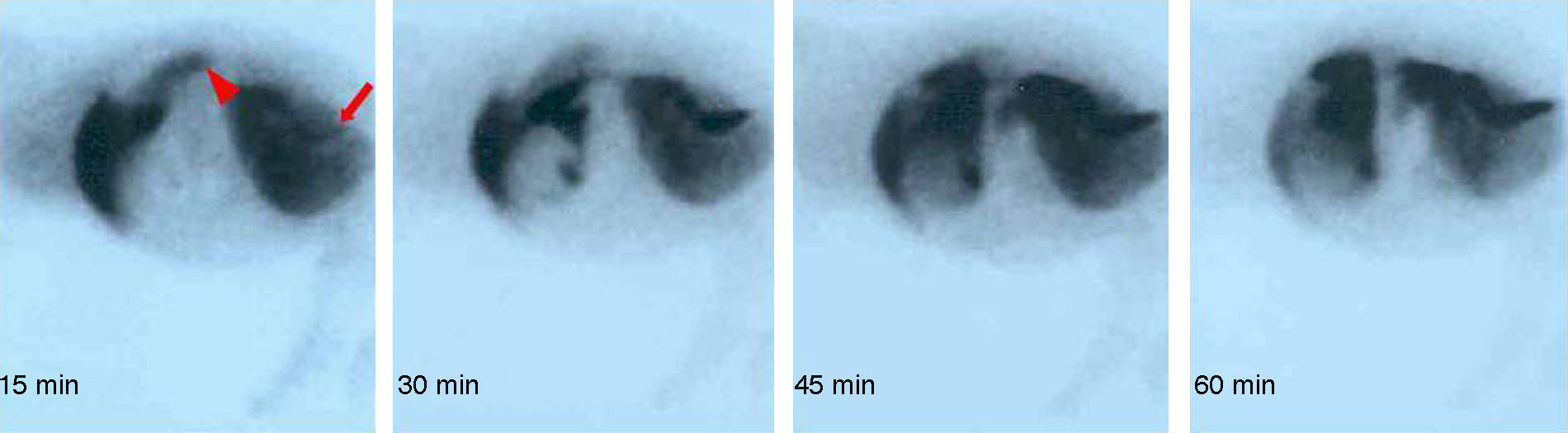
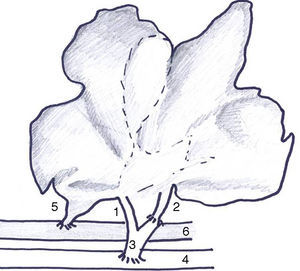
Para la valoración de la integridad y funcionalidad hepática del injerto se realizó un estudio gammagráfico con una gammacámara E.CAM Single® (Siemens, Erlangen, Alemania) de 2 tipos: a) gammagrafía con microagregado de albúmina humana coloidal marcada con 99mTc, y b) gammagrafía dinámica con ácido di-iso-propil-imino-diacético (DI-sida) marcado con 99mTc. Los controles se realizaron a los 7 y 14 días o ante deterioro del animal.
Se tomaron muestras del injerto los días 3 (estudio precoz), 10 (estudio intermedio) y 21 (estudio tardío) y se utilizó como tejido control una muestra del hígado nativo. Las muestras hepáticas se obtuvieron con un trucut ecoguiado o mediante biopsia abierta en los casos en los que el día de la toma de muestra coincidió con una laparotomía. Debido al riesgo de hemorragia, las muestras de endotelio portal solo se tomaron el día 21, antes de sacrificar a los animales15. Todas las muestras se tiñeron con hematoxilina- eosina y tricrómico de Masson y fueron evaluadas por 2 patólogos que desconocían los códigos de las muestras.
Para determinar el porcentaje de tejido dañado, se calculó el área de parénquima afectado de una superficie conocida (10 campos a 4x, 800.000μm2/campo). Para analizar otros parámetros, seguimos la siguiente puntuación:
- 1.
Dilatación sinusoidal y congestión: (−) negativo; (+) 0-10% del parénquima afectado; (++) 10-20%; (+++) más del 20%.
- 2.
Infiltrado inflamatorio mononuclear inespecífico: (−) negativo; (+) manguitos perivasculares con localización periportal.
- 3.
Hiperplasia de conductos biliares: (−) negativo; (+) neoformación de conductos biliares en áreas periportales.
En las mediciones hemodinámicas y bioquímicas, para asegurar la reproducibilidad, se calculó la media de 3 mediciones consecutivas23. Para determinar si cambiaban a lo largo de la cirugía, se comparó cada fase con la fase previa y con el valor basal por medio de la prueba T de Student.
Respecto al estudio histopatológico, para valorar los cambios a lo largo del tiempo, cada fase se comparó con las otras mediante el test de Wilcoxon. Además, cada fase se comparó con las muestras del hígado nativo mediante el test de Mann-Whitney.
ResultadosAnálisis hemodinámico (n=15)Al acabar la cirugía se consideró un trasplante exitoso si se objetivaba flujo arterial al injerto, un drenaje venoso adecuado y producción biliar.
La reperfusión del injerto arterializado produjo un aumento de la FC respecto a la basal (p=0,004) y a la fase de pinzamiento venoso (p=0,004); y una disminución de las resistencias vasculares respecto a la fase de pinzamiento (p=0,021). Al final del implante, el GC permaneció elevado (p=0.001), al igual que la FC respecto a la fase basal (p=0,002) (tabla 1).
Mediciones hemodinámicas en la fase basal (A), tras el pinzamiento de la vena cava inferior (B), tras la reperfusión (C) y al cierre de la piel (D)
| A | B | C | D | |
|---|---|---|---|---|
| PAM (mmHg) | 96,1±18,4 | 81,2±16,7* | 81,8±24,7 | 94,0±13,4 |
| GC (l/min) | 2,3±0,6 | 1,9±0,5* | 2,4±0,8 | 2,8±0,7** |
| FC (latidos/min) | 143,8±20,6 | 145,0±38,3 | 168,7±29,0*,** | 170,4 ±18,1*,** |
| RVS (dyn/s/cm−5) | 3015,0±285,4 | 3630,0±657,3* | 2.660,0±866,6* | 2.936,7±621,0 |
| PVC (mmHg) | 8,4±3,2 | 8,3±3,5 | 8,3±3,7 | 10,3±3,2*,** |
| GEDV (ml) | 260,1±67,4 | 222,7±59,6* | 276,9±93,9 | 258,0±54,4 |
| ITBV (ml) | 333,1±84,0 | 282,0±71,7* | 338,7±112,9 | 329,1±68,1 |
| EVLW (ml) | 177,3±35,2 | 174,2±36,7 | 191,4±41,1 | 209,5±65,0 |
T de Student. Valores expresados como media±DE.
EVLW: volumen pulmonar extravascular (EVLW); FC: frecuencia cardiaca; GC: gasto cardiaco; GEDV: volumen telediastólico global; ITBV: volumen sanguíneo intratorácico; PAM: presión arterial media; PVC: presión venosa central; RVS: resistencias vasculares sistémicas (RVS).
* p<0,05 respecto a valores previos.
** p<0,05 respecto a valores basales.
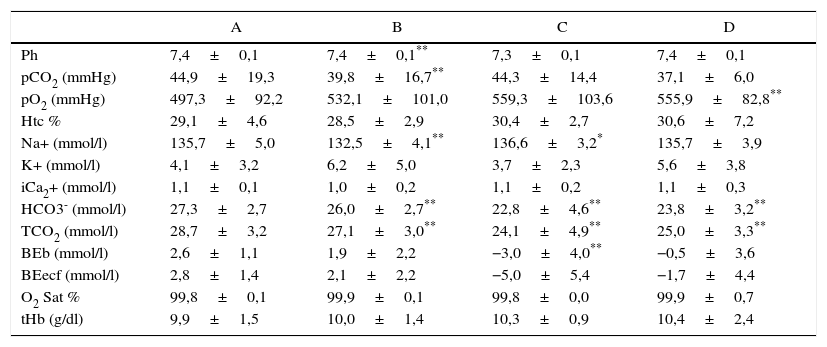
Durante la reperfusión del injerto el sodio aumentó (p=0,014) respecto al valor previo; el bicarbonato (p=0,009) y el exceso de bases (p=0,03) disminuyeron respecto a valores basales. Al final de la cirugía, la pO2 permaneció elevada (p=0,01) y el bicarbonato disminuido (p=0,037) respecto a valores basales (tabla 2).
Cambios metabólicos durante la fase basal (A), tras el pinzamiento de la vena cava inferior (B), tras la reperfusión (C) y al cierre de la piel (D)
| A | B | C | D | |
|---|---|---|---|---|
| Ph | 7,4±0,1 | 7,4±0,1** | 7,3±0,1 | 7,4±0,1 |
| pCO2 (mmHg) | 44,9±19,3 | 39,8±16,7** | 44,3±14,4 | 37,1±6,0 |
| pO2 (mmHg) | 497,3±92,2 | 532,1±101,0 | 559,3±103,6 | 555,9±82,8** |
| Htc % | 29,1±4,6 | 28,5±2,9 | 30,4±2,7 | 30,6±7,2 |
| Na+ (mmol/l) | 135,7±5,0 | 132,5±4,1** | 136,6±3,2* | 135,7±3,9 |
| K+ (mmol/l) | 4,1±3,2 | 6,2±5,0 | 3,7±2,3 | 5,6±3,8 |
| iCa2+ (mmol/l) | 1,1±0,1 | 1,0±0,2 | 1,1±0,2 | 1,1±0,3 |
| HCO3- (mmol/l) | 27,3±2,7 | 26,0±2,7** | 22,8±4,6** | 23,8±3,2** |
| TCO2 (mmol/l) | 28,7±3,2 | 27,1±3,0** | 24,1±4,9** | 25,0±3,3** |
| BEb (mmol/l) | 2,6±1,1 | 1,9±2,2 | −3,0±4,0** | −0,5±3,6 |
| BEecf (mmol/l) | 2,8±1,4 | 2,1±2,2 | −5,0±5,4 | −1,7±4,4 |
| O2 Sat % | 99,8±0,1 | 99,9±0,1 | 99,8±0,0 | 99,9±0,7 |
| tHb (g/dl) | 9,9±1,5 | 10,0±1,4 | 10,3±0,9 | 10,4±2,4 |
T de Student. Valores expresados como media±DE.
Beb: exceso de bases; BEecf: exceso bases fluido extracelular; HCO3: bicarbonato estándar; Htc: hematocrito; iCa2+: calcio ionizado; O2 Sat: saturación de oxígeno; pCO2 presión parcial de dióxido de carbono; Ph: Ph arterial; pO2: presión parcial de oxígeno; TCO2: concentración CO2 total en plasma; tHb: hemoglobina total.
* p<0,05 respecto a valores previos.
** p<0,05 respecto a valores basales.
Con la excepción de un animal que tuvo trombosis en la anastomosis arterial, en el resto la gammagrafía demostró claramente la funcionalidad del injerto arterializado (fig. 2).
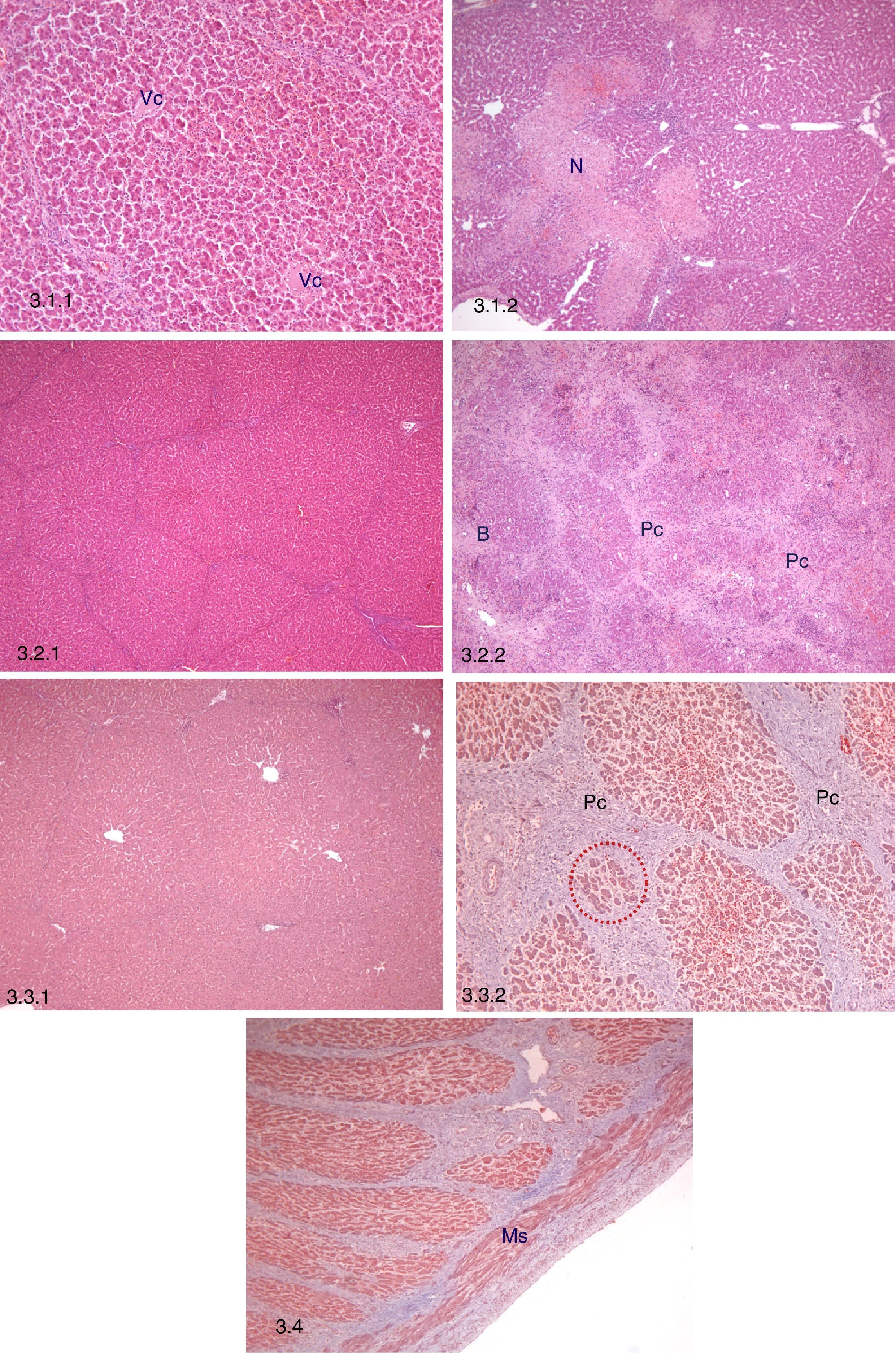
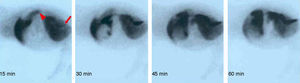
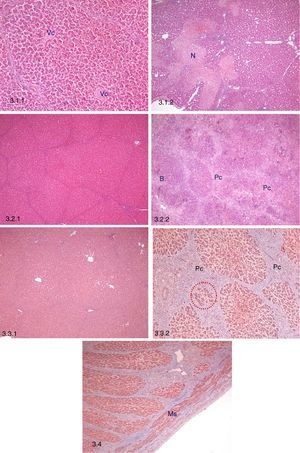
Estudio histopatológico precoz (n=12)Todas las muestras conservaban la arquitectura y morfología hepáticas. El principal hallazgo fue un aumento en el porcentaje de tejido con focos de necrosis perilobular junto con hemorragias y trombosis, comparado con el hígado nativo (p=0,048) (tabla 3; fig. 3.1). También se observó infiltrado inflamatorio mononuclear inespecífico, congestión y dilatación sinusoidal.
Hallazgos histopatológicos en el modelo de TAHH-AVP
| Control | 3 días | 10 días | 21 días | |
|---|---|---|---|---|
| Proliferación conectiva perilobular (%) | 10,6±1,0 | 15,5±7,5 | 15,6±3,7* | 16,3±8,1 |
| Necrosis (%) | 0,0±0,0 | 7,9±9,7* | 0,0±0,0 | 0,0±0,0 |
| Áreas posnecróticas (%) | 0,0±0,0 | 0,0±0,0 | 7,6±8,5* | 6,0±7,5 |
| Dilatación sinusoidal | - | ++ | +++ | ++ |
| Congestión | - | + | ++ | + |
| Infiltrado inespecífico mononuclear | - | + | + | + |
| Hiperplasia de conductos biliares | - | - | + | + |
Valores expresados como media±DE.
Test de Mann-Whitney. * p<0,05 respecto a control.
Estudio histopatológico. 3.1 Estudio histolópatológico precoz (3 días post-TAHH). 3.1.1: Preservación de la arquitectura hepática, vena centrolobulillar (Vc), H-E, 10x. 3.1.2: Necrosis focal perilobular (N), H-E, 5x. 3.2. Estudio histopatológico intermedio (10 días post-TAHH). 3.2.1: Persistencia de la arquitectura hepática, H-E, 5x. 3.2.2: Proliferación conectiva (Pc) e hiperplasia de conductos biliares (B), H-E, 5x. 3.3. Estudio histopatológico tardío (21 días post-TAHH). 3.3.1: Persistencia de la arquitectura hepática, H-E, 5x. 3.3.2: Regeneración nodular posnecrótica, proliferación conectiva (Pc) e hiperplasia de hepatocitos entre el tejido conectivo (punteado rojo), tricrómico de Masson, 10x. 3.4 Porta intrahepática en una muestra obtenida el día 21, fibras musculares lisas (Ms), tricómico de Masson, 5x.
Todas las muestras conservaron la arquitectura y morfología hepáticas. Los principales hallazgos fueron: 1) aumento significativo de proliferación conectiva perilobular vs. hígado nativo (p=0,007) y 2) aumento significativo de áreas con regeneración posnecrótica vs. hígado nativo (p = 0,046) (tabla 3; fig. 3.2). Además, se observó infiltrado inflamatorio mononuclear inespecífico, congestión y dilatación sinusoidal persistente, junto con hiperplasia de conductos biliares asociada a las áreas de regeneración posnecrótica.
Estudio histopatológico tardío (21 días postrasplante, n=10)Todas las muestras conservaron la arquitectura hepática, y el infiltrado inflamatorio mononuclear inespecífico, la congestión y la dilatación sinusoidal continuaron presentes (tabla 3; fig. 3.3).
Estudio histopatológico de la vena portaEl análisis histopatológico de la vena porta a los 21 días no reveló cambios significativos (fig. 3.4).
Estudio histopatológico del hígado nativoEn ninguna de las fases del estudio histopatológico se objetivó atrofia.
DiscusiónEl TAHH fue la técnica empleada durante los inicios del trasplante hepático, si bien no tuvo una amplia difusión al asociarse a problemas de competencia de flujo portal entre hígado nativo e injerto, obstrucción de drenaje venoso y falta de espacio en el abdomen4. La AVP asociada al TAHH constituye una variante técnica que evita el fenómeno de competencia por el flujo portal entre los 2 hígados y deja el hilio hepático nativo intacto13–16,18. Nuestro modelo actual disminuye el número de anastomosis vasculares respecto a otros modelos13,15–17, lo cual disminuye el riesgo de trombosis, que resulta especialmente importante en el contexto del xenotrasplante, ya que la sangre porcina muestra una alta tendencia a la coagulación24.
En el estudio hemodinámico, durante el pinzamiento de la vena cava infrahepática se observa un descenso de la precarga por disminución del retorno venoso, que se refleja en el descenso del volumen telediastólico global y del volumen sanguíneo intratorácico. A su vez, el descenso de la precarga provoca la disminución del GC y, como consecuencia, de la presión arterial media. Esta situación se intenta compensar con un aumento de las RVS25. Durante la reperfusión, la liberación del pinzamiento aórtico y la incorporación del injerto disminuyen las RVS, además, la precarga aumenta por incorporación del volumen retenido25,26. Estos 2 hechos producen un aumento compensatorio del GC al que también contribuye el aumento de la FC.
Finalizado el trasplante, el GC aumenta respecto al valor basal, asegurando la reperfusión del injerto. El incremento del GC ocurre fundamentalmente a expensas de la FC, que aumenta sus valores tras la reperfusión, y este hecho podría deberse a una reposición conservadora de la volemia. El que los marcadores de la precarga, volumen telediastólico global y volumen sanguíneo intratorácico únicamente varíen tras el pinzamiento vascular parece corroborarlo. Así, una reposición de la volemia más agresiva habría elevado el GC con una menor elevación de la FC. Se podría señalar que un aumento del GC podría ser perjudicial en un fallo hepático agudo donde el GC permanece elevado. Sin embargo, este fenómeno se ha visto también en la clínica del trasplante hepático tras la reperfusión del injerto y normalmente es bien tolerado por los receptores25. Por otro lado, la presión venosa central aumenta al final de la cirugía, lo que podría deberse al cierre de la cavidad abdominal más que a cambios en la volemia, mostrándose un indicador poco fiable de la precarga.
Las variaciones bioquímicas son poco importantes debido, probablemente, a la funcionalidad del hígado nativo y a la menor infusión de fluidos que en un trasplante hepático clínico27. Además, tanto las variaciones del sodio como las del bicarbonato y pCO2 están dentro de los valores de referencia. Aunque el hígado nativo dificulta el estudio de la respuesta bioquímica, el implante del injerto arterializado no provoca, por sí mismo, cambios metabólicos significativos.
Respecto al estudio histopatológico todas las muestras, en las 3 fases del estudio, conservan la arquitectura y morfología hepáticas. El principal hallazgo histopatológico precoz es la presencia de focos de necrosis perilobular. Este hallazgo se ha descrito en modelos en ratas28 y en estudios de regeneración hepática29. Schleimer et al. indican que la elevada concentración de oxígeno del flujo portal arterializado podría ser la causa, ya que los radicales libres de oxígeno no neutralizados por el glutatión podría iniciar la cascada de la apoptosis29. En nuestro modelo el origen de los focos de necrosis parece ser multifactorial, sobre todo por la isquemia-reperfusión y el hiperaflujo arterial portal.
A los 10 días el principal hallazgo es la proliferación conectiva perilobular, que está asociada históricamente a la AVP y aparece descrita tanto en la cirugía de la hipertensión portal como en modelos de TOH-AVP30–33. Probablemente es consecuencia de la adaptación del injerto al hiperaflujo. En los modelos clínicos de TAHH-AVP, la arterialización se realiza interponiendo un injerto vascular similar al descrito por nuestro grupo13–15 y, aunque estos autores no objetivan proliferación conectiva en sus injertos, debemos tener en cuenta que el estroma hepático en el cerdo está mucho más desarrollado que el estroma hepático humano34.
De igual manera, en nuestro modelo se observa un aumento significativo de áreas con regeneración posnecrótica, como evolución de la necrosis perilobular evidenciada en el estudio precoz. Además, y asociada a estas áreas posnecróticas, objetivamos hiperplasia de conductos biliares, que no pensamos que se relacione con una obstrucción parcial del drenaje biliar, ya que la producción biliar fue continua y la escintigrafía dinámica mostró una adecuada eliminación biliar por parte del injerto. El daño por isquemia-reperfusión que origina una colangiopatía isquémica asociada con estenosis de canalículos podría ser el origen de la proliferación de nuevos conductos biliares.
El estudio histopatológico tardío reveló áreas de regeneración nodular posnecrótica (lóbulos desorganizados con hepatocitos atróficos y grupos de hepatocitos dentro del tejido conectivo), junto con una disminución de la hiperplasia de colangiolos.
En todas las fases del estudio histopatológico se objetivó dilatación sinusoidal, congestión e infiltrado mononuclear inespecífico. La dilatación sinusoidal coincide con la descrita en modelos clínicos y experimentales de TAHH-AVP15,28 y la congestión, también aparece detallada en un modelo de regeneración hepática tras una resección del 70% del hígado asociada a una AVP con regulación del flujo29. Estos hallazgos probablemente sean debidos al hiperaflujo. En cuanto al infiltrado mononuclear de tipo inespecífico, no asociado a rechazo35, también se ha descrito en hígados arterializados de rata30,36 y perro37, y Erhard et al. describieron infiltrado linfocítico en los sinusoides de un modelo clínico de TAHH-AVP14.
Finalmente, en nuestro modelo no observamos ni dilatación, ni aumento de las fibras de colágeno en la vena, porta tal y como describieron Li et al.38. Tampoco objetivamos esteatosis en ninguna de nuestras preparaciones, aunque sí que aparece descrita en modelos similares15,32.
En conclusión, el TAHH-AVP se tolera bien hemodinámicamente, y conlleva un ligero incremento del GC. Las variaciones en el metabolismo y equilibrio ácido-base son mínimas, y son debidas más a la técnica quirúrgica que a la reperfusión del injerto arterializado. Este modelo no condiciona cambios importantes en la histología hepática, y mantiene la arquitectura y estructura hepática funcional, si bien es común encontrar focos de necrosis perilobular a los 3 días y proliferación conectiva perilobular a los 10 días.
Autoría/colaboradoresContribución específica de cada autor:
Olga M. Fernandez-Rodriguez participó en el desarrollo de la investigación, diseño experimental, redacción del artículo y análisis de datos. Dirección: Animalario. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Antonio Ríos participó en el desarrollo de la investigación, diseño experimental y redacción del artículo. Dirección: Departamento de Cirugía. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Carlos G. Palenciano participó en el desarrollo de la investigación, diseño experimental, y análisis de datos. Dirección: Departamento de Anestesia. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Pablo Ramírez participó en el diseño experimental. Dirección: Departamento de Cirugía. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
José Luis Navarro participó en el desarrollo de la investigación. Dirección: Departamento de Medicina Nuclear. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Laura Martínez-Alarcón participó en el desarrollo de la investigación. Dirección: Departamento de Cirugía. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Carlos Martínez participó en el desarrollo de la investigación y análisis de datos. Dirección: Unidad de Cirugía Experimental. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Teodomiro Fuente participó en el desarrollo de la investigación. Dirección: Departamento de Medicina Nuclear. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
José Antonio Pons participó en el desarrollo de la investigación. Dirección: Departamento de Medicina Interna. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
José Antonio Navarro participó en el desarrollo de la investigación y análisis de datos. Dirección: Departamento de Enfermedad Animal. Facultad de Veterinaria. Espinardo, 30100, Murcia. España.
Maruja Majado participó en el desarrollo de la investigación. Dirección: Departamento de Hematología. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Pedro Martínez participó en el desarrollo de la investigación. Dirección: Departamento de Análisis Clínicos. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Pascual Parrilla participó en el diseño experimental. Dirección: Departamento de Cirugía. Hospital Clínico Universitario Virgen de la Arrixaca. Ctra. Madrid-Cartagena, s/n. El Palmar, 30120, Murcia, España.
Conflicto de interesesSin conflicto de intereses.
Los autores agradecen al Dr. Pedro Luis Tornel, Dr. Pablo Pelegrin, Dr. Manuel Canteras y a la Dra. Guadalupe Ruiz Merino su contribución esencial en el trabajo.