La exenteración pélvica (EP) ofrece la mejor oportunidad de curación para neoplasias malignas primarias o recurrentes de órganos pélvicos localmente avanzadas con invasión de estructuras adyacentes. Los objetivos de este estudio fueron analizar los resultados de las exenteraciones pélvicas por diferentes orígenes que incluyeron resección rectal y valorar los resultados de la reconstrucción fecal y urinaria.
MétodosEstudio retrospectivo de una serie de 111 exenteraciones pélvicas con resección rectal para distintos tipos de cáncer pélvico realizadas entre enero de 2000 y abril de 2014 en dos centros de referencia terciarios nacionales.
ResultadosSe realizaron 36 anastomosis colorrectales. Las reconstrucciones urológicas realizadas fueron 30 colostomías húmedas en asa lateral (DBWC), 14 conductos ileales de Bricker (CIB) y 2 ureterocutaneostomías. Setenta y un pacientes (64%) presentaron complicaciones postoperatorias. Seis muertes (5,4%) ocurrieron dentro de los 30días postoperatorios. La supervivencia global a 5años después de resección R0 fue del 62,6%; R1: 42,7%; R2: 24,2% (p=0,018). La invasión del margen de resección se asoció con los peores índices de supervivencia global, recidiva local y recurrencia a distancia.
ConclusionesLas exenteraciones pélvicas por diferentes neoplasias deben realizarse en centros de referencia y por cirujanos especializados. La anastomosis después de la exenteración pélvica supraelevadora modificada para el cáncer de ovario es segura. La DBWC puede considerarse una opción válida para la reconstrucción urológica. El factor pronóstico más importante después de la exenteración pélvica para los tumores pélvicos malignos es el estado de los márgenes quirúrgicos.
Pelvic exenteration (PE) offers the best chance of cure for locally advanced primary or recurrent pelvic organ malignancies invading adjacent organs. The aims of this study were to analyse results for any pelvic exenteration that includes rectal resection and the analysis of results of fecal and urinary reconstruction.
MethodFrom January 2000 to April 2014, 111 PE with rectal resection for any pelvic cancer were analysed retrospectively at two national tertiary referral centers.
ResultsThirty-six colorectal anastomosis were performed. Urologic reconstructions performed were 30 double barrelled wet colostomy (DBWC), 14 Bricker ileal conduit (BIC), and 2 ureterocutaneostomies. Postoperative complications occurred in 71 patients (64%). Six deaths (5.4%) occurred within 30 postoperative days. Five-year overall survival following R0 resection was 62.6%; R1: 42.7%; R2: 24.2% (P=.018). The resection margin status was associated with overall survival, local recurrence and distant recurrence.
ConclusionPelvic exenterations for any cause need to be performed in referral centers and by specialized surgeons. Anastomosis after modified supralevator pelvic exenteration for ovarian cancer, is safe. DBWC can be considered a valid option for urologic reconstruction. The most important prognostic factor after pelvic exenteration for malignant pelvic tumors is the status of surgical margins.
La exenteración pélvica (EP) representa la mejor alternativa curativa en tumores primarios localmente avanzados o metástasis pélvicas recurrentes en órganos adyacentes1.
De acuerdo al sexo del paciente, la EP se puede definir como: exenteración pélvica anterior (EPA), que incluye la exéresis de la vejiga y los uréteres distales además de la resección de los órganos ginecológicos centrales en mujeres, u órganos urológicos en hombres, sin incluir la resección rectosigmoidea; exenteración pélvica posterior (EPP), cuando el recto es resecado además de los órganos ginecológicos y urológicos, pero la resección de la vejiga no está incluida, y exenteración pélvica total (EPT), cuando los órganos intestinales, ginecológicos y urológicos son removidos. La EPP puede incluir la resección del canal anal o bien preservarlo (exenteración pélvica supraelevadora modificada [EPSM])2. Cualquiera de estas técnicas es sumamente agresiva para el paciente y de gran dificultad técnica para los cirujanos.
La EP es más frecuentemente indicada para enfermedades recurrentes que primarias. El cáncer cervical recurrente es la enfermedad con mayor tasa de EP3. Aproximadamente el 10% de los cánceres rectales primarios presentan infiltración de órganos adyacentes4 y el 50% de los cánceres rectales recurrentes son extraluminales5.
Sea el tumor un cáncer de recto primario o una recidiva del rectal, o bien un cáncer ginecológico o urológico, la resección total con márgenes patológicos libres es uno de los factores pronósticos más importantes después de la EP por cáncer6-8. Diferentes series han demostrado una doble tasa de supervivencia libre de enfermedad a 5años (del 30 al 60%) al comparar los pacientes que presentan márgenes negativos con aquellos que presentan márgenes positivos9.
Una vez completada la resección, la reconstrucción del tracto urinario y fecal constituye el segundo tema fundamental por afrontar. La indicación de la reconstrucción intestinal posterior a la EP constituye una difícil decisión para los cirujanos colorrectales, así como la realización de una anastomosis primaria puede presentar dificultad técnica.
El objetivo principal de nuestro estudio fue analizar los resultados quirúrgicos tras EP por cualquier origen tumoral que incluya resección rectal. Nuestro objetivo secundario fue analizar los resultados de las técnicas de reconstrucción intestinal y urinaria.
MétodosRevisión retrospectiva de una serie de pacientes consecutivos a quienes se les realizó una EP con resección rectal para cualquier tipo de cáncer pélvico, entre el año 2000 y el año 2014, en dos centros terciarios nacionales de referencia: el Hospital Universitario de Bellvitge (HUB) y el Hospital Universitario del Vall d’Hebron (HUVH), en Barcelona. El estudio ha sido aprobado por el comité ético local.
Todos los pacientes fueron intervenidos por un equipo especializado en cirugía colorrectal, con el apoyo de cirujanos ginecólogos, urológicos, ortopédicos de la columna vertebral y cirujanos plásticos, según del caso. El número de cirujanos involucrados en las intervenciones fue restringido para cualquiera de las especialidades. Las decisiones en cuanto al tratamiento fueron discutidas en sesiones con un equipo multidisciplinario de referencia. Todos los pacientes incluidos en dicha serie fueron intervenidos con intención curativa.
La indicación quirúrgica se estableció luego de confirmar el diagnóstico por biopsia en tumores primarios y en casos recurrentes. Sin embargo, algunas de las indicaciones quirúrgicas para recidivas pélvicas estuvieron basadas en el alto nivel de sospecha a partir de los hallazgos radiológicos.
Las imágenes y la estatificación de los tumores fueron obtenidas por resonancia magnética (RM) de alta resolución de la pelvis, tomografía computarizada (TC) de tórax, abdomen y pelvis, y tomografía de emisión de positrones (PET).
El tratamiento quirúrgico de recidiva pélvica fue indicado en casos en los que las lesiones pélvicas no infiltraran las estructuras vasculares ni las raíces de los nervios sacros (nivel S2 o superior). En el caso de que los márgenes negativos fueran factibles, la presencia de metástasis a distancia resecables (hepática o pulmonar) no se consideró criterio de exclusión para la realización de la exenteración.
Las EP son clasificadas como EPT, si incluyen la remoción de la vejiga y uréteres distales, el recto y los órganos centrales pélvicos, o EPP, si comportan la remoción de los órganos centrales junto al rectosigmoide, con o sin resección del canal anal (EPSM)7. Enfoques individualizados, tales como la sacrectomía, fueron también registrados10.
La confección de estoma derivativo posterior a la anastomosis colorrectal se realizó según criterio del cirujano.
La decisión de realizar del tipo de reconstrucción urinaria se tomó tras la discusión entre el paciente y el urólogo especialista, el cirujano colorrectal y de acuerdo a la situación intraoperatoria. Se procedió tanto a la ureterocutaneostomía como a la construcción de conductos urinarios. Las técnicas para la confección de los conductos urinarios incluyeron una ureteroileostomía, también llamada conducto ileal de Bricker (CIB)11, o colostomía húmeda de doble cañón (CHDC)12, en la que los uréteres se encuentran implantados en una colostomía latero-terminal para formar así una ureterocolostomía.
Las decisiones sobre la reconstrucción perineal estuvieron basadas en el tamaño del defecto residual. Si el defecto residual era pequeño, se realizó un cierre primario. Ante defectos más amplios, se realizó un cierre combinado con epiploplastia o malla. En caso de grandes defectos perineales se recurrió a la realización de colgajos miocutáneos por los cirujanos plásticos.
Se registraron los datos demográficos y preoperatorios: índice de masa corporal, edad, diagnóstico de cáncer, comorbilidades (hábito tabáquico, hipertensión, diabetes y enfermedad pulmonar), ASA score de la Sociedad Americana de Anestesiólogos y datos preoperatorios de laboratorio (hemoglobina, creatinina y albúmina). El tratamiento adyuvante y neoadyuvante también fue registrado. Los resultados clínicos se obtuvieron de las historias médicas.
Las complicaciones se catalogaron según la clasificación de Clavien Dindo13. Se registraron la mortalidad y las complicaciones postoperatorias a corto plazo dentro de los primeros 30días postoperatorios, o durante la estancia hospitalaria si esta era mayor de 30días; incluían: septicemia, fallo multiorgánico, hemoperitoneo postoperatorio, fuga anastomótica, dehiscencia de la herida perineal, índices y causas de reintervención quirúrgica. La fuga anastomótica fue diagnosticada en casos de contenido fecal en drenajes pélvicos, en la herida abdominal o perineal y/o por la extravasación anastomótica de contraste en TC. La fuga urinaria fue definida como la presencia de concentración elevada de creatinina en los drenajes abdominales o a través de la herida y/o ante evidencia de extravasación de contraste desde el conducto urinario identificada en prueba de imagen.
Las complicaciones postoperatorias tras los primeros 30días del postoperatorio fueron también evaluadas e incluidas. Se analizaron con especial interés las fístulas enteroperineales, las hernias paraestómicas o perineales y las posibles complicaciones urológicas (estenosis o pielonefritis).
Se registraron los informes patológicos de histología, la situación ganglionar y el estatus de los márgenes. El estado del margen de resección fue R0: márgenes de resección microscópicamente libres de al menos 1mm; R1: margen de resección microscópicamente involucrado con tumor a menos de 1mm; R2: margen de resección macroscópicamente afectado.
Se calcularon la supervivencia global (SG), la recidiva local (RL) y la recidiva a distancia (RD) a 3 y 5años.
Los datos cuantitativos se presentan como media y desviación estándar o mediana y el rango intercuartil. Los datos cualitativos se presentan como números absolutos y porcentajes. El estudio comparativo fue realizado usando la prueba de ji-cuadrado para datos cualitativos y la prueba de Mann-Whitney o la prueba de Kruskal-Wallis para datos cuantitativos. Los factores pronósticos de supervivencia fueron evaluados mediante el análisis univariante de variables registradas por el método de Kaplan-Meier y la prueba de rango logarítmico (log-rank test). Se realizó una regresión multivariante de Cox para ajustar los resultados de supervivencia por el tipo de tumor y el estado del margen de resección. Todos los valores de p inferiores a 0,05 fueron considerados significativos. Se utilizó el software R3.1.1 (R Fundación para el Cálculo Estadístico, Viena, Austria).
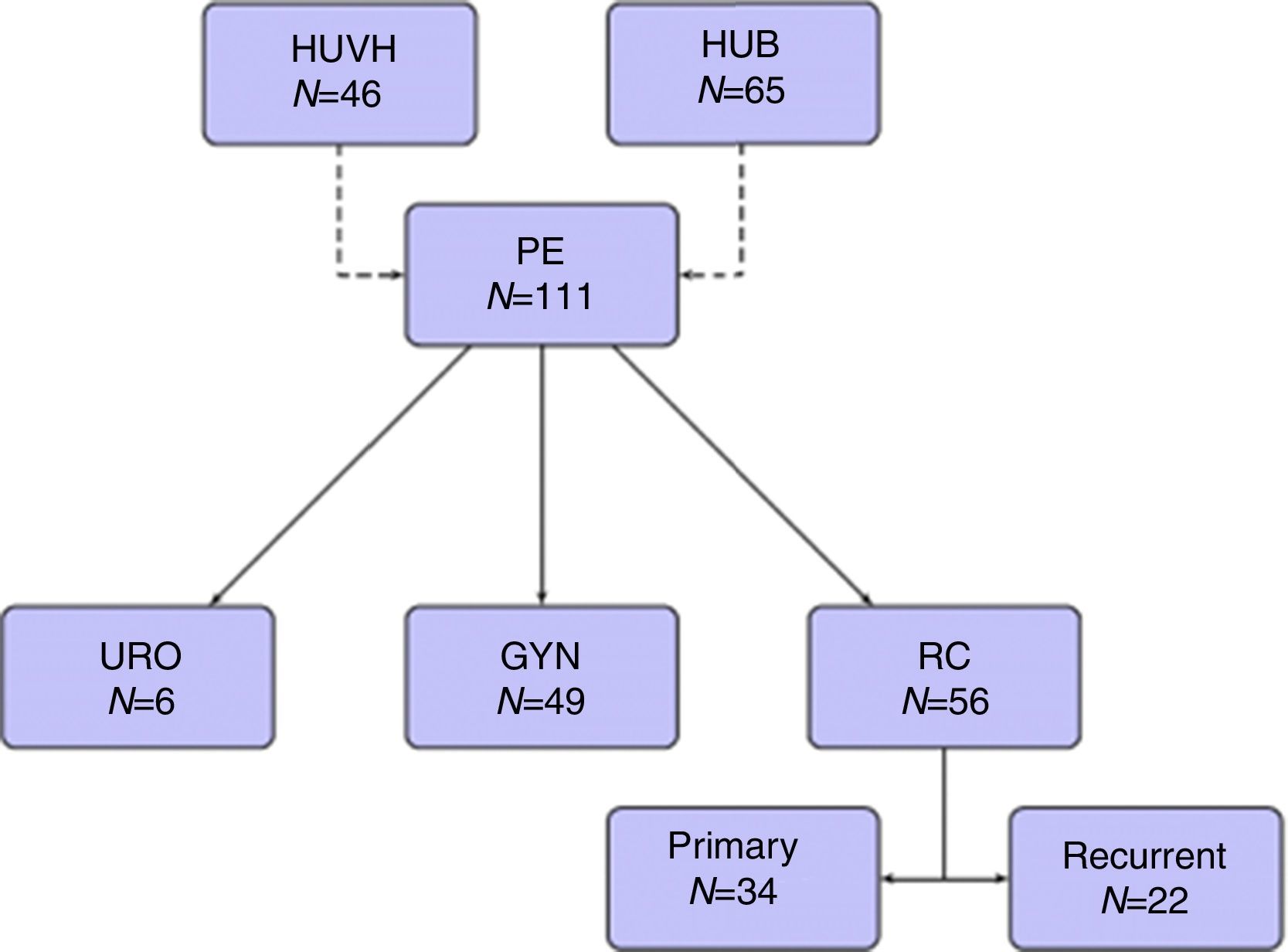
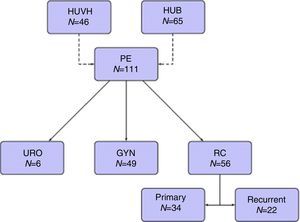
ResultadosCiento once pacientes fueron incluidos durante el período de estudio: 65 del HUB y 46 del HUVH. Parte de los pacientes del HUB con recidivas de cáncer rectal han sido recientemente incluidos en una publicación previa14.
Cuarenta y nueve pacientes (44,1%) fueron intervenidos quirúrgicamente por tumores ginecológicos, 34 (30,6%) por cáncer rectal primario, 22 (19,8%) por recidivas de cáncer rectal y 6 (5,4%) por tumores urológicos (fig. 1).
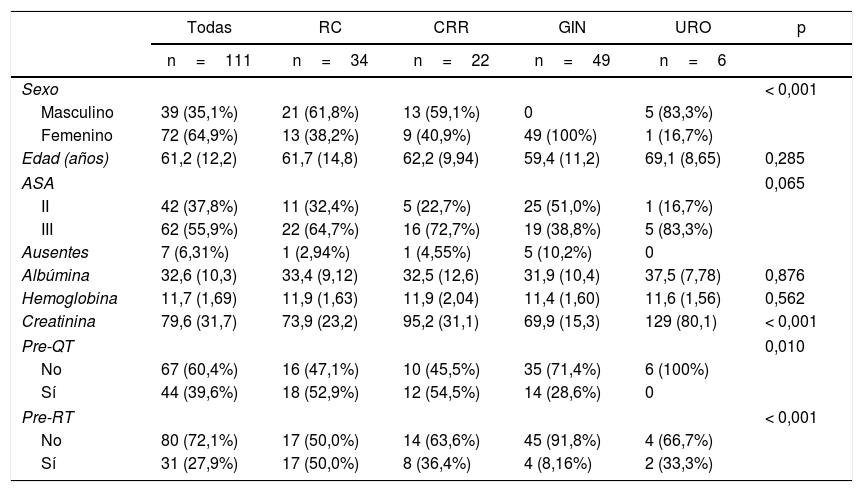
La distribución del tratamiento preoperatorio y sus variables se muestra en la tabla 1, estratificada como tumor primario de tipo maligno. La edad media fue de 61,2años, y el 35,1% de los pacientes fueron de sexo masculino. No se registraron diferencias en los niveles de hemoglobina, función renal (medida por la creatinina), condiciones nutricionales (medidas por la albúmina), comorbilidades o ASA score (índice establecido por la Sociedad Americana de Anestesiólogos).
Variables preoperatorias estratificadas por tipo de malignidad primaria
| Todas | RC | CRR | GIN | URO | p | |
|---|---|---|---|---|---|---|
| n=111 | n=34 | n=22 | n=49 | n=6 | ||
| Sexo | < 0,001 | |||||
| Masculino | 39 (35,1%) | 21 (61,8%) | 13 (59,1%) | 0 | 5 (83,3%) | |
| Femenino | 72 (64,9%) | 13 (38,2%) | 9 (40,9%) | 49 (100%) | 1 (16,7%) | |
| Edad (años) | 61,2 (12,2) | 61,7 (14,8) | 62,2 (9,94) | 59,4 (11,2) | 69,1 (8,65) | 0,285 |
| ASA | 0,065 | |||||
| II | 42 (37,8%) | 11 (32,4%) | 5 (22,7%) | 25 (51,0%) | 1 (16,7%) | |
| III | 62 (55,9%) | 22 (64,7%) | 16 (72,7%) | 19 (38,8%) | 5 (83,3%) | |
| Ausentes | 7 (6,31%) | 1 (2,94%) | 1 (4,55%) | 5 (10,2%) | 0 | |
| Albúmina | 32,6 (10,3) | 33,4 (9,12) | 32,5 (12,6) | 31,9 (10,4) | 37,5 (7,78) | 0,876 |
| Hemoglobina | 11,7 (1,69) | 11,9 (1,63) | 11,9 (2,04) | 11,4 (1,60) | 11,6 (1,56) | 0,562 |
| Creatinina | 79,6 (31,7) | 73,9 (23,2) | 95,2 (31,1) | 69,9 (15,3) | 129 (80,1) | < 0,001 |
| Pre-QT | 0,010 | |||||
| No | 67 (60,4%) | 16 (47,1%) | 10 (45,5%) | 35 (71,4%) | 6 (100%) | |
| Sí | 44 (39,6%) | 18 (52,9%) | 12 (54,5%) | 14 (28,6%) | 0 | |
| Pre-RT | < 0,001 | |||||
| No | 80 (72,1%) | 17 (50,0%) | 14 (63,6%) | 45 (91,8%) | 4 (66,7%) | |
| Sí | 31 (27,9%) | 17 (50,0%) | 8 (36,4%) | 4 (8,16%) | 2 (33,3%) | |
CR: cáncer rectal; CRR: cáncer rectal recurrente; GIN: tumores ginecológicos; URO: tumores urológicos.
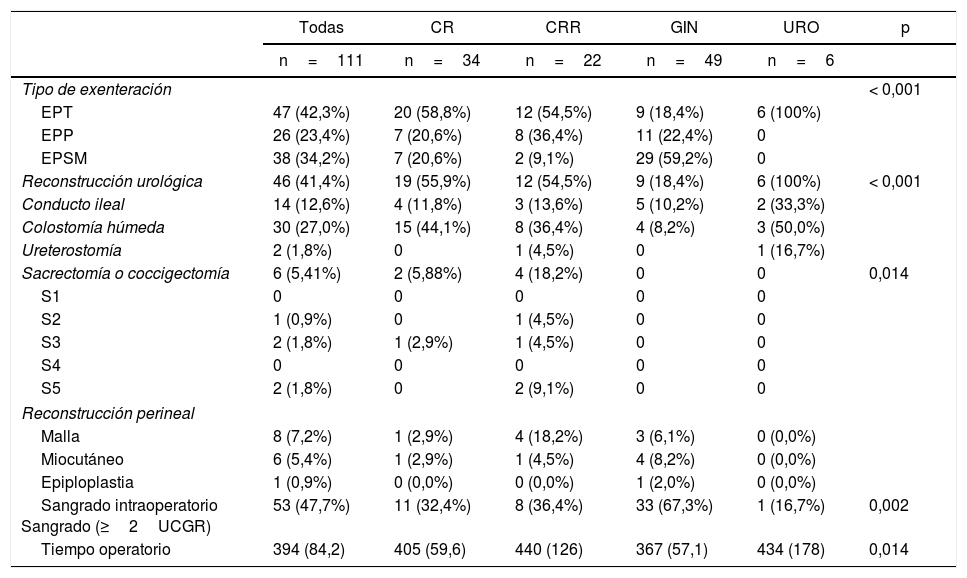
Los datos quirúrgicos e intraoperatorios se informan en la tabla 2. La EPT se realizó en 47 pacientes, la EPSM en 36 pacientes y la EPP en 28 pacientes. La mayoría de los pacientes con tumor ginecológico (29/49, 59,18%) se sometieron a EPSM. Se realizó una sacrectomía o una coccigectomía en 5 pacientes. La duración media de la cirugía fue de 394min. Hubo un tiempo de operación significativamente más corto para tumores ginecológicos. Después de EPSM, se realizaron 36 anastomosis colorrectales: 29 en pacientes ginecológicos (cáncer de ovario, 100%), todos ellos sin ileostomía derivativa, y en 7 en pacientes con neoplasia rectal primaria o recurrente. En seis de estos siete pacientes se realizó ileostomía temporal. Cuatro de las seis ileostomías fueron posteriormente revertidas. La reconstrucción urológica después de EPT consistió en CHDC en 30 pacientes, CIB en 14 pacientes, ureterocutaneostomía en 2 pacientes y un paciente perdido. El 12,6% de los pacientes requirieron reconstrucción perineal: 6 colgajos miocutáneos y 8 reconstrucciones con malla.
Datos quirúrgicos e intraoperatorios estratificados por tipo de malignidad primaria
| Todas | CR | CRR | GIN | URO | p | |
|---|---|---|---|---|---|---|
| n=111 | n=34 | n=22 | n=49 | n=6 | ||
| Tipo de exenteración | < 0,001 | |||||
| EPT | 47 (42,3%) | 20 (58,8%) | 12 (54,5%) | 9 (18,4%) | 6 (100%) | |
| EPP | 26 (23,4%) | 7 (20,6%) | 8 (36,4%) | 11 (22,4%) | 0 | |
| EPSM | 38 (34,2%) | 7 (20,6%) | 2 (9,1%) | 29 (59,2%) | 0 | |
| Reconstrucción urológica | 46 (41,4%) | 19 (55,9%) | 12 (54,5%) | 9 (18,4%) | 6 (100%) | < 0,001 |
| Conducto ileal | 14 (12,6%) | 4 (11,8%) | 3 (13,6%) | 5 (10,2%) | 2 (33,3%) | |
| Colostomía húmeda | 30 (27,0%) | 15 (44,1%) | 8 (36,4%) | 4 (8,2%) | 3 (50,0%) | |
| Ureterostomía | 2 (1,8%) | 0 | 1 (4,5%) | 0 | 1 (16,7%) | |
| Sacrectomía o coccigectomía | 6 (5,41%) | 2 (5,88%) | 4 (18,2%) | 0 | 0 | 0,014 |
| S1 | 0 | 0 | 0 | 0 | 0 | |
| S2 | 1 (0,9%) | 0 | 1 (4,5%) | 0 | 0 | |
| S3 | 2 (1,8%) | 1 (2,9%) | 1 (4,5%) | 0 | 0 | |
| S4 | 0 | 0 | 0 | 0 | 0 | |
| S5 | 2 (1,8%) | 0 | 2 (9,1%) | 0 | 0 | |
| Reconstrucción perineal | ||||||
| Malla | 8 (7,2%) | 1 (2,9%) | 4 (18,2%) | 3 (6,1%) | 0 (0,0%) | |
| Miocutáneo | 6 (5,4%) | 1 (2,9%) | 1 (4,5%) | 4 (8,2%) | 0 (0,0%) | |
| Epiploplastia | 1 (0,9%) | 0 (0,0%) | 0 (0,0%) | 1 (2,0%) | 0 (0,0%) | |
| Sangrado intraoperatorio Sangrado (≥2UCGR) | 53 (47,7%) | 11 (32,4%) | 8 (36,4%) | 33 (67,3%) | 1 (16,7%) | 0,002 |
| Tiempo operatorio | 394 (84,2) | 405 (59,6) | 440 (126) | 367 (57,1) | 434 (178) | 0,014 |
CR: cáncer rectal; CRR: cáncer rectal recurrente; EPP: exenteración pélvica posterior; EPSM: exenteración pélvica supraelevadora modificada; EPT: exenteración pélvica total; GIN: tumores ginecológicos; UCGR: unidad de concentrado de glóbulos rojos; URO: tumores urológicos.
La transfusión intraoperatoria de dos o más unidades de concentrado de glóbulos rojos fue necesaria en 53 pacientes (47,0%).
Los tipos de tumores más comunes fueron adenocarcinoma (87,5%) en cáncer rectal primario y recurrente, adenocarcinoma seroso de cáncer de ovario (37,7%) en tumores ginecológicos y carcinoma de células transicionales infiltrante de vejiga (50%) en tumores urológicos. Otros tumores ginecológicos fueron: adenocarcinoma de ovario (10 casos), tumor de endometrio recurrente (9 casos), tumor ovárico de células limpias (6 casos) y carcinoma escamoso recurrente (6 casos).
Durante el examen patológico no se hallaron células malignas en 10 pacientes. Dos de ellos se sometieron a quimio-radioterapia neoadyuvante y los resultados se interpretaron como una total respuesta patológica. En 8 pacientes el diagnóstico previo realizado mediante imagen no se confirmó después de la cirugía. Tres pacientes con sospecha de recidiva de cáncer rectal mostraron fibrosis inflamatoria, y 5 pacientes con radioterapia previa para el cáncer epidermoide de cuello uterino o de vulva mostraron respuesta inflamatoria actínica. Estos 8 pacientes fueron excluidos del análisis de SG, RL y RD.
Se excluyeron cinco pacientes para el análisis de la tasa de SG, RL y RD debido a pérdida durante el seguimiento, y se excluyó a un paciente para el análisis de la tasa de SG, SG y RD según el tipo de resección y el estado del margen debido a un informe patológico incompleto.
Los márgenes de resección fueron negativos o R0 en 66 de 97 pacientes (68%). No hubo diferencia en el porcentaje de resecciones R0 según el tipo de tumor. En 31 pacientes (32%) los márgenes de resección fueron positivos: 21 R1 y 10 R2.
El número medio de ganglios resecados fue de 20,1 (DE: 12,7). La infiltración ganglionar se presentó en un total de 31 pacientes (44,3%).
Los tratamientos oncológicos complementarios consistieron en terapia neoadyuvante en 75 pacientes, radioterapia en 31 y quimioterapia en 44 pacientes.
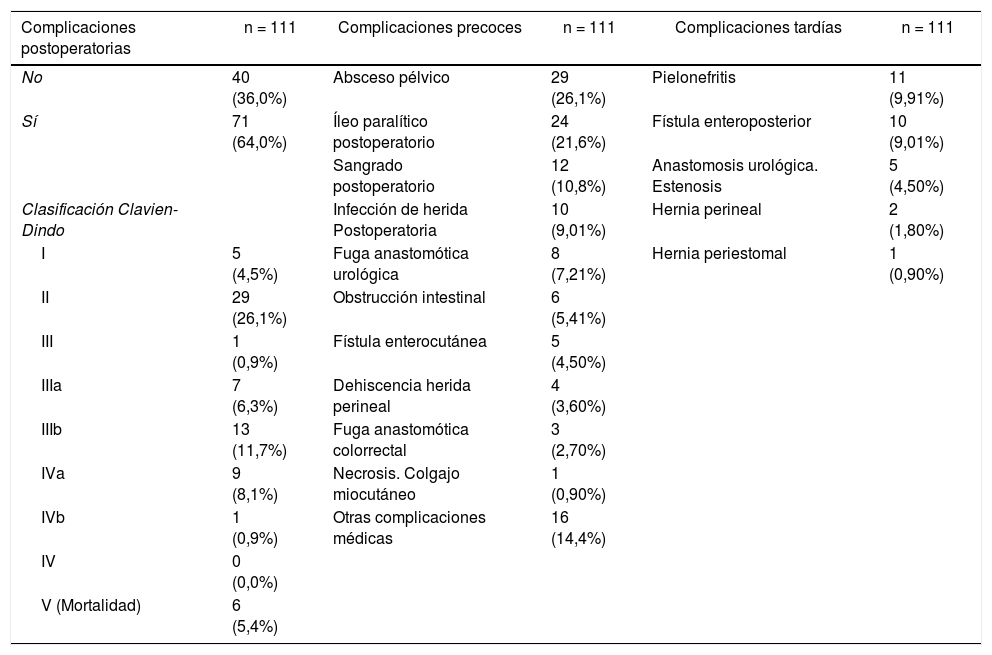
Setenta y un pacientes (64%) desarrollaron al menos una complicación postoperatoria, y el 26,1% fueron considerados en el grupoii de la clasificación de Clavien-Dindo. Las complicaciones postoperatorias más comunes fueron absceso pélvico (26,1%) e íleo postoperatorio (21,6%). Seis pacientes (5,41%) necesitaron ser reintervenidos por obstrucción intestinal. Doce pacientes (10,8%) presentaron hemorragia postoperatoria (necesitaron dos o más unidades de concentrado de glóbulos rojos); 6 de ellos fueron tratados mediante técnicas endovasculares o reintervención. Las complicaciones postoperatorias tempranas se detallan en la tabla 3. Tres (8,33%) de 36 pacientes con anastomosis colorrectal desarrollaron una fuga anastomótica, todos ellos en el grupo de tumores ginecológicos. De estas tres pacientes, una necesitó colostomía final, una requirió drenaje percutáneo y la tercera paciente murió por shock séptico. La complicación urológica temprana más común fue la fuga urinaria en el 13% de los pacientes con reconstrucción urológica (6 pacientes). Tres pacientes presentaron fugas después del procedimiento de Bricker (21%) y fueron tratados con una nefrostomía en dos casos y mediante reimplante uretral en el tercero. Los otros tres pacientes presentaron fugas después de CHDC (10%); se trataron de forma conservadora en dos casos y mediante reimplante uretral en el último paciente. Las complicaciones urológicas tardías más frecuentes fueron pielonefritis (12,6%), que afectó a 11 casos (3 pacientes después de CIB, 7 pacientes después de CHDC y uno de ellos después de ureterocutaneostomía), fístula enteroperineal (9%) y estenosis de anastomosis urológica en 4 pacientes (3,6%) (dos pacientes después de CIB y dos después de CHDC).
Complicaciones postoperatorias precoces y tardías
| Complicaciones postoperatorias | n = 111 | Complicaciones precoces | n = 111 | Complicaciones tardías | n = 111 |
|---|---|---|---|---|---|
| No | 40 (36,0%) | Absceso pélvico | 29 (26,1%) | Pielonefritis | 11 (9,91%) |
| Sí | 71 (64,0%) | Íleo paralítico postoperatorio | 24 (21,6%) | Fístula enteroposterior | 10 (9,01%) |
| Sangrado postoperatorio | 12 (10,8%) | Anastomosis urológica. Estenosis | 5 (4,50%) | ||
| Clasificación Clavien-Dindo | Infección de herida Postoperatoria | 10 (9,01%) | Hernia perineal | 2 (1,80%) | |
| I | 5 (4,5%) | Fuga anastomótica urológica | 8 (7,21%) | Hernia periestomal | 1 (0,90%) |
| II | 29 (26,1%) | Obstrucción intestinal | 6 (5,41%) | ||
| III | 1 (0,9%) | Fístula enterocutánea | 5 (4,50%) | ||
| IIIa | 7 (6,3%) | Dehiscencia herida perineal | 4 (3,60%) | ||
| IIIb | 13 (11,7%) | Fuga anastomótica colorrectal | 3 (2,70%) | ||
| IVa | 9 (8,1%) | Necrosis. Colgajo miocutáneo | 1 (0,90%) | ||
| IVb | 1 (0,9%) | Otras complicaciones médicas | 16 (14,4%) | ||
| IV | 0 (0,0%) | ||||
| V (Mortalidad) | 6 (5,4%) |
En los primeros 30 días se registraron seis muertes (5,4%) por sangrado, fuga de anastomosis, insuficiencia respiratoria y paro cardíaco.
El tiempo medio de seguimiento fue de 8,5 meses (DE: 4,3). Los motivos de mortalidad fueron progresión del cáncer en 41 pacientes y motivos no oncológicos en 13 pacientes. La recidiva local se diagnosticó en 27 pacientes, con una media de 17,3 (DE: 14,6) meses, mientras que se diagnosticaron metástasis a distancia en 27 pacientes, con una media de 17,1 (DE: 12,1) meses.
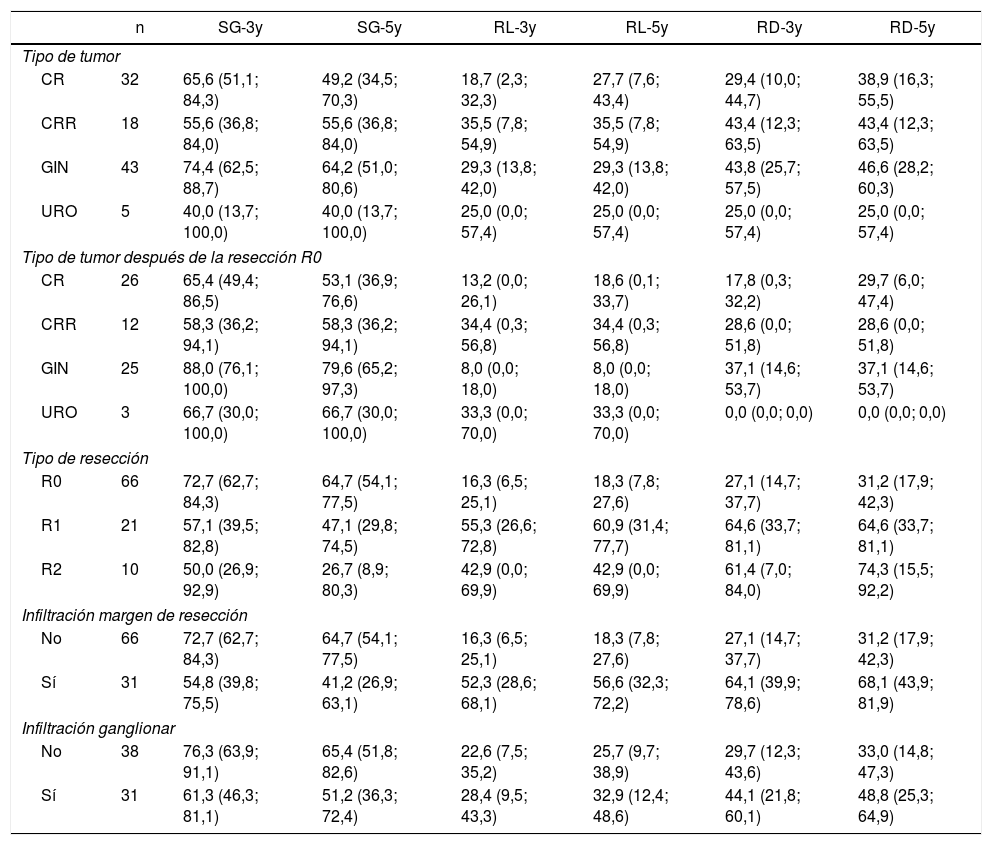
La SG, la RL y la RD a 3 y 5 años, según el tipo de tumor, el tipo de tumor después de la resección R0, el estado del margen de resección y la invasión ganglionar, se muestran en la tabla 4.
Supervivencia Global a 3 y 5 años, Recidiva Local y Recidiva a Distancia
| n | SG-3y | SG-5y | RL-3y | RL-5y | RD-3y | RD-5y | |
|---|---|---|---|---|---|---|---|
| Tipo de tumor | |||||||
| CR | 32 | 65,6 (51,1; 84,3) | 49,2 (34,5; 70,3) | 18,7 (2,3; 32,3) | 27,7 (7,6; 43,4) | 29,4 (10,0; 44,7) | 38,9 (16,3; 55,5) |
| CRR | 18 | 55,6 (36,8; 84,0) | 55,6 (36,8; 84,0) | 35,5 (7,8; 54,9) | 35,5 (7,8; 54,9) | 43,4 (12,3; 63,5) | 43,4 (12,3; 63,5) |
| GIN | 43 | 74,4 (62,5; 88,7) | 64,2 (51,0; 80,6) | 29,3 (13,8; 42,0) | 29,3 (13,8; 42,0) | 43,8 (25,7; 57,5) | 46,6 (28,2; 60,3) |
| URO | 5 | 40,0 (13,7; 100,0) | 40,0 (13,7; 100,0) | 25,0 (0,0; 57,4) | 25,0 (0,0; 57,4) | 25,0 (0,0; 57,4) | 25,0 (0,0; 57,4) |
| Tipo de tumor después de la resección R0 | |||||||
| CR | 26 | 65,4 (49,4; 86,5) | 53,1 (36,9; 76,6) | 13,2 (0,0; 26,1) | 18,6 (0,1; 33,7) | 17,8 (0,3; 32,2) | 29,7 (6,0; 47,4) |
| CRR | 12 | 58,3 (36,2; 94,1) | 58,3 (36,2; 94,1) | 34,4 (0,3; 56,8) | 34,4 (0,3; 56,8) | 28,6 (0,0; 51,8) | 28,6 (0,0; 51,8) |
| GIN | 25 | 88,0 (76,1; 100,0) | 79,6 (65,2; 97,3) | 8,0 (0,0; 18,0) | 8,0 (0,0; 18,0) | 37,1 (14,6; 53,7) | 37,1 (14,6; 53,7) |
| URO | 3 | 66,7 (30,0; 100,0) | 66,7 (30,0; 100,0) | 33,3 (0,0; 70,0) | 33,3 (0,0; 70,0) | 0,0 (0,0; 0,0) | 0,0 (0,0; 0,0) |
| Tipo de resección | |||||||
| R0 | 66 | 72,7 (62,7; 84,3) | 64,7 (54,1; 77,5) | 16,3 (6,5; 25,1) | 18,3 (7,8; 27,6) | 27,1 (14,7; 37,7) | 31,2 (17,9; 42,3) |
| R1 | 21 | 57,1 (39,5; 82,8) | 47,1 (29,8; 74,5) | 55,3 (26,6; 72,8) | 60,9 (31,4; 77,7) | 64,6 (33,7; 81,1) | 64,6 (33,7; 81,1) |
| R2 | 10 | 50,0 (26,9; 92,9) | 26,7 (8,9; 80,3) | 42,9 (0,0; 69,9) | 42,9 (0,0; 69,9) | 61,4 (7,0; 84,0) | 74,3 (15,5; 92,2) |
| Infiltración margen de resección | |||||||
| No | 66 | 72,7 (62,7; 84,3) | 64,7 (54,1; 77,5) | 16,3 (6,5; 25,1) | 18,3 (7,8; 27,6) | 27,1 (14,7; 37,7) | 31,2 (17,9; 42,3) |
| Sí | 31 | 54,8 (39,8; 75,5) | 41,2 (26,9; 63,1) | 52,3 (28,6; 68,1) | 56,6 (32,3; 72,2) | 64,1 (39,9; 78,6) | 68,1 (43,9; 81,9) |
| Infiltración ganglionar | |||||||
| No | 38 | 76,3 (63,9; 91,1) | 65,4 (51,8; 82,6) | 22,6 (7,5; 35,2) | 25,7 (9,7; 38,9) | 29,7 (12,3; 43,6) | 33,0 (14,8; 47,3) |
| Sí | 31 | 61,3 (46,3; 81,1) | 51,2 (36,3; 72,4) | 28,4 (9,5; 43,3) | 32,9 (12,4; 48,6) | 44,1 (21,8; 60,1) | 48,8 (25,3; 64,9) |
CR: cáncer rectal; CRR: cáncer rectal recurrente; GIN: tumores ginecológicos; R0: márgenes de resección microscópicamente libres de al menos 1mm; R1: margen de resección microscópicamente involucrado con tumor a menos de 1mm; R2: margen de resección macroscópicamente afecto; URO: tumores urológicos.
La SG a 5 años según el tipo de tumor (todas las resecciones incluidas) y con R0 (excluidas las resecciones R1-R2) fue del 49,2 y del 53,1% para cáncer rectal, del 55,6 y del 58,3% para cáncer rectal recurrente, del 64,2 y del 79,6% para tumores ginecológicos, y del 40 y del 66,7% para tumores urológicos. La SG a 5años después de la resección completa (R0) fue del 64,7%. Fue menor para aquellos con enfermedad residual: 47,1% para R1 y 26,7% para R2 (p=0,01).
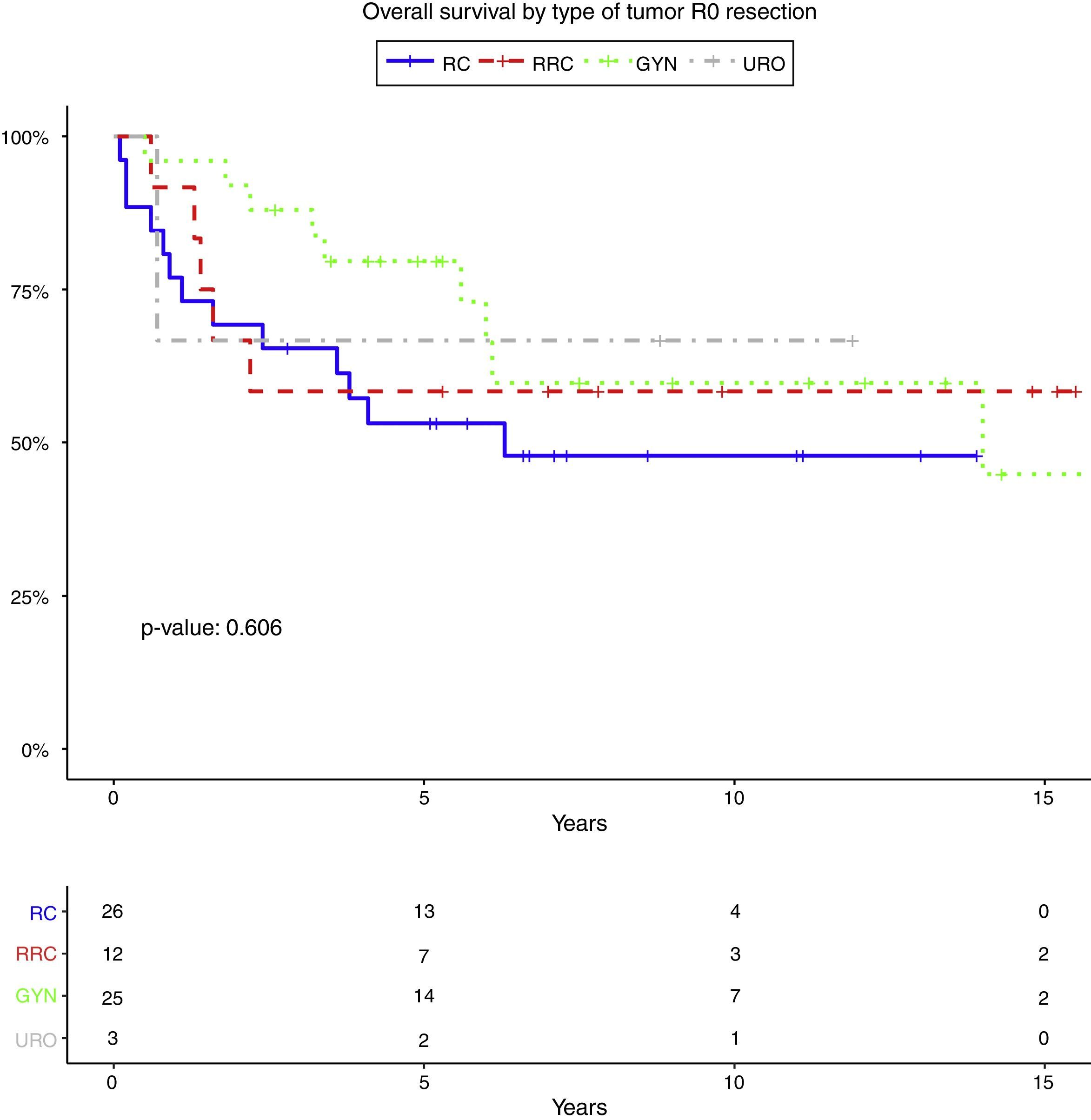
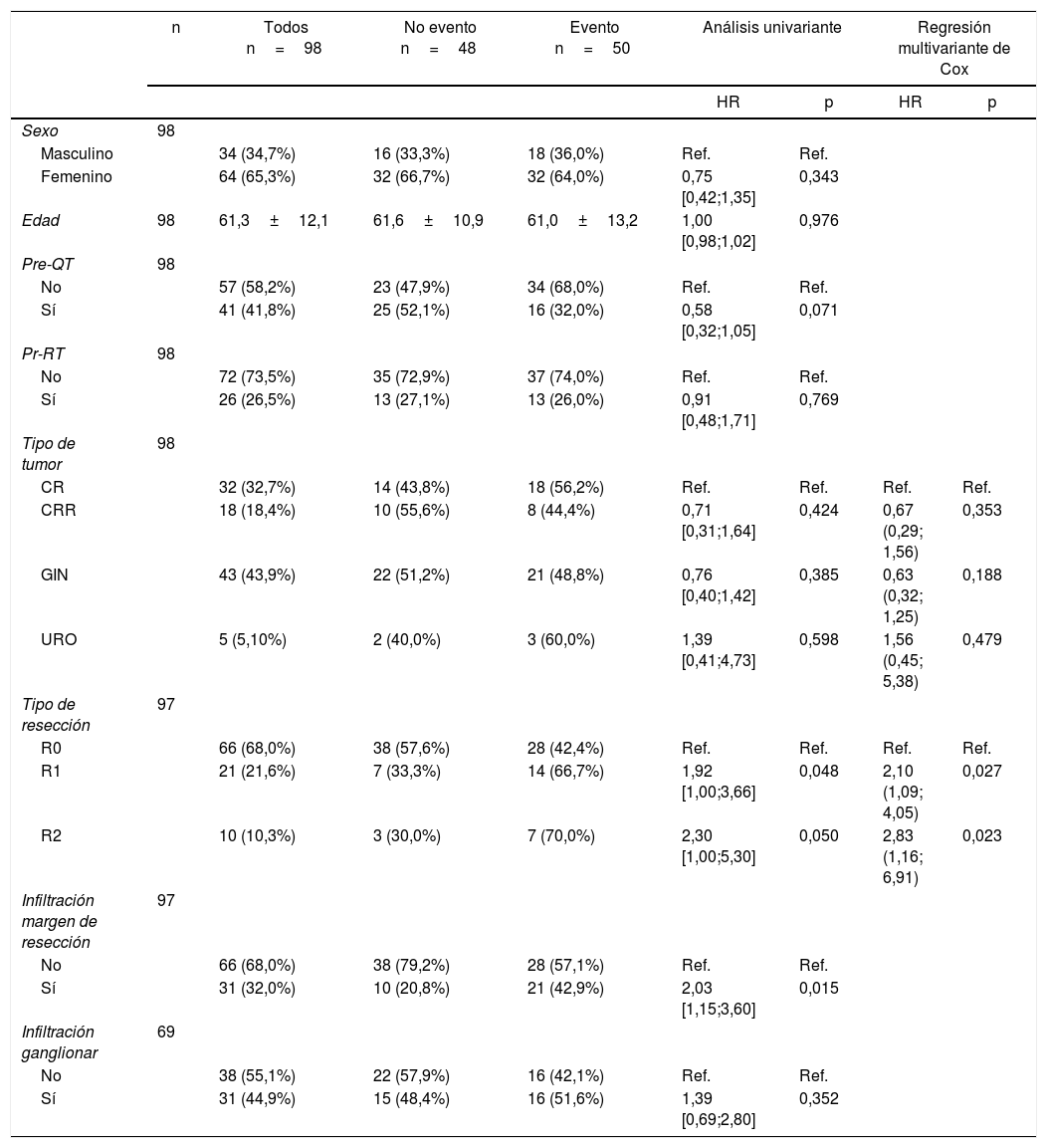
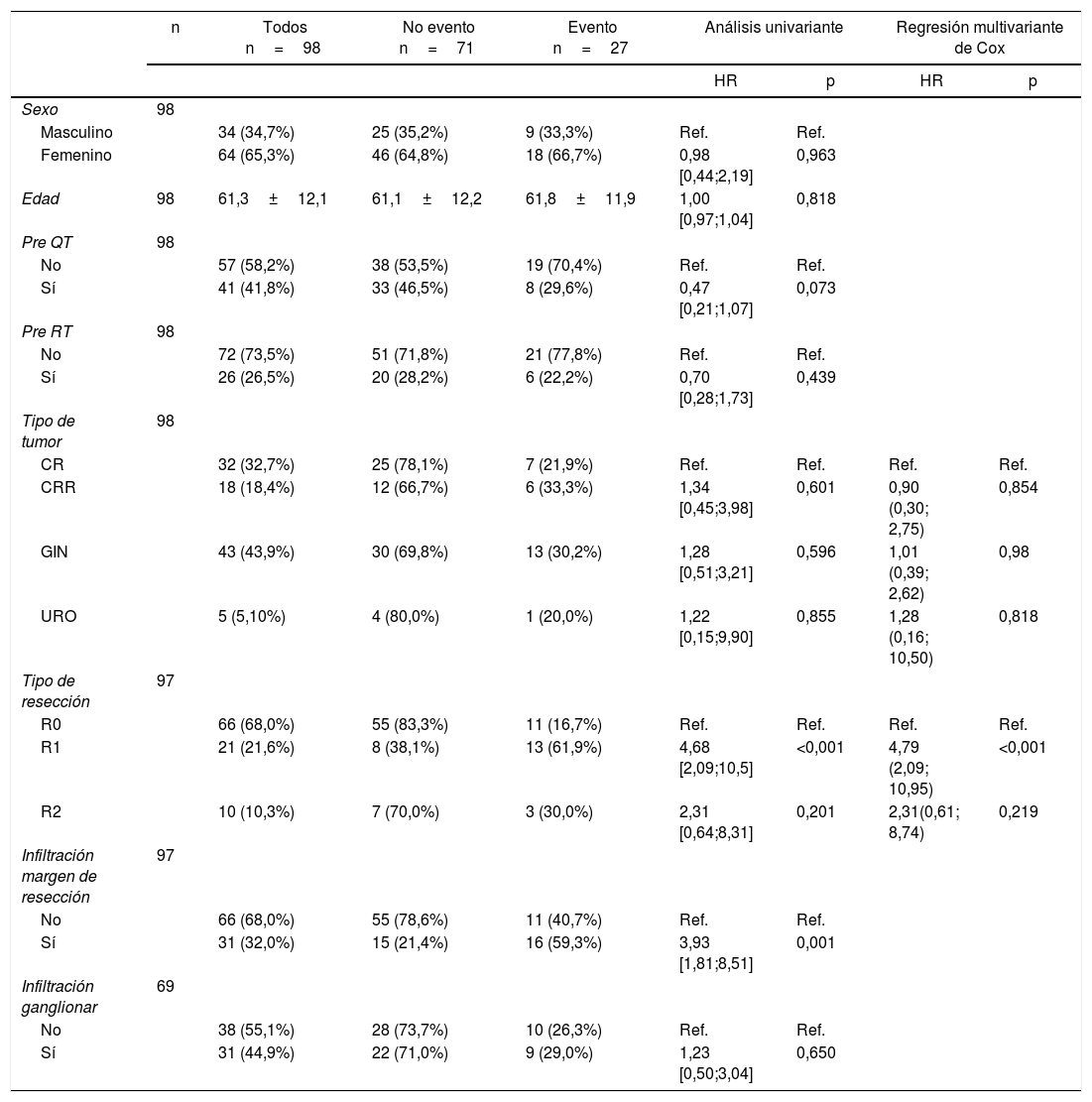
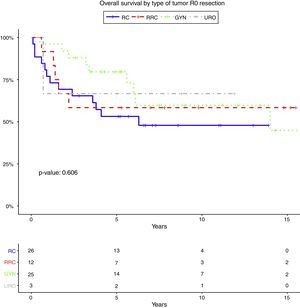
Las tablas 5-7 describen el análisis de los factores pronósticos. El análisis univariante mostró que el sexo, la edad, el tipo de tumor, la quimioterapia neoadyuvante, la radioterapia o el estado de los ganglios no estaban asociados con la SG, la RL y RD. Después de la resección R0, el tipo de tumor no fue un factor pronóstico de SG (fig. 2).
Factores pronósticos para la supervivencia global
| n | Todos n=98 | No evento n=48 | Evento n=50 | Análisis univariante | Regresión multivariante de Cox | |||
|---|---|---|---|---|---|---|---|---|
| HR | p | HR | p | |||||
| Sexo | 98 | |||||||
| Masculino | 34 (34,7%) | 16 (33,3%) | 18 (36,0%) | Ref. | Ref. | |||
| Femenino | 64 (65,3%) | 32 (66,7%) | 32 (64,0%) | 0,75 [0,42;1,35] | 0,343 | |||
| Edad | 98 | 61,3±12,1 | 61,6±10,9 | 61,0±13,2 | 1,00 [0,98;1,02] | 0,976 | ||
| Pre-QT | 98 | |||||||
| No | 57 (58,2%) | 23 (47,9%) | 34 (68,0%) | Ref. | Ref. | |||
| Sí | 41 (41,8%) | 25 (52,1%) | 16 (32,0%) | 0,58 [0,32;1,05] | 0,071 | |||
| Pr-RT | 98 | |||||||
| No | 72 (73,5%) | 35 (72,9%) | 37 (74,0%) | Ref. | Ref. | |||
| Sí | 26 (26,5%) | 13 (27,1%) | 13 (26,0%) | 0,91 [0,48;1,71] | 0,769 | |||
| Tipo de tumor | 98 | |||||||
| CR | 32 (32,7%) | 14 (43,8%) | 18 (56,2%) | Ref. | Ref. | Ref. | Ref. | |
| CRR | 18 (18,4%) | 10 (55,6%) | 8 (44,4%) | 0,71 [0,31;1,64] | 0,424 | 0,67 (0,29; 1,56) | 0,353 | |
| GIN | 43 (43,9%) | 22 (51,2%) | 21 (48,8%) | 0,76 [0,40;1,42] | 0,385 | 0,63 (0,32; 1,25) | 0,188 | |
| URO | 5 (5,10%) | 2 (40,0%) | 3 (60,0%) | 1,39 [0,41;4,73] | 0,598 | 1,56 (0,45; 5,38) | 0,479 | |
| Tipo de resección | 97 | |||||||
| R0 | 66 (68,0%) | 38 (57,6%) | 28 (42,4%) | Ref. | Ref. | Ref. | Ref. | |
| R1 | 21 (21,6%) | 7 (33,3%) | 14 (66,7%) | 1,92 [1,00;3,66] | 0,048 | 2,10 (1,09; 4,05) | 0,027 | |
| R2 | 10 (10,3%) | 3 (30,0%) | 7 (70,0%) | 2,30 [1,00;5,30] | 0,050 | 2,83 (1,16; 6,91) | 0,023 | |
| Infiltración margen de resección | 97 | |||||||
| No | 66 (68,0%) | 38 (79,2%) | 28 (57,1%) | Ref. | Ref. | |||
| Sí | 31 (32,0%) | 10 (20,8%) | 21 (42,9%) | 2,03 [1,15;3,60] | 0,015 | |||
| Infiltración ganglionar | 69 | |||||||
| No | 38 (55,1%) | 22 (57,9%) | 16 (42,1%) | Ref. | Ref. | |||
| Sí | 31 (44,9%) | 15 (48,4%) | 16 (51,6%) | 1,39 [0,69;2,80] | 0,352 | |||
CR: cáncer rectal; CRR: cáncer rectal recurrente; GIN: tumores ginecológicos; R0: márgenes de resección microscópicamente libres de al menos 1mm; R1: margen de resección microscópicamente involucrado con tumor a menos de 1mm; R2: margen de resección macroscópicamente afecto; URO: tumores urológicos.
Factores pronósticos de recidiva local
| n | Todos n=98 | No evento n=71 | Evento n=27 | Análisis univariante | Regresión multivariante de Cox | |||
|---|---|---|---|---|---|---|---|---|
| HR | p | HR | p | |||||
| Sexo | 98 | |||||||
| Masculino | 34 (34,7%) | 25 (35,2%) | 9 (33,3%) | Ref. | Ref. | |||
| Femenino | 64 (65,3%) | 46 (64,8%) | 18 (66,7%) | 0,98 [0,44;2,19] | 0,963 | |||
| Edad | 98 | 61,3±12,1 | 61,1±12,2 | 61,8±11,9 | 1,00 [0,97;1,04] | 0,818 | ||
| Pre QT | 98 | |||||||
| No | 57 (58,2%) | 38 (53,5%) | 19 (70,4%) | Ref. | Ref. | |||
| Sí | 41 (41,8%) | 33 (46,5%) | 8 (29,6%) | 0,47 [0,21;1,07] | 0,073 | |||
| Pre RT | 98 | |||||||
| No | 72 (73,5%) | 51 (71,8%) | 21 (77,8%) | Ref. | Ref. | |||
| Sí | 26 (26,5%) | 20 (28,2%) | 6 (22,2%) | 0,70 [0,28;1,73] | 0,439 | |||
| Tipo de tumor | 98 | |||||||
| CR | 32 (32,7%) | 25 (78,1%) | 7 (21,9%) | Ref. | Ref. | Ref. | Ref. | |
| CRR | 18 (18,4%) | 12 (66,7%) | 6 (33,3%) | 1,34 [0,45;3,98] | 0,601 | 0,90 (0,30; 2,75) | 0,854 | |
| GIN | 43 (43,9%) | 30 (69,8%) | 13 (30,2%) | 1,28 [0,51;3,21] | 0,596 | 1,01 (0,39; 2,62) | 0,98 | |
| URO | 5 (5,10%) | 4 (80,0%) | 1 (20,0%) | 1,22 [0,15;9,90] | 0,855 | 1,28 (0,16; 10,50) | 0,818 | |
| Tipo de resección | 97 | |||||||
| R0 | 66 (68,0%) | 55 (83,3%) | 11 (16,7%) | Ref. | Ref. | Ref. | Ref. | |
| R1 | 21 (21,6%) | 8 (38,1%) | 13 (61,9%) | 4,68 [2,09;10,5] | <0,001 | 4,79 (2,09; 10,95) | <0,001 | |
| R2 | 10 (10,3%) | 7 (70,0%) | 3 (30,0%) | 2,31 [0,64;8,31] | 0,201 | 2,31(0,61; 8,74) | 0,219 | |
| Infiltración margen de resección | 97 | |||||||
| No | 66 (68,0%) | 55 (78,6%) | 11 (40,7%) | Ref. | Ref. | |||
| Sí | 31 (32,0%) | 15 (21,4%) | 16 (59,3%) | 3,93 [1,81;8,51] | 0,001 | |||
| Infiltración ganglionar | 69 | |||||||
| No | 38 (55,1%) | 28 (73,7%) | 10 (26,3%) | Ref. | Ref. | |||
| Sí | 31 (44,9%) | 22 (71,0%) | 9 (29,0%) | 1,23 [0,50;3,04] | 0,650 | |||
CR: cáncer rectal; CRR: cáncer rectal recurrente; GIN: tumores ginecológicos; R0: márgenes de resección microscópicamente libres de al menos 1mm; R1: margen de resección microscópicamente involucrado con tumor a menos de 1mm; R2: margen de resección macroscópicamente afecto; URO: tumores urológicos.
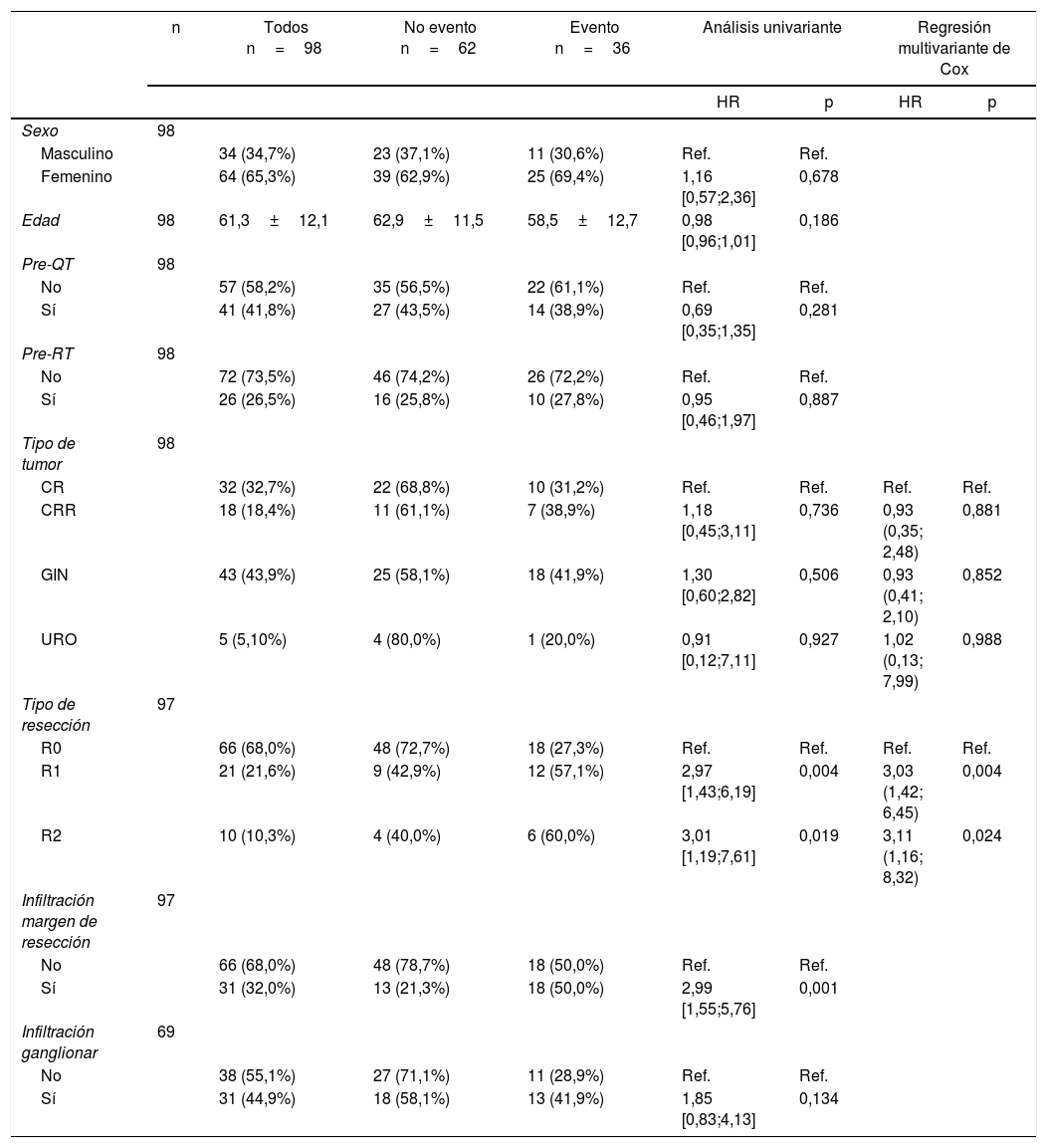
Factores pronósticos de recurrencia a distancia
| n | Todos n=98 | No evento n=62 | Evento n=36 | Análisis univariante | Regresión multivariante de Cox | |||
|---|---|---|---|---|---|---|---|---|
| HR | p | HR | p | |||||
| Sexo | 98 | |||||||
| Masculino | 34 (34,7%) | 23 (37,1%) | 11 (30,6%) | Ref. | Ref. | |||
| Femenino | 64 (65,3%) | 39 (62,9%) | 25 (69,4%) | 1,16 [0,57;2,36] | 0,678 | |||
| Edad | 98 | 61,3±12,1 | 62,9±11,5 | 58,5±12,7 | 0,98 [0,96;1,01] | 0,186 | ||
| Pre-QT | 98 | |||||||
| No | 57 (58,2%) | 35 (56,5%) | 22 (61,1%) | Ref. | Ref. | |||
| Sí | 41 (41,8%) | 27 (43,5%) | 14 (38,9%) | 0,69 [0,35;1,35] | 0,281 | |||
| Pre-RT | 98 | |||||||
| No | 72 (73,5%) | 46 (74,2%) | 26 (72,2%) | Ref. | Ref. | |||
| Sí | 26 (26,5%) | 16 (25,8%) | 10 (27,8%) | 0,95 [0,46;1,97] | 0,887 | |||
| Tipo de tumor | 98 | |||||||
| CR | 32 (32,7%) | 22 (68,8%) | 10 (31,2%) | Ref. | Ref. | Ref. | Ref. | |
| CRR | 18 (18,4%) | 11 (61,1%) | 7 (38,9%) | 1,18 [0,45;3,11] | 0,736 | 0,93 (0,35; 2,48) | 0,881 | |
| GIN | 43 (43,9%) | 25 (58,1%) | 18 (41,9%) | 1,30 [0,60;2,82] | 0,506 | 0,93 (0,41; 2,10) | 0,852 | |
| URO | 5 (5,10%) | 4 (80,0%) | 1 (20,0%) | 0,91 [0,12;7,11] | 0,927 | 1,02 (0,13; 7,99) | 0,988 | |
| Tipo de resección | 97 | |||||||
| R0 | 66 (68,0%) | 48 (72,7%) | 18 (27,3%) | Ref. | Ref. | Ref. | Ref. | |
| R1 | 21 (21,6%) | 9 (42,9%) | 12 (57,1%) | 2,97 [1,43;6,19] | 0,004 | 3,03 (1,42; 6,45) | 0,004 | |
| R2 | 10 (10,3%) | 4 (40,0%) | 6 (60,0%) | 3,01 [1,19;7,61] | 0,019 | 3,11 (1,16; 8,32) | 0,024 | |
| Infiltración margen de resección | 97 | |||||||
| No | 66 (68,0%) | 48 (78,7%) | 18 (50,0%) | Ref. | Ref. | |||
| Sí | 31 (32,0%) | 13 (21,3%) | 18 (50,0%) | 2,99 [1,55;5,76] | 0,001 | |||
| Infiltración ganglionar | 69 | |||||||
| No | 38 (55,1%) | 27 (71,1%) | 11 (28,9%) | Ref. | Ref. | |||
| Sí | 31 (44,9%) | 18 (58,1%) | 13 (41,9%) | 1,85 [0,83;4,13] | 0,134 | |||
CR: cáncer rectal; CRR: cáncer rectal recurrente; GIN: tumores ginecológicos; R0: márgenes de resección microscópicamente libres de al menos 1mm; R1: margen de resección microscópicamente involucrado con tumor a menos de 1mm; R2: margen de resección macroscópicamente afecto; URO: tumores urológicos.
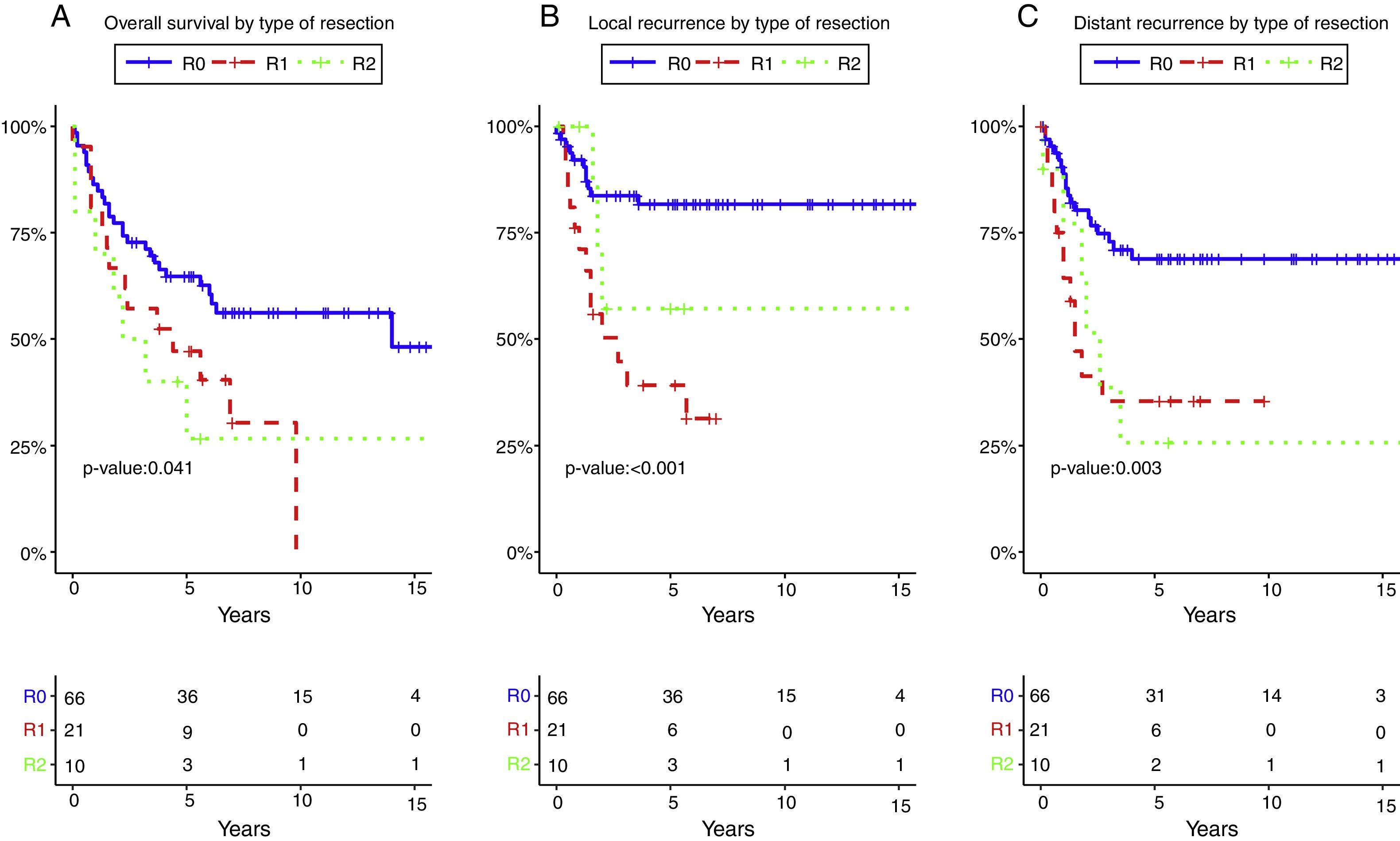
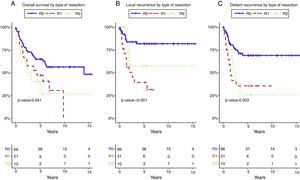
El estado del margen de resección y los márgenes positivos se asociaron en el análisis univariante con menor SG (p=0,01) (fig. 3A), RL (p<0,001) (fig. 3B) y RD (p=0,003) (fig. 3C). Después del ajuste por tipo de tumor, el estado del margen de resección se asoció con menores SG, RL y RD.
Supervivencia global (A), recidiva local (B) y recidiva a distancia (C) según el estado del margen de resección.
R0: márgenes de resección microscópicamente libres de al menos 1mm; R1: margen de resección microscópicamente afectado con tumor a menos de 1mm del margen de resección; R2: margen de resección macroscópicamente afectado.
En el presente estudio se ha observado que las tasas de morbimortalidad después de la EP con resección rectal por diferentes motivos oncológicos, realizadas en centros de referencia y por un equipo quirúrgico multidisciplinario con experiencia, se pueden mantener en un rango aceptable. Sin embargo, la tasa de complicaciones postoperatorias confirma la necesidad de cooperación entre diferentes especializaciones.
En series publicadas anteriormente, la EP se ha asociado con altas tasas de morbimortalidad15,16. Se ha reportado que la morbilidad varía entre el 37 y el 100% y la mortalidad postoperatoria varía entre el 0 y el 25%9. En el presente estudio las complicaciones y las tasas de mortalidad postoperatorias generales observadas fueron del 64 y del 5,4%, respectivamente. Las complicaciones postoperatorias más comunes fueron: absceso pélvico, íleo postoperatorio y complicaciones médicas. En la indicación de procedimientos quirúrgicos agresivos es fundamental mantener una mortalidad baja. La mortalidad reportada en esta serie, situada en el bajo rango registrado en la literatura, reafirma la decisión de tratar estos pacientes. Todos los procedimientos fueron realizados por cirujanos colorrectales experimentados, lo que podría haber influido en los resultados.
La indicación de anastomosis colorrectal y el rol de la ileostomía derivativa durante una EP no están claras debido a la variabilidad de los tumores pélvicos primarios y recurrentes, al tipo de procedimientos quirúrgicos, al nivel de anastomosis, a la posibilidad de radiación adyuvante y a un deficiente estado nutricional de los pacientes. Todos estos factores son considerados de riesgo para fuga de anastomosis colorrectal17. Sin embargo, si no hay más factores de riesgo que en una cirugía de cáncer de recto no extendida, en casos particulares podría realizarse una anastomosis colorrectal.
En este estudio se realizó una ileostomía de derivación en 6 pacientes basándose en los factores de riesgo descritos con anterioridad y en el nivel de la anastomosis (por debajo de los 7cm del margen anal) cuando el tumor era cáncer de recto primario o recidiva18.
Cuando se considera la cirugía oncológica ginecológica, los datos relativos a la radioterapia previa como factor de riesgo para la fuga anastomótica son escasos y retrospectivos. Dichos datos no respaldan que siempre se realice una derivación proximal19,20. Según el tipo de tumor, las tasas de fuga anastomótica en el escenario ginecológico varían del 2,1 al 53,8%, con la tasa promedio más baja en cáncer de ovario21.
En esta serie, en ninguna de las 29 anastomosis colorrectales posteriores a una cirugía de cáncer de ovario se realizó ileostomía derivativa. El nivel de la anastomosis (a más de 7cm del margen anal) y la integridad de la arteria mesentérica inferior (debido a que una sección alta de esta arteria no es necesaria en este tipo de tumores22) ayudaron a tomar esta decisión.
Tres de estos pacientes desarrollaron una fuga anastomótica, lo que representa una tasa de fuga del 10% entre los pacientes con cáncer de ovario, superior al 0-4% informado en la literatura23. Tal vez sería necesaria una selección más precisa de este tipo de pacientes respecto a la realización o no de una ileostomía derivativa.
La reconstrucción urinaria después de EPT consistió en 2 ureterostomías, 14 CIB, siempre con colostomía terminal, y 30 CHDC. Las complicaciones relacionadas con la reconstrucción urinaria varían del 45 al 65%. Las fugas y la obstrucción de la anastomosis entérico-urinaria son las complicaciones urológicas tempranas más frecuentes (10%), mientras que la estenosis y las fístulas, con una tasa del 16% de los pacientes según publicaciones24, son las complicaciones urológicas tardías más frecuentes. Algunos autores refirieron que la reconstrucción CHDC podría asociarse con un mayor riesgo de pielonefritis y desarrollo de neoplasia de reservorio urinario25,26. Sin embargo, como Teixera et al.27 refirieron en 2012, la CHDC tuvo menos complicaciones totales incluyendo sepsis, filtración y colecciones pélvicas, con ausencia de complicaciones en una fístula del intestino delgado. En esta serie, ambos tipos de reconstrucción urinaria mostraron una cantidad similar de fugas y estenosis, con un mayor número de pielonefritis después de CHDC. Por lo tanto, la CHDC puede considerarse una opción válida, aunque son necesarios más estudios.
Un estudio sobre resecciones multiviscerales por cáncer de recto identificó una tasa de SG a 5años del 48%28. En la presente serie se observó una tasa de SG a 5años similar para el cáncer de recto tras resección R0. Además, el tipo de tumores malignos después de la resección R0 no fue un factor pronóstico de la SG.
Si el tumor original es un cáncer rectal, ginecológico o urológico primario o recidivante, la resección con margen libre ha demostrado ser la clave para el control local después de la EP de las neoplasias pélvicas avanzadas29. Kraybill et al.30 reportaron una tasa de supervivencia a 5años del 25% en pacientes con márgenes positivos, frente al 44% en pacientes con márgenes negativos.
En la presente serie se reporta una tasa de supervivencia a 5años del 64,7% en pacientes con márgenes negativos, frente al 41,2% en pacientes con márgenes positivos. Además, el estado de los márgenes quirúrgicos fue la única variable que mostró una influencia significativa en la SG, RL y RD.
La variabilidad de los tumores pélvicos y las múltiples opciones de terapia neoadyuvante deben considerarse una limitación de la serie. Sin embargo, este estudio tiene como objetivo analizar la viabilidad y los resultados de la EP con resección rectal frente a diversos tumores malignos. De hecho, en todas las series un cirujano colorrectal estuvo involucrado y se realizaron una cantidad considerable de anastomosis colorrectales.
En conclusión, debido a la complejidad quirúrgica, la variabilidad de los resultados oncológicos y la morbilidad postoperatoria, la EP debe realizarse en centros de referencia y por cirujanos especializados. Parece razonable realizar una anastomosis colorrectal tras una EPSM por cáncer de ovario, aunque futuros estudios podrían contribuir a la selección de pacientes candidatos a estoma derivativo. La CHDC puede considerarse una opción válida para la reconstrucción urológica con resultados similares al CIB. El factor pronóstico más importante después de la EP para tumores pélvicos malignos es el estado del margen quirúrgico.
AutoríaGarcía-Granero: diseño del estudio, obtención de datos, redacción del trabajo.
Biondo: diseño de estudio, redacción del artículo, supervisión de estudios.
Kreisler: obtención de datos, interpretación de resultados, revisión crítica.
Espin-Basany: obtención de datos, interpretación de resultados, revisión crítica.
González-Castillo: obtención de datos, revisión crítica.
Valverde: obtención de datos, revisión crítica.
Trenti: obtención de datos, revisión crítica.
Gil-Moreno: obtención e interpretación de resultados, revisión crítica.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores agradecen a Bernat Miguel, estadístico y gerente de datos de la Unidad de Cirugía Colorrectal del Hospital Universitario de Bellvitge e IDIBELL, por el análisis estadístico.