Hasta un 40% de los sarcomas de partes blandas (SPB) son resecados de forma no planificada, dejando tumor residual en más del 50% de los casos. La implicación pronóstica de estas resecciones no está claramente definida, dado que existen escasos estudios comparativos que demuestren cómo afecta a la tasa de recurrencia local, de metástasis y de supervivencia.
MétodosRevisión retrospectiva de pacientes intervenidos de un SPB de enero de 2000 a enero de 2016 clasificándolos respecto a intervención planificada o no planificada. Se compararon las tasas de recurrencia y metástasis en global y por estadios.
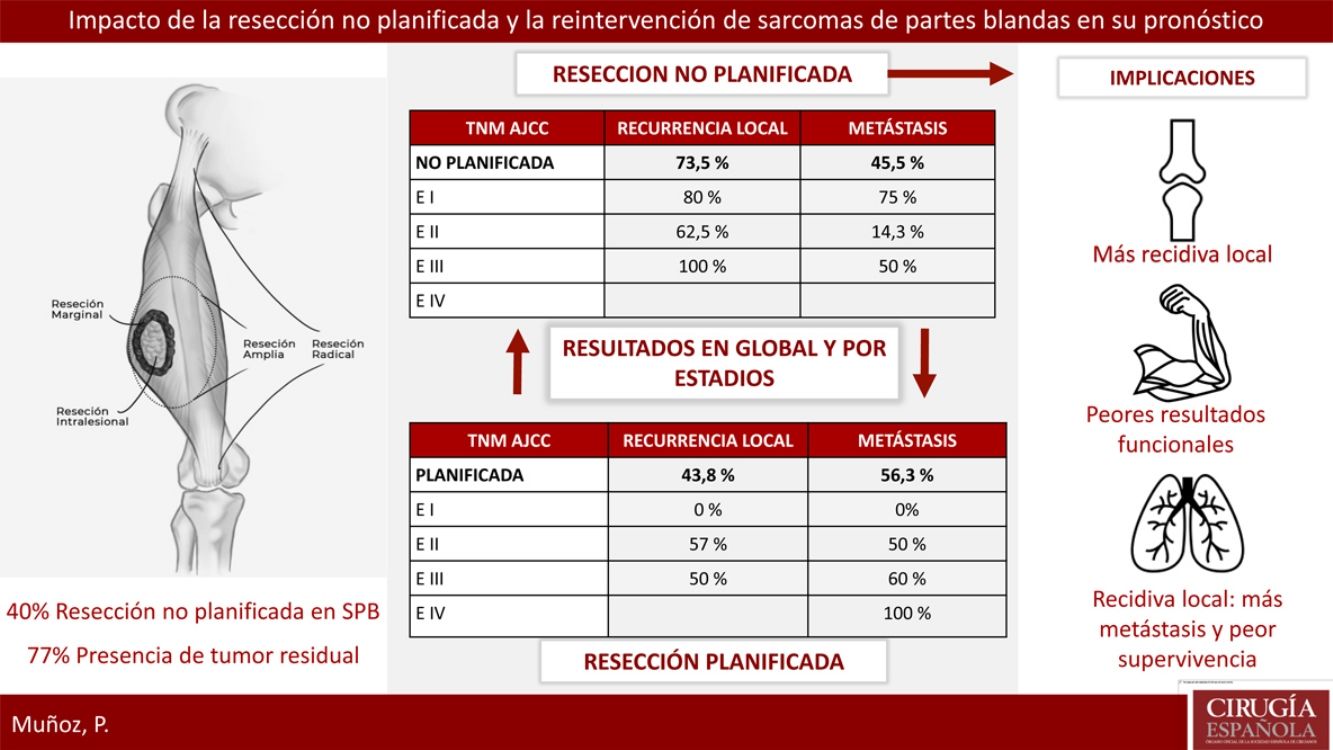
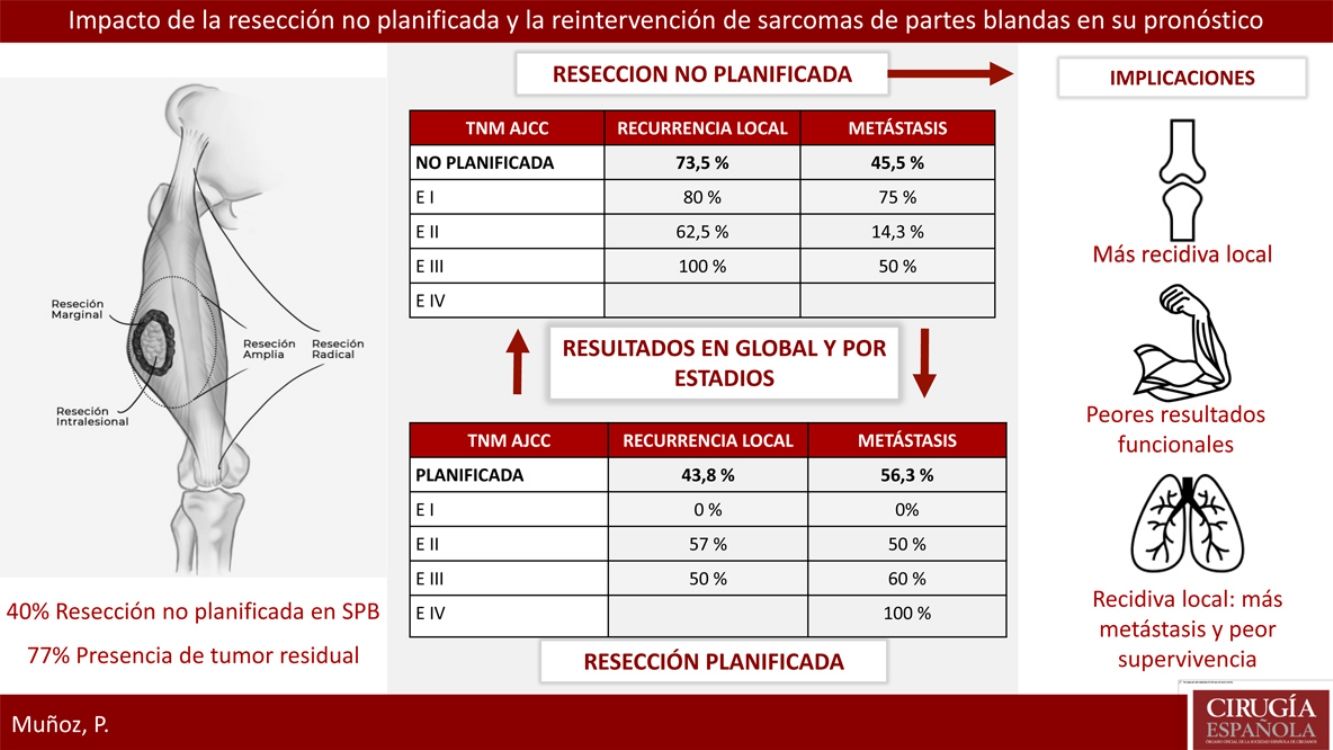
ResultadosVeintitrés pacientes con SPB fueron tratados de forma planificada y 16 de forma no planificada, con 13 reintervenciones. El 40% del grupo planificado presentó un estadio avanzado respecto al 20% del grupo no planificado. El 77% de los pacientes con resección no planificada reintervenidos presentaron tumor residual en la pieza. La tasa de recidiva local en el grupo de no planificados fue considerablemente más alta (73,5% frente al 43,8%). La tasa de metástasis en no planificados fue del 45,5%, frente al 56,3% en planificados (p > 0,05). En el grupo de no planificados el patrón de recidiva fue más errático con peores resultados en estadios precoces.
ConcusionesLa resección no planificada de los SPB asocia mayores tasas de recurrencia local y peores resultados funcionales a pesar del manejo oncológico posterior. En las lesiones de partes blandas es fundamental reconocer los signos de alarma que sugieren malignidad para llevar a cabo un estudio diagnóstico específico y evitar resecciones inadecuadas.
Up to 40% of all initial operations for soft tissue sarcoma (STS) are unplanned, which would leave residual macroscopic tumor in more than 50% of the cases. The effect this has on local recurrence rate, metastases rate and survival has never been fully established, due to the lack of randomized studies.
MethodsRetrospective review of patients with STS treated in our unit between January 2001-January 2016. We classified them whether they had been treated by initial planned or unplanned operation. Outcomes were compared in both groups globally and stage-matched. Endpoints were local recurrence and distant metastases.
ResultsTwenty-three patients of STS underwent a planned excision and 16 an unplanned excision, 13 of them underwent further re-excision. 40% of patients with planned excision had an advanced stage in regard to the unplanned excision group which presented earlier stages. 77% of patients with unplanned excision had residual tumor identified after surgical re-excision. Local recurrence rate in the unplanned excision group was considerably higher 73,5% vs. 43,8%. Metastases rate was lower in planned excision group, 45,5% vs 56,3% (P > .05). The recurrence pattern in the unplanned excision group was unstable, with worse outcomes in earlier stages.
ConclusionThe unplanned excision of a soft tissue sarcoma may compromise disease local control, with higher rates of local recurrence and metastases, and worse functional out- comes, despite further oncological treatment. We need to recognize the clinical features for malignancy risk in soft tissue lumps for a safe diagnosis to avoid inadequate resections.
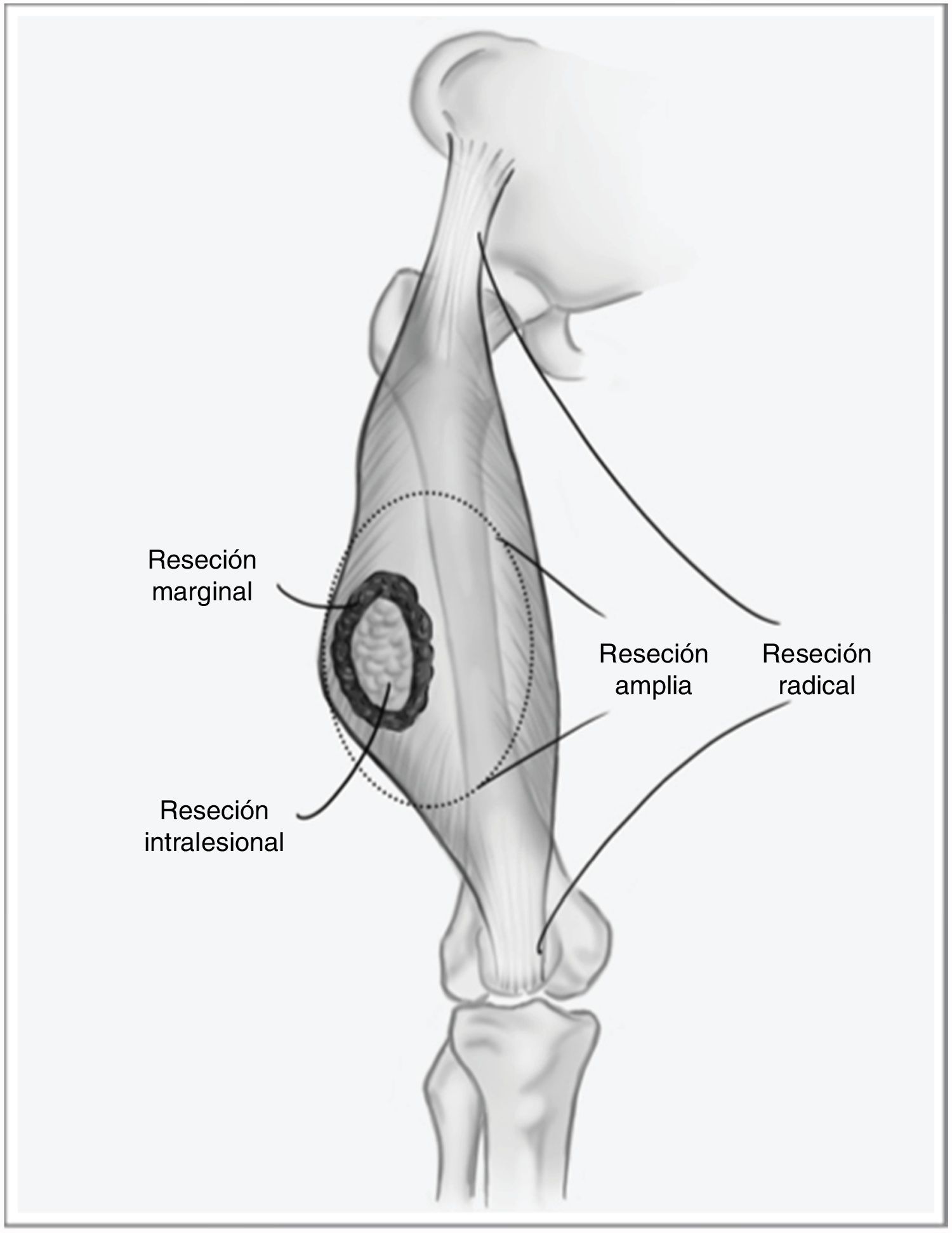
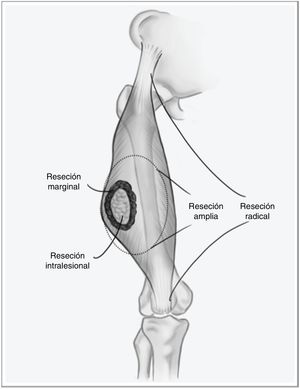
Los sarcomas de partes blandas (SPB) son un grupo heterogéneo de tumores, con más de 70 tipos histológicos diferentes, y su pronóstico está determinado por la características del tumor primario1. Son neoplasias infrecuentes, por lo que es habitual que se manejen de forma errónea comprometiendo el pronóstico de la enfermedad. Se trata de tumores agresivos, estimándose que aproximadamente el 50% de los pacientes fallecerán a causa de su sarcoma. No obstante, cuando la enfermedad debuta de forma localizada, existe la posibilidad de un tratamiento curativo. El pilar fundamental de este tratamiento es la cirugía con márgenes amplios, mediante una escisión amplia, y no marginal, que implicaría ir a través de la pseudocápsula del tumor (fig. 1), asociada a radioterapia en caso de tumores de alto riesgo —alto grado histológico, profundos o mayores de 5cm— o en caso de que el margen de resección tumoral sea menor de 1cm2,3. El beneficio de la quimioterapia adyuvante es limitado, con escasa repercusión en la supervivencia respecto a los efectos secundarios que produce. En estudios recientes se ha demostrado que la quimioterapia neoadyuvante es capaz de mejorar la supervivencia en cinco tipos de sarcomas de alto riesgo, además de favorecer la posibilidad de resecciones menos agresivas y mejorar la tasa de resecciones completas, fundamental en el control local de esta enfermedad, y en menor medida en la supervivencia global4.
Dada la baja frecuencia y heterogeneidad de estos tumores, las guías clínicas consideran que es imprescindible que se manejen en centros especializados en sarcomas con amplia experiencia en su tratamiento5.
Uno de los principales escollos del manejo de los SPB es la resección no planificada —resección no oncológica—, que afecta a aproximadamente el 40% de los casos diagnosticados6,7. Esta cirugía supone una resección intralesional o enucleación a través de la pseudcápsula tumoral, que no es un límite histológico del tumor sino una corona de células sanas de los tejidos circundantes infiltradas por el tumor. Este fenómeno implica que no exista una frontera tisular para las células tumorales, y se asocia a un aumento significativo de la recurrencia local respecto a las resecciones estandarizadas. En un trabajo de Zagars et al.8 en el que el objetivo era documentar la influencia de la re-resección en pacientes con una cirugía no planificada en el pronóstico de la enfermedad se evidenció que más del 53% de los pacientes reintervenidos presentaban tumor residual en la pieza y demostraron que la reintervención era un factor determinante en la disminución de la tasa de recidiva local (RL) (85% vs 78%), en el tiempo libre de metástasis y en la supervivencia específica de enfermedad en los pacientes en los que se había llevado a cabo una cirugía incompleta.
Cuando se reseca un sarcoma de forma no planificada, el enfermo debe ser derivado a un centro de referencia para un manejo específico. Una vez allí, se deberá revisar el estudio anatomopatológico, estratificar el riesgo del tumor y llevar a cabo un estudio de imagen para estudiar la viabilidad y la extensión de la nueva resección, y un estudio de extensión, sobre todo si ha pasado mucho tiempo desde la primera cirugía. Las guías clínicas recomiendan que estos casos sean tratados siempre mediante una nueva resección con márgenes libres y radioterapia adyuvante, haya o no evidencia de lesión residual, pues no es posible predecir qué pacientes tendrán tumor residual9. Múltiples estudios han investigado la repercusión de estas resecciones en la tasa de RL, recidiva a distancia y supervivencia global, demostrando un perjuicio claro en el control local y en los resultados funcionales. Sin embargo, los resultados son menos claros en términos de supervivencia global10.
Este estudio analiza de forma retrospectiva las diferencias pronósticas en términos de RL, recidiva a distancia y supervivencia de los pacientes con diagnóstico de SPB que fueron tratados mediante una resección no planificada en nuestro centro respecto a aquellos que se operaron de forma planificada, con o sin tratamiento adyuvante.
MétodosSe llevó a cabo un estudio descriptivo retrospectivo de todos los pacientes intervenidos de un SPB desde el año 2000 en nuestro servicio. Los datos de los pacientes se registraron a través de la base de datos y del archivo de historias clínicas de nuestro hospital.
Inicialmente se clasificó a los pacientes respecto a si la primera intervención fue planificada o no planificada. Se consideró resección no planificada la no realizada según los estándares oncológicos establecidos, bien por no tener un diagnóstico histológico preoperatorio, o por manejo quirúrgico erróneo —enucleación o cirugía intralesional— al sospechar una lesión benigna como diagnóstico inicial. También se incluyeron los pacientes que fueron derivados a nuestro hospital tras una resección no planificada.
Se registró la edad al diagnóstico, el sexo, la localización, la histología, el estadio tumoral y el grado tumoral. El grado tumoral es una característica histológica de agresividad y está relacionado con el riesgo de metástasis; en nuestra serie se clasificó según el sistema de graduación del French Federation of Cancer Centers Sarcoma Group (FFCCSG)11. La clasificación por estadios se llevó a cabo según la 7.ª edición y no la 8.ª de la American Joint Commission on Cancer para SPB, dado que en el momento de la revisión no se había publicado esta última actualización12.
En el grupo de «no planificados» se registró si se había llevado a cabo reintervención y la existencia de tumor residual en la nueva pieza. Finalmente se compararon las tasas de recurrencia local y de metástasis en ambos grupos de forma global y por estadios.
Análisis estadísticoEl análisis estadístico se llevó a cabo con la versión 24. del software estadístico SPSS. Se utilizó la prueba del chi cuadrado para el análisis de las variables de este estudio y la prueba log Rank en el análisis de supervivencia. Se consideró estadísticamente significativo un valor de p<0,05.
ResultadosDe enero de 2000 a enero de 2016, 23 pacientes con un SPB fueron tratados de forma planificada y 16 de forma no planificada, de los cuales 13 fueron reintervenidos.
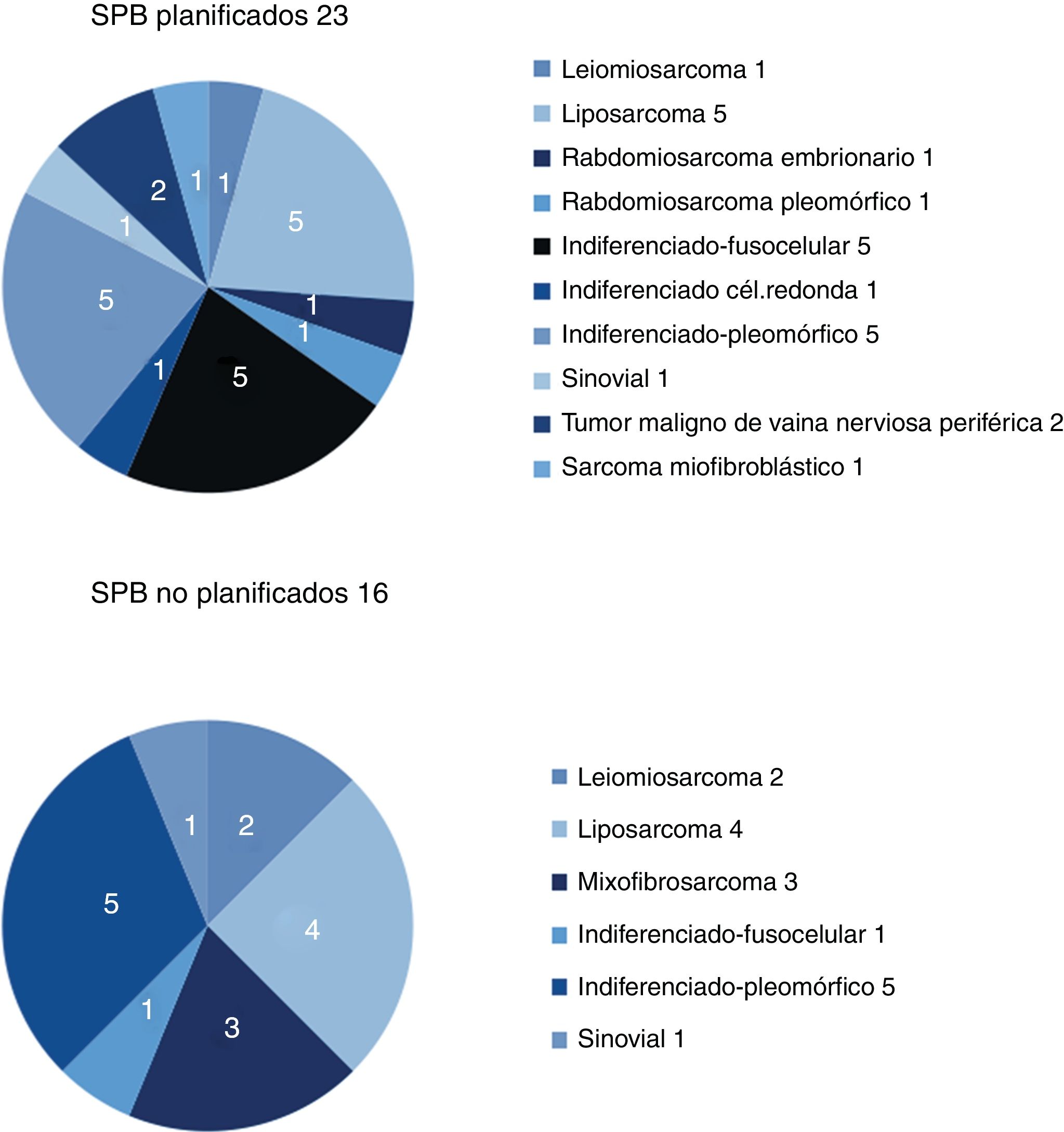
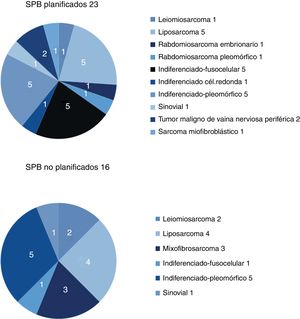
Los resultados respecto a sexo y localización fueron superponibles en ambos grupos, y la localización más frecuente fue el miembro inferior. La histología más frecuente en el grupo de no planificados fue el liposarcoma (25%), y en el de planificados, el sarcoma indiferenciado, con hasta un 50% si se agrupaban los distintos subtipos. Entre ambos grupos se identificaron más de 11 histologías diferentes (fig. 2).
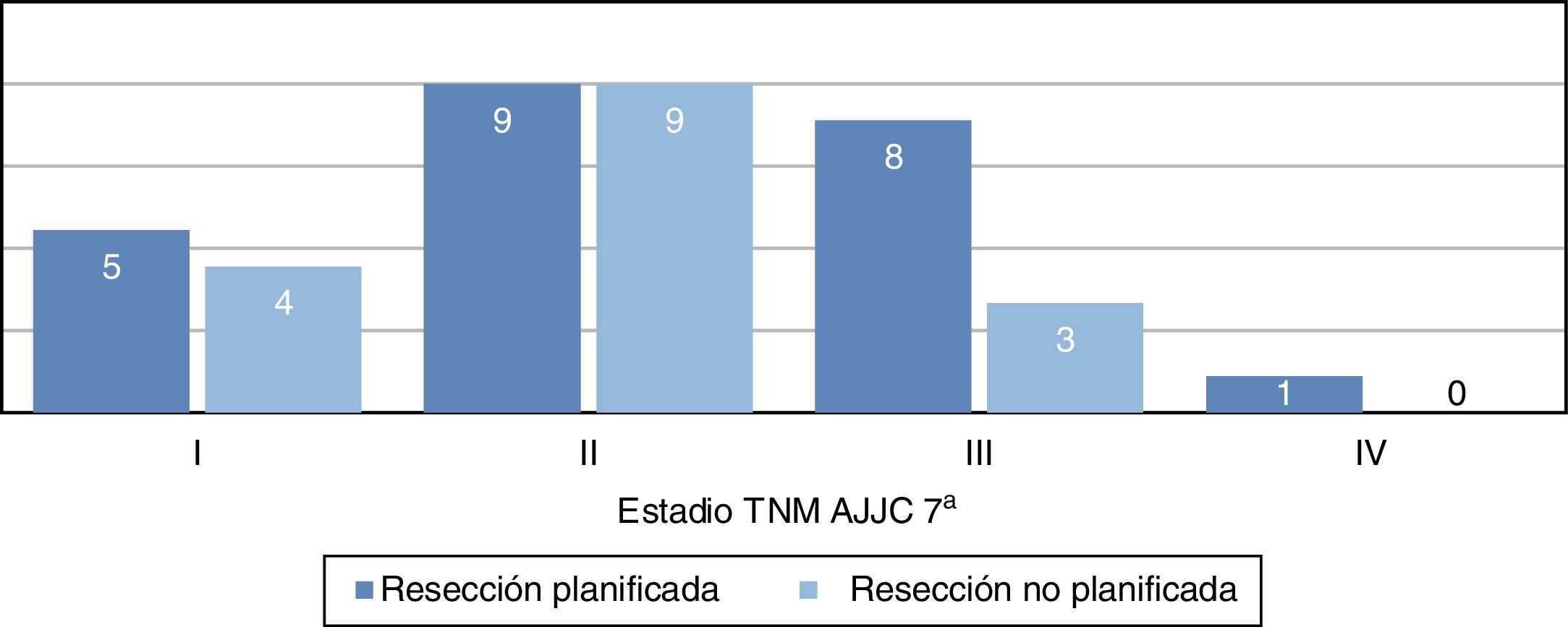
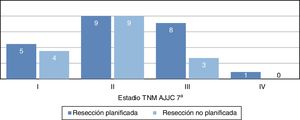
La distribución por estadios (fig. 3) no fue estadísticamente significativa, probablemente por un error tipo2 debido al pequeño tamaño muestral; sin embargo, se evidencia que la mayor parte de tumores en el grupo de resección no planificada pertenecen a estadiosI yII. Las características demográficas y patológicas de ambos grupos se resumen en la tabla 1.
Características demográficas y patológicas
| Variable | Planificados | No planificados |
|---|---|---|
| n | 23 | 16 |
| Edad, mediana (años) | 66 (13-84) | 59 (28-82) |
| Sexo | ||
| Masculino | 17 (73%) | 12 (75%) |
| Femenino | 6 (26%) | 4 (25%) |
| Localización | ||
| Miembro superior | 2 (9%) | 5 (31%) |
| Miembro inferior | 14 (60%) | 7 (44%) |
| Tronco | 5 (22%) | 3 (19%) |
| Otros (cabeza y cuello, clavicular) | 2 (9%) | 1 (6%) |
| Histología | ||
| Leiomiosarcoma | 1 (4%) | 2 (12,5%) |
| Liposarcoma | 5 (22%) | 4 (25%) |
| Indiferenciado | 11 (48%) | 6 (37.5%) |
| Mixofibrosarcoma | (0%) | 3 (19%) |
| Sinovial | 1 (4%) | 1 (6%) |
| Otros (fig. 2) | 5 (22%) | |
| Tamaño | ||
| T1 (< o igual a 5,0 cm) | 7 (30%) | 3 (18%) |
| T2(> o igual a 5,1cm) | 16 (70%) | 13 (82%) |
| Profundidad | ||
| Superficial (a) | 6 (26%) | 12 (75%) |
| Profundo (b) | 20 (74%) | 4 (25%) |
| Grado tumoral | ||
| 1 | 6 (26%) | 6 (37.5%) |
| 2 | 6 (26%) | 4 (25%) |
| 3 | 11 (47%) | 6 (37.5%) |
| TNM AJCC | ||
| I | 5 (22%) | 4 (25%) |
| II | 9 (39%) | 9 (57%) |
| III | 8 (35%) | 3 (18%) |
| IV | 1 (4%) | 0 |
Se llevó a cabo una reintervención en 13 de los 16 pacientes sometidos a una resección no planificada. El 100% de los estos pacientes presentaron márgenes afectos en la primera intervención. El 77% de los pacientes reintervenidos presentaron tumor residual macroscópico en la pieza de la reintervención.
El grupo de resección no planificada fue sometido a un mayor número de reintervenciones (mediana de 4) y presentó peores resultados funcionales, registrándose al menos tres amputaciones de miembros y una hemipelvectomía. El 71,4% del grupo de no planificados vs 85% del grupo de planificados recibieron algún tipo de tratamiento radioterápico (radioterapia intraoperatoria vs radioterapia adyuvante).
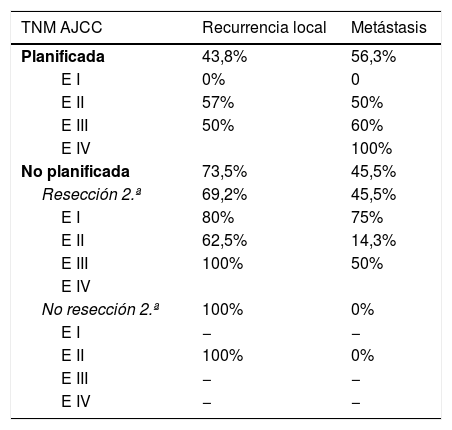
Respecto a la presencia de RL o recidiva a distancia, se llevó a cabo un análisis global y por estadios para eliminar el sesgo que confiere un peor pronóstico a los tumores con resección planificada por contener estadios más avanzados. La tasa de RL global en el grupo de no planificados fue del 73,5%, respecto al 43,8% en los planificados. El 100% de los tumores resecados de forma no planificada que no fueron reintervenidos presentaron una RL. La tasa de metástasis global en el grupo de no planificados fue del 45,5%, respecto al 56,3% en los planificados. Ninguna de estas diferencias fue estadísticamente significativa (p>0,05).
En la tabla 2 se muestra cómo el patrón de RL como el de recidiva a distancia siguen una distribución progresiva al estadio tumoral en los tumores con resección planificada; sin embargo, en los no planificados la distribución de la recidiva es más errática, siendo llamativo el mal pronóstico de los tumores en estadios más precoces en este grupo.
Resultados por estadios en ambos grupos
| TNM AJCC | Recurrencia local | Metástasis |
|---|---|---|
| Planificada | 43,8% | 56,3% |
| E I | 0% | 0 |
| E II | 57% | 50% |
| E III | 50% | 60% |
| E IV | 100% | |
| No planificada | 73,5% | 45,5% |
| Resección 2.ª | 69,2% | 45,5% |
| E I | 80% | 75% |
| E II | 62,5% | 14,3% |
| E III | 100% | 50% |
| E IV | ||
| No resección 2.ª | 100% | 0% |
| E I | − | − |
| E II | 100% | 0% |
| E III | − | − |
| E IV | − | − |
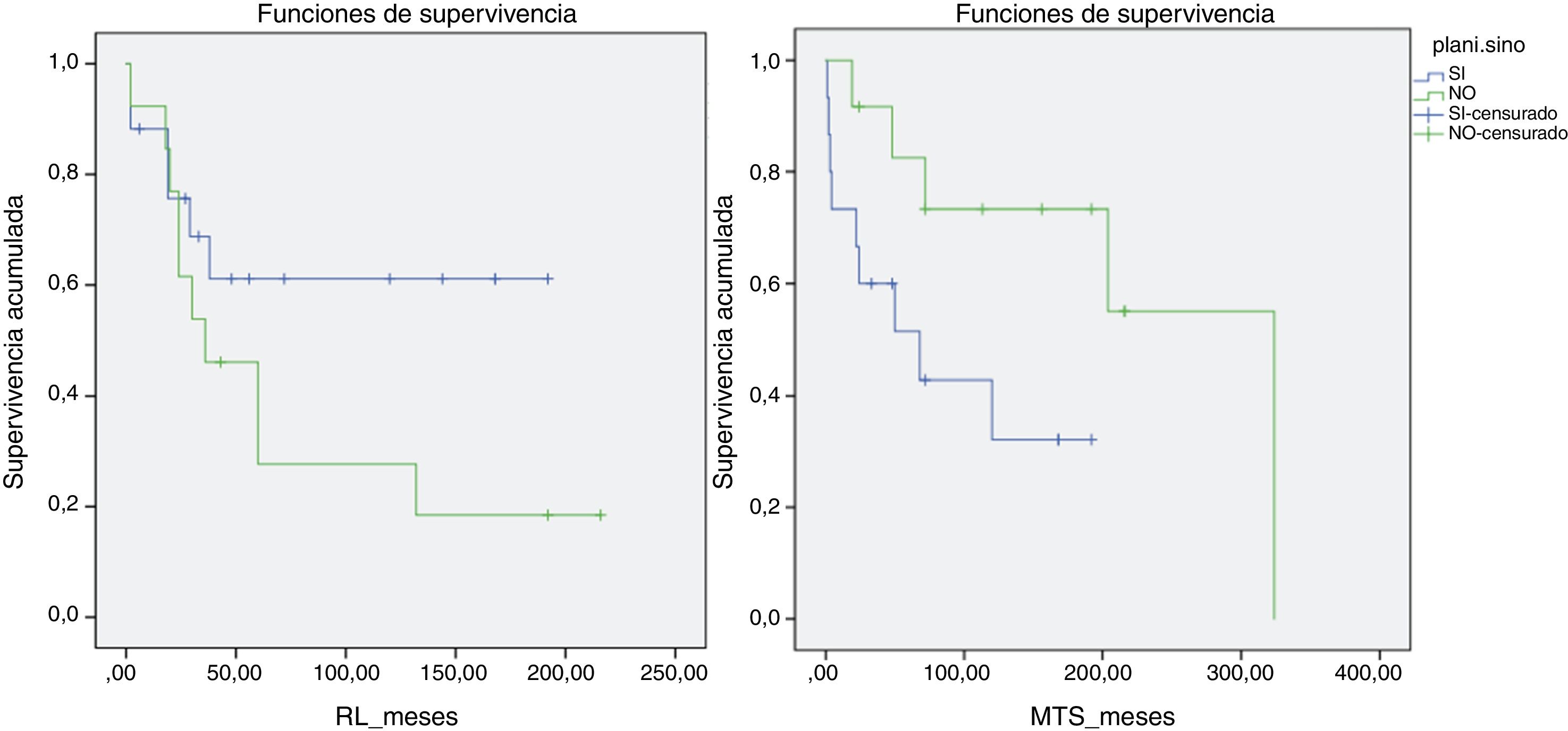
Así mismo se llevó a cabo un análisis de supervivencia respecto a RL, metástasis y supervivencia global comparando ambos grupos. La mediana de tiempo hasta la RL en el grupo de no planificados fue de 6años y en el grupo de planificados de más de 10años (p>0,05). Sin embargo los resultados fueron más favorables en relación con la presencia de metástasis y con la supervivencia en el grupo de no planificados, siendo estadísticamente significativa (p=0,048) la comparación mediante la prueba log rank respecto al desarrollo de metástasis (fig. 4). Se analizó si la tasa de RL tenía relación con el empleo de radioterapia adyuvante o intraoperatoria, sin lograrse significación estadística. Sin embargo, las medianas de tiempo alcanzadas fueron de 116meses hasta la RL en el grupo que recibió radioterapia y de 65meses en el grupo de no tratamiento.
Se estudió la relación entre RL y presencia de metástasis y supervivencia. El 60% de los pacientes con una RL presentaron metástasis a lo largo de su evolución, mientras que solo el 25% de los que no presentaron una RL desarrolló metástasis (en todos estos casos se trató de una recidiva a distancia precoz, menos de 4meses desde el diagnóstico). El 46% de los pacientes con RL fallecieron a causa de la enfermedad respecto al 18,2% de los pacientes que no tuvieron RL (p>0,05).
DiscusiónLa resección no planificada en los SPB compromete de forma habitual el manejo oncológico de estos tumores, que requieren una cirugía amplia de al menos 1-3cm de margen13. Este concepto fue introducido por primera vez por Giuliano e Eilber14 en 1985 como aquella cirugía en la que se realiza una biopsia escisional o en la que se reseca la lesión sin haber llevado a cabo un proceso diagnóstico adecuado y sin la intención de conseguir un margen adecuado15. Esta situación es frecuente porque los tumores de partes blandas benignos son una patología muchísimo más frecuente que los sarcomas, y es la falta de sospecha de que se trate de una lesión maligna lo que lleva a este error en el manejo. Tal y como demuestra la literatura, la mayor parte de sarcomas manejados de forma no planificada son lesiones pequeñas y superficiales16. En nuestra cohorte, más del 80% de tumores resecados de forma no planificada medían menos de 5cm y el 75% eran superficiales a la fascia.
Si hacemos referencia a la distribución por estadios, vemos una tendencia en la que la mayor parte de tumores no planificados se encuentran en el estadioIIb (fig. 3), que corresponde a tumores pequeños de alto grado histológico. La distribución por estadios en el grupo de planificados es más homogénea y además alberga un mayor porcentaje de estadios avanzados, lo que demuestra que las lesiones grandes son estudiadas más frecuentemente.
La histología del sarcoma también sería un factor de riesgo para una resección no planificada, dado que las lesiones con alto contenido graso y aspecto homogéneo son más frecuentemente confundidas con un lipoma u otra lesión benigna. Las series de Fiore y Lewis coinciden en que el liposarcoma es el tumor más frecuentemente encontrado en el grupo de resecciones no planificadas, lo que coincide con nuestra serie, donde se encontró un liposarcoma en el 25% de estos casos17.
Una cirugía no planificada de un sarcoma implica la existencia de células tumorales residuales en el lecho de la cirugía que habrían perdido su límite anatómico18. Este fenómeno se ha asociado a mayores tasas de recurrencia local y peores resultados funcionales por la necesidad de reintervenciones extensas para el control local. En nuestra serie, el 77% de los tumores reintervenidos presentaban tumor residual, y en todos ellos se lograron márgenes libres en la reintervención. Sin embargo, la reintervención no lograría compensar el efecto negativo de la resección no planificada, presentando este grupo de pacientes una tasa de RL del 73,5%, frente al 44% en el grupo en que se llevó a cabo una intervención planificada. No se demuestra una clara repercusión negativa de la resección no planificada en la tasa de metástasis ni en la supervivencia, y de hecho en el análisis de supervivencia de nuestra serie el grupo de resección no planificada presenta mejores resultados que el grupo control. Esta controversia también aparece en la mayoría de estudios al respecto, donde queda claro el perjuicio sobre el control local y los peores resultados funcionales, pero donde, de manera paradójica, se evidencia mayor tasa de metástasis en el grupo control19. Este fenómeno podría explicarse por el hecho de que no existe homogeneidad en las características de los tumores de ambos grupos respecto al estadio tumoral. En un trabajo brillante, Hayes et al. abordan este problema mediante un análisis pronóstico estratificado por estadio tumoral entre ambos grupos, demostrando que en los tumores con estadioIII la diferencia entre la tasa de metástasis y la supervivencia específica de enfermedad es significativa, con peores resultados en el grupo de resección no planificada20. Además de la distinta distribución por estadios, existen también diferencias importantes en la localización y la histología entre ambos grupos, con características patológicas de mejor pronóstico en el grupo de no planificados. En nuestra serie, el 75% son de localización superficial, y principalmente liposarcomas y pleomórficos. Es sabido que muchos sarcomas superficiales —el sarcoma pleomórfico dérmico, el tumor lipomatoso atípico/liposarcoma bien diferenciado, el leiomiosarcoma— son menos agresivos que su contraparte profunda, sobre todo por su escasa capacidad metastásica21.
Nuestra revisión no permite demostrar la influencia de la RL en el desarrollo de metástasis ni en la mortalidad, aunque porcentualmente sus tasas son mucho más altas en los pacientes que presentaron una RL (60% de metástasis y 46% de mortalidad). En series mayores sí se confirma la hipótesis de una repercusión negativa de la RL en el pronóstico de los SPB, planteando que un fracaso en el control local, con múltiples recidivas y reintervenciones, sería finalmente determinante de una peor supervivencia al tener un efecto directo en la diseminación metastásica o por el efecto perjudicial de una RL en una localización anatómica crítica22.
La mejor estrategia para prevenir el manejo erróneo de los SPB es la difusión del concepto de cómo abordar una lesión de partes blandas que pueda ser potencialmente un sarcoma. Es cierto que es difícil esclarecer las características clínicas de esta enfermedad, pero se han descrito cinco signos de alarma que deben hacernos sospechar malignidad: crecimiento rápido, tamaño mayor de 5cm, lesión dolorosa, lesión profunda a la fascia y lesión que recurre tras su extirpación23. Si existe alguna de estas características deberá realizarse una ecografía en menos de 2semanas, y si la ecografía no puede confirmar que se trate de una lesión benigna, o persiste la sospecha, el paciente deberá ser derivado a un centro especializado para un estudio de extensión con RM y biopsia con aguja gruesa, preferiblemente radioguiada para localizar las zonas más heterogéneas de la lesión24,25. El estudio anatomopatológico preoperatorio resultará fundamental para identificar la histología y el grado tumoral que guíen la planificación de su tratamiento, que en algunos casos puede incluir un tratamiento quimioterápico neoadyuvante.
Conflicto de interesesTodos los autores declaran que no existe conflicto de intereses.