Con el auge de la gastrectomía vertical (GV) en el tratamiento de la obesidad mórbida, las complicaciones asociadas a este procedimiento aumentan1. Entre las más frecuentes tenemos la fuga de la línea de grapas, con su consecuente fístula1–3. Estas fugas son características del tercio proximal del estómago y presentan sus características particulares. Diversas publicaciones describen algoritmos para el tratamiento de las fístulas tras GV. Algunas recomiendan endoprótesis esófago-gástricas en aquellos casos en que las condiciones del paciente permiten un manejo conservador2–5. El uso de estas endoprótesis pretende el aislamiento del punto de fuga, que permite un cierre más temprano. No obstante, el uso de las prótesis no está exento de complicaciones tales como: migración y atrapamiento del stent, obstrucción del tránsito de alimentos, disfagia, sialorrea, hemorragia e inclusive perforación esofágica5.
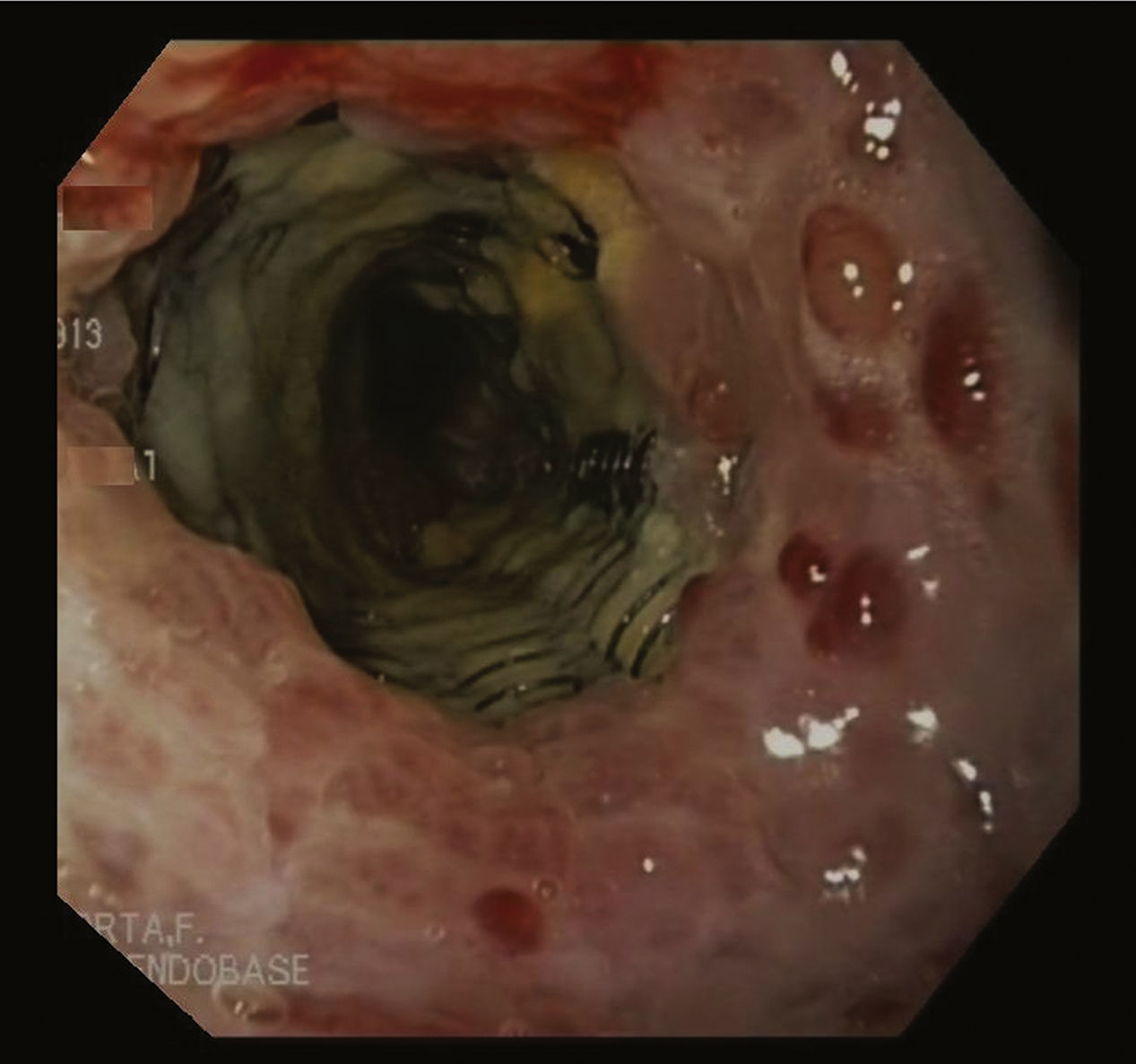
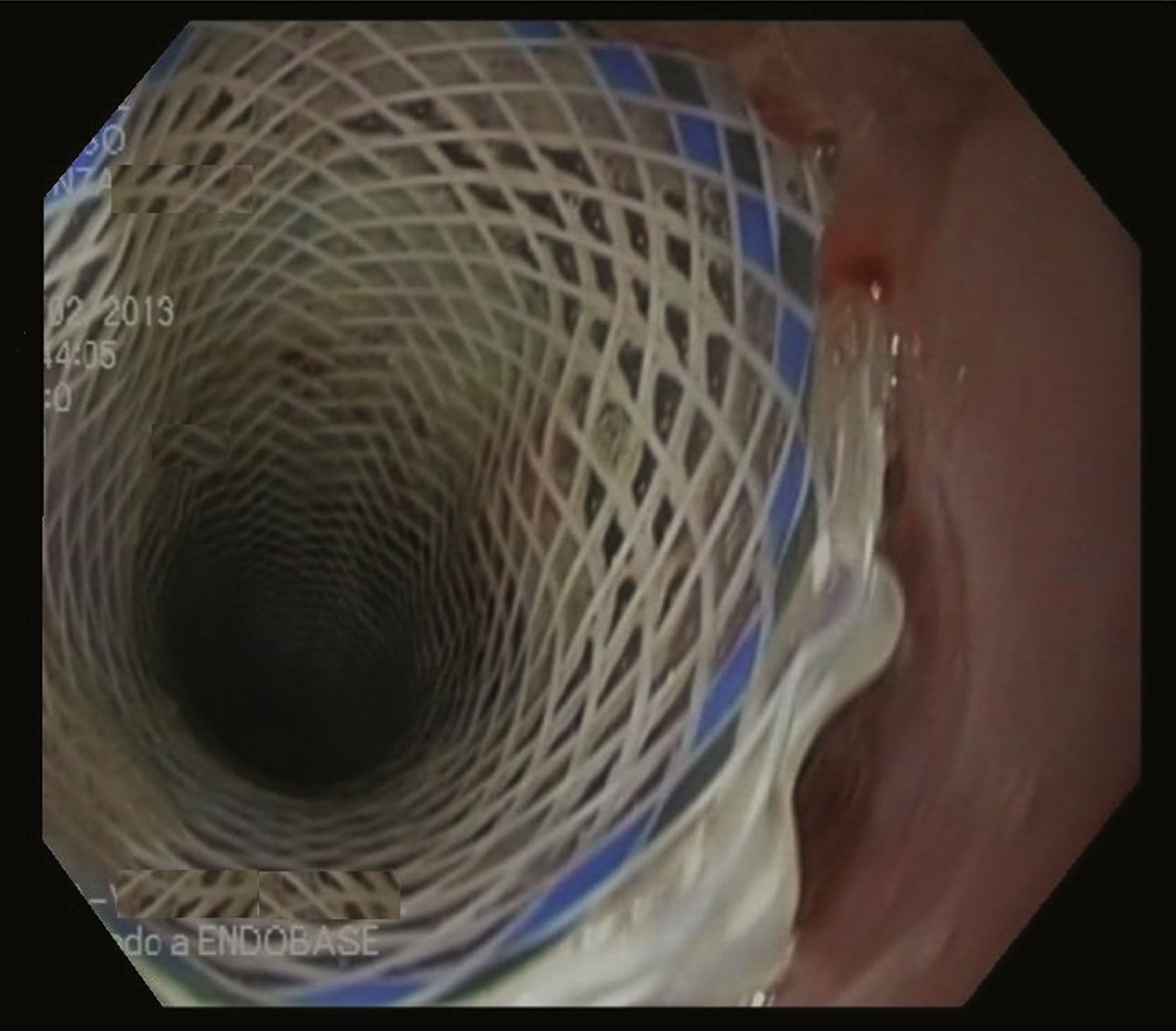
Caso clínicoMujer de 49 años con obesidad mórbida en quien se realizó una GV laparoscópica, sin incidencias postoperatorias. Dos meses después de la cirugía presentó fiebre intermitente durante una última semana, sin otra sintomatología asociada. Las pruebas revelaron leucocitosis y PCR elevada. Un TC abdominal mostró un absceso en la región subhepática. Se intentó drenaje percutáneo del absceso; pero, durante el procedimiento la paciente se inestabilizó y presentó hematemesis y signos de shock séptico, por lo que se la trasladó a quirófano para realizar una laparotomía exploradora. Se drenó el absceso a lo largo de la línea de grapas sin poder objetivar fuga alguna, así que se realizó una endoscopia intraoperatoria que evidenció el punto de disrupción. Con este hallazgo, se colocó un stent de metal parcialmente cubierto Ultraflex® (Boston Scientific®) 12cm de longitud y 18mm de diámetro. Cuatro semanas más tarde, se citó para retirar la prótesis, pero el procedimiento no resultó puesto que ambos extremos del stent estaban cubiertos por tejido hiperplásico de manipulación compleja por el riesgo de perforación esofágica (fig. 1). Por tanto, se aplicó la técnica del «stent in stent» colocando de forma coaxial una nueva prótesis totalmente recubierta Polyflex® (Boston Scientific®) con el objetivo de obtener la necrosis del tejido hiperplásico. A los 15 días, una nueva endoscopia reveló que el primer stent se había separado de la pared y se procedió a extraer ambas prótesis (fig. 2). La paciente evolucionó favorablemente y recibió el alta 3 días después.
DiscusiónEl uso de endoprótesis en el esófago se acepta de forma extendida en el tratamiento paliativo de enfermedad maligna del esófago. En estas situaciones, la finalidad es conservar paso a través de la luz del esófago y no es infrecuente observar nuevas obstrucciones de dicha luz en el stent, que se atribuyen a la progresión del tumor. No obstante, cuando estos dispositivos son utilizados en situaciones donde no subyace una neoplasia, el desarrollo de tejido redundante suele estar relacionado con una reacción a cuerpo extraño5,6. Este fenómeno ocurre como resultado de un estímulo local que genera la proliferación de tejido de granulación. La incidencia de esta hiperplasia benigna de la mucosa ha aumentado con el uso de stent en enfermedad benigna7–9. Aunque estos casos carecen de confirmación patológica, generan dudas en el manejo de las fístulas tras GV, ya que el grado de atrapamiento de las endoprótesis no es siempre evidente, y el riesgo de perforación esofágica es latente.
El origen de esta hiperplasia está insuficientemente descrito y existen diferentes opiniones. Muchos endoscopistas sugieren que se debe al tipo de stent utilizado, ya que este fenómeno es más evidente con las prótesis metálicas que en aquellos con cubierta de plástico8. De hecho, la cubierta de plástico se considera una ventaja en la evolución de los stent pues fue creada con el objetivo de inducir menor reacción local. Sin embargo, existen estudios que plantean que la hiperplasia aparece sin relación con la presencia o no de la cubierta de plástico y citan algunos mecanismos causantes de este fenómeno como son: erosiones durante la colocación del stent, la presión circunferencial al colocar la prótesis, el diámetro de la endoprótesis, etc.9. Los endoscopistas coinciden en que el tiempo de permanencia de las prótesis en el organismo es importante, ya que en enfermedad benigna, períodos prolongados del stent en contacto con la mucosa esofágica es determinante en la aparición de complicaciones, con lo cual es recomendable retirarlas lo antes posible7–9.
Cuando se produce un caso de hiperplasia benigna, la eliminación del stent puede ser un procedimiento de riesgo, ya que en la extracción del stent están descritas perforaciones esofágicas9. Existen varios enfoques para resolver esta complicación con el menor daño posible. Así pues, la técnica del «stent in stent» es la que mejor aceptación ha obtenido entre endoscopistas10. Esta técnica implica la colocación de un stent recubierto de plástico en su totalidad por dentro del stent atrapado. Este segundo stent debe ser del mismo diámetro pero mayor longitud que el primero, con el fin de lograr una cierta presión sobre las áreas de hiperplasia de la mucosa en la primera endoprótesis, y así generar una necrosis del tejido redundante y como consecuencia la liberación de ambos stent. Algunos autores recomiendan extraer ambas prótesis pasados de 10 a 14 días después de realizar el «stent in stent»10.
FinanciaciónPara la realización de este manuscrito no se recibieron ayudas, becas ni financiación alguna.
Manuscrito presentado como Póster en la Reunión Nacional de la Sección de Cirugía Endoscópica, del 24 al 26 de abril de 2013, Murcia.