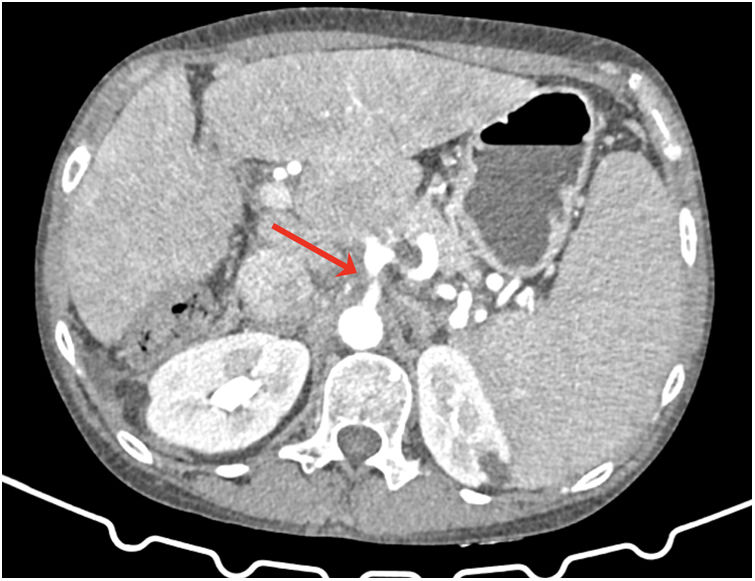
El síndrome del ligamento arcuato mediano (SLAM) consiste en la compresión extrínseca del tronco celiaco por las bandas fibrosas del ligamento arcuato mediano (LAM)1. Fue descrito por primera vez en 1917 por Lipshutz et al1-3, pero no fue hasta 1963 cuando Harjola et al. realizaron las primeras cirugías para solventar el SLAM1,4. En 1972, Colapinto et al. utilizaron por primera vez la TAC para el diagnóstico de SLAM y se ha convertido en el mejor método diagnóstico5.
El SLAM normalmente suele ser asintomático, ya que se desarrolla circulación colateral, pero en el 10-25% de los casos puede presentarse algún tipo de isquemia funcional1. Los pacientes sintomáticos pueden presentar dolor abdominal sin causa evidente, posprandial o desencadenado por el ejercicio, pérdida de peso, náuseas y vómitos1,3.
La existencia de un SLAM no correctamente evaluado y no tratado puede causar complicaciones graves tras cirugías supramesocólicas, especialmente la duodeno-pancreatectomía cefálica6. El número de publicaciones sobre pacientes con SLAM a los que se efectúa trasplante hepático (TH) es muy escaso, y no existen recomendaciones internacionalmente admitidas de la mejor estrategia terapéutica a realizar1. Se ha postulado que el SLAM puede causar disfunción en el injerto hepático al disminuir, en el postoperatorio, la velocidad media del flujo de la arteria hepática, causando por tanto una disminución del flujo al injerto, pudiendo producir trombosis de la arteria hepática y complicaciones biliares3. Presentamos nuestra experiencia en tratamiento sincrónico de SLAM y TH.
Se ha realizado un estudio observacional retrospectivo en una base de datos prospectiva de todos los pacientes intervenidos de TH en el periodo de septiembre de 2012 a diciembre de 2021. Se seleccionaron aquellos en los que la TAC preoperatoria evidenció SLAM (fig. 1). Realizamos derivación porto-cava temporal y efectuamos la sección del LAM tras completar la hepatectomía total.
Realizamos ecografía Doppler en las primeras 24h tras el TH para comprobar la permeabilidad del flujo arterial. Se estudiaron variables clínicas preoperatorias (edad, sexo, etiología de la hepatopatía, MELD y hemoglobina preoperatoria e índice de riesgo de donación [IRD]); intraoperatorias (tiempo de isquemia fría, perdidas hemáticas, flujo arterial y portal previo al trasplante y tras la realización de este, y tiempo quirúrgico), y postoperatorias (complicaciones medidas según clasificación de Clavien-Dindo7, especialmente las vasculares, estancia hospitalaria, supervivencia del injerto y del paciente).
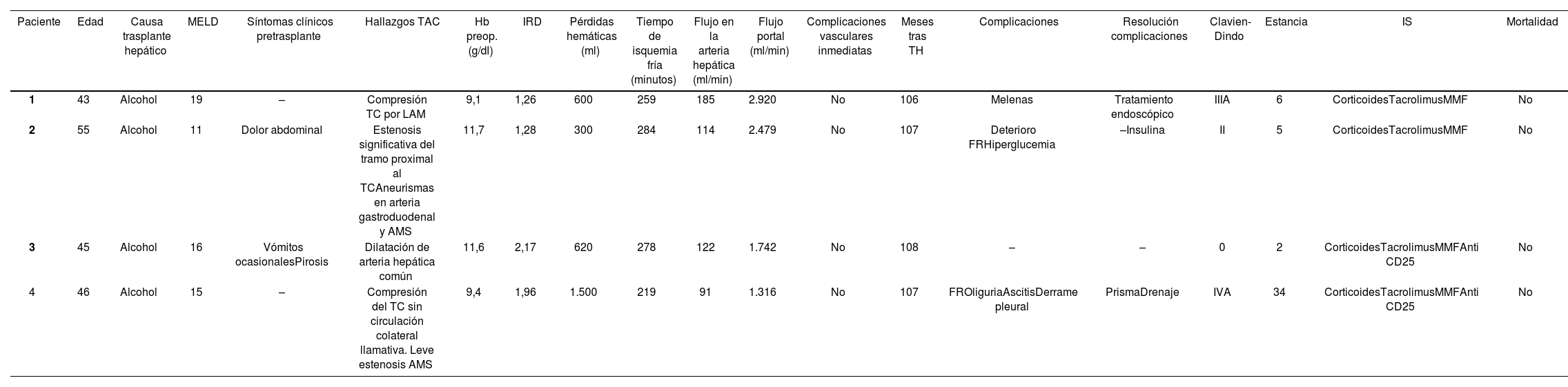
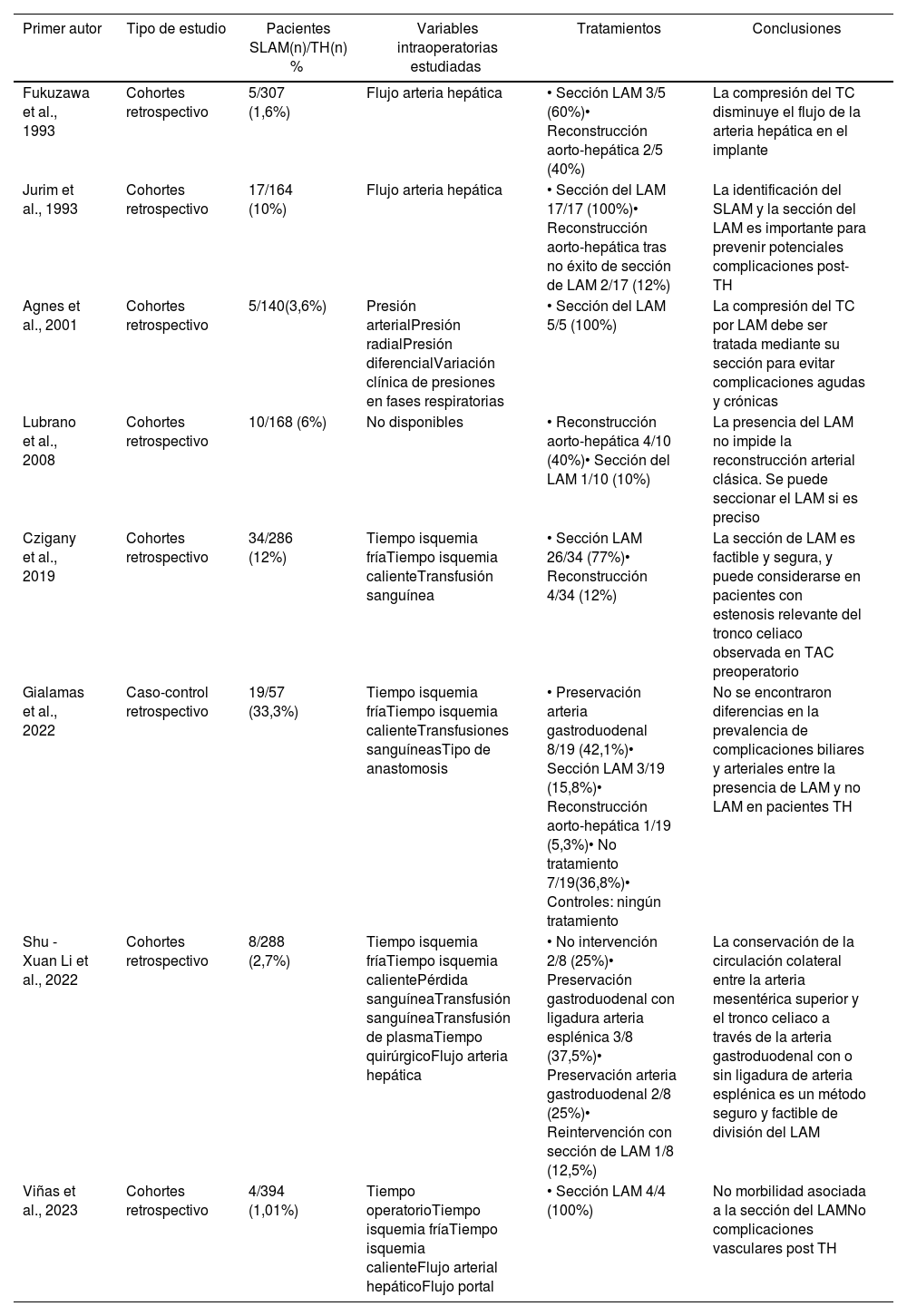
Hemos intervenido a 4 pacientes. La incidencia de SLAM en nuestra serie fue del 1,01% (4/394). No hubo complicaciones relacionadas con la sección del LAM. Todos los injertos presentaron buena perfusión tras realizar las anastomosis venosas y arteriales, y no hubo complicaciones vasculares o biliares postrasplante. En ninguno de estos pacientes se usaron injertos vasculares. Los datos de los pacientes se resumen en la tabla 1. Se han revisado las series publicadas en la literatura sobre TH y SLAM (tabla 2).
Características de los pacientes intervenidos
| Paciente | Edad | Causa trasplante hepático | MELD | Síntomas clínicos pretrasplante | Hallazgos TAC | Hb preop. (g/dl) | IRD | Pérdidas hemáticas (ml) | Tiempo de isquemia fría (minutos) | Flujo en la arteria hepática (ml/min) | Flujo portal (ml/min) | Complicaciones vasculares inmediatas | Meses tras TH | Complicaciones | Resolución complicaciones | Clavien-Dindo | Estancia | IS | Mortalidad |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 43 | Alcohol | 19 | – | Compresión TC por LAM | 9,1 | 1,26 | 600 | 259 | 185 | 2.920 | No | 106 | Melenas | Tratamiento endoscópico | IIIA | 6 | CorticoidesTacrolimusMMF | No |
| 2 | 55 | Alcohol | 11 | Dolor abdominal | Estenosis significativa del tramo proximal al TCAneurismas en arteria gastroduodenal y AMS | 11,7 | 1,28 | 300 | 284 | 114 | 2.479 | No | 107 | Deterioro FRHiperglucemia | –Insulina | II | 5 | CorticoidesTacrolimusMMF | No |
| 3 | 45 | Alcohol | 16 | Vómitos ocasionalesPirosis | Dilatación de arteria hepática común | 11,6 | 2,17 | 620 | 278 | 122 | 1.742 | No | 108 | – | – | 0 | 2 | CorticoidesTacrolimusMMFAnti CD25 | No |
| 4 | 46 | Alcohol | 15 | – | Compresión del TC sin circulación colateral llamativa. Leve estenosis AMS | 9,4 | 1,96 | 1.500 | 219 | 91 | 1.316 | No | 107 | FROliguriaAscitisDerrame pleural | PrismaDrenaje | IVA | 34 | CorticoidesTacrolimusMMFAnti CD25 | No |
AMS: arteria mesentérica superior; FR: fallo renal; Hb: hemoglobina; IRD: índice de riesgo de donante; LAM: ligamento arcuato mediano; TAC: tomografía axial computarizada; TC: tronco celiaco; TH: trasplante hepático.
Resumen de las series publicadas
| Primer autor | Tipo de estudio | Pacientes SLAM(n)/TH(n) % | Variables intraoperatorias estudiadas | Tratamientos | Conclusiones |
|---|---|---|---|---|---|
| Fukuzawa et al., 1993 | Cohortes retrospectivo | 5/307 (1,6%) | Flujo arteria hepática | • Sección LAM 3/5 (60%)• Reconstrucción aorto-hepática 2/5 (40%) | La compresión del TC disminuye el flujo de la arteria hepática en el implante |
| Jurim et al., 1993 | Cohortes retrospectivo | 17/164 (10%) | Flujo arteria hepática | • Sección del LAM 17/17 (100%)• Reconstrucción aorto-hepática tras no éxito de sección de LAM 2/17 (12%) | La identificación del SLAM y la sección del LAM es importante para prevenir potenciales complicaciones post-TH |
| Agnes et al., 2001 | Cohortes retrospectivo | 5/140(3,6%) | Presión arterialPresión radialPresión diferencialVariación clínica de presiones en fases respiratorias | • Sección del LAM 5/5 (100%) | La compresión del TC por LAM debe ser tratada mediante su sección para evitar complicaciones agudas y crónicas |
| Lubrano et al., 2008 | Cohortes retrospectivo | 10/168 (6%) | No disponibles | • Reconstrucción aorto-hepática 4/10 (40%)• Sección del LAM 1/10 (10%) | La presencia del LAM no impide la reconstrucción arterial clásica. Se puede seccionar el LAM si es preciso |
| Czigany et al., 2019 | Cohortes retrospectivo | 34/286 (12%) | Tiempo isquemia fríaTiempo isquemia calienteTransfusión sanguínea | • Sección LAM 26/34 (77%)• Reconstrucción 4/34 (12%) | La sección de LAM es factible y segura, y puede considerarse en pacientes con estenosis relevante del tronco celiaco observada en TAC preoperatorio |
| Gialamas et al., 2022 | Caso-control retrospectivo | 19/57 (33,3%) | Tiempo isquemia fríaTiempo isquemia calienteTransfusiones sanguíneasTipo de anastomosis | • Preservación arteria gastroduodenal 8/19 (42,1%)• Sección LAM 3/19 (15,8%)• Reconstrucción aorto-hepática 1/19 (5,3%)• No tratamiento 7/19(36,8%)• Controles: ningún tratamiento | No se encontraron diferencias en la prevalencia de complicaciones biliares y arteriales entre la presencia de LAM y no LAM en pacientes TH |
| Shu -Xuan Li et al., 2022 | Cohortes retrospectivo | 8/288 (2,7%) | Tiempo isquemia fríaTiempo isquemia calientePérdida sanguíneaTransfusión sanguíneaTransfusión de plasmaTiempo quirúrgicoFlujo arteria hepática | • No intervención 2/8 (25%)• Preservación gastroduodenal con ligadura arteria esplénica 3/8 (37,5%)• Preservación arteria gastroduodenal 2/8 (25%)• Reintervención con sección de LAM 1/8 (12,5%) | La conservación de la circulación colateral entre la arteria mesentérica superior y el tronco celiaco a través de la arteria gastroduodenal con o sin ligadura de arteria esplénica es un método seguro y factible de división del LAM |
| Viñas et al., 2023 | Cohortes retrospectivo | 4/394 (1,01%) | Tiempo operatorioTiempo isquemia fríaTiempo isquemia calienteFlujo arterial hepáticoFlujo portal | • Sección LAM 4/4 (100%) | No morbilidad asociada a la sección del LAMNo complicaciones vasculares post TH |
CCI: Comprehensive Complications Index; CD: Clavien Dindo; LAM: ligamento arcuato mediano; SLAM: sindrome de ligamento arcuato mediano; TC: tronco celiaco; TH: trasplante hepático.
El SLAM es una condición infrecuente en la población general. La incidencia descrita en pacientes a los que se les efectúa un TH oscila entre el 1,6 y el 33% según las series publicadas3, aunque en nuestra serie es un poco inferior (1%). La clínica del SLAM es inespecífica: dos de nuestros pacientes presentaron dolor abdominal, en un caso acompañado de vómitos. Los síntomas habituales del SLAM pueden ser atribuidos a la hepatopatía crónica8. Por tanto, su diagnóstico es difícil y requiere una exhaustiva valoración radiológica de la TAC pretrasplante, y poder así establecer una estrategia quirúrgica intraoperatoria adecuada1,3,8,9.
No hay recomendaciones establecidas sobre el tratamiento del SLAM en pacientes a los que se va a efectuar un TH1,3. Existe una clasificación del SLAM en pacientes a los que se les realiza duodenopancreatectomía cefálica adaptando el tratamiento según el porcentaje y la longitud de la estenosis8, pero se desconoce si este algoritmo es aplicable en el TH. Se acepta que en pacientes sintomáticos el tratamiento quirúrgico es obligatorio, pero si no produce síntomas evidentes no hay consenso sobre si se debe tratar o no1,3,8,9. Los defensores de tratar cualquier SLAM en pacientes a los que se les efectúa un TH argumentan que si no es tratado pueden incrementarse las complicaciones vasculares y biliares post-TH, y que su tratamiento no incrementa la morbilidad1. Pero en las escasas series publicadas no hay datos que confirmen una mayor incidencia de complicaciones vasculares y biliares tras TH si hay SLAM asintomático y no es tratado1,10.
Cuando se trata el SLAM en pacientes a los que se les efectúa un TH, las distintas opciones terapéuticas son: sección del LAM, preservación de la arteria gastroduodenal o técnicas más complejas, como el bypass aorto-hepático o también técnicas endovasculares3,8-10. En nuestra serie realizamos sección del LAM en todos los casos, sin presentar morbilidad asociada a esta técnica. Una de las posibles complicaciones postuladas sobre la sección del LAM es que se produzca hemorragia debido a la existencia de varices y abundante circulación colateral en dicha zona. Creemos que la derivación porto-cava que realizamos en todos nuestros pacientes minimiza este riesgo, facilitando la sección del LAM.
En conclusión, el SLAM en pacientes a los que se les va a efectuar un TH es infrecuente, habitualmente asintomático, y requiere un estudio exhaustivo de la TAC pretrasplante. No hay algoritmos terapéuticos de alta evidencia científica, pero dado que su tratamiento —sección del LAM— no incrementa la morbilidad, creemos recomendable realizarlo para evitar posibles complicaciones vasculares y/o biliares postoperatorias.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.