El objetivo de este estudio fue evaluar las alteraciones proteicas de las lipoproteínas de alta densidad (HDL) provocadas por la hiperhomocisteinemia inducida por ingesta de metionina en ratones y su relación con 2de las propiedades antiaterogénicas más importantes de las HDL.
Métodos y resultadosLa hiperhomocisteinemia inducida por administración de metionina resultó en un aumento (∼8veces) de la concentración plasmática de homocisteína. La hiperhomocisteinemia se correlacionó inversamente con la concentración plasmática de colesterol HDL y del componente proteico principal de las HDL, la apolipoproteína (apo) A-I. El eflujo de colesterol desde macrófagos a las HDL in vivo disminuyó en ratones hiperhomocisteinémicos en comparación con los controles. Sin embargo, el transporte reverso del colesterol desde macrófagos a heces no se observó alterado. Por otro lado, la capacidad de las HDL de ratones hiperhomocisteinémicos de prevenir la modificación oxidativa de las lipoproteínas de baja densidad (LDL) disminuyó, observándose también una reducción en la actividad plasmática de paraoxonasa-1 (PON1) y en la concentración plasmática de apoA-I y con una disminución relativa en la cantidad de apoA-IV (∼1,5veces) en las HDL de ratones hiperhomocisteinémicos comparados con las de los controles.
ConclusiónLa disminución en la protección contra la modificación oxidativa de las LDL por parte de las HDL de ratones hiperhomocisteinémicos se asoció con una disminución de apoA-I, PON1 y apoA-IV.
The aim of this study was to evaluate the proteic changes in high-density lipoproteins (HDL) induced by methionine-induced hyperhomocysteinemia in mice and its relationship with two of their main antiatherogenic properties.
Methods and resultsThe oral administration of methionine resulted in an elevation (∼8times) in the plasma concentration of homocysteine. Hyperhomocysteinemia was inversely correlated with the plasma concentration of HDL cholesterol and its main protein component of HDL, apolipoprotein (apo) A-I, respectively. The cholesterol efflux in vivo from macrophages to HDL was decreased in hyperhomocysteinemic mice compared with the control mice. However, the reverse cholesterol transport from macrophages to feces remained unchanged. On the other hand, the ability of HDL from hyperhomocysteinemic mice to prevent the oxidative modification of low-density lipoproteins (LDL) was found decreased and associated with a concomitant reduction in the plasma activity of paraoxonase-1 (PON1) and the plasma concentration of apoA-I, and with a relative reduction in the apoA-IV content (∼1.5times) in the hyperhomocysteinemic HDL, respectively.
ConclusionThe decrease in the ability of HDL from hyperhomocysteinemic mice to prevent LDL from oxidation was associated with a decrease in the apoA-I, PON1 and apoA-IV.
La homocisteína (Hcy) es un aminoácido sulfurado no proteico intermediario derivado de la vía metabólica de la metionina1. En la práctica clínica, se considera que un paciente presenta hiperhomocisteinemia cuando se alcanzan concentraciones plasmáticas de Hcy superiores a 14μM en ayunas2. La hiperhomocisteinemia es una condición clínica que puede manifestarse como consecuencia de alteraciones nutricionales o genéticas3,4 y afecta alrededor de entre el 5 y el 10% de las personas sanas y entre el 20 y el 40% de los pacientes con enfermedades cardiovasculares, siendo considerada un factor de riesgo independiente para las enfermedades cardiovasculares4,5. Aunque hay evidencias de una conexión entre hiperhomocisteinemia, dislipidemia y arteriosclerosis, esta es compleja y todavía está en buena parte por dilucidar. Entre los últimos, destaca la alteración de la función endotelial vascular, el aumento de la proliferación de las células del músculo liso vascular, el aumento de la infiltración de monocitos y leucocitos, la estimulación de la expresión de citocinas inflamatorias, el aumento de la peroxidación lipídica y la oxidación de las lipoproteínas circulantes6–8.
La hiperhomocisteinemia suele asociarse con una deficiencia parcial de lipoproteínas de alta densidad (HDL) que además son disfuncionales9–14, lo que resulta en una merma en su capacidad ateroprotectora. En este contexto, se ha observado que las HDL de sujetos hiperhomocisteinémicos presentan una menor capacidad para promover el eflujo de colesterol desde macrófagos (el primer paso del transporte reverso de colesterol [TRC]) in vitro en humanos14, en modelos experimentales10 e in vivo15. A pesar de ello, en este último estudio el aumento de Hcy en plasma no se asoció con una eliminación del colesterol desde macrófagos a heces alterada en comparación con la de los controles. Teniendo en cuenta que un aumento de los marcadores de estrés oxidativo inducido por el aumento y la acumulación de la Hcy es un evento importante en el desarrollo de la arteriosclerosis tanto en humanos como en modelos animales7,12,16,17, diferentes estudios han sugerido alteraciones en otra de las funciones antiaterogénicas de las HDL: su capacidad antioxidante de las lipoproteínas de baja densidad (LDL)7. En un estudio reciente, en un modelo experimental de hiperhomocisteinemia se ha demostrado que las HDL aisladas de plasmas hiperhomocisteinémicos presentaron una capacidad antioxidante de LDL reducida, estando ello asociado a una disminución en la concentración de HDL circulantes y en la actividad enzimática de 2 de las principales enzimas antioxidantes asociadas a HDL (PON1 y PAF AH)15.
El objetivo del presente estudio fue examinar el efecto de la hiperhomocisteinemia sobre el contenido proteico de las HDL, incluyendo un análisis proteómico, y su potencial relación con 2 de las funciones antiaterogénicas mejor conocidas de las HDL: TRC y capacidad de protección antioxidante.
Materiales y métodosAnimales y tratamientoLos ratones C57BL/6NCrl utilizados en el estudio fueron obtenidos de Charles River Laboratories International, Inc. (código027; Bar Harbour, ME, EE.UU.). Para el estudio se adquirieron un total de 24ratones macho de 2meses de edad (25,1±1,2g). Los ratones fueron distribuidos aleatoriamente en 2grupos y se les mantuvo con una dieta estándar (Dieta de mantenimiento para ratones y ratas A04, Scientific Animal Food&Engineering, Augy, Francia) que contiene un 3% de grasa y un 0,02% de colesterol durante 20semanas. A uno de los 2grupos se les indujo hiperhomocisteinemia mediante la administración de 1% (v/v) de metionina a través del agua de bebida durante el mismo periodo (grupo MET), mientras que el grupo de ratones control (grupo CTRL) recibieron el mismo tipo de agua pero sin metionina. Los animales se mantuvieron en una sala con la temperatura controlada (20°C) y un ciclo de luz/oscuridad de 12h. El acceso de los ratones al agua y a la comida fue ad líbitum. En algunos experimentos la manipulación de los animales se realizó entre las 9 y las 11a.m. El ayuno consistió en la deprivación de alimento durante 6h antes de su sacrificio. Los ratones anestesiados en atmósfera de Forane® fueron desangrados mediante punción cardíaca y posteriormente sacrificados. Todos los procedimientos realizados con los animales estaban en estricto acuerdo con las recomendaciones publicadas en la Guía del Cuidado y Uso de Animales de Laboratorio18 y revisado y aprobado por el Comité de Cuidado Animal del Institut de Recerca del Hospital de la Santa Creu i Sant Pau y el Departament d’Agricultura, Ramaderia, Pesca, Alimentació i Medi Natural de la Generalitat de Catalunya.
Análisis bioquímicosLos métodos utilizados para el análisis de lípidos y lipoproteínas han sido descritos previamente19. La concentración de Hcy plasmática se determinó mediante la utilización de un kit comercial de Abbott adaptado a un Architect ci16200 (Abbott Diagnostics, Irving, Texas, EE.UU.). Los lípidos plasmáticos y las actividades ALT/AST se determinaron mediante la utilización de kits comerciales adaptados a un autoanalizador COBAS c501 (Roche Diagnostics, Alemania)19. Las HDL se aislaron mediante ultracentrifugación secuencial a 100.000g durante 24h19. La composición de las HDL, incluyendo el colesterol total y libre, triglicéridos y fosfolípidos, se determinó mediante la utilización de métodos adaptados a un autoanalizador COBAS c501 (Roche Diagnostics, Alemania). La concentración de proteínas de HDL se determinó por el método del BCA (TermoScientific, Rockford, Illinois, EE.UU.). La concentración plasmática de apoA-I se determinó mediante un ensayo ELISA específico tal y como se ha descrito previamente20. El tamaño de las partículas de HDL se determinó mediante una electroforesis de gel en gradiente en un gel no desnaturalizante de poliacrilamida del 4-30%, posteriormente teñido con Coomassie G-25020. Tras la preincubación del suero durante 6h con un inhibidor de la lecitina:colesterol aciltransferasa (LCAT), se cuantificó la cantidad relativa de partículas preβ-HDL formadas mediante la resolución de las muestras con una inmunoelectroforesis bidimensional tal y como se ha descrito previamente21. La concentración de preβ-HDL se calculó como el producto entre el porcentaje de preβ-HDL y la concentración plasmática de apoA-I en las mismas muestras.
Transporte reverso de colesterol específico de macrófagos in vivoLa línea celular J774 de macrófagos de ratón (American Type Culture Collection, Manassas, VA, EE.UU.) fue cultivada en flascones de 75cm2 (T-75). Para el marcaje se sembraron 5millones de células/T-75, que se cultivaron en medio RPMI 1640 suplementado con un 10% de suero bovino fetal. Tras llegar al 90% de confluencia, los macrófagos se incubaron en presencia de 5μCi/pocillo [1α, 2α(n)-3H]-colesterol (GE Healthcare Europe GmbH, Alemania), 100μg de LDL acetilada y un 10% de suero libre de lipoproteínas durante 48h20. A continuación, los macrófagos marcados radiactivamente con [3H]colesterol y resuspendidos en 0,9% (p/v) de salino fueron sometidos a 2lavados con solución fosfato-salino (PBS). Las células provenientes de diferentes T-75 fueron mezcladas antes de ser inyectadas por vía intraperitoneal a los ratones de ambas condiciones experimentales. A cada ratón se le inyectaron unos ∼10·106 de células, lo que, dado el proceso de marcaje radiactivo de las células, supone que se inyectaron ∼3,0·106cpm en 0,5ml de salino por ratón; la viabilidad celular medida con azul de tripano fue >90%. Tras la inyección de los macrófagos marcados, los ratones fueron alojados individualmente en jaulas metabólicas y se recolectaron las heces producidas durante 2días para determinar la cantidad de radiactividad derivada del colesterol en heces para cada animal. Al final del experimento (48h después de la inyección), los ratones fueron sacrificados, exsanguinados mediante punción cardíaca, y su hígado recolectado. Seguidamente se determinó el contenido de [3H]colesterol en el plasma y en las HDL mediante el recuento de centelleo20. Las HDL asociadas a [3H]colesterol se obtuvieron tras precipitación con ácido fosfotúngstico y cloruro de magnesio (Roche Diagnostics GmbH, Alemania)19. Los lípidos de hígado y heces se extrajeron con una solución de hexano:isopropanol (3:2; v:v). La capa lipídica se recogió y se evaporó con nitrógeno, midiéndose el contenido de [3H]20. El contenido de [3H] en los ácidos biliares fecales se determinó a partir de la fase acuosa que resulta de la extracción lipídica de las heces. Una cantidad conocida de [1α, 2α(n)-3H]-colesterol (GE Healthcare) y [3H(G)]-ácido taurocólico (PerkinElmer, California, EE.UU.) se utilizó como control interno. La cantidad de [3H] recogida en cada espécimen se expresó como fracción de la dosis inyectada.
Susceptibilidad a la oxidación de las lipoproteínasLas lipoproteínas aisladas a partir de mezclas de plasmas de ratones se dializaron en tampón fosfato salino mediante columnas PD-10 (GE Healthcare). La oxidación se inició al añadir 2,5μmol/l CuSO4 a LDL humanas (0,1mmol/l fosfolípidos) en ausencia/presencia de los diferentes tipos de HDL (0,1mmol/l de fosfolípidos)22. La formación de dienos conjugados se determinó en un lector de microplacas Synergy HT (BioTek Synergy, Winooski, VT, EE.UU.) mediante la monitorización continua de la absorbancia a longitud de onda de 234nm, a una temperatura de 37°C durante 6h. Al final del ensayo la reacción se detuvo mediante la adición de 50μmol/l de EDTA y 20μmol/l de hidroxitolueno butilado. La lag phase se calculó tal como se ha descrito previamente22. La cinética de la LDL en las mezclas de HDL+LDL de cada condición se calculó mediante la sustracción de la cinética de la incubación de sus correspondientes HDL.
Actividades de enzimas asociadas a lipoproteínas de alta densidadLa actividad arilesterasa del plasma total se midió utilizando un sustrato de fenilacetato22. La actividad de la arilesterasa del suero sensible a EDTA se calculó restándole la resistente a EDTA y se expresó como la actividad paraoxonasa (PON)122. La actividad de la acetil hidrolasa del factor plaquetario activado (PAF AH) se determinó utilizando un kit comercial (Cayman Chemical, Ann Arbor, Michigan, EE.UU.)22. La actividad de la proteína transferidora de fosfolípidos (PLTP) se midió utilizando un ensayo radiométrico tal y como se ha descrito previamente23. La actividad LCAT se determinó a través de la medición de su capacidad esterificadora endógena utilizando [7(n)-3H]colesterol como sustrato22.
Análisis proteómicos de lipoproteínas de alta densidadLas muestras de HDL de cada uno de los grupos se analizaron en un espectrómetro Maxis High Resolution Q-TOF (Bruker, Bremen, Alemania) acoplado a un sistema nano-HPLC (Proxeon, Odense, Dinamarca). Las muestras disueltas en agua con un 5% acetonitrilo y un 0,1% de ácido fórmico fueron primero concentradas en una columna de esta empresa con 100μm de diámetro interno y 2cm de altura, para ser posteriormente cargadas en una columna de nanoseparación Acclaim PepMap de 75μm de diámetro interno y 15cm de altura (Dionex). La cromatografía se realizó utilizando un gradiente de 0,1% de ácido fórmico-acetonitrilo (5-35% en 90min; velocidad de flujo 300nl/min). La columna fue acoplada al espectrómetro de masas (MS) con una entrada a través de una fuente de ionización Captive Spray (Bruker). La adquisición de MS queda fijada a los ciclos de MS (1Hz), seguido de MS/MS (0,5-2Hz) de los 8iones precursores más intensos con un umbral de intensidad de 5.000cuentas y utilizando un tiempo de exclusión dinámico de 0,5min. Todos los espectros fueron adquiridos en el rango 100-2.200Da. Los datos de LC-MSMS fueron analizados utilizando el software Data Análisis 4.0 (Bruker).
Las proteínas se identificaron mediante la utilización del programa Mascot (Matriz Science, Londres, Reino Unido) y búsqueda en el SwissProt Mouse database (16.544secuencias). Se examinaron los espectros MS/MS con un precursor de tolerancia de masa de 10ppm, fragmento de tolerancia de 0,04Da, específico de tripsina con un máximo de 2divisiones perdidas, estableciendo como modificación fija la carbamidometilación de la cisteína y como modificación variable la oxidación de la metionina. El análisis diferencial cuantitativo de las muestras se realizó por medio de 2métodos diferentes: un análisis de recuento espectral y un análisis LC-MS/MS 2D de intensidad de mapas utilizando el software Progenesis LC-MS/MS.
Análisis cuantitativos de la RT-PCR a tiempo realEl ARN hepático se aisló mediante el método TRIzol® (Gibco/BRL, Grand Island, NY. EE.UU.). Las muestras de ARN se repurificaron utilizando el kit RNeasy mini kit Plus (QIAGEN, CA, EE.UU.), comprobándose su integridad mediante una electroforesis en gel de agarosa. A continuación, se realizó la transcripción inversa del ARN total (1μg) con Oligo(dT)15 utilizando M-MLV Reverse Transcriptase, RNase H Minus, Point Mutant (Promega Corporation, MD, EE.UU.) para generar el ADNc. Se utilizaron tanto sondas TaqMan® como primers prediseñados y validados (Assays-on-Demand; Applied Biosystems, Foster City, CA, EE.UU.). La PCR a tiempo real se realizó en un Termociclador C1000 acoplado a CFX96 Real-Time System (Bio-Rad Laboratories SA, Life Science Group, Madrid, España). Todos los análisis se realizaron por duplicado y los niveles relativos de ARN se determinaron utilizando gliceraldehído 3fosfato deshidrogenasa (GAPDH) como control interno.
Análisis estadísticosLos datos se presentan como la mediana (25°; 75° percentiles). Los análisis estadísticos se realizaron utilizando el Graphpad Prism software (GPAD, version 4.0, San Diego, CA, EE.UU.). El test de Mann-Whitney U se utilizó para comparar las diferencias entre grupos. Cuando se tuvieron que comparar más de 2grupos se utilizó el test de Kruskal-Wallis seguido de postest de Dunns. El cálculo de la relación entre Hcy y el colesterolHDL, apoA-I y el porcentaje de dosis en HDL, respectivamente, se realizó mediante el test de correlación de Spearman. Las diferencias entre grupos se consideraron estadísticamente significativas con un valor p<0,05.
ResultadosEfecto de la hiperhomocisteinemia sobre diferentes parámetros corporales y bioquímicosLa inducción de hiperhomocisteinemia mediante la administración de metionina no cambió el peso de los ratones al final del estudio (peso de ratones del grupo MET 29,5 [24,0; 34,7]g vs. peso de ratones del grupo CTRL 30,6 [28,7; 33,0]g) ni causó toxicidad hepática a juzgar por los niveles plasmáticos de las actividades enzimáticas ALT y AST y el tamaño del hígado entre ambas condiciones (datos no mostrados). La administración de metionina tampoco causó alteraciones en la pauta de consumo de comida y de agua entre ambos grupos de ratones (datos no mostrados).
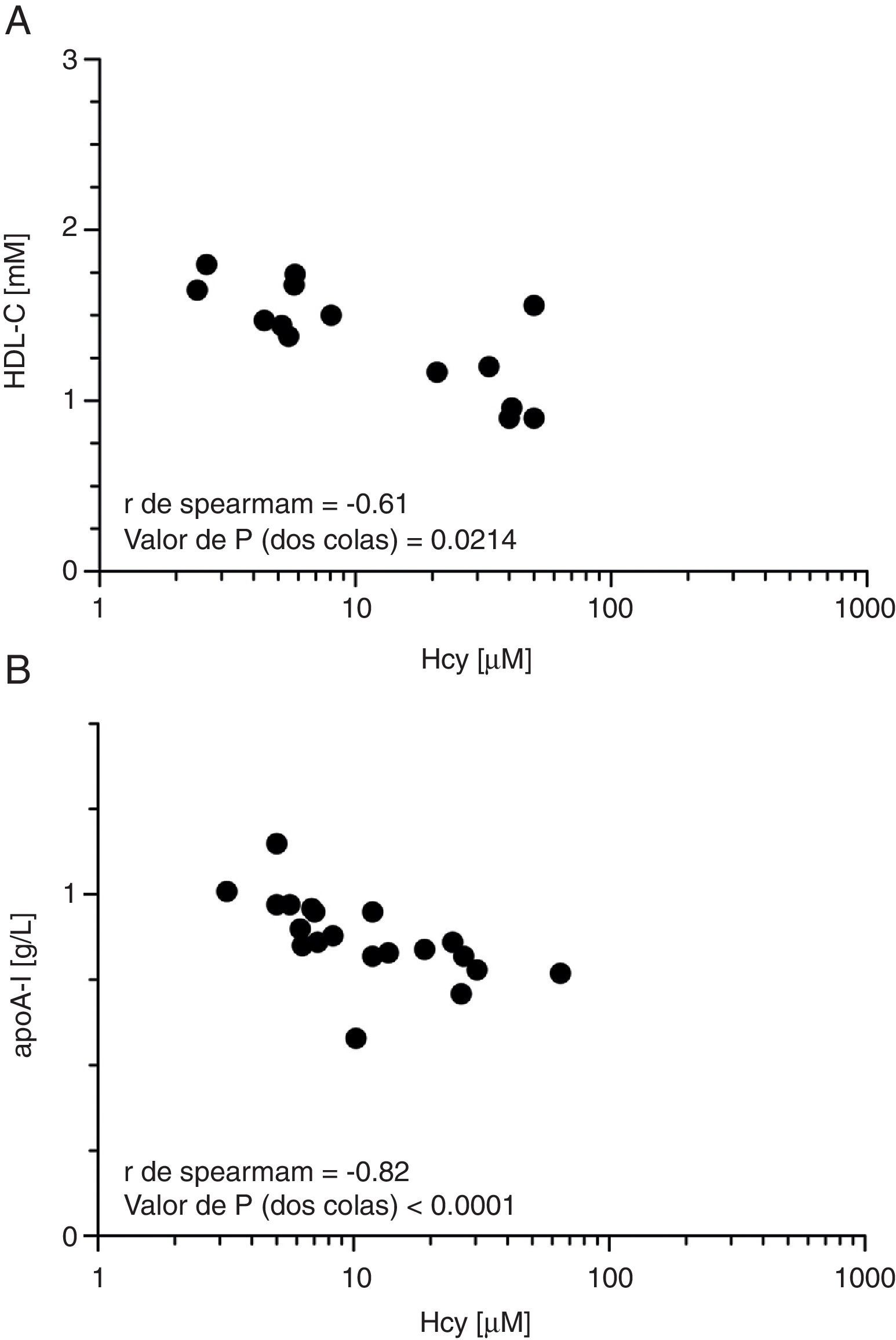
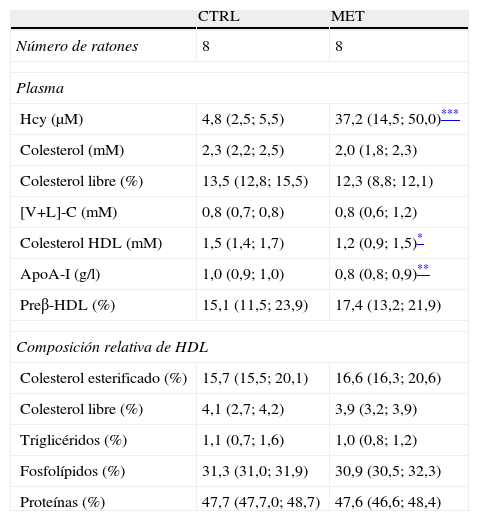
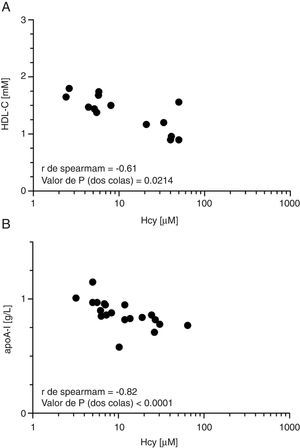
La suplementación en el agua de metionina resultó en una elevación de la concentración plasmática de Hcy en ayunas (∼8veces) en los ratones tratados en comparación con los controles (tabla 1). La hiperhomocisteinemia resultante se asoció a su vez con una disminución significativa en la concentración plasmática de colesterolHDL (∼20%; p<0,05) y de apoA-I (∼15%; p<0,05), respectivamente (tabla 1). Ello no estuvo acompañado de cambios en el porcentaje de pre-β-HDL, ni en la composición relativa de las HDL aisladas por ultracentrifugación secuencial (tabla 1). La concentración plasmática de preβ-HDL se encontró disminuida en el grupo de ratones hiperhomocisteinémicos en comparación con los controles (grupo MET: 0,13 [0,12-0,14]g/l vs. grupo CTRL: 0,20 [0,15-0,24]g/l; p=0,016). Las HDL aisladas de este modo y separadas mediante electroforesis en gradiente de densidad tampoco mostraron cambios en su tamaño (datos no mostrados). Las concentraciones plasmáticas de colesterolHDL y de apoA-I se correlacionaron inversamente con la concentración plasmática de Hcy (fig. 1), siendo la correlación entre la concentración plasmática de apoA-I y la de Hcy la que mostró mayor significación estadística (fig. 1B).
Parámetros bioquímicos en plasma y composición relativa de HDL aisladas de plasma de ratones controles e hiperhomocisteinémicos
| CTRL | MET | |
| Número de ratones | 8 | 8 |
| Plasma | ||
| Hcy (μM) | 4,8 (2,5; 5,5) | 37,2 (14,5; 50,0)*** |
| Colesterol (mM) | 2,3 (2,2; 2,5) | 2,0 (1,8; 2,3) |
| Colesterol libre (%) | 13,5 (12,8; 15,5) | 12,3 (8,8; 12,1) |
| [V+L]-C (mM) | 0,8 (0,7; 0,8) | 0,8 (0,6; 1,2) |
| Colesterol HDL (mM) | 1,5 (1,4; 1,7) | 1,2 (0,9; 1,5)* |
| ApoA-I (g/l) | 1,0 (0,9; 1,0) | 0,8 (0,8; 0,9)** |
| Preβ-HDL (%) | 15,1 (11,5; 23,9) | 17,4 (13,2; 21,9) |
| Composición relativa de HDL | ||
| Colesterol esterificado (%) | 15,7 (15,5; 20,1) | 16,6 (16,3; 20,6) |
| Colesterol libre (%) | 4,1 (2,7; 4,2) | 3,9 (3,2; 3,9) |
| Triglicéridos (%) | 1,1 (0,7; 1,6) | 1,0 (0,8; 1,2) |
| Fosfolípidos (%) | 31,3 (31,0; 31,9) | 30,9 (30,5; 32,3) |
| Proteínas (%) | 47,7 (47,7,0; 48,7) | 47,6 (46,6; 48,4) |
CTRL: ratones control; Hcy: homocisteína; MET, ratones hiperhomocisteinémicos mediante la administración de agua suplementada con metionina a través del agua de bebida; [V+L]-C, colesterol de VLDL y LDL.
En el caso del estudio de la composición relativa de HDL, los datos se obtuvieron a partir de 3mezclas/grupo experimental provenientes de mezclas de plasma de 3-4ratones cada una. Los resultados se expresaron como la mediana (25°; 75° percentiles).
Efecto de la hiperhomocisteinemia sobre la concentración de colesterolHDL (HDL-C) y apoA-I. A)Correlación de Spearman entre concentración plasmática de Hcy y colesterolHDL. B)Correlación de Spearman entre concentración plasmática de Hcy y apoA-I. El plasma fue obtenido a partir de sangre de animales tras 6h de deprivación de alimento.
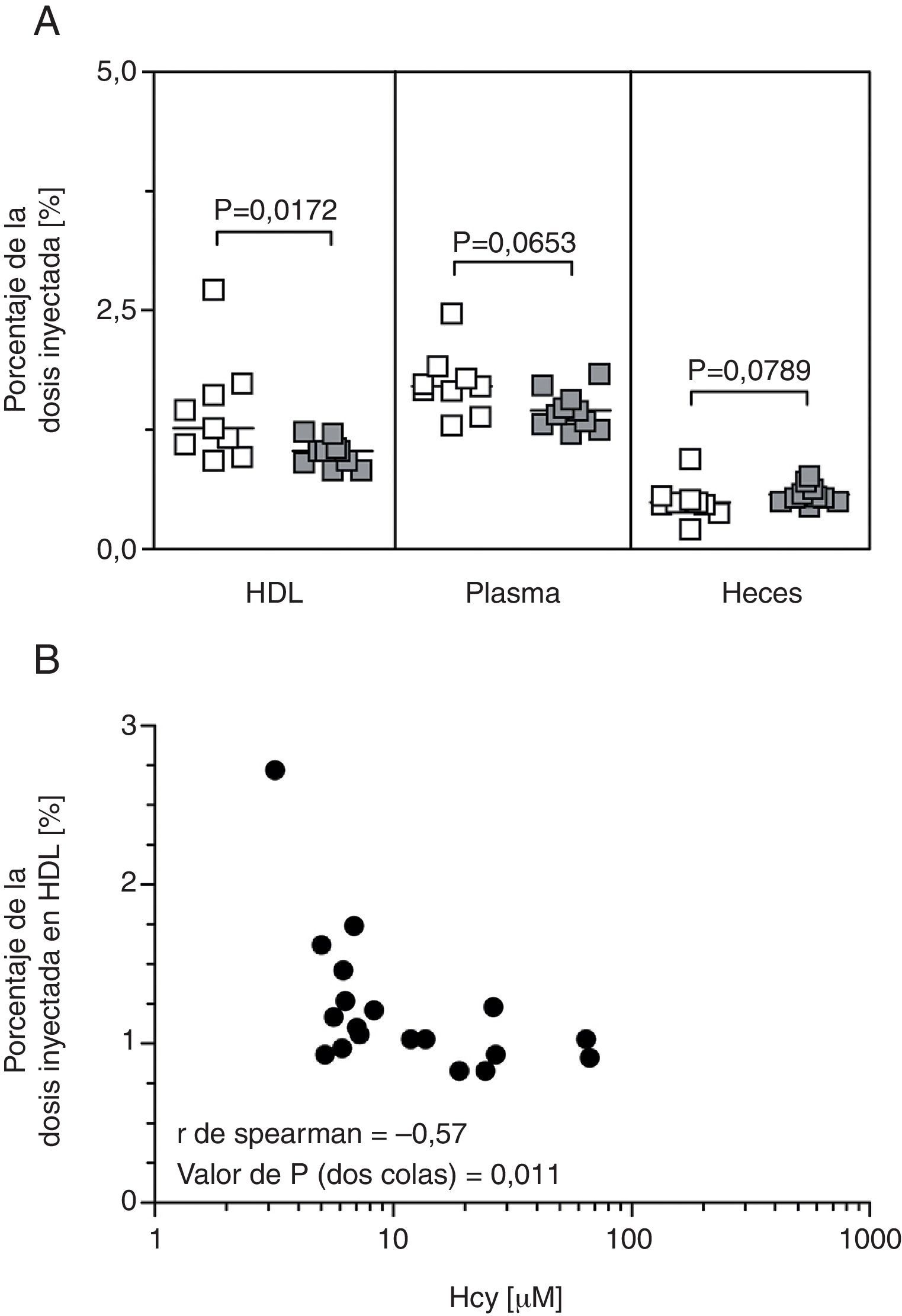
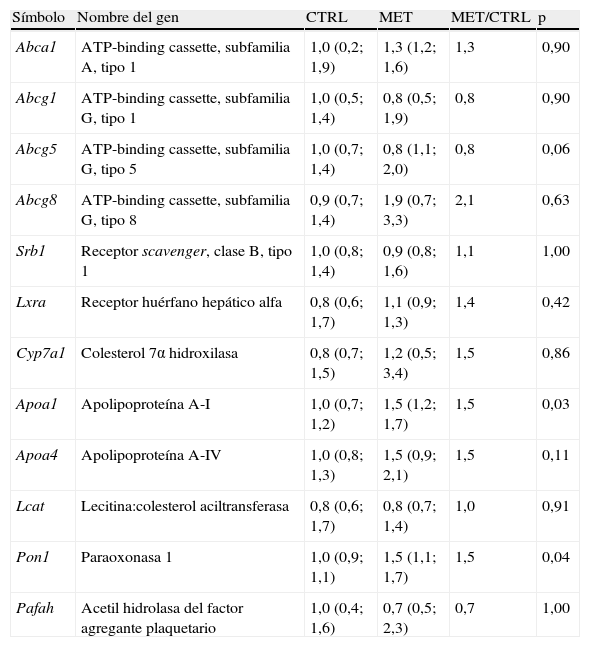
El porcentaje de la dosis inyectada de [3H]colesterol en HDL disminuyó significativamente en los ratones hiperhomocisteinémicos en comparación con el mostrado por los controles a las 48h de la inyección (fig. 2A), estando este parámetro significativamente correlacionado con la concentración de Hcy plasmática (fig. 2B). Sin embargo, no hubo cambios significativos en la recuperación de [3H] en el hígado ni en las heces recolectadas durante un período de 48h (fig. 2A). De modo consistente con estos datos, el desarrollo de hiperhomocisteinemia no alteró el patrón de expresión hepática de genes diana involucrados en el TRC (p.ej., Srb1, Abca1, Abcg1, Abcg5, Abcg8, Cyp7a1, Lxra) en comparación con el de los ratones controles (tabla 2).
Efecto de la hiperhomocisteinemia sobre el transporte reverso de colesterol (TRC) específico de macrófagos in vivo. A)La cantidad de [3H] en plasma, HDL, hígado y heces se expresó como la fracción de la dosis inyectada durante 48h. Los valores se expresaron como mediana (25°; 75° percentiles) (n=9-10). B)Correlación de Spearman entre el porcentaje de la dosis inyectada medida en HDL y la concentración plasmática de Hcy.
Efecto de la hiperhomocisteinemia en la expresión de genes relacionados con el metabolismo lipídico en hígado
| Símbolo | Nombre del gen | CTRL | MET | MET/CTRL | p |
| Abca1 | ATP-binding cassette, subfamilia A, tipo 1 | 1,0 (0,2; 1,9) | 1,3 (1,2; 1,6) | 1,3 | 0,90 |
| Abcg1 | ATP-binding cassette, subfamilia G, tipo 1 | 1,0 (0,5; 1,4) | 0,8 (0,5; 1,9) | 0,8 | 0,90 |
| Abcg5 | ATP-binding cassette, subfamilia G, tipo 5 | 1,0 (0,7; 1,4) | 0,8 (1,1; 2,0) | 0,8 | 0,06 |
| Abcg8 | ATP-binding cassette, subfamilia G, tipo 8 | 0,9 (0,7; 1,4) | 1,9 (0,7; 3,3) | 2,1 | 0,63 |
| Srb1 | Receptor scavenger, clase B, tipo 1 | 1,0 (0,8; 1,4) | 0,9 (0,8; 1,6) | 1,1 | 1,00 |
| Lxra | Receptor huérfano hepático alfa | 0,8 (0,6; 1,7) | 1,1 (0,9; 1,3) | 1,4 | 0,42 |
| Cyp7a1 | Colesterol 7α hidroxilasa | 0,8 (0,7; 1,5) | 1,2 (0,5; 3,4) | 1,5 | 0,86 |
| Apoa1 | Apolipoproteína A-I | 1,0 (0,7; 1,2) | 1,5 (1,2; 1,7) | 1,5 | 0,03 |
| Apoa4 | Apolipoproteína A-IV | 1,0 (0,8; 1,3) | 1,5 (0,9; 2,1) | 1,5 | 0,11 |
| Lcat | Lecitina:colesterol aciltransferasa | 0,8 (0,6; 1,7) | 0,8 (0,7; 1,4) | 1,0 | 0,91 |
| Pon1 | Paraoxonasa 1 | 1,0 (0,9; 1,1) | 1,5 (1,1; 1,7) | 1,5 | 0,04 |
| Pafah | Acetil hidrolasa del factor agregante plaquetario | 1,0 (0,4; 1,6) | 0,7 (0,5; 2,3) | 0,7 | 1,00 |
CTRL: ratones control; MET: ratones hiperhomocisteinémicos mediante la administración de agua suplementada con metionina a través del agua de bebida; MET/CTRL: tasa de cambio entre la condición MET y CTRL.
El número de ratones empleado para cada grupo experimental fue de 5. Los resultados se expresaron como la mediana (25°; 75° percentiles).
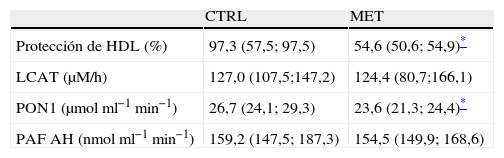
También se evaluó el progreso de la oxidación lipídica a través de la monitorización de la formación de dienos conjugados para comparar la capacidad protectora contra la oxidación de LDL por parte de HDL aisladas de uno y otro grupo (tabla 3). Los resultados mostraron que las HDL de ratones hiperhomocisteinémicos presentaron una capacidad antioxidante de LDL in vitro disminuida (∼2veces menor; p<0,05) en comparación con la que mostraron las HDL de ratones controles (tabla 3).
Efecto de la hiperhomocisteinemia sobre las propiedades antioxidantes de HDL
| CTRL | MET | |
| Protección de HDL (%) | 97,3 (57,5; 97,5) | 54,6 (50,6; 54,9)* |
| LCAT (μM/h) | 127,0 (107,5;147,2) | 124,4 (80,7;166,1) |
| PON1 (μmolml−1min−1) | 26,7 (24,1; 29,3) | 23,6 (21,3; 24,4)* |
| PAF AH (nmolml−1min−1) | 159,2 (147,5; 187,3) | 154,5 (149,9; 168,6) |
CTRL: ratones control; MET: ratones hiperhomocisteinémicos mediante la administración de agua suplementada con metionina a través del agua de bebida.
El número de ratones empleado para cada grupo experimental fue de 8, salvo para el dato indicador de la protección contra la oxidación de LDL por parte de las HDL in vitro (referido en la tabla como Protección de HDL [%]) que se obtuvo de HDL aisladas a partir de 3mezclas de plasma de cada grupo experimental. Los resultados se expresaron como la mediana (25°; 75° percentiles).
Para profundizar en el estudio de la alteración en la capacidad antioxidante de LDL conferida por las HDL de ratones hiperhomocisteinémicos se analizó la concentración (apoA-I) o actividad (PON1, PAF AH y LCAT) de proteínas asociadas a HDL y con reconocido potencial antioxidante (tablas 1 y 3). De un lado, tal y como se ha indicado anteriormente, la concentración plasmática de apoA-I disminuyó en ratones hiperhomocisteinémicos en comparación con los controles (tabla 1) a pesar de un aumento significativo (∼1,5veces; p=0,03) en los niveles relativos de su ARNm hepático (tabla 2). Por otro lado, de las actividades determinadas, solo la actividad PON1 en plasma se encontró significativamente disminuida en ratones hiperhomocisteinémicos (∼10%; p<0,05) comparado con los controles (tabla 3). Teniendo en cuenta que la diferencia observada en la actividad PON1 entre ambos grupos de ratones podría deberse a una disminución en su expresión, se analizó la expresión génica de esta proteína en el hígado. Su expresión se encontró significativamente aumentada en el hígado de ratones hiperhomocisteinémicos (1,5 veces; p=0,04) en comparación con los controles (tabla 2). Finalmente, no se detectaron cambios significativos en la expresión génica hepática (tabla 2) de PAF AH ni de LCAT entre ambos grupos (tabla 3).
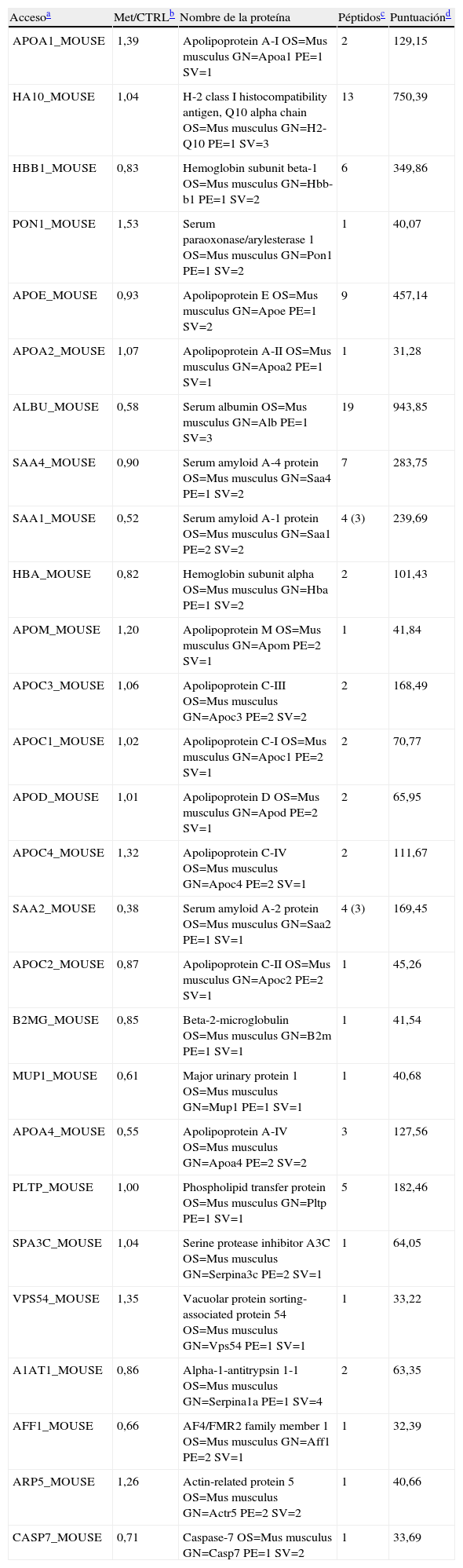
Análisis del proteoma de lipoproteínas de alta densidad de ratones hiperhomocisteinémicosSe identificaron un total de 27 proteínas, de las cuales aproximadamente el 50% fueron proteínas consideradas propiamente de HDL, siendo 9 de ellas apolipoproteínas, 2 de ellas enzimas, y 3 de ellas, proteínas séricas amiloides (tabla 4). El resto de proteínas identificadas incluyeron, entre muchas otras, la albúmina y diferentes subunidades de la hemoglobina, conocidos contaminantes en este tipo de análisis. (tabla 4). Para facilitar la interpretación de los resultados se debe considerar que: a)los datos se obtuvieron a partir de la comparación de cantidades iguales de proteína de HDL aisladas de una y otra condición experimental, y b)solo se consideraron como indicativos de cambios relevantes aquellos iguales o superiores a la mitad o doble, según corresponda, en comparación con la condición control. Atendiendo a este criterio, solo una de las apolipoproteínas, la apoA-IV, se encontró disminuida en las HDL de ratones hiperhomocisteinémicos en comparación con las de los controles (tabla 4). Este cambio no fue debido a una menor expresión génica de ApoA-IV hepática (tabla 2). En cuanto a las proteínas con actividad antioxidante reconocida, solo la PON1 se observó aumentada (∼1,5veces) en las HDL de ratones hiperhomocisteinémicos en comparación con las de los controles (tabla 4). No se lograron identificar otras proteínas asociadas a HDL con papel antioxidante tales como la PAF AH y LCAT. No se observaron cambios en la proporción relativa de PLTP en las HDL de los ratones hiperhomocisteinémicos en comparación con las de los controles (tabla 4). Consistentemente, la actividad PLTP en plasma de ratones hiperhomocisteinémicos no difirió en comparación con la de los controles (12,4 [8,7; 18,9] μmolml−1h−1 en ratones hiperhomocisteinémicos vs. 19,0 [12,8; 33,1]μmolml−1h−1 en ratones controles; p=0,07). Por último, se observó una disminución en la proporción relativa de las 2isoformas principales de proteínas séricas amiloides, SAA1 y SAA2, en las HDL de los ratones hiperhomocisteinémicos en comparación con las de los controles (tabla 4).
Listado de proteínas identificadas en HDL de ratones hiperhomocisteinémicos y controles
| Accesoa | Met/CTRLb | Nombre de la proteína | Péptidosc | Puntuaciónd |
| APOA1_MOUSE | 1,39 | Apolipoprotein A-I OS=Mus musculus GN=Apoa1 PE=1 SV=1 | 2 | 129,15 |
| HA10_MOUSE | 1,04 | H-2 class I histocompatibility antigen, Q10 alpha chain OS=Mus musculus GN=H2-Q10 PE=1 SV=3 | 13 | 750,39 |
| HBB1_MOUSE | 0,83 | Hemoglobin subunit beta-1 OS=Mus musculus GN=Hbb-b1 PE=1 SV=2 | 6 | 349,86 |
| PON1_MOUSE | 1,53 | Serum paraoxonase/arylesterase 1 OS=Mus musculus GN=Pon1 PE=1 SV=2 | 1 | 40,07 |
| APOE_MOUSE | 0,93 | Apolipoprotein E OS=Mus musculus GN=Apoe PE=1 SV=2 | 9 | 457,14 |
| APOA2_MOUSE | 1,07 | Apolipoprotein A-II OS=Mus musculus GN=Apoa2 PE=1 SV=1 | 1 | 31,28 |
| ALBU_MOUSE | 0,58 | Serum albumin OS=Mus musculus GN=Alb PE=1 SV=3 | 19 | 943,85 |
| SAA4_MOUSE | 0,90 | Serum amyloid A-4 protein OS=Mus musculus GN=Saa4 PE=1 SV=2 | 7 | 283,75 |
| SAA1_MOUSE | 0,52 | Serum amyloid A-1 protein OS=Mus musculus GN=Saa1 PE=2 SV=2 | 4 (3) | 239,69 |
| HBA_MOUSE | 0,82 | Hemoglobin subunit alpha OS=Mus musculus GN=Hba PE=1 SV=2 | 2 | 101,43 |
| APOM_MOUSE | 1,20 | Apolipoprotein M OS=Mus musculus GN=Apom PE=2 SV=1 | 1 | 41,84 |
| APOC3_MOUSE | 1,06 | Apolipoprotein C-III OS=Mus musculus GN=Apoc3 PE=2 SV=2 | 2 | 168,49 |
| APOC1_MOUSE | 1,02 | Apolipoprotein C-I OS=Mus musculus GN=Apoc1 PE=2 SV=1 | 2 | 70,77 |
| APOD_MOUSE | 1,01 | Apolipoprotein D OS=Mus musculus GN=Apod PE=2 SV=1 | 2 | 65,95 |
| APOC4_MOUSE | 1,32 | Apolipoprotein C-IV OS=Mus musculus GN=Apoc4 PE=2 SV=1 | 2 | 111,67 |
| SAA2_MOUSE | 0,38 | Serum amyloid A-2 protein OS=Mus musculus GN=Saa2 PE=1 SV=1 | 4 (3) | 169,45 |
| APOC2_MOUSE | 0,87 | Apolipoprotein C-II OS=Mus musculus GN=Apoc2 PE=2 SV=1 | 1 | 45,26 |
| B2MG_MOUSE | 0,85 | Beta-2-microglobulin OS=Mus musculus GN=B2m PE=1 SV=1 | 1 | 41,54 |
| MUP1_MOUSE | 0,61 | Major urinary protein 1 OS=Mus musculus GN=Mup1 PE=1 SV=1 | 1 | 40,68 |
| APOA4_MOUSE | 0,55 | Apolipoprotein A-IV OS=Mus musculus GN=Apoa4 PE=2 SV=2 | 3 | 127,56 |
| PLTP_MOUSE | 1,00 | Phospholipid transfer protein OS=Mus musculus GN=Pltp PE=1 SV=1 | 5 | 182,46 |
| SPA3C_MOUSE | 1,04 | Serine protease inhibitor A3C OS=Mus musculus GN=Serpina3c PE=2 SV=1 | 1 | 64,05 |
| VPS54_MOUSE | 1,35 | Vacuolar protein sorting-associated protein 54 OS=Mus musculus GN=Vps54 PE=1 SV=1 | 1 | 33,22 |
| A1AT1_MOUSE | 0,86 | Alpha-1-antitrypsin 1-1 OS=Mus musculus GN=Serpina1a PE=1 SV=4 | 2 | 63,35 |
| AFF1_MOUSE | 0,66 | AF4/FMR2 family member 1 OS=Mus musculus GN=Aff1 PE=2 SV=1 | 1 | 32,39 |
| ARP5_MOUSE | 1,26 | Actin-related protein 5 OS=Mus musculus GN=Actr5 PE=2 SV=2 | 1 | 40,66 |
| CASP7_MOUSE | 0,71 | Caspase-7 OS=Mus musculus GN=Casp7 PE=1 SV=2 | 1 | 33,69 |
La hiperhomocisteinemia suele encontrarse asociada con una disminución de HDL que además son disfuncionales, ya que presentan una función ateroprotectora alterada tanto en humanos como en modelos animales6,10,14,15. Sin embargo, hasta la fecha ningún estudio previo ha abordado si esta alteración en la funcionalidad de las HDL hiperhomocisteinémicas podría estar asociada a cambios en su proteoma. En este trabajo se presentan datos que relacionan la pérdida de potencial antioxidante de HDL con alteraciones en su composición proteica en un modelo animal de hiperhomocisteinemia.
La concentración plasmática de Hcy aumentó de forma significativa en el grupo que recibió metionina a través del agua de bebida alcanzando concentraciones de Hcy similares a las ya publicadas utilizando modelos animales similares5,15,24. Del mismo modo, el aumento en la concentración plasmática de Hcy se correlacionó con una disminución en la concentración plasmática de colesterolHDL y apoA-I, respectivamente. Sin embargo, y de forma consistente con datos previos propios15, la disminución en la concentración de HDL observada en ratones hiperhomocisteinémicos no estuvo asociada ni con alteraciones en el tamaño de las partículas HDL ni con cambios en su composición relativa de lípidos y proteínas, aunque sí con alteraciones en su función. En diferentes estudios previos se ha descrito que la deficiencia de HDL podría ser debida a una disminución en su tasa de producción10,15. Los niveles de expresión génica hepática de apoA-I aumentados junto con la concentración plasmática de apoA-I disminuida en ratones hiperhomocisteinémicos sugieren que el mecanismo involucrado posiblemente sea postranscripcional. Recientemente se ha descrito que el estrés de retículo endoplasmático suele asociarse con estrés oxidativo e hipoalfalipoproteinemia en diferentes enfermedades cardiometabólicas25, y este además se asocia con una inhibición en la secreción de apoA-I26, siendo ello plenamente compatible con nuestros datos.
Una de las funciones antiaterogénicas de las HDL es su acción en el TRC27. En este contexto, la capacidad de eflujo de colesterol desde las células a partículas preβ-HDL es reconocido como el primer paso en el TRC, mientras que la esterificación mediada por LCAT que convierte el colesterol libre en su forma éster es un paso crítico en la maduración de las HDL28. En nuestro estudio, ni la actividad plasmática de LCAT ni su expresión hepática se encontraron alteradas en ratones hiperhomocisteinémicos, pero sus HDL presentaron menor capacidad de promover el eflujo de colesterol desde macrófagos in vivo, pudiendo ser ello debido al menos en parte a una disminución en la concentración plasmática de preβ-HDL. Sin embargo, ello no estuvo asociado a diferencias en el TRC específico desde macrófagos a heces entre ambos grupos. De forma consistente con estos datos, tampoco se observaron cambios en la expresión génica de proteínas involucradas en el TRC en ratones hiperhomocisteinémicos en comparación con los controles.
Otra función antiaterogénica clave de las HDL es su acción antioxidante en plasma27. Las HDL son los principales transportadores de lipoperóxidos en plasma, inhiben la formación de hidroperóxidos lipídicos tóxicos y los eliminan de las LDL29. En nuestro estudio, las HDL de ratones hiperhomocisteinémicos presentaron una protección contra la oxidación de LDL menor que las de los controles, siendo una de las posibles causas que llevarían a una pérdida del potencial antioxidante de las HDL la disminución de su concentración en plasma. En este sentido, este empeoramiento en la protección antioxidante de las HDL de ratones hiperhomocisteinémicos se asoció principalmente a una reducción no solo en la concentración de apoA-I circulante sino también en la actividad de una de las principales enzimas asociadas a HDL con potencial antioxidante, la PON1, siendo este cambio consistente con nuestros datos previos15. Por otro lado, el análisis proteómico de estas HDL reveló cambios significativos en proteínas con reconocido potencial antioxidante. Así, se observó un aumento relativo en la cantidad de PON1 en HDL, y este aumento estuvo relacionado con un aumento en la expresión de PON1 en el hígado. Sin embargo, estos datos contrastaron con los niveles séricos de esta actividad enzimática, que se encontraron disminuidos, a la par que la reducción de HDL observada en ratones hiperhomocisteinémicos. Parte del estrés oxidativo observado en ratones hiperhomocisteinémicos se atribuye a una especie altamente reactiva que se denomina Hcy-tiolactona y que se encontraría aumentada en estos ratones. Dada su capacidad en reducir el estrés oxidativo, la PON1 contribuye en la función ateroprotectora de HDL tanto en ratones como en humanos protegiendo de la N-homocisteinilización de proteínas tales como la apoA-I a través de su actividad Hcy-tiolactonasa en humanos y ratones12. Esta es una actividad también propia de PON1. De este modo, una reducción global en la actividad PON1 resultaría en un empeoramiento global del estrés oxidativo a través de un aumento en la concentración de Hcy-tiolactona circulantes y su acumulación en tejidos.
También se encontró una disminución relativa en la cantidad relativa de apoA-IV en las partículas de HDL de ratones hiperhomocisteinémicos en comparación con las de los controles. Estudios recientes en humanos y modelos animales indican que apoA-IV inhibe la peroxidación lipídica29 y, por tanto, su disminución relativa en las partículas HDL de ratones hiperhomocisteinémicos podría contribuir significativamente en la disminución de su potencial antioxidante, siendo este efecto agravado por la deficiencia parcial de HDL observada en estos ratones en comparación con los controles.
En conclusión, nuestros datos han confirmado y ampliado los cambios que se presentan a nivel proteico en las HDL de ratones hiperhomocisteinémicos que se relacionan con alteraciones en su funcionalidad ateroprotectora. En concreto, estos resultados sugieren un papel relevante de apoA-IV en la merma del potencial antioxidante de las HDL de ratones hiperhomocisteinémicos y, por consiguiente, en su poder antiaterogénico.
Limitaciones del estudioEl modelo animal de hiperhomocisteinemia inducido por administración de metionina a través del agua de bebida es un modelo experimental, por lo que la traslación de los resultados obtenidos a humanos requiere una demostración específica y directa.
Dado que nuestro grupo ha reproducido los resultados relativos a la protección contra la oxidación de LDL por parte de HDL de ratones hiperhomocisteinémicos utilizando la administración de Hcy y no solo de metionina (datos no mostrados), se sugiere un efecto directo de la Hcy sobre las HDL, independientemente de la metionina30.
Por último, el análisis proteómico que se presenta es un análisis piloto y los resultados se obtuvieron a partir de HDL aisladas a partir de una sola mezcla de plasmas de ratón de cada condición experimental, y aunque representativo (n=8/condición), es necesario repetir el estudio con más muestras independientes por grupo y validar los resultados con inmunoensayos convencionales.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Protección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
FinanciaciónEste estudio fue financiado por una Beca de la Fundación Española de Arteriosclerosis - ALMIRALL 2010 (a F.B-V.) y por el Ministerio de Sanidad y Consumo, Instituto de Salud CarlosIII, beca FIS PI 10-00277 (a J.J.). T.L.E. es receptora de beca predoctoral FIS PI12/00226. CIBER de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) es un proyecto del Instituto de Salud Carlos III.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses asociado con este estudio.
Queremos trasladar nuestro agradecimiento a Antonia Rubio, Margarita Domingo y Luis García Tato por ocuparse del bienestar animal, así como a Helena Quesada y José Luis Sánchez Quesada por su asesoramiento científico.
Este trabajo responde a una comunicación titulada «Efectos de la hiperhomocisteinemia sobre dos de las propiedades antiaterogénicas de las lipoproteínas de alta densidad: capacidad antioxidantes de las lipoproteínas de baja densidad y transporte reverso de colesterol in vivo específico de macrófagos en ratones», Mención Especial 2012 (17/30) a las Mejores Comunicaciones presentadas en el XXV Congreso Nacional de la SEA (Reus, 2012).






![Efecto de la hiperhomocisteinemia sobre el transporte reverso de colesterol (TRC) específico de macrófagos in vivo. A)La cantidad de [3H] en plasma, HDL, hígado y heces se expresó como la fracción de la dosis inyectada durante 48h. Los valores se expresaron como mediana (25°; 75° percentiles) (n=9-10). B)Correlación de Spearman entre el porcentaje de la dosis inyectada medida en HDL y la concentración plasmática de Hcy. Efecto de la hiperhomocisteinemia sobre el transporte reverso de colesterol (TRC) específico de macrófagos in vivo. A)La cantidad de [3H] en plasma, HDL, hígado y heces se expresó como la fracción de la dosis inyectada durante 48h. Los valores se expresaron como mediana (25°; 75° percentiles) (n=9-10). B)Correlación de Spearman entre el porcentaje de la dosis inyectada medida en HDL y la concentración plasmática de Hcy.](https://static.elsevier.es/multimedia/02149168/0000002500000004/v1_201310310053/S0214916813000533/v1_201310310053/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)