Introducción
La función de la apolipoproteína (apo) A-II en el metabolismo lipoproteico y su relación con la arteriosclerosis es poco conocida, a pesar de ser la segunda proteína cuantitativamente más importante de las lipoproteínas de alta densidad (HDL)1-4. La sobreexpresión de la apo A-II de ratón es proaterogénica5. La sobreexpresión de la apo A-II humana (h) en ratones transgénicos también induce un aumento en la susceptibilidad a la arteriosclerosis cuando estos ratones son alimentados con una dieta rica en grasas y colesterol o cuando son cruzados con ratones deficientes en apo E6,7.
Es muy probable que la apo A-II tenga un papel en la regulación del metabolismo de los ácidos grasos libres (AGL), ya que ratones deficientes en apo A-II presentan una disminución de AGL y triglicéridos, hipersensibilidad a la insulina y un catabolismo acelerado de partículas remanentes8. Además, la sobreexpresión de apo A-II de ratón se ha relacionado con la obesidad y la resistencia a la insulina9. Ratones transgénicos de la apo A-IIh y de ratón presentan, también, un incremento en las lipoproteínas que contienen apo B7,10-16 y un deterioro de una de las funciones antiaterogénicas principales de las HDL, la protección de la modificación oxidativa de las lipoproteínas de baja densidad (LDL)17,18, lo que explicaría en parte su mayor susceptibilidad al desarrollo de arteriosclerosis5-7,13.
La HDL es un ligando del receptor CD3619, lo que conlleva la posibilidad de una interacción apo A-II-CD36 que altere el metabolismo de los AGL y la resistencia a la insulina. Sin embargo, en estudios con ratones transgénicos de apo A-II de ratón y deficientes del receptor CD36 se ha demostrado que el efecto de la apo A-II en los AGL es independiente del receptor CD3620. Este mismo trabajo demostró que la disminución de la oxidación de los AGL de estos ratones transgénicos de apo A-II era explicada, en parte, por la disminución de la expresión de la enzima acil-CoA-deshidrogenasa muscular20. Por tanto, en este estudio se ha identificado una potencial interacción entre apo A-II y la betaoxidación de los ácidos grasos.
Estudios en humanos también han demostrado una relación entre apo A-II, la concentración de AGL y triglicéridos, y la obesidad visceral21,22. Además, la región 1q21-24 (la apo A-II está localizada en 1q23) presenta ligamiento genético con la diabetes mellitus tipo 2 (DM2)23-27. Cabe destacar además que, en familias holandesas con hiperlipemia familiar combinada (HFC), las concentraciones plasmáticas de apo A-II estaban incrementadas en pacientes con respecto de los individuos normolipémicos28. En este sentido, dos estudios recientes han identificado ligamiento genético entre el factor de transcripción USF1 y la HFC en familias finlandesas y asociación con la concentración de glucosa y parámetros lipídicos en un estudio multicéntrico con individuos sanos europeos29,30. Debido a que el USF1 regula la expresión de apo A-II, estos datos sugieren un papel modulador, más que casual, de la apo A-II en la HFC y DM21.
El objetivo principal de este estudio es la identificación de proteínas diferencialmente expresadas en el hígado de ratones transgénicos de apo A-IIh. Para ello, y mediante el análisis de geles bidimensionales, se determinaron los perfiles de expresión proteica en el hígado de ratones transgénicos de apo A-IIh, y se compararon con los de los ratones control de la cepa C57BL/6 en una situación de ayunas o tras una carga oral de aceite de oliva. Tras el análisis comparativo de los geles, se identificaron las proteínas expresadas diferencialmente mediante espectrometría de masas Matrix Assisted Laser Desorption Ionization Time of Flight (MALDI-TOF) y alternativamente por espectrometría MALDI-TOF/TOF o ESI-trampa iónica.
Material y métodos
Animales y dietas
Los procesos de experimentación en animales fueron aprobados por el Comité de Ética Animal del Institut de Recerca de l'Hospital de la Santa Creu i Sant Pau y el Departament d'Agricultura, Ramaderia i Pesca de la Generalitat de Catalunya. Los estudios se realizaron con ratones C57BL/6 (controles) y ratones transgénicos de apo A-IIh hembras de 6 meses de edad11. Los ratones fueron alimentados con dieta estándar (A04 Rodent standard diet, Panlab) y mantenidos en condiciones óptimas de temperatura (21 °C) y humedad relativa (55%), con ciclos programados de luz-oscuridad de 12 h y con libre acceso a agua.
Respuesta posprandial de triglicéridos
Los ratones se subdividieron en 2 grupos experimentales según si la extracción de sangre de la vena de la cola era en situación de ayunas o posprandial. La situación de ayunas consistía en la privación de la comida a las 21 horas y obtención de las muestras a las 10 horas. Para la respuesta posprandial de triglicéridos, se privaba de la comida a las 21 horas y después de realizar una primera extracción de sangre de la vena de la cola (t = 0), se realizaba una carga oral de 150 µl de aceite de oliva a las 9 horas31,32. Muestras adicionales de sangre fueron extraídas a diferentes intervalos después de la administración de aceite de oliva. Los valores de triglicéridos en plasma en los distintos puntos se determinaron mediante un método comercial de tipo enzimático y colorimétrico adaptado a un autoanalizador Hitachi 911 (Roche Diagnostics) 7.
Perfil lipoproteico
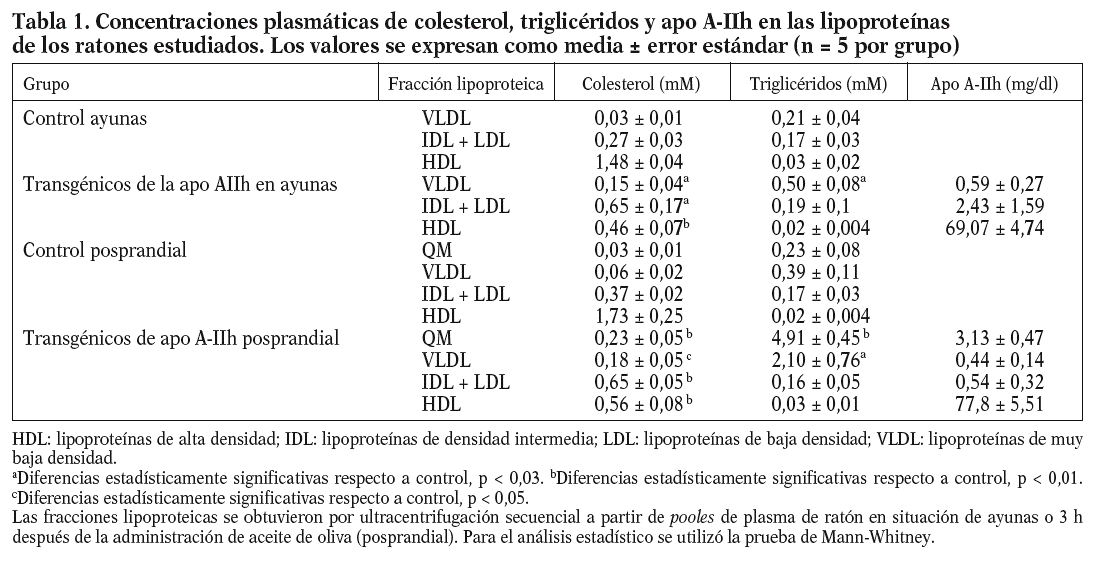
Las fracciones lipoproteicas se aislaron de pooles de plasma de ratón en situación de ayunas o 3 h después de la administración de aceite mediante ultracentrifugación secuencial7,11. De cada fracción lipoproteica obtenida se determinaron las concentraciones plasmáticas de colesterol, triglicéridos y apo A-IIh a partir de métodos comerciales adaptados a un autoanalizador BM/HITACHI 911 (Roche y Kamiya Biomedical Company)7.
Catabolismo de las lipoproteínas ricas en triglicéridos in vivo
La fracción de lipoproteínas de densidad inferior a 1,006 g/ml aislada por ultracentrifugación (lipoproteínas ricas en triglicéridos) en ratones en situación de ayuno o 3 h después de la administración de aceite fue marcada radiactivamente con [3H] trioleína33,34. En todos los casos, se inyectaron por vía intravenosa 500.000 cpm contenidas en la fracción de lipoproteínas ricas en triglicéridos en 100 µl de salino. La tasa catabólica fraccional (TCF) se calculó usando el recíproco del área bajo de la curva que formó la caída de la radiactividad plasmática a lo largo del tiempo33,34.
Actividades de la lipoproteína lipasa (LPL)
Los ratones fueron inyectados intraperitonealmente con 500 U/kg de heparina (Laboratorios Farmacéuticos Rovi, Madrid, España). La sangre se recogió 30 min después y el plasma se almacenó a 80 °C hasta la realización de los ensayos. La actividad LPL se midió usando una emulsión marcada radiactivamente13,33. Por otro lado, una concentración equivalente a 0,3 mM de triglicéridos de VLDL de ratones control y transgénicos se utilizó también como sustrato en los experimentos de lipólisis in vitro, tal y como se ha descrito previamente34. La tasa de AGL se expresó como µmol de AGL por min y por litro.
Betaoxidación hepática
Los hígados de los ratones en situación de ayunas o a las 3 h de la administración de aceite se perfundieron y homogenizaron en tampón compuesto de 150 mM NaCl, 1 mM dithiothreitol, 30 mM EDTA y 50 mM KH2PO4. La betaoxidación hepática se determinó tal y como ha sido previamente descrita35.
Prueba de tolerancia a la glucosa (PTOG)
La PTOG se realizó mediante el cálculo del área bajo la curva de las concentraciones de glucosa obtenidas en diferentes tiempos tras una inyección intraperitoneal de la misma (2 mg/g peso corporal)33,36.
Electroforesis bidimensional (2D-DIGE) y análisis de imagen
Se sacrificó a 2 grupos de ratones transgénicos y controles independientes en situación de ayunas o a las 3 h de la administración de aceite (n = 6 por genotipo y grupo). Se extrajeron los hígados previamente perfundidos con salino para eliminar los restos de hemoglobina y se congelaron con nitrógeno líquido para su posterior análisis. Cada muestra fue homogeneizada mecánicamente con un pistón de teflón en 0,5 ml de tampón de Lisis (30 mM Tris, 7 M urea, 2 M tiourea, 4% CHAPS) al que se añadió (1/100 v/v) un cóctel de inhibidores de proteasas (GE Healthcare, Amersham). A continuación se sonicó la muestra y se centrifugó a 10.000 g durante 10 min a 4 °C; se sometió 100 µl de cada muestra a precipitación con ácido tricloroacético/acetona (2D Clean-Up Kit, GE Healthcare, Amersham). Los precipitados de proteína se resuspendieron en tampón de lisis y se ajustó el pH a 8,0. La concentración proteica se determinó por el método Bradford (RC/DC Kit BioRad)37. La concentración de proteína de las muestras se ajustó a 2 mg/ml y las muestras se marcaron con 400 pmol fluorocromos Cy (Cy3 o Cy5)/50 µg de proteína durante 30 min de acuerdo con el protocolo proporcionado por el fabricante (GE Healthcare, Amersham). El estándar interno se preparó mezclando una concentración equivalente de cada una de las 24 muestras y se marcó de forma análoga las muestras con Cy2. En todos los casos, se añadió 1 µl de una solución 10 mM de lisina durante 10 min, para neutralizar el exceso de Cy. A continuación, las muestras marcadas con Cy3 y Cy5 se mezclaron con el estándar interno a una concentración de 50 µg de proteína por Cy y por gel y se añadió a cada muestra un volumen equivalente de tampón 7 M urea, 2 M tiourea, 4% CHAPS, 2% DTT, 2% anfolitos pH 3-10 NL (GE Healthcare, Amersham) y 0,002% de azul de bromofenol. Se analizó las 24 muestras simultáneamente en un diseño de 12 geles, junto con la muestra estándar. Para evitar una posible desviación de los datos, se marcó la mitad de las muestras de cada grupo con Cy3 y la otra mitad con Cy5. La muestra estándar se marco con Cy2. Así, 2 muestras y el estándar fueron separados en cada uno de los geles. La separación de las proteínas en una primera dimensión se realizó en tiras de acrilamida con gradiente de pH inmovilizado (Immobiline DryStrips, GE Healthcare, Amersham) de 24 cm y pH 3-10. El isoelectroenfoque (IEF) se llevó a cabo con un equipo IPGphor (GE Healthcare, Amersham). Las condiciones de focalización fueron: 3 h a 300 V, 6 h a 1.000 V, 3 h a 8.000 V y 4 h 40 min a 8.000 V. Para obtener la separación de las proteínas en una segunda dimensión, se realizó una segunda electroforesis en una cubeta Ettan DALT Six (GE Healthcare, Amersham) aplicando las tiras equilibradas del IEF sobre los geles (26 22 cm) de acrilamida (12,5%) un voltaje de 3 V/gel durante 30 min y a continuación 17 V/gel durante 5 h y 40 min. Los geles bidimensionales se escanearon con las apropiadas longitudes de onda de emisión y excitación y se obtuvieron las imágenes de fluorescencia para cada uno de los tres fluorocromos con una resolución de 100 µm mediante el escáner Typhoon 9400 (GE Healthcare, Amersham). Para el análisis de las imágenes de fluorescencia generadas se utilizó el software DeCyder v.5.0 (GE Healthcare, Amersham). Se seleccionaron las manchas para las que se observaron variaciones superiores a 1,1 veces significativas con un valor de p < 0,001 en las comparaciones entre los diferentes grupos.
Identificación de proteínas por espectrometría de masas
Se tiñeron geles preparativos con plata, siguiendo un protocolo compatible con espectrometría de masas38. Las proteínas seleccionadas se recortaron de los geles y se sometieron a digestión con tripsina (Promega Gold) en el gel, utilizando un robot SpotPicker (GE Healthcare, Amersham) y un digestor Proteineer DP (Bruker Ultraflex). La identificación se llevó a cabo mediante la técnica de "huella dactilar peptídica". En la preparación de la muestra para espectrometría de masas MALDI-TOF se utilizó como matriz de ionización ácido *-ciano hidroxicinámico y soportes de muestra AnchorChip (Bruker Ultraflex). Se analizaron los digeridos trípticos por espectrometría de masas MALDI-TOF (Bruker Ultraflex), y se identificaron en las bases de datos por comparación del mapa peptídico observado con los deducidos teóricamente a partir de las secuencias, utilizando el algoritmo de búsqueda MASCOT (Matrix Science). En los casos en que no se obtuvo una identificación clara mediante esta técnica, la identificación se corroboró mediante datos de secuencia, a partir de espectros MS/MS obtenidos por espectrometría MALDI-TOF/TOF o ESI-trampa iónica. La búsqueda en la base de datos se realizó en este caso mediante el programa MASCOT (Matriz Science).
Análisis estadístico
Se utilizó un análisis estadístico de Mann-Whitney para comparar las diferencias entre los grupos experimentales. Se utilizó el programa GraphPad Prism version 4.00 for Windows (GraphPad Software). Se consideró estadísticamente significativo los valores de p < 0,05. Todos los valores se presentan como la media ± error estándar.
Resultados
Perfil lipoproteico y respuesta posprandial de triglicéridos en ratones transgénicos de apo A-IIh
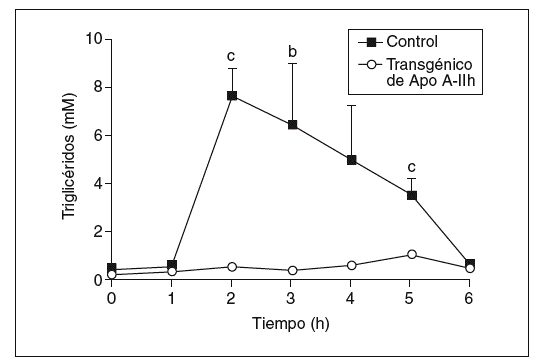
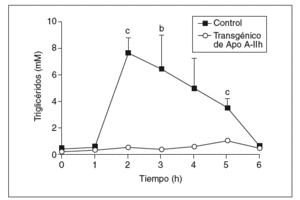
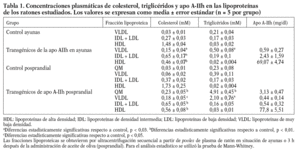
Los datos obtenidos en ratones transgénicos de apo A-IIh confirmaron la deficiencia de colesterol unido a lipoproteínas de alta densidad (cHDL) y el incremento de colesterol y triglicéridos de las lipoproteínas de muy baja densidad (VLDL) que presentan estos ratones en ayunas (tabla 1)11-13. Tras la carga oral de aceite de oliva, se observó un aumento de triglicéridos en plasma en los ratones transgénicos de apo A-IIh, alcanzando un máximo entre las 2 y las 3 h (fig. 1). Las concentraciones plasmáticas de colesterol, triglicéridos y apo A-IIh fueron también determinadas en las distintas fracciones lipoproteicas (tabla 1). Los ratones transgénicos presentaban altas concentraciones de colesterol de las lipoproteínas que contienen apo B, así como un aumento de los triglicéridos asociados a quilomicrones y VLDL (tabla 1). Estos cambios estaban asociados a una deficiencia de cHDL similar a la que presentaban los ratones transgénicos en ayunas (tabla 1).
Figura 1. Respuesta a la carga oral de aceite de oliva en ratones controles y transgénicos de apo A-IIh. Los triglicéridos se determinaron antes y después de la carga oral de aceite. Los valores se expresan como media ± error estándar (n = 5 ratones por grupo). Para el análisis estadístico se utilizó la prueba de Mann-Whitney. bp < 0,03. cp < 0,01.
Actividad LPL, metabolismo de las VLDL y betaoxidación
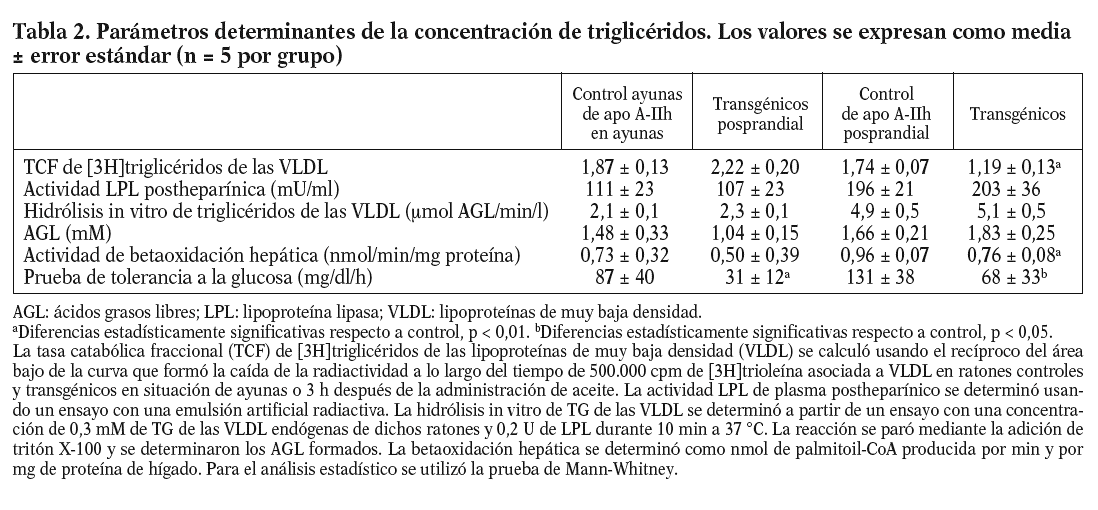
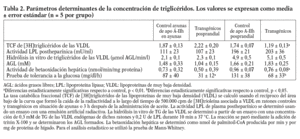
La tasa catabólica fraccional en plasma de las lipoproteínas ricas en triglicéridos estaba muy disminuida en situación posprandial (tabla 2). La actividad LPL postheparínica y la hidrólisis in vitro de triglicéridos de las VLDL aumentaron en los ratones tras ser sometidos a una carga oral de aceite de oliva. Sin embargo, no se observaron diferencias estadísticamente significativas en estas magnitudes cuando se comparaban los ratones transgénicos y los controles en la situación de ayunas o posprandial, respectivamente (tabla 2). Tres horas después de la carga oral de aceite de oliva, los hígados de los ratones transgénicos presentaban una reducción significativa en la betaoxidación hepática. El área bajo la curva de la prueba de sobrecarga de glucosa estaba reducida en los ratones transgénicos de la apo A-II (tabla 2).
Perfil de expresión proteica
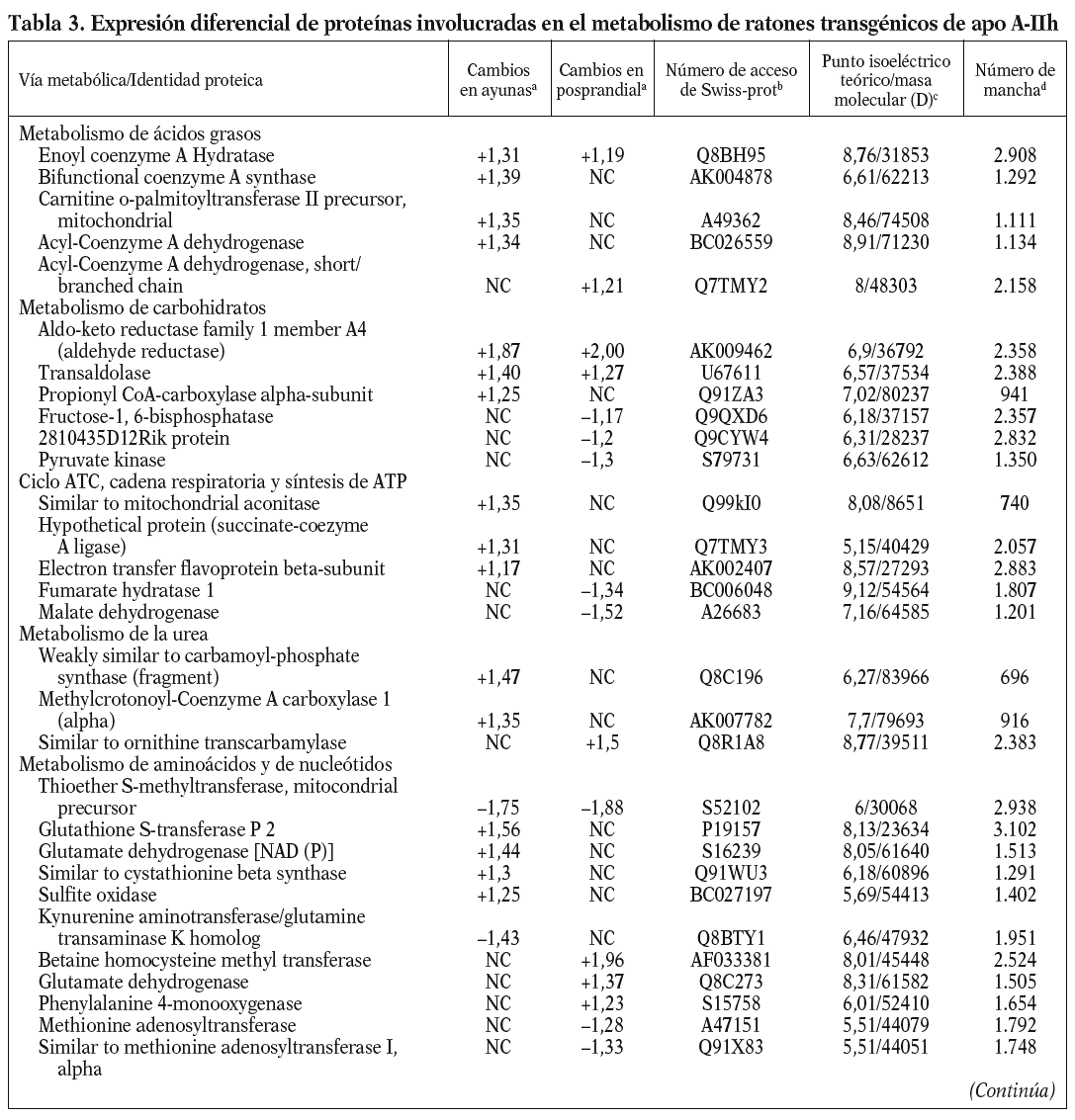
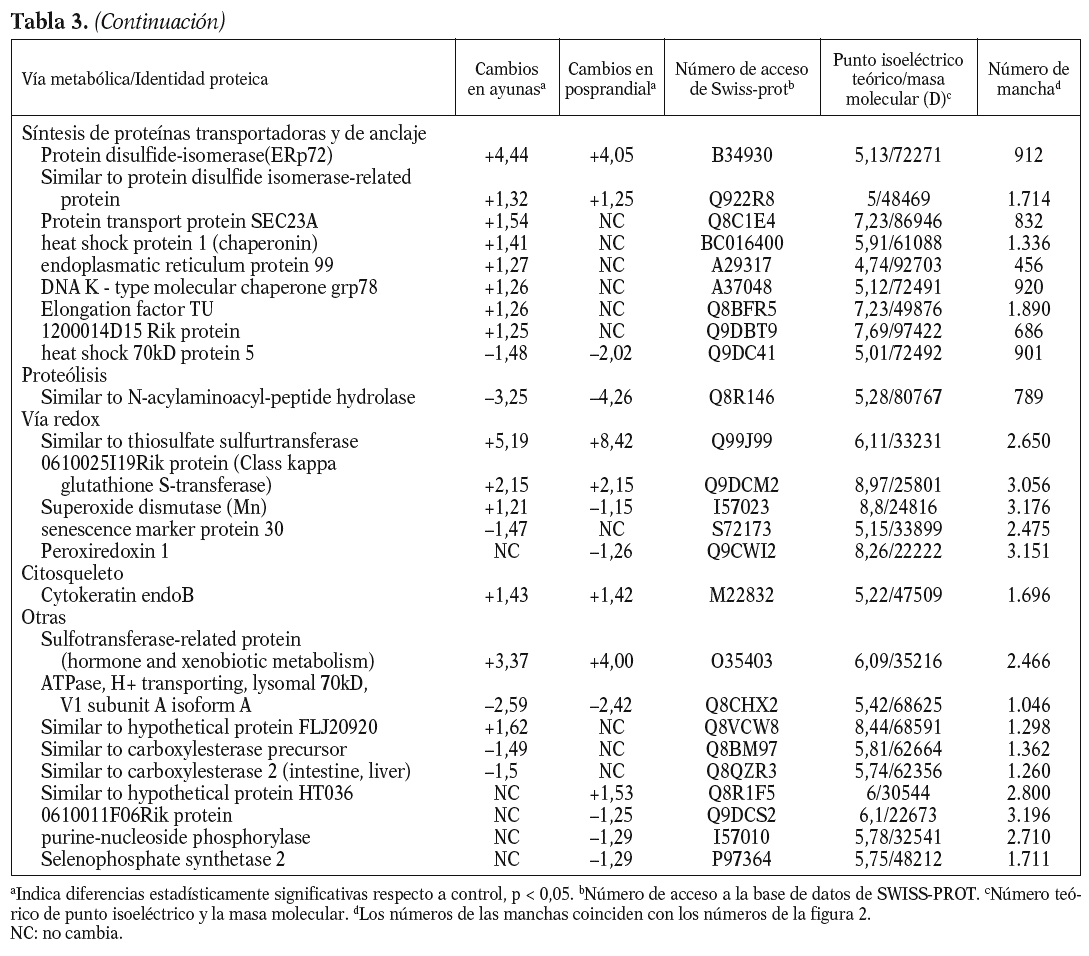
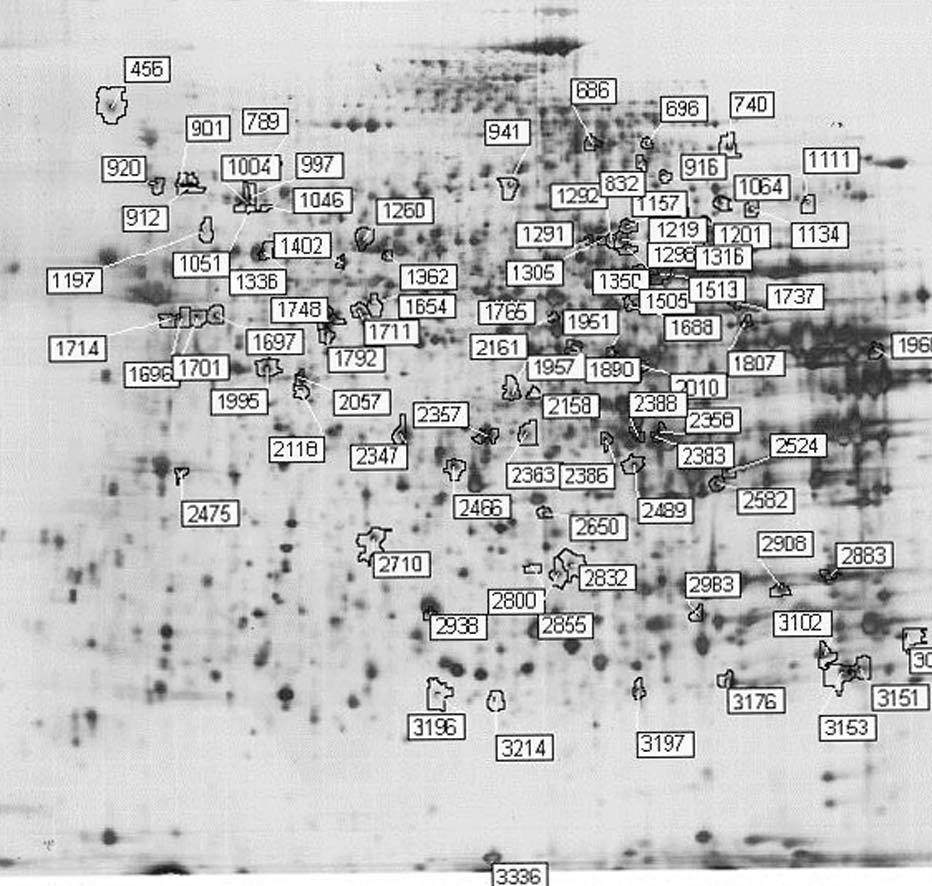
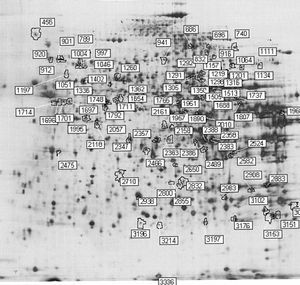
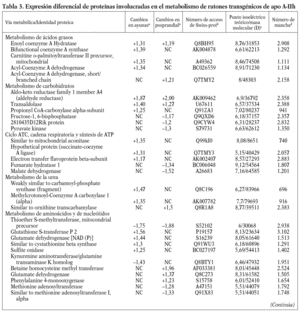
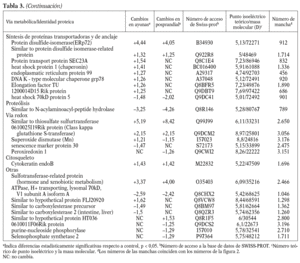
Para los experimentos 2D-DIGE se utilizaron 100 mg del hígado de 12 ratones transgénicos y 12 controles. La mitad de los hígados de cada genotipo se había obtenido en ayunas y la otra mitad 3 h después de la carga oral de aceite de oliva. Se consiguió detectar aproximadamente 1.000 manchas presentes en todos los geles y se realizó el análisis estadístico tal y como se ha descrito con anterioridad. Comparando el perfil de expresión proteico en situación de ayunas y posprandial, se identificaron 55 proteínas alteradas en los ratones transgénicos de apo A-IIh en comparación con los ratones controles (fig. 2). Concretamente, en situación de ayunas se encontraron 38 proteínas diferencialmente expresadas en ratones transgénicos de apo A-II y 31 en situación posprandial. Catorce de estas proteínas estaban diferencialmente expresadas en ambas situaciones, 13 de ellas en el mismo sentido. La relación de la expresión proteica y su categorización según la vía metabólica se presentan en la tabla 3.
Figura 2. Ejemplo representativo de electroforesis bidimensional con tinción de plata de proteínas de hígado de ratón: prime ra dimensión, pH 3-10; segunda dimensión, SDS-PAGE al 12,5%. Los números de las manchas se corresponden con los de la tabla 3.
Discusión
Uno de los resultados más novedosos de este estudio es que los ratones transgénicos de apo A-IIh presentan una reducción sustancial en el catabolismo de las lipoproteínas ricas en triglicéridos tras una sobrecarga oral de aceite de oliva. Estos resultados contrastan con resultados previos de nuestro grupo en los que se demostraba que los ratones transgénicos en situación de ayunas presentaban una sobreproducción hepática de triglicéridos de VLDL13,33. Sin embargo, una línea independiente de ratones transgénicos de apo A-IIh también presentaba una severa hipertrigliceridemia en situación posprandial, concomitante con un enriquecimiento de apo A-II de las VLDL y una severa reducción del contenido de apo A-II y colesterol de las HDL10,39. Esta hipertrigliceridemia tendía a normalizarse cuando los ratones transgénicos eran sometidos a un ayuno prolongado junto con un incremento del contenido de apo A-II de HDL10. Estos resultados podrían deberse a un efecto directo de la apo A-IIh en la actividad LPL in vivo de forma que los triglicéridos de los quilomicrones y las VLDL se acumulan en el plasma durante horas después de una carga oral de ácidos grasos, aunque son finalmente hidrolizados tras un ayuno prolongado10. Sin embargo, nuestros ratones transgénicos de apo A-IIh no presentaban cambios significativos en la actividad LPL postheparínica ni en la hidrólisis in vitro de los triglicéridos de sus VLDL endógenas cuando se comparaban con las respectivas magnitudes de los ratones control (tabla 2). Además, los ratones transgénicos tampoco presentaron una relación recíproca entre las HDL y las VLDL en la transición del estado posprandial a ayunas (tabla 1), en contraste con lo que habían descrito previamente Boisfer et al10. Así, es más probable que la formación de partículas de HDL pequeñas (pre-ß) que contienen apo A-IIh en los ratones transgénicos39-41 inhiban la LPL in vivo10 y provoquen una hipertrigliceridemia grave tras la carga oral de ácidos grasos. Por otro lado, una reducción de la actividad de los receptores como el receptor de LDL, LRP, el receptor scavenger tipo B1 y el CD36, también puede influir en el metabolismo de las lipoproteínas ricas en tri glicéridos en situación posprandial32,42-44. Sin embargo, nuestro análisis proteómico de las muestras hepáticas no reveló cambios en la concentración de estas proteínas. En cambio, los ratones transgénicos en ayunas presentaban aumentos significativos de varias enzimas implicadas en la betaoxidación (enoil-CoA-hidratasa, precursora de la carnitinpalmitoiltransferasa II, acil-CoA-deshidrogenasa), así como en la sintasa CoA bifuncional y en la cantidad de varias enzimas clave en el ciclo de los ácidos tricarboxílicos (ATC). La mayoría de estos cambios no se detectó en situación de poscarga oral de ácidos grasos y el ratón transgénico presentó una reducción significativa en dos de las enzimas clave del ciclo ATC (malato-deshidrogenasa y fumarato-hidratasa 1). De forma consistente, los perfiles de expresión génica hepáticos de los ratones transgénicos de apo A-IIh, obtenidos mediante microarrays de Affymetrix, han demostrado que 12 y 8 genes implicados en la betaoxidación y el ciclo ATC, respectivamente, están reprimidos en los ratones transgénicos en situación de poscarga oral de ácidos grasos (Ribas et al, datos no publicados). Estos cambios sugieren que existe una reducción de la betaoxidación hepática en los ratones transgénicos, especialmente en la situación posprandial, y ello puede favorecer la acumulación, el empaquetamiento y la secreción de triglicéridos33. Una explicación de los cambios observados en nuestros ratones transgénicos sería la relación existente entre la lipólisis de las lipoproteínas ricas en triglicéridos y la generación de ligandos del receptor activado por proliferadores peroxisómicos (PPAR)45, que pueden influir en la expresión de genes implicados en la betaoxidación. Así, los cambios observados podrían ser consecuencia de la inhibición de la actividad LPL in vivo y, por tanto, secundarios a la acción de apo A-II sobre el metabolismo de las lipoproteínas ricas en triglicéridos. Esta hipótesis es consistente con el hecho de que nuestros ratones transgénicos de apo A-IIh presentan una respuesta incompleta a fenofibrato por parte de varios genes regulados por PPAR-*34.
Nuestros ratones transgénicos presentaban una marcada aceleración en la PTCG, lo que es consistente con estudios previos de nuestro grupo33. Estos cambios podrían ser consecuencia, al menos en parte, de la depleción del colesterol adrenal que presentan estos ratones transgénicos46, junto con un fenotipo de hipocortisolismo que podría influir sobre la gluconeogénesis hepática47. Una reducción en la actividad de las enzimas malato-deshidrogenasa y fructosa-1,6-bisfosfato podría influir sobre la tasa de gluconeogénesis en los ratones transgénicos, aunque estos dos cambios no fueron consistentes en las dos situaciones de alimentación estudiadas en nuestros ratones transgénicos. También es posible la existencia de un cambio entre los AGL y la glucosa como sustrato energético mayoritario en nuestros ratones transgénicos, tal y como ocurre en los ratones deficientes de PPAR-* que presentan severa hipoglucemia concomitante con una disfunción de la betaoxidación hepática48.
Varias enzimas implicadas en el metabolismo de los aminoácidos, incluido el metabolismo de la homocisteína, estaban alteradas en los ratones transgénicos. La hiperhomocisteinemia es un factor de riesgo cardiovascular, pero no nos consta que se haya descrito alguna relación entre la expresión de apo A-II y el metabolismo de la homocisteína. Una explicación más probable es la relación recíproca que se ha observado entre betaoxidación de AGL y el metabolismo de los aminoácidos, tal y como se ha descrito para las enzimas ornitín-carbamoil-transferasa y betaína-homocisteína metil transferasa49. También es posible que los cambios en la betaoxidación y el ciclo ATC estén asociados a la formación de especies reactivas del oxígeno y la expresión de genes implicados en las vías redox50. Algunas de estas enzimas estaban reducidas en la situación posprandial, como en el caso de superóxido-dismutasa y peroxiredoxina-1. Por otro lado, uno de los cambios más acentuados fue la regulación al alza de la proteína disulfido isomerasa (Erp72) en los ratones transgénicos. Esta proteína es parte de la maquinaria del retículo endoplasmático de los hepatocitos y constituye una de las subunidades de la proteína microsomal transferidora de triglicéridos, por lo que podría contribuir a un incremento en la maduración de las VLDL y su posterior secreción hepática51.
En conclusión, nuestros ratones transgénicos de apo A-IIh presentan una hipertrigliceridemia posprandial acentuada y potencialmente proaterogénica. Estos cambios se deben, en parte, a un defecto en el catabolismo de las lipoproteínas ricas en triglicéridos. A través de una aproximación proteómi ca fuimos capaces de detectar cambios en el proteoma del hígado de los ratones transgénicos de apo A-IIh. Algunas de estas proteínas podrían estar implicadas en el proceso por el que la apo A-II regula el metabolismo de los AGL y los triglicéridos, o al contrario, ser simplemente el reflejo hepático de éstos. Distinguir entre estas dos posibilidades requerirá de nuevos estudios.