Los triglicéridos se consideran un factor independiente de riesgo vascular. La influencia, por separado, de polimorfismos en genes como APOE, APOA5, LPL, LIPC y CETP sobre dichos niveles está descrita, por lo que resulta de interés su análisis conjunto y el estudio de interacciones con factores ambientales.
MétodosSe han genotipado en 1.825 sujetos (80% varones, edad media 36 años) procedentes del estudio ICARIA, el polimorfismo de APOE, 2 variantes de APOA5 (S19W y -1131 T/C), 5 de LPL (D9N, N291S, PvuII, HindIII y S447X), 1 de LIPC (-250G/A) y 1 de CETP (TaqIβ) mediante PCR-restricción y ensayos TaqMan. El efecto conjunto de las variantes se ha analizado mediante regresión lineal con la variable triglicéridos transformada logarítmicamente y corrigiendo por covariables. Las interacciones se han explorado mediante contrastes múltiples.
ResultadosEl alelo ¿4 de APOE, los polimorfismos de APOA5 S19W y -1131T/C y las variantes de LPL, D9N y N291S mostraron un efecto elevador de triglicéridos significativo e independiente. Los polimorfismos HindIII y S447X de LPL se asociaron significativamente con una reducción de los niveles de TG. Las variantes PvuII (LPL), -250G/A (LIPC) y TaqIβ (CETP) no mostraron asociaciones significativas. Se encontró una tendencia estadística (p=0,048) para la interacción entre obesidad abdominal (perímetro de cintura >102cm en hombres; >88cm en mujeres) y el alelo APOE-¿4.
ConclusionesNuestro trabajo muestra la influencia del alelo ¿4 de APOE y de las variantes S19W y -1131T/C de APOA5 y D9N, N291S, HindIII y S447X de LPL sobre los niveles de triglicéridos y sugiere un efecto modulador de la obesidad abdominal sobre el alelo ¿4.
Triglyceride levels are considered to be an independent vascular risk factor. The influence of polymorphisms in genes such as APOE, APOA5, LPL, LIPC and CETP on these levels has been separately described. The aim of the present study was to analyze the combined effects of these polymorphisms and their interaction with environmental factors.
MethodsWe genotyped the APOE polymorphism, two variants of APOA5 (S19W and -1131 T/C), five of LPL (D9N, N291S, PvuII, HindIII and S447X), one of LIPC (-250G/A) and one of CETP (TaqIβ) by polymerase chain reaction-restriction and TaqMan assays in 1825 subjects (80% male, mean age 36years) from the ICARIA study. The combined effect of the variants was analyzed by linear regression with the log-transformed triglyceride variable and adjustment for covariates. The interactions were explored by multiple comparisons.
ResultsThe ¿4 allele of APOE, the APOA5 polymorphisms S19W and -1131T/C and the LPL variants D9N and N291S independently and significantly increased triglyceride levels. The HindIII and S447X LPL polymorphisms were significantly associated with lower triglyceride levels. The PvuII (LPL), -250G/A (LIPC) and TaqIβ (CETP) variants showed no significant associations. There was a statistical trend (p=0.048) for an interaction between abdominal obesity (waist circumference >102cm in men and >88cm in women) and the APOE-¿4 allele.
ConclusionsOur study shows the influence of the APOE-¿4 allele, the S19W and -1131T/C polymorphisms of APOA5 and the LPL-D9N, N291S, HindIII and S447X variants on triglyceride levels and suggests that the effect of the ¿4 allele could by modulated by interaction with abdominal obesity.
La consideración de los cambios en los niveles de triglicéridos (TG) como un factor independiente de riesgo cardiovascular está avalada por diversos estudios1,2. La trigliceridemia es un rasgo fenotípico complejo como refleja la gran variedad de partículas ricas en TG, principalmente quilomicrones, VLDL e IDL. Además, la hipertrigliceridemia (HTG) es una de las características que definen el síndrome metabólico3 y está presente en la dislipidemia genética más común, la hiperlipidemia familiar combinada.
Dentro del conjunto de factores responsables de la expresión fenotípica de la trigliceridemia y que, por tanto, pueden influir en el riesgo cardiovascular, es de interés el análisis de los factores genéticos y sus interacciones con factores ambientales, como posibles moduladores de su efecto4.
De entre los posibles genes candidatos implicados en el metabolismo de los TG y de las lipoproteínas, la influencia de los genes de APOE, APOA5, LPL, LIPC y CETP es clara. Estos genes codifican para enzimas y apolipoproteínas ampliamente citadas en la literatura por su relación con la expresión de la trigliceridemia, ya que juegan un papel esencial en la eliminación, transporte y remodelado de las lipoproteínas ricas en TG5–9.
La asociación entre los alelos comunes de APOE (¿2, ¿3 y ¿4), las enfermedades cardiovasculares y los cambios en los niveles de colesterol es de las más sólidas descritas en la literatura; sin embargo, es más discutida su asociación con las variaciones en los niveles de TG10, que parece ser más dependiente del contexto ambiental11.
Los polimorfismos más informativos del gen de APOA5 son la variante de cambio de sentido S19W y la variante del promotor -1131T/C. Ambas están asociadas con un aumento en los niveles de TG en diversas poblaciones incluso con la presencia de HTG grave y de enfermedad cardiovascular12–14.
Entre las variantes del gen LPL, D9N y N291S se han asociado en distintos estudios con niveles elevados de TG y con enfermedad coronaria15,16. Al contrario, los polimorfismos HindIII y S447X se han relacionado con perfiles más favorables17–19. El papel de la variante intrónica PvuII es más controvertido, ya que existen estudios en los que se asocia a cambios en los niveles de lípidos e incluso a una mayor prevalencia de enfermedad vascular20, mientras que en otros no se pone de manifiesto ningún efecto21.
Los genes LIPC y CETP son dos buenos ejemplos de la importancia del contexto genético y ambiental en el que se analizan los polimorfismos. Las variantes más conocidas del gen LIPC son las del promotor, como por ejemplo -250G/A. Su estudio es interesante, pues aun estando asociadas con niveles más altos de colesterol HDL, también tienen relación con la enfermedad arterial periférica22. También la variante -514T/C —en desequilibrio de ligamiento con la anterior— se asocia con cambios en los niveles de TG en algunas poblaciones23.
Finalmente, la variante TaqIβ del gen CETP se ha estudiado en relación a los niveles de colesterol HDL, la interacción con factores ambientales, su relación con el síndrome metabólico y, con resultados controvertidos, su asociación con el riesgo cardiovascular9. Dada la estrecha relación entre el metabolismo de TG y C-HDL, su estudio puede resultar de interés en el marco de este trabajo.
En este contexto hemos determinado las frecuencias alélicas del polimorfismo de APOE, de dos variantes de APOA5 (S19W y -1131 T/C), cinco variantes de LPL (D9N, N291S, PvuII, HindIII y S447X) una de LIPC (-250G/A) y otra de CETP (TaqIβ), en una cohorte de población laboral malagueña, con el objetivo de analizar la asociación de estas variantes con los niveles séricos de TG y valorar si se producía alguna interacción entre estas variantes y los factores ambientales determinados en la población de estudio.
MétodosPoblación de estudioEste trabajo forma parte del proyecto ICARIA (Ibermutuamur CArdiovascular RIsk Assessment)24,25, que tiene como objetivo evaluar los factores de riesgo y el riesgo cardiovascular global en los trabajadores protegidos, con ocasión de los reconocimientos médicos anuales realizados en esta mutua de accidentes de trabajo. El presente estudio incluye 1.825 sujetos (1.460 varones y 365 mujeres) que acudieron a reconocimiento médico en la provincia de Málaga entre 2004 y 2005, y firmaron el consentimiento informado para participar en él. Se consideraron criterios de exclusión el encontrase en situación de baja laboral o no otorgar el consentimiento para dicha participación. El estudio fue aprobado por el Comité Ético-Científico de Ibermutuamur y cumple las recomendaciones de Helsinki. Los datos recogidos han sido tratados confidencialmente, siguiendo la vigente Ley Orgánica de Protección de Datos española.
Todos los trabajadores cumplimentaron un cuestionario que incluía la edad, el género, la categoría profesional, la medicación, el consumo de tabaco y de alcohol, y antecedentes de diabetes, hipertensión, dislipidemia y enfermedad cardiovascular, de acuerdo a los criterios publicados previamente25. El reconocimiento médico incluyó la determinación de peso, talla, perímetro abdominal y dos medidas de presión arterial en el mismo brazo con al menos 1min de intervalo entre ambas, empleando un aparato semiautomático validado (Omron M41, Omron Electronics, Hoofddorp. Holanda). Las determinaciones bioquímicas se llevaron a cabo, en una muestra de suero obtenida tras 12h de ayuno, en el laboratorio de referencia de Ibermutuamur, siguiendo protocolos estándar y los controles de calidad establecidos por la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC).
Se consideró a los trabajadores como fumadores si fumaban al ser incluidos en el estudio o habían dejado de fumar menos de un año antes. En cuanto al consumo de alcohol, se distinguieron dos grupos: los que manifestaban consumir alcohol diariamente, de forma moderada, frente a los consumidores ocasionales y los no consumidores. La hipertensión se definió cuando había diagnóstico previo o tratamiento, o las presiones arteriales fueron ≥140/90mmHg. El perímetro de cintura (PC) se consideró elevado a partir de 102cm en hombres y 88cm en mujeres3. Los valores del riesgo cardiovascular SCORE para países de bajo riesgo y el riesgo relativo se generaron automáticamente24,26. Se consideró la presencia de HTG si los niveles séricos de TG en ayunas eran ≥150mg/dl3.
Análisis genéticosEl ADN genómico se obtuvo utilizando un BioRobot® EZ1 (QIAGEN, Hilden, Alemania) a partir de sangre congelada extraída en EDTA. Todas las reacciones de PCR empleadas en el genotipado se llevaron a cabo en un iCycler iQ™ (BioRad, California, EE.UU.) con las mezclas de reacción iQ™ SYBR Green Supermix (análisis por restricción) o iQ™ Supermix (análisis con sondas fluorescentes). Los polimorfismos de APOE (rs429358, rs7412), HindIII de LPL (rs320) y TaqIβ de CETP (rs708272) se determinaron mediante amplificación por PCR y el análisis de los fragmentos de restricción. Los productos de amplificación fueron digeridos, respectivamente, con los enzimas de restricción HhaI, HindIII y TaqI siguiendo las instrucciones del fabricante (Takara, Japón). Los fragmentos resultantes fueron separados en geles con distintos porcentajes de agarosa o acrilamida según el tamaño de los fragmentos resultantes.
Los polimorfismos de LPL: PvuII (rs285), D9N (rs1801177), N291S (rs268) y S447X (rs328), la variante de LIPC -250G/A (rs2070895) y las de APOA5: S19W (rs3135506) y -1131T/C (rs662799) se genotiparon empleando sondas lineales fluorogénicas y el modo de discriminación alélica de la aplicación informática del termociclador iQ™.
Para controlar la calidad del genotipado se emplearon muestras de genotipo conocido, se repitió el análisis en las muestras que presentaron un patrón de bandas ambiguo (variantes por PCR y restricción) y aquellas con datos ópticos aberrantes (ensayos con sondas). Además, se duplicaron los genotipos del 10% de las muestras seleccionadas al azar. La tasa de error de genotipado fue menor del 1%.
Análisis estadísticoLos análisis estadísticos se realizaron con los programas SPSS (versión 14.0 para Windows) y R27. Se consideró un valor de p<0,05 como estadísticamente significativo. La prueba de χ2 se utilizó para verificar el equilibrio Hardy-Weinberg y para comparar frecuencias alélicas. Cuando los valores esperados en más del 20% de las casillas, en tablas de contingencia, fueron inferiores a 5 se aplicó el test de Fisher. El paquete SNPassoc de R se empleó para las medidas de desequilibrio de ligamiento y para comprobar la validez de la clasificación de los sujetos de acuerdo a los modelos genéticos dominante (portadores: heterocigotos y homocigotos para los alelos menos frecuentes, frente a no portadores: homocigotos para el alelo más frecuente), codominante (homocigotos menos frecuentes o heterocigotos frente a homocigotos más frecuentes) o recesivo (homocigotos para el alelo menos frecuente frente a homocigotos más frecuentes y heterocigotos).
La variable TG se transformó logarítmicamente para mejorar la normalidad de la distribución. Los resultados se expresaron finalmente en la escala original, al deshacer dicha transformación, como medias geométricas (MG) y los correspondientes intervalos de confianza (IC), asimétricos, al 95%. Las pruebas de ANOVA o t de Student se emplearon para comparar medias entre grupos para variables con una distribución normal. La prueba U de Mann-Whitney se aplicó para analizar diferencias entre grupos para variables ordinales.
Se elaboró un modelo de regresión lineal para contrastar la hipótesis nula de no asociación entre las variantes genéticas y el logaritmo de TG, ajustando por edad, género, perímetro de cintura, presión arterial, glucemia, consumo de tabaco y alcohol. A causa de la transformación logarítmica, los coeficientes «B» asociados al efecto de cada variante fueron multiplicativos. Las posibles interacciones entre las variantes genéticas y los factores no genéticos se evaluaron introduciendo en el modelo, uno por uno, los correspondientes factores de interacción de dos términos (variante X factor) ajustando para las covariables y aplicando, en el nivel de significación estadística, la corrección de Bonferroni para contrastes múltiples. Se emplearon métodos estándar de diagnóstico para asegurar la corrección de los modelos de regresión.
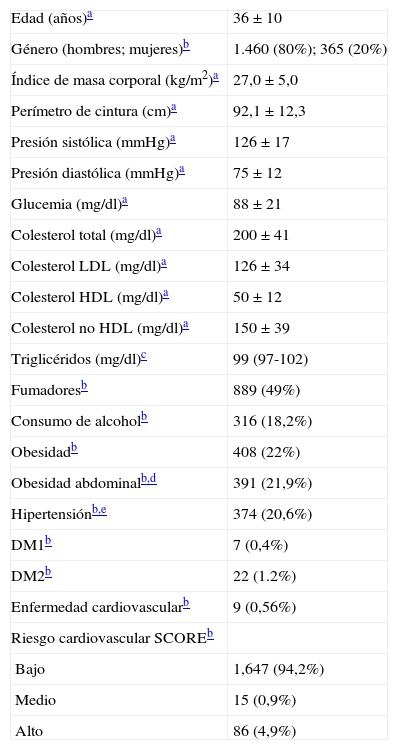
ResultadosLas principales características de la cohorte analizada se muestran en la tabla 1. De forma similar a lo descrito en la población laboral a nivel nacional25, la media de edad fue inferior a 40 años, los hombres fueron mayoría y el factor de riesgo más frecuente fue el consumo de tabaco. La prevalencia de HTG (TG ≥150mg/dl) fue del 22,8%. Sólo un hombre presentó niveles de TG superiores a 1.000mg/dl.
Características demográficas, antropométricas, bioquímicas y clínicas de los sujetos de estudio (n=1.825)
| Edad (años)a | 36±10 |
| Género (hombres; mujeres)b | 1.460 (80%); 365 (20%) |
| Índice de masa corporal (kg/m2)a | 27,0±5,0 |
| Perímetro de cintura (cm)a | 92,1±12,3 |
| Presión sistólica (mmHg)a | 126±17 |
| Presión diastólica (mmHg)a | 75±12 |
| Glucemia (mg/dl)a | 88±21 |
| Colesterol total (mg/dl)a | 200±41 |
| Colesterol LDL (mg/dl)a | 126±34 |
| Colesterol HDL (mg/dl)a | 50±12 |
| Colesterol no HDL (mg/dl)a | 150±39 |
| Triglicéridos (mg/dl)c | 99 (97-102) |
| Fumadoresb | 889 (49%) |
| Consumo de alcoholb | 316 (18,2%) |
| Obesidadb | 408 (22%) |
| Obesidad abdominalb,d | 391 (21,9%) |
| Hipertensiónb,e | 374 (20,6%) |
| DM1b | 7 (0,4%) |
| DM2b | 22 (1.2%) |
| Enfermedad cardiovascularb | 9 (0,56%) |
| Riesgo cardiovascular SCOREb | |
| Bajo | 1,647 (94,2%) |
| Medio | 15 (0,9%) |
| Alto | 86 (4,9%) |
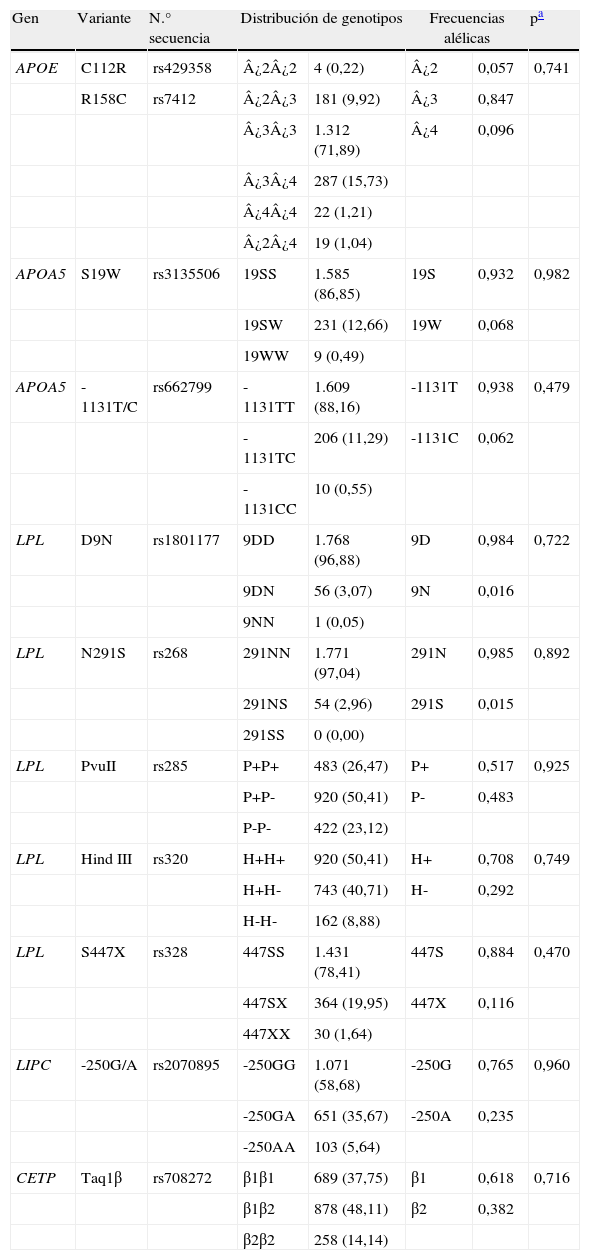
Todos los sujetos fueron genotipados para los polimorfismos relacionados en la tabla 2. Nuestra población estuvo en equilibrio Hardy-Weinberg para todas las variantes analizadas. Entre los alelos de APOE fueron, respectivamente, de más a menos frecuente ¿3 (85%), ¿4 (10%) y ¿2 (6%). Las dos variantes de APOA5 mostraron frecuencias alélicas similares (19W, 6,8%; -1131C, 6,2%). La frecuencia alélica más alta correspondió al alelo P- del polimorfismo PvuII de LPL (48%) y la más baja a los alelos 9N y 291S del mismo gen (1,6 y 1,5%). Los alelos TaqIβ2 (CETP); -250A (LIPC), H+ (LPL) y S447X (LPL) presentaron frecuencias intermedias (38, 24, 29 y 12%, respectivamente).
Distribución de genotipos (número de personas y porcentaje) y frecuencias alélicas de los polimorfismos estudiados
| Gen | Variante | N.° secuencia | Distribución de genotipos | Frecuencias alélicas | pa | ||
| APOE | C112R | rs429358 | ¿2¿2 | 4 (0,22) | ¿2 | 0,057 | 0,741 |
| R158C | rs7412 | ¿2¿3 | 181 (9,92) | ¿3 | 0,847 | ||
| ¿3¿3 | 1.312 (71,89) | ¿4 | 0,096 | ||||
| ¿3¿4 | 287 (15,73) | ||||||
| ¿4¿4 | 22 (1,21) | ||||||
| ¿2¿4 | 19 (1,04) | ||||||
| APOA5 | S19W | rs3135506 | 19SS | 1.585 (86,85) | 19S | 0,932 | 0,982 |
| 19SW | 231 (12,66) | 19W | 0,068 | ||||
| 19WW | 9 (0,49) | ||||||
| APOA5 | -1131T/C | rs662799 | -1131TT | 1.609 (88,16) | -1131T | 0,938 | 0,479 |
| -1131TC | 206 (11,29) | -1131C | 0,062 | ||||
| -1131CC | 10 (0,55) | ||||||
| LPL | D9N | rs1801177 | 9DD | 1.768 (96,88) | 9D | 0,984 | 0,722 |
| 9DN | 56 (3,07) | 9N | 0,016 | ||||
| 9NN | 1 (0,05) | ||||||
| LPL | N291S | rs268 | 291NN | 1.771 (97,04) | 291N | 0,985 | 0,892 |
| 291NS | 54 (2,96) | 291S | 0,015 | ||||
| 291SS | 0 (0,00) | ||||||
| LPL | PvuII | rs285 | P+P+ | 483 (26,47) | P+ | 0,517 | 0,925 |
| P+P- | 920 (50,41) | P- | 0,483 | ||||
| P-P- | 422 (23,12) | ||||||
| LPL | Hind III | rs320 | H+H+ | 920 (50,41) | H+ | 0,708 | 0,749 |
| H+H- | 743 (40,71) | H- | 0,292 | ||||
| H-H- | 162 (8,88) | ||||||
| LPL | S447X | rs328 | 447SS | 1.431 (78,41) | 447S | 0,884 | 0,470 |
| 447SX | 364 (19,95) | 447X | 0,116 | ||||
| 447XX | 30 (1,64) | ||||||
| LIPC | -250G/A | rs2070895 | -250GG | 1.071 (58,68) | -250G | 0,765 | 0,960 |
| -250GA | 651 (35,67) | -250A | 0,235 | ||||
| -250AA | 103 (5,64) | ||||||
| CETP | Taq1β | rs708272 | β1β1 | 689 (37,75) | β1 | 0,618 | 0,716 |
| β1β2 | 878 (48,11) | β2 | 0,382 | ||||
| β2β2 | 258 (14,14) | ||||||
Por otra parte, se observó que los polimorfismos HindIII y S447X de LPL se encontraban en fuerte desequilibrio de ligamiento (D’=0,984; r2=0,308; p<0,00001). Además, la variante PvuII de LPL se encontró asociada a varios polimorfismos del mismo gen: S447X (D’=0,943; r2=0,125); HindIII (D’=0,098; r2=0,313) y D9N (D’=0,798; r2=0,011), p<0,00001, p<0,00001 y p<0,001, respectivamente.
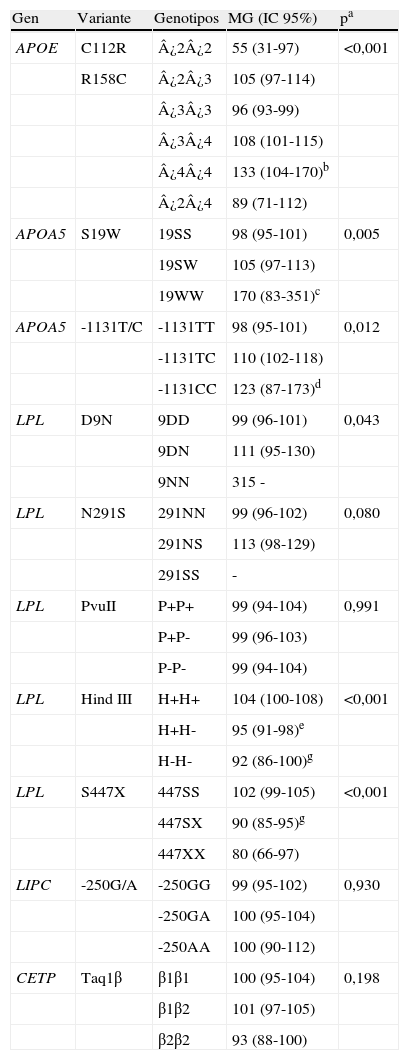
Asociación entre las variantes genéticas y los niveles de triglicéridosLa tabla 3 muestra las medias geométricas y los intervalos de confianza al 95% de los niveles de TG que presentan los genotipos de los polimorfismos analizados.
Medias geométricas e intervalos de confianza al 95% de los niveles de triglicéridos (mg/dl) según los genotipos de las variantes analizadas
| Gen | Variante | Genotipos | MG (IC 95%) | pa |
| APOE | C112R | ¿2¿2 | 55 (31-97) | <0,001 |
| R158C | ¿2¿3 | 105 (97-114) | ||
| ¿3¿3 | 96 (93-99) | |||
| ¿3¿4 | 108 (101-115) | |||
| ¿4¿4 | 133 (104-170)b | |||
| ¿2¿4 | 89 (71-112) | |||
| APOA5 | S19W | 19SS | 98 (95-101) | 0,005 |
| 19SW | 105 (97-113) | |||
| 19WW | 170 (83-351)c | |||
| APOA5 | -1131T/C | -1131TT | 98 (95-101) | 0,012 |
| -1131TC | 110 (102-118) | |||
| -1131CC | 123 (87-173)d | |||
| LPL | D9N | 9DD | 99 (96-101) | 0,043 |
| 9DN | 111 (95-130) | |||
| 9NN | 315 - | |||
| LPL | N291S | 291NN | 99 (96-102) | 0,080 |
| 291NS | 113 (98-129) | |||
| 291SS | - | |||
| LPL | PvuII | P+P+ | 99 (94-104) | 0,991 |
| P+P- | 99 (96-103) | |||
| P-P- | 99 (94-104) | |||
| LPL | Hind III | H+H+ | 104 (100-108) | <0,001 |
| H+H- | 95 (91-98)e | |||
| H-H- | 92 (86-100)g | |||
| LPL | S447X | 447SS | 102 (99-105) | <0,001 |
| 447SX | 90 (85-95)g | |||
| 447XX | 80 (66-97) | |||
| LIPC | -250G/A | -250GG | 99 (95-102) | 0,930 |
| -250GA | 100 (95-104) | |||
| -250AA | 100 (90-112) | |||
| CETP | Taq1β | β1β1 | 100 (95-104) | 0,198 |
| β1β2 | 101 (97-105) | |||
| β2β2 | 93 (88-100) |
aValor p de las pruebas ANOVA o t de Student con la variable transformada logarítmicamente.
Diferencias significativas (p<0,05) en el análisis post-hoc de Bonferroni.
bcomparado con ¿3¿3.
ccomparado con 19SS y 19SW; incluye un hombre con TG>1.000mg/dl.
dcomparado con -1131TT.
e,fcomparado con H+H+.
gcomparado con 447SS.
Se observaron diferencias significativas entre los genotipos de APOE. Las variantes S19W y -1131T/C de APOA5 y D9N de LPL se asociaron significativamente con concentraciones más altas de TG. Los portadores del polimorfismo N291S de LPL tuvieron niveles mayores de TG que los no portadores, si bien no se alcanzó la significación estadística. Al contrario, los polimorfismos S447X y HindIII de LPL mostraron un efecto reductor de los niveles de TG. No se encontraron diferencias significativas entre los niveles de TG de los genotipos de las variantes PvuII (LPL), -250G/A (LIPC) ni TaqIβ (CETP), si bien los homocigotos B2B2 de este polimorfismo presentaron menores niveles que el resto (p=0,076).
Antes de la elaboración del modelo de regresión lineal los sujetos se reclasificaron para analizar grupos de mayor tamaño y evitar situaciones de elevada colinealidad de acuerdo a lo siguiente.
En relación al polimorfismo de APOE se distinguió entre portadores (genotipos ¿4¿4, ¿3¿4, ¿2¿4) y no portadores (genotipos ¿3¿3, ¿2¿3, ¿2¿2) del alelo ¿4, los primeros con niveles más altos de TG (MG, 110mg/dl; CI al 95%, 103-117) que los no portadores (MG, 98; IC al 95%, 94-100; p=0,001). Para el alelo ¿2 los individuos se agruparon conforme a un modelo codominante: no portadores (¿3¿4, ¿3¿3 y ¿4¿4; MG, 98; IC al 95%, 96-102); heterocigotos (¿2¿3 y ¿2¿4; MG, 104; IC al 95%, 96-112) y homocigotos (¿2¿2; MG, 55; IC al 95%, 31-97); p=0,067. No se obtuvieron diferencias significativas al comparar portadores y no portadores de ¿2. Se descartó el modelo recesivo al incluir sólo 4 personas. En todos los casos se obtuvo el mismo resultado al excluir de los análisis los sujetos ¿2¿4.
Para las variantes S19W y -1131T/C de APOA5 las personas se clasificaron como portadores o no portadores (grupo referencia) del alelo menos frecuente según un modelo dominante. En el caso de la variante D9N se realizó la misma agrupación al haber una sola persona con genotipo 9NN. En el caso del polimorfismo TaqIβ, los sujetos se agruparon según el modelo recesivo.
Para los individuos portadores de las variantes de LPL S447X y HindIII, en desequilibrio de ligamiento y asociados con un efecto protector, se definieron tres grupos: homocigotos para los alelos más frecuentes de ambas variantes (ninguna variante protectora); portadores de HindIII o de S447X (una variante protectora), y portadores de HindIII y S447X (dos variantes protectoras). Los genotipos de cada grupo y los correspondientes niveles de TG se especifican en la tabla 4. Puede verse que el 99% de los sujetos con una variante protectora fueron portadores del polimorfismo HindIII.
Distribución de genotipos y niveles de triglicéridos según la presencia de los polimorfismos de LPL HindIII y/o S447X
| Número de variantes protectoras | Genotipos | TGa |
| 0 variantes protectoras (n=916) | 447SS/H+H+ (n=916) | 104 (100-108) |
| 1 variante protectora (n=519) | 447SS/H+H- (n=459) | 98 (94-103) |
| 447SS/H-H- (n=56) | ||
| 447SX/H+H+ (n=4) | 89 (84-94)b | |
| 2 variantes protectoras (n=390) | 447SX/H+H- (n=284) | |
| 447SX/H-H- (n=76) | ||
| 447XX/H-H- (n=30) |
No se incluyeron en el modelo las variantes PvuII de LPL (colineal con otros polimorfismos del gen, sin diferencias en el análisis univariante) ni -250G/A de LIPC (sin diferencias en el análisis univariante).
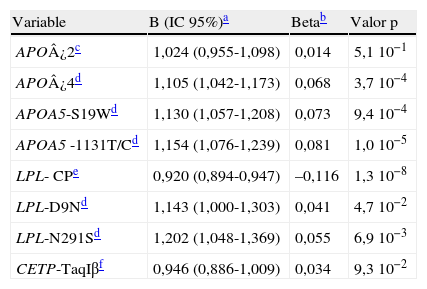
Como se muestra en la tabla 5, tras ajustar por las covariables género, edad, perímetro de cintura, glucemia, presiones sistólica y diastólica, hábito de fumar e ingesta de alcohol, el modelo de regresión lineal mostró una asociación significativa del alelo ¿4 de APOE y de los polimorfismos D9N y N291S de LPL, S19W y -1131T/C de APOA5 con un efecto elevador independiente y aditivo de los niveles de TG. Además, se confirma la asociación con una disminución de los niveles de TG de la combinación de variantes de LPL consideradas protectoras (HindIII/S447X).
Modelo de regresión lineal para la asociación entre las variantes y los niveles de triglicéridos corrigiendo por covariables
| Variable | B (IC 95%)a | Betab | Valor p |
| APO¿2c | 1,024 (0,955-1,098) | 0,014 | 5,1 10−1 |
| APO¿4d | 1,105 (1,042-1,173) | 0,068 | 3,7 10−4 |
| APOA5-S19Wd | 1,130 (1,057-1,208) | 0,073 | 9,4 10−4 |
| APOA5 -1131T/Cd | 1,154 (1,076-1,239) | 0,081 | 1,0 10−5 |
| LPL- CPe | 0,920 (0,894-0,947) | –0,116 | 1,3 10−8 |
| LPL-D9Nd | 1,143 (1,000-1,303) | 0,041 | 4,7 10−2 |
| LPL-N291Sd | 1,202 (1,048-1,369) | 0,055 | 6,9 10−3 |
| CETP-TaqIβf | 0,946 (0,886-1,009) | 0,034 | 9,3 10−2 |
Se excluyeron los sujetos que tomaban tratamiento hipolipemiante y una persona con TG>1.000mg/dl (n=1.731). R2=0,30.
Coeficiente multiplicativo e intervalo de confianza al 95% del efecto de cada variante obtenido tras deshacer la transformación logarítmica.
Portadores del alelo menos frecuente (homocigotos y heterocigotos) frente a los homocigotos más frecuentes (grupo referencia).
Ninguno de los alelos no incluidos inicialmente del modelo (P-; PvuII-LPL; -250A; -250G/A-LIPC) alcanzó la significación al corregir individualmente por las covariables.
Puesto que no se encontraron pruebas de un efecto diferente de las variantes según el sexo (interacciones no significativas entre los polimorfismos y el sexo), se mantuvo el análisis del grupo completo de trabajadores para el resto del estudio.
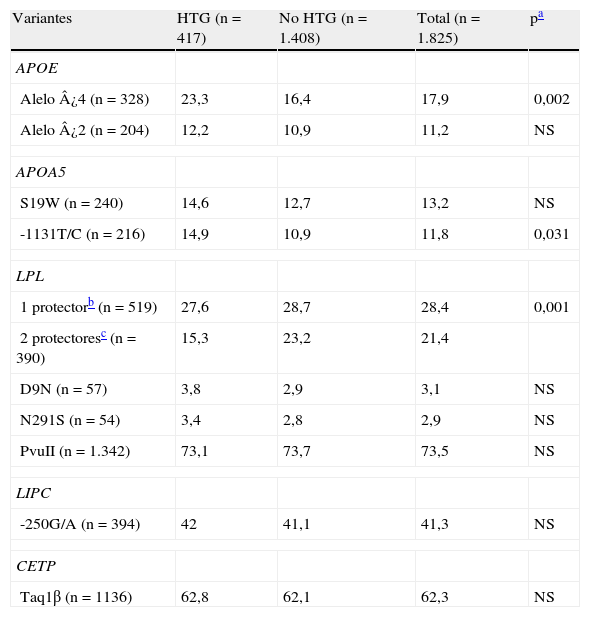
En la tabla 6 se muestra la frecuencia de portadores de las variantes en los grupos de sujetos con y sin HTG. Se encontraron diferencias significativas para los alelos ¿4 de APOE y -1131C de APOA5 (mayor frecuencia en el grupo de HTG) y para la combinación de polimorfismos protectores (HindIII/S447X) de LPL, que aparecieron con menor frecuencia en el grupo de HTG.
Frecuencia (%) de portadores de los polimorfismos según la presencia o ausencia de hipertrigliceridemia
| Variantes | HTG (n=417) | No HTG (n=1.408) | Total (n=1.825) | pa |
| APOE | ||||
| Alelo ¿4 (n=328) | 23,3 | 16,4 | 17,9 | 0,002 |
| Alelo ¿2 (n=204) | 12,2 | 10,9 | 11,2 | NS |
| APOA5 | ||||
| S19W (n=240) | 14,6 | 12,7 | 13,2 | NS |
| -1131T/C (n=216) | 14,9 | 10,9 | 11,8 | 0,031 |
| LPL | ||||
| 1 protectorb (n=519) | 27,6 | 28,7 | 28,4 | 0,001 |
| 2 protectoresc (n=390) | 15,3 | 23,2 | 21,4 | |
| D9N (n=57) | 3,8 | 2,9 | 3,1 | NS |
| N291S (n=54) | 3,4 | 2,8 | 2,9 | NS |
| PvuII (n=1.342) | 73,1 | 73,7 | 73,5 | NS |
| LIPC | ||||
| -250G/A (n=394) | 42 | 41,1 | 41,3 | NS |
| CETP | ||||
| Taq1β (n=1136) | 62,8 | 62,1 | 62,3 | NS |
El análisis de las interacciones potenciales se realizó mediante contrastes múltiples al introducir en el modelo de regresión lineal, uno por uno, los factores de interacción de dos términos entre las variantes genéticas con efecto significativo previo y los factores secundarios: consumo de tabaco, de alcohol, edad, perímetro de cintura, obesidad abdominal, glucemia, glucemia elevada e hipertensión. Mediante este procedimiento no se obtuvo ninguna interacción significativa tras aplicar la corrección de Bonferroni. Sólo se encontró una interacción con un nivel de significación inferior a 0,05 entre el alelo ¿4 de APOE y la obesidad abdominal (B, 1.164; IC al 95%, 1.001-1.356; p=0,049).
DiscusiónNuestro estudio describe por primera vez el análisis simultáneo del polimorfismo de APOE y de variantes comunes de los genes APOA5 (S19W y -1131T/C), LPL (D9N, N291S, PvuII, HindIII y S447X), LIPC (-250G/A) y CETP (TaqIβ) en relación a los niveles de TG en una población mediterránea española amplia y bien caracterizada.
Los resultados de nuestro trabajo muestran claramente un efecto independiente y aditivo de algunas de las variantes determinadas: elevador de los niveles de TG en el caso del alelo ¿4 de APOE, de los polimorfismos de APOA5 S19W y -1131T/C y de las variantes de LPL D9N y N291S y protector o reductor en el caso de los polimorfismos HindIII y S447X de LPL. Por otra parte, en nuestra población, las variantes PvuII (LPL), -250G/A (LIPC) y TaqIβ (CETP) no mostraron asociación con los niveles de TG. Además, nuestros resultados sugieren que el efecto del alelo APOE-¿4 podría estar modulado por la interacción con la obesidad abdominal.
La frecuencia del alelo ¿4 en nuestra población (9,6%) está dentro del rango descrito para las poblaciones del sur de Europa28, si bien es algo mayor que la descrita en otras poblaciones laborales españolas: 7,8% en población madrileña29, 7,5% en las Islas Canarias30 y 7,1% en población valenciana11.
Las frecuencias de los alelos APOA5 19W y -1131C encontradas por nosotros (6,2 y 6,8%, respectivamente) son similares a las calculadas en población caucásica de distinta zona geográfica13 y similar a la descrita recientemente en la población española del estudio EPIGEM31.
En nuestra población la frecuencia de portadores de los polimorfismos D9N y N291S del gen LPL resultó alrededor del 3%, es decir, entre el 1 y el 7% descrito en sujetos caucásicos sanos32,33, si bien, en nuestro conocimiento, en estos estudios no se analiza ninguna población del entorno mediterráneo de este tamaño. En cuanto a los polimorfismos protectores de LPL, HindIII y S447X, las frecuencias alélicas determinadas en nuestra población están en el rango de otras poblaciones europeas34 y son ligeramente inferiores a las encontradas en otra población española mediterránea17.
Las asociaciones significativas encontradas en nuestro trabajo entre las variantes genéticas y los niveles de TG que les atribuyen un efecto elevador (alelo ¿4, polimorfismos S19W, -1131T/C, D9N, N291S) o reductor (variantes HindIII y S447X) de TG están de acuerdo con la mayoría de los estudios publicados anteriormente11,12,15, siendo la primera vez que se describe su análisis simultáneo en un población de este tamaño y, por tanto, el efecto independiente de cada una de ellas.
Para las variantes analizadas hay estudios que permiten considerarlas funcionales y justificar las asociaciones encontradas por nosotros y otros autores. En el caso del polimorfismo de APOE, según el metaanálisis de Dallongeville et al35, tanto los portadores de ¿2 como los de ¿4 podrían asociarse a cambios en los niveles de TG. En nuestro trabajo sólo los portadores de ¿4 se asocian independientemente a concentraciones más altas de TG. Se ha descrito que las partículas de VLDL están relativamente enriquecidas en la isoforma ¿436. Dado que las lipoproteínas más ricas en APOE son peor sustrato para la lipólisis, debido a su efecto inhibidor37 el enriquecimiento en la isoforma ¿4 propiciaría una lipólisis parcial. En este sentido es plausible una interacción entre una situación de lipólisis disminuida por la presencia de este alelo y una situación de sobreproducción de partículas ricas en TG, por ejemplo, cuando el perímetro de cintura es elevado38. En nuestro trabajo, la interacción entre ambos factores muestra un coeficiente B con una magnitud importante de TG; sin embargo, no alcanza la significación estadística con el método de análisis empleado, probablemente debido a un problema de potencia estadística limitada, por lo que merece la pena ser valorada en otros estudios. También se ha mostrado que el efecto inhibidor de la apolipoproteína E es más pronunciado en la isoforma ¿239, que además se asocia a concentraciones más altas de la apolipoproteína. Por lo tanto, las partículas que contengan esa isoforma también serían peores sustratos para la enzima LPL, si bien en nuestros trabajadores no hemos podido poner de manifiesto un efecto elevador de TG del alelo ¿2.
El efecto funcional de la variante S19W de APOA5 que hemos determinado ha sido estudiado por Talmud et al40, que muestran una función alterada del péptido señal de la apolipoproteína que afectaría a su secreción. Por otra parte, existen estudios en los que la presencia de la variante del promotor, -1131T/C, se asocia con niveles más bajos de Apo AV41, y además también está descrita, para los dos polimorfismos de APOA5 analizados, la asociación con niveles más bajos de actividad LPL42. Asumiendo, por tanto, un efecto de los polimorfismos de APOA5 estudiados sobre la lipólisis, la interacción entre estas variantes con factores secundarios asociados con liposíntesis de novo sería esperable; sin embargo, tal efecto no se manifiesta en nuestra población. En el estudio de Evans et al43 se describe la asociación entre la variante -1131T/C de APOA5 y un aumento significativo en los niveles de TG en pacientes con hiperlipidemia sólo cuando tenían sobrepeso. En nuestra población, muy diferente de la estudiada por Evans et al, el efecto tanto de -1131T/C como de S19W es claramente independiente de los factores secundarios analizados. Por otra parte, se da la circunstancia de que los portadores hipertrigliceridémicos de la variante S19W presentan significativamente menos prevalencia de obesidad abdominal que los hipertrigliceridémicos no portadores, de forma que no habría casos suficientes en los que valorar una posible interacción entre el factor genético y el factor ambiental.
Está descrito que los polimorfismos no sinónimos D9N y N291S afectan, respectivamente, a la secreción y dimerización de la enzima LPL44, y se ha sugerido45 que el efecto que estas modificaciones tienen sobre la actividad LPL —y por tanto sobre la lipólisis— puede no ser suficiente como para alterar los niveles de TG; sin embargo, en nuestro estudio ambos polimorfismos se asocian, independientemente del perímetro de cintura y otros factores de confusión, con un efecto elevador significativo (20 y 14% de aumento, respectivamente; tabla 5). Lógicamente, la baja frecuencia de estos polimorfismos reduce su impacto poblacional.
En relación a las variantes protectoras de LPL, es interesante señalar que Razzaghi et al46 han descrito un efecto funcional independiente para la variante intrónica HindIII que parece situarse en un región reguladora18. En el caso de la variante S447X, la eliminación de los dos últimos aminoácidos del extremo C terminal provoca un aumento de la actividad de la enzima47. La proximidad física entre estos dos polimorfismos, que están en casi total desequilibrio de ligamiento, dificulta la atribución de un efecto independiente a las dos variantes; sin embargo, en nuestra población hemos evaluado la presencia de un solo alelo protector, que en el 96% de los casos corresponde a la variante HindIII, estando asociada significativamente a un efecto reductor independiente (tabla 5).
Aunque nuestro estudio avala resultados de estudios previos y aporta nuevos hallazgos con resultados consistentes, es necesario señalar ciertas limitaciones. Si se acepta que el efecto de los polimorfismos genéticos depende del contexto genético y ambiental en el que éstos se analizan, es lógico pensar que las características inherentes a la población analizada (área geográfica, edad, estado de salud) son las que condicionan principalmente los resultados obtenidos. Por otra parte, dado el carácter multifactorial y multigénico de la variable que estamos analizando —los niveles de TG—, es muy probable que el análisis de otras variantes en otros genes y otras variables ambientales como la dieta y el ejercicio físico, no consideradas en este trabajo, ayuden a explicar mejor la variabilidad en los niveles de TG y pongan de manifiesto interacciones hasta ahora no descritas que expliquen la manifestación de HTG.
En conclusión, nuestro trabajo muestra la implicación del alelo ¿4 de APOE y de las variantes S19W y -1131T/C de APOA5 y D9N, N291S, HindIII y S447X de LPL sobre los cambios en los niveles de TG de la población analizada, y sugiere un efecto modulador del perímetro de cintura sobre el alelo ¿4.
FinanciaciónEste trabajo ha sido parcialmente financiado por una beca FEA/SEA 2006 para la Investigación Clínico-Epidemiológica concedida en el XIX congreso Nacional de la Sociedad Española de Arteriosclerosis celebrado en Santander.
Contribución de los autoresTodos los autores cumplen las condiciones de autoría requeridas por la revista para ser firmantes del artículo.
Conflicto de interesesSe declara un conflicto de interés no económico en relación con el trabajo de genotipado por estar presentadas las siguientes solicitudes de patente:
- 1.
Conjunto de cebadores, sondas, procedimiento y kit para el genotipado del polimorfismo genético -1131T/C del gen APOA5. Ariza MJ, Rioja J, Valdivielso P, Sánchez-Chaparro MA, González-Santos P. Número de solicitud: P200802184.
- 2.
Conjunto de cebadores, sondas, procedimiento y kit para el genotipado del polimorfismo genético -250 G/A del gen LIPC. Ariza MJ, Rioja J, Valdivielso P, Sánchez-Chaparro MA, González-Santos P. Número de solicitud: P200802185.
- 3.
Conjunto de cebadores, sondas, procedimiento y kit para el genotipado del polimorfismo genético S447X del gen LPL. Ariza MJ, Rioja J, Valdivielso P, Sánchez-Chaparro MA, González-Santos P. Número de solicitud: P200802182.
- 4.
Conjunto de cebadores, sondas, procedimiento y kit para el genotipado del polimorfismo genético S19W del gen APOA5. Ariza MJ, Rioja J, Valdivielso P, Sánchez-Chaparro MA, González-Santos P. Número de solicitud: P200802183.
Los autores agradecen a las doctoras Guadalupe Requena Santos y Martha Cabrera Sierra su contribución en la obtención y depuración de los datos clínicos.