Los niveles elevados de cLDL se asocian a un riesgo cardiovascular elevado, y para su tratamiento se emplean, de forma ordinaria, las estatinas. Sin embargo, incluso en los enfermos con cLDL controlado persiste un riesgo residual comúnmente asociado a la persistencia de alteraciones lipídicas (niveles elevados de triglicéridos con o sin descenso de HDL asociado). Por tanto, se considera necesario valorar triglicéridos y HDL para valorar adecuadamente el riesgo cardiovascular.
Los datos clínicos apoyan la seguridad y la eficacia de una combinación de estatinas con otros fármacos hipolipemiantes, tales como el fenofibrato. Los pacientes con hipertrigliceridemia y HDL bajo son los que más se pueden beneficiar de esta combinación. En estos pacientes con dislipidemia aterogénica la consecución del objetivo terapéutico en la fracción de colesterol-no-HDL se transforma en una prioridad, dado que el colesterol-no-HDL se considera una medida más precisa que el cLDL para valorar el riesgo cardiovascular.
LDLc levels are associated with increase of cardiovascular risk, and statins are currently used for their control. Nevertheless, a despite of LDLc levels at goal, a residual risk is persistent, commonly associated with persistent lipids modifications (high triglycerides and low HDLc). So, it is necessary to evaluate triglycerides and HDL to assessment cardiovascular risk.
Clinical data are consistent with efficacy and safety of combination therapy with statin and other lipid lowering drugs, for instance fenofibrate. Patients with hipertriglyceridemia and low HDLc are the group with most potential improve. In that patients with atherogenic dyslipidemia, the target for therapeutic objectives related with non-HDL-cholesterol is a priority, because non-HDL-cholesterol is considered as a more accuracy measure to assessment cardiovascular risk.
La dislipidemia no-LDL-dependiente (hipertrigliceridemia con o sin HDL bajo asociado) es un problema que se encuentra infratratado en nuestro medio, pero su control es ineludible a la hora de reducir el riesgo cardiovascular1. Además, la dislipidemia aterogénica constituye una parte importante del riesgo residual de origen lipídico en los pacientes tratados con estatinas2.
Un grupo de expertos en dislipidemias y riesgo cardiovascular ha participado en un proceso de debate y discusión sobre las evidencias que soportan el riesgo cardiovascular asociado a la dislipidemia aterogénica, así como aquellas que apoyan el empleo de un tratamiento combinado estatina-fenofibrato para un correcto manejo farmacológico. Las conclusiones de este grupo se han publicado recientemente, y constituyen una revisión sobre el problema y un consenso sobre los principales puntos que se han debatido3.
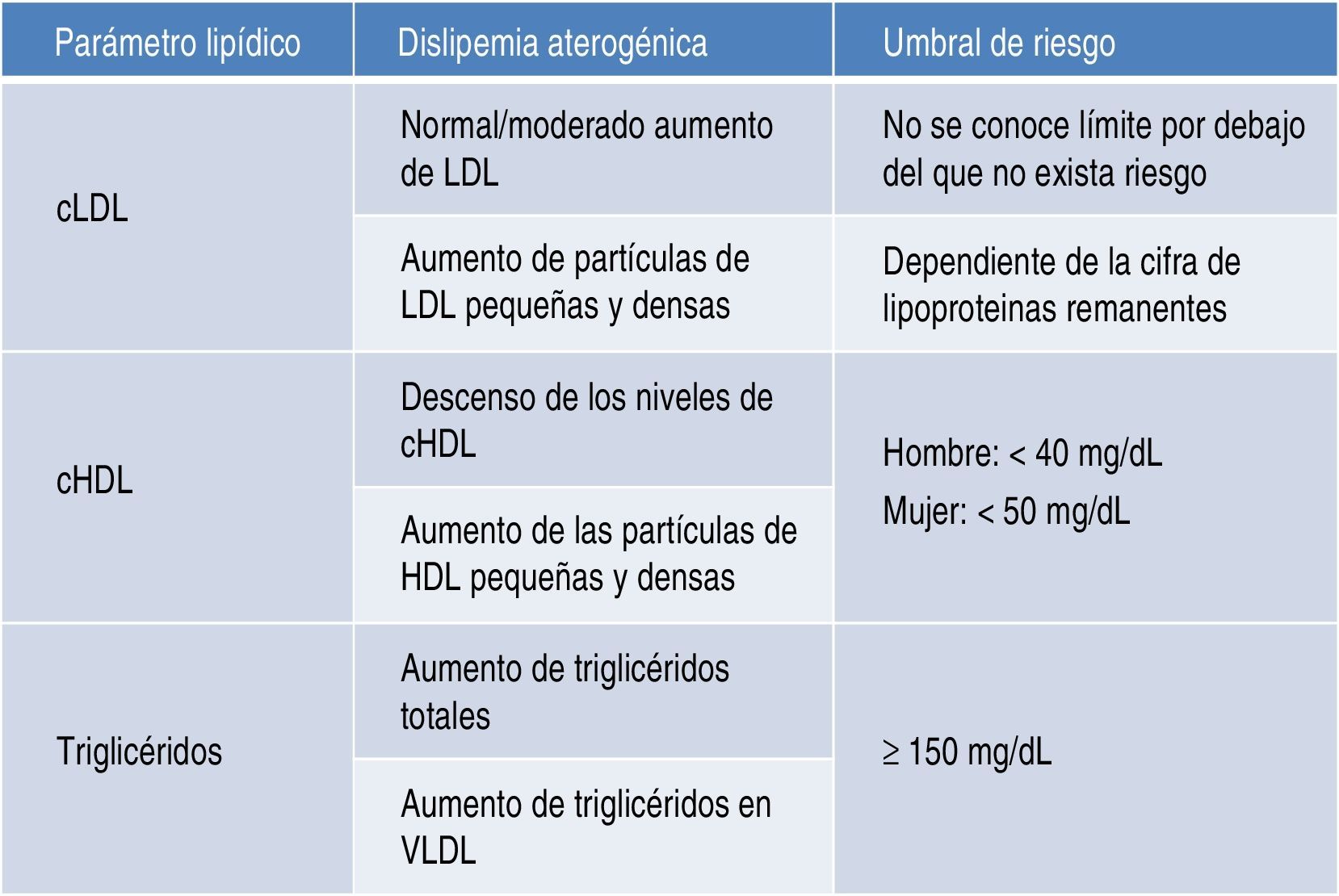
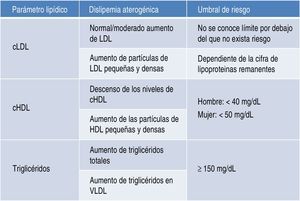
Riesgo cardiovascular asociadoDislipidemia aterogénicaLa dislipidemia aterogénica se caracteriza por un incremento de los niveles de triglicéridos totales y de triglicéridos unidos a lipoproteínas de muy baja densidad (VLDL), descenso de los niveles de lipoproteínas de alta densidad (HDL), y niveles de lipoproteínas de alta densidad (LDL) normales o solo moderadamente elevados (fig. 1). Las partículas de LDL son más pequeñas y densas de lo que son habitualmente, con un elevado potencial aterogénico. Las partículas de HDL son, asimismo, pequeñas y densas4,5.
La dislipidemia aterogénica es muy frecuente como dislipidemia residual en pacientes tratados con estatinas6,7, y se encuentra notablemente infratratada8.
Alteraciones lipídicas y riesgo macrovascularSon numerosísimas las evidencias que demuestran la asociación entre niveles elevados de colesterol LDL (cLDL) con el incremento de riesgo cardiovascular, y esto incluye evidencias epidemiológicas, de asociación genética y sobre los beneficios observables con el tratamiento de dicha dislipidemia9,10.
Sin embargo, comprender la asociación entre el incremento de riesgo cardiovascular con el HDL bajo o la hipertrigliceridemia tiene una mayor complejidad, a pesar de que no existen dudas sobre dicha asociación tanto en la enfermedad coronaria como en la cerebrovascular11,12.
La molécula de HDL es muy heterogénea en términos de propiedades fisicoquímicas tales como tamaño, densidad, composición o apolipoproteínas constituyentes. De hecho, sus funciones van más allá del simple transporte reverso de colesterol y alcanza a efectos antioxidantes, antiinflamatorios, vasodilatadores, inmunomoduladores o citoprotectores13,14. No obstante, es clara la asociación de HDL bajo (sobre todo si es inferior a 35mg/dl) con un aumento del riesgo vascular en pacientes tratados con estatinas según se constata en importantes metaanálisis, tanto en la población general15 como en los diabéticos16.
Asimismo, en los pacientes tratados con estatinas la existencia de una hipertrigliceridemia se acompaña de una mayor tasa de accidentes cardiovasculares y muerte por este origen17,18, así como de una mayor tasa de recurrencias19. Aún más, cuando la terapia con estatinas es intensiva hasta permitir alcanzar los 70mg/dl de LDL, el efecto beneficioso es menor (reducción de riesgo del 16%) si la cifra de triglicéridos es superior a 150mg/dl, que si es inferior (reducción de riesgo del 26%)18. Además, la hipertrigliceridemia no determinada en ayunas puede servir como marcador de riesgo20.
Como cabe pensar, se ha comprobado que el mayor riesgo de enfermedad coronaria se produce por el efecto sinérgico de los niveles elevados de triglicéridos con descenso de HDL21. Además, de los datos de seguimiento del estudio Framingham se desprende que el mayor riesgo se encuentra cuando coexisten alteraciones en las 3 fracciones lipídicas: población con LDL superior a 130mg/dl, HDL inferior a 40mg/dl y triglicéridos por encima de 150mg/dl22.
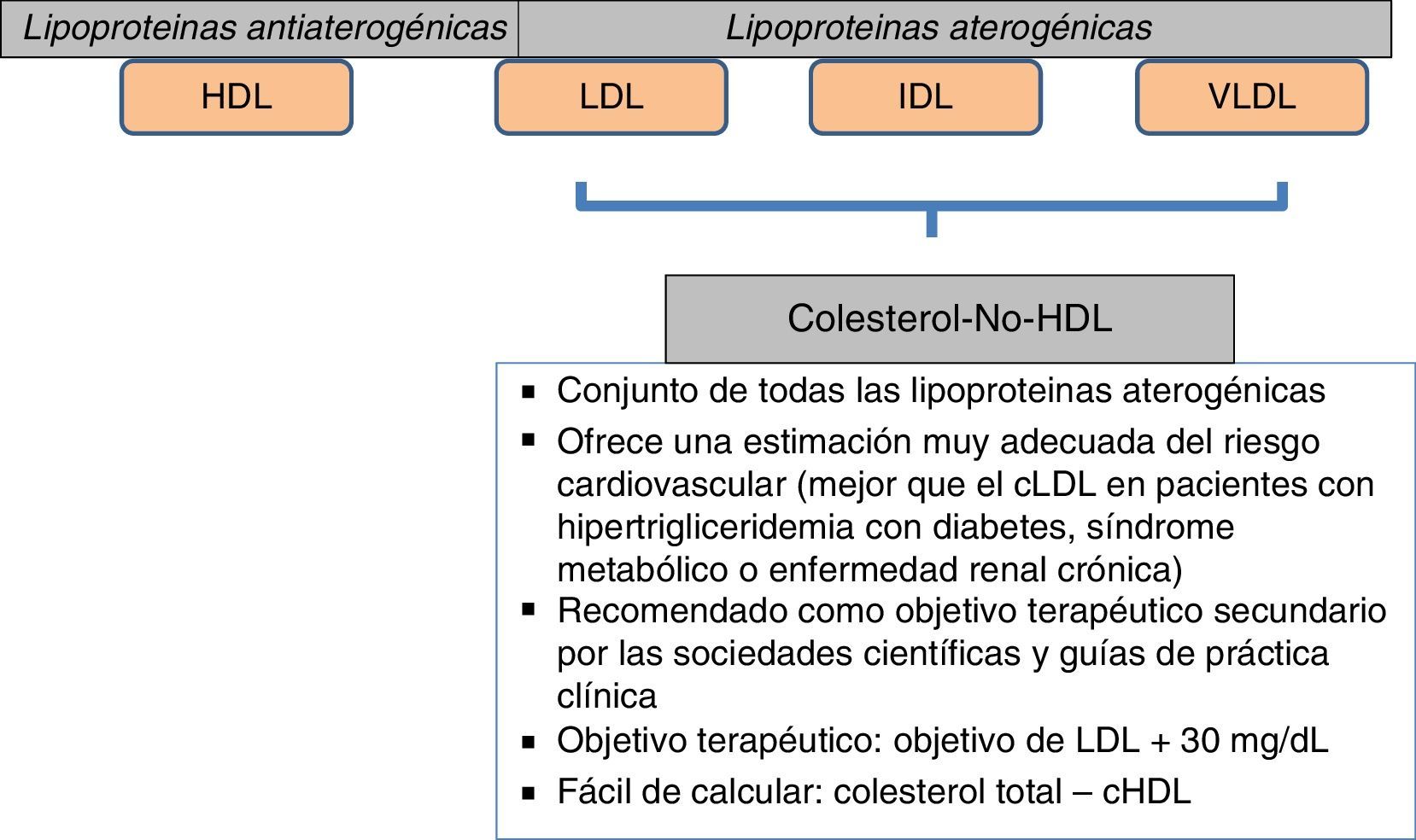
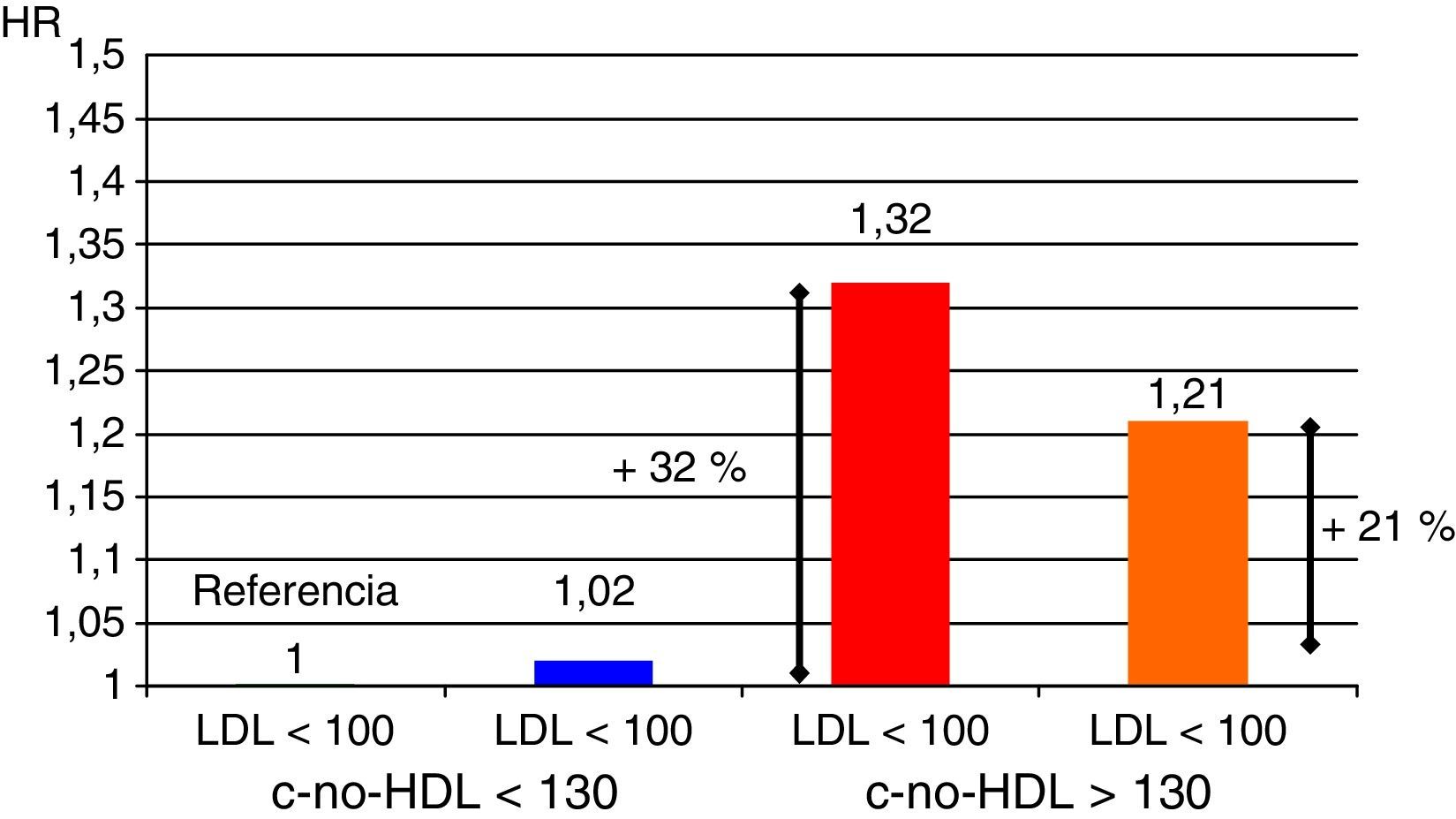
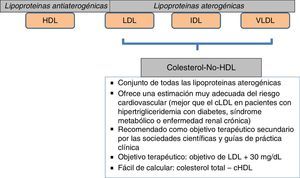
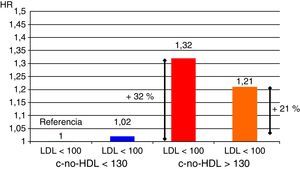
Un aspecto importante a considerar va más allá que la simple cuantificación aislada de triglicéridos o de HDL como factores de riesgo. En este sentido, el conjunto de lipoproteínas remanentes ricas en triglicéridos se ha demostrado como un robusto factor de riesgo cardiovascular; por otra parte, el cálculo de todo el colesterol-no-HDL permite emplear un adecuado objetivo terapéutico. Con respecto al primer grupo, el incremento de riesgo que se le atribuye alcanza a un 37% por cada incremento de 90mg/dl de lipoproteínas remanentes ricas en triglicéridos23,24. En el otro sentido, el colesterol-no-HDL ha sido señalado por la Sociedad Europea de Arteriosclerosis como un objetivo secundario en el tratamiento de las dislipidemias25, calculado como el objetivo de LDL más 30mg/dl. En consecuencia, se marca un objetivo de colesterol-no-HDL de 130mg/dl en todos los pacientes diabéticos en general, y de 100mg/dl en los diabéticos con enfermedad vascular previa, insuficiencia renal, lesión de órganos diana o factores de riesgo adicionales. Habida cuenta que el colesterol-no-HDL señala el conjunto de lipoproteínas aterogénicas, es un marcador particularmente interesante para estimar el riesgo cardiovascular con mayor exactitud en grupos de pacientes con diabetes mellitus, síndrome metabólico o insuficiencia renal crónica (fig. 2). Un muy interesante metaanálisis de trabajos publicados entre 1994 y 200826 demuestra que los enfermos que alcanzan objetivos de LDL pero no de colesterol-no-HDL tienen un incremento de riesgo del 32% en comparación con aquellos que alcanzan ambos objetivos (fig. 3).
Objetivo terapéutico: colesterol-no-HDL. Aumento de riesgo cardiovascular según consecución de objetivos.
Fuente: adaptado de Boekholdt et al.26.
Las complicaciones microvasculares en los pacientes diabéticos, especialmente las derivadas de la nefropatía, retinopatía o neuropatía, son responsables de más del 50% de la discapacidad asociada a la diabetes mellitus tipo227, y también se encuentran relacionadas con la existencia de dislipidemia aterogénica28,29. En consecuencia, esta dislipidemia se ha identificado como un componente del riesgo residual microvascular de origen lipídico30.
Así, el descenso de HDL es un factor pronóstico para el desarrollo de nefropatía (en particular albuminuria de nuevo comienzo)31, y el aumento en el índice triglicéridos/HDL se encuentra relacionado con el riesgo de retinopatía o nefropatía diabética32. En el estudio REALIST-micro, llevado a cabo en 13 países, los niveles elevados de triglicéridos y el descenso de HDL se asocian significativamente y de forma independiente a las complicaciones microvasculares, particularmente las renales33. La asociación epidemiológica con la neuropatía es menos consistente34. Estos hallazgos son consistentes con el beneficio observado con un abordaje multifactorial (presión arterial, glucemia y dislipidemia) en los pacientes con diabetes mellitus tipo2, en los que se puede comprobar un beneficio no solo macrovascular con disminución del riesgo en un 53%, sino también microvascular, con descensos del riesgo del 61% para nefropatía, del 58% para retinopatía y del 63% para neuropatía35.
TratamientoTerapia de primera línea para la dislipidemiaLos datos de los más importantes metaanálisis sobre el beneficio observado en los estudios de intervención con estatinas señalan que al cabo de los 5años no solo se produce una reducción del 21% de accidentes vasculares mayores, sino que también se reduce la mortalidad coronaria, la de origen cardiovascular en general e, incluso, la mortalidad por todas las causas15. En pacientes con diabetes mellitus tipo2, un metaanálisis de 14 estudios demuestra que por cada mmol/l (aproximadamente 40mg/dl) de reducción de LDL se reduce la mortalidad coronaria en un 22%, la mortalidad de origen vascular en un 13% y la mortalidad total en un 9%16.
Más recientemente se ha constatado que el descenso adicional de LDL mediante terapia combinada con fármacos hipocolesterolemiantes (ezetimiba asociada a estatina) cuando se emplea después de un síndrome coronario agudo se acompaña de un descenso adicional del 24% en la concentración de LDL, y de una mejoría significativa en el objetivo clínico compuesto por infarto de miocardio, angina inestable, revascularización, ictus o muerte de origen cardiovascular35.
Sin embargo, aun en condiciones estándar, o incluso óptimas, de tratamiento hipocolesterolemiante, persiste un riesgo inaceptablemente elevado de padecer accidentes cardiovasculares, y la dislipidemia aterogénica se ha reconocido como un elemento determinante entre los que contribuyen a este riesgo residual2. En este sentido, una estrategia que se ha demostrado útil ha sido la terapia combinada hipolipemiante, asociando una estatina frente a la hipercolesterolemia, con un fibrato frente a la dislipidemia aterogénica36.
En suma, la terapia combinada se nos presenta como un instrumento útil para conseguir un mayor efecto hipocolesterolemiante, o para conseguir un abordaje global de la dislipidemia LDL y no-LDL dependiente. Son estrategias más agresivas, pero con resultados esperanzadores para reducir el riesgo cardiovascular36,37, del mismo modo que lo estamos comprobando con la terapia combinada de fármacos hipotensores con diferentes mecanismos de acción, lo que logra mejorar el tratamiento y control de otro factor de riesgo fundamental como es la hipertensión arterial. Adicionalmente hemos de considerar el posible beneficio sobre la adherencia terapéutica que se pueda obtener cuando se emplea una combinación a dosis fija en un solo comprimido, teniendo en cuenta que mejorar la adherencia se acompaña de una reducción adicional de riesgo de mortalidad cardiovascular38.
Fenofibrato en la reducción del riesgo cardiovascularEl fenofibrato índice distintas modificaciones del metabolismo lipídico, principalmente por cambios en la expresividad de diferentes genes. Son las fundamentales: reducción de los triglicéridos, aumento de HDL y reducción de las partículas LDL pequeñas y densas39.
En consecuencia, el fenofibrato asociado a una estatina, cuando se emplea en pacientes con hiperlipidemia combinada, como el caso del estudio SAFARI40, es capaz de ofrecer un beneficio global en el perfil lipídico, que ya es posible constatar a las 4 semanas de tratamiento: reducciones significativas de colesterol total, de LDL, triglicéridos y apoB, con aumento de HDL y de apoA1, a lo que se une el descenso del colesterol-no-HDL y de la proporción de partículas de LDL pequeñas y densas.
En los pacientes con diabetes mellitus, las evidencias disponibles proceden del estudio FIELD41. Los pacientes diabéticos fueron tratados con fenofibrato siempre y cuando tuvieran cifras de triglicéridos superiores a 150mg/dl, y aunque no se obtuvo una reducción significativa de la mortalidad cardiovascular (reducción del 11%), se demostró una reducción relativa de infarto de miocardio no fatal del 24%. Otro hallazgo trascendente fue que el tratamiento con fenofibrato (ajustado al eventual empleo de estatina) resultó clínicamente eficaz para reducir conjuntamente la muerte cardiovascular, el infarto de miocardio y la necesidad de revascularización en un 14% cuando el HDL era inferior a 40mg/dl, un 13% cuando los triglicéridos eran superiores a 200mg/dl y un 27% cuando estaban presentes ambas anomalías lipídicas.
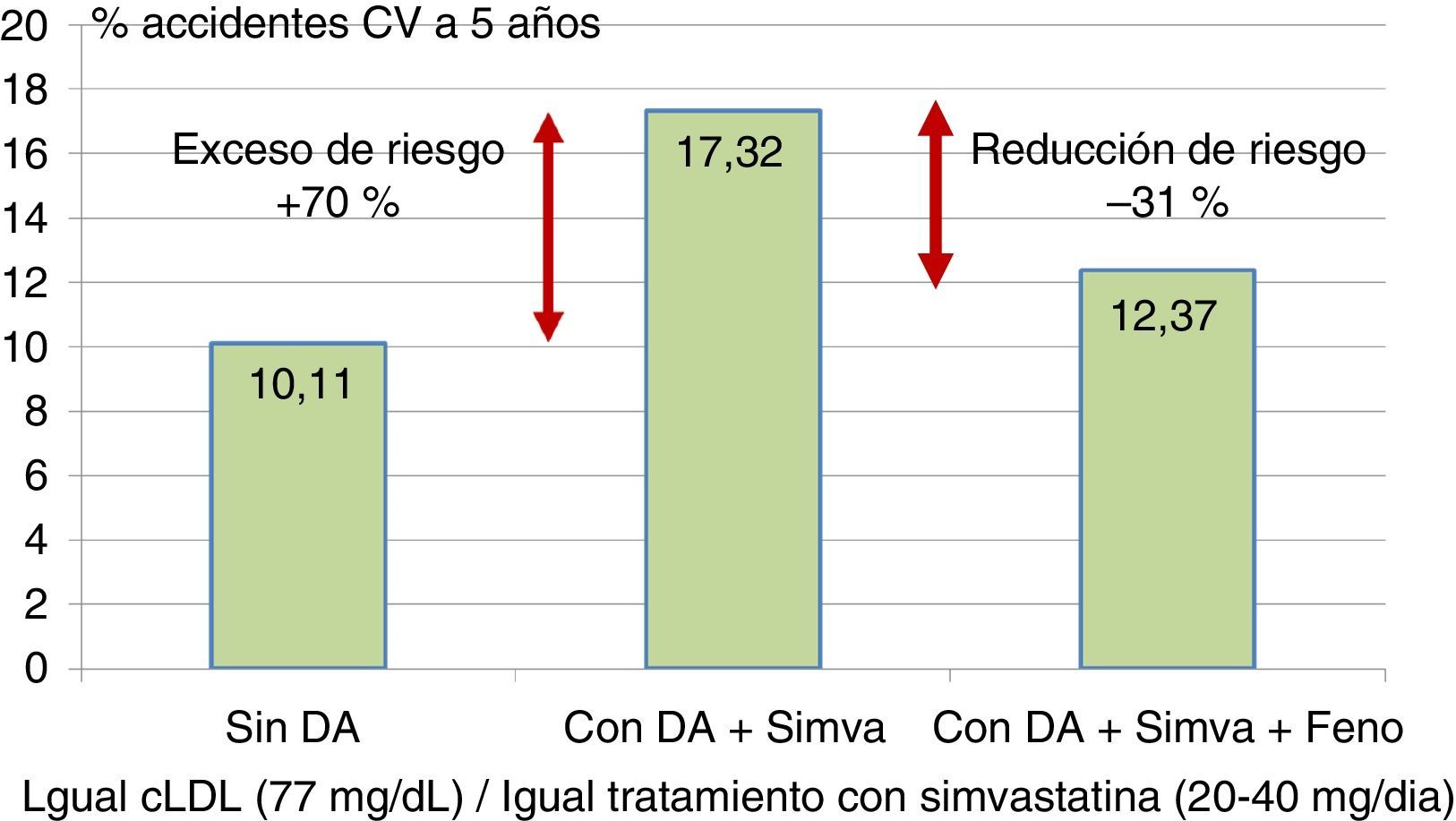
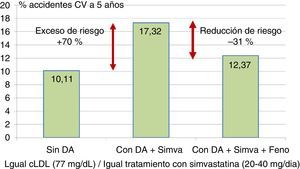
El estudio ACCORD supuso otro hito en el empleo del fenofibrato en los pacientes diabéticos. Fueron tratados con una combinación de fenofibrato y simvastatina o con la estatina sola en monoterapia42. En conjunto, la reducción adicional de riesgo relativo de accidentes cardiovasculares (coronarios o cerebrovasculares) o de muerte de origen vascular debida a la asociación terapéutica resultó del 8%. Sin embargo, en los pacientes con triglicéridos por encima de 200mg/dl y HDL inferior a 35mg/dl, la reducción de riesgo de mortalidad cardiovascular, infarto o ictus alcanzó el 31%, necesitando tratar solo 20 individuos para evitar un episodio. De esta forma, el exceso de riesgo del 71% que en el estudio ACCORD se puede atribuir a la presencia de la dislipidemia aterogénica, se puede reducir casi a la mitad empleando fenofibrato asociado a la estatina (fig. 4).
Por tanto, no disponemos de datos de que el fenofibrato reduzca el riesgo cardiovascular empleado indiscriminadamente en la población en general, pero su empleo está indicado en los pacientes con dislipidemia aterogénica o con alguno de sus elementos, porque resulta eficaz para reducir los accidentes cardiovasculares. Esto ha sido ratificado en un metaanálisis de los principales estudios con fibratos, en el que se demuestra la reducción del riesgo de accidentes coronarios del 35% en los pacientes con dislipidemia aterogénica43. Y esta evidencia se ha incorporado a las guías de práctica clínica más adecuadas a nuestro medio, tanto de origen europeo44 como nacional45, y a las recomendaciones de la agencia europea del medicamento (EMA)46.
Seguridad de la terapia combinada fenofibrato-estatinaEl fenofibrato no tiene influencia en el metabolismo y la farmacocinética de las estatinas, mientras que otros fibratos, como el gemfibrocilo, sí la tienen, por lo que en este caso se puede producir aumento de la concentración plasmática de estatina y un riesgo adicional de miotoxicidad47. Por el contrario, la asociación de fenofibrato y estatina se ha mostrado segura en todos los ensayos que incluyen un gran número de pacientes y/o un gran periodo de tiempo de tratamiento.
Además, los efectos de la asociación fenofibrato-estatina sobre la elevación enzimática de enzimas musculares y/o hepáticas, o sobre el aumento transitorio de la creatinina, no difieren de lo observado en régimen de monoterapia, y así es comprobable la reversibilidad de los efectos48,49.
Por el contrario, se han detectado 2 posibles efectos beneficiosos de la asociación fenofibrato-estatina, al margen de los resultados clínicos sobre las complicaciones cardiovasculares. El primero de ellos se relaciona con una menor pérdida anual de la tasa de filtrado glomerular, particularmente en los casos de mayor hipertrigliceridemia, hallazgo del estudio FIELD48, y con una mayor reducción en la progresión de la albuminuria, lo que ha sido un hallazgo común en FIELD y ACCORD48,50. El segundo hecho beneficioso es un potencial efecto favorable sobre el metabolismo de los hidratos de carbono, muy especialmente en los enfermos con síndrome metabólico51; y dado que es conocido el efecto diabetógeno de las estatinas52, este efecto mitigador de la capacidad hiperglucemiante de la estatina debería de ser considerado como un beneficio adicional.
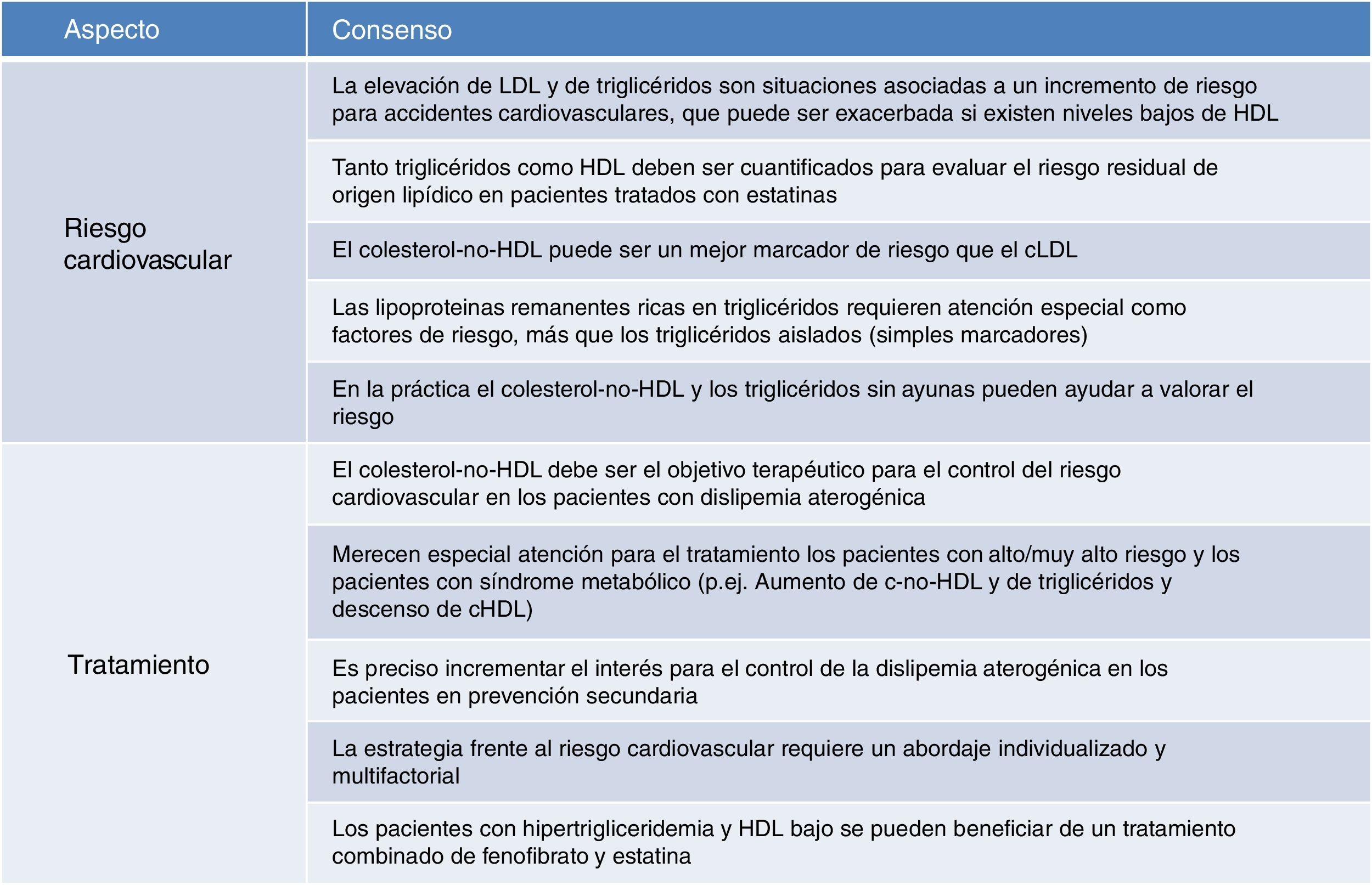
Puntos de consensoA la vista de los datos disponibles y de las evidencias más importantes señaladas, los puntos de consenso del panel europeo de expertos acerca de la dislipidemia aterogénica se refieren, fundamentalmente, a su relación estrecha con el riesgo cardiovascular y al tratamiento del proceso cuando está presente.
No obstante, cabe señalar algunas consideraciones generales previas:
- •
La importancia de un esfuerzo adicional de investigación para conocer en profundidad algunos aspectos fisiopatológicos todavía pendientes.
- •
La conveniencia de simplificar la definición de dislipidemia aterogénica al objeto de hacerla más prácticamente reconocible.
Con respecto al riesgo cardiovascular asociado a la dislipidemia aterogénica, los puntos clave del consenso son:
- •
Al margen del papel del cLDL como factor de riesgo, es inequívoco el papel que juega la hipertrigliceridemia, que además resulta exacerbado en presencia de niveles elevados de LDL o bajos de HDL. Es uno de los elementos clave del riesgo residual de origen lipídico.
- •
En consecuencia, para evaluar el riesgo cardiovascular de este origen es imprescindible la determinación de triglicéridos y de HDL, por cuanto aunque muy frecuentemente la asociación hipertrigliceridemia+HDL bajo caminan juntas, se puede presentar cada anomalía en solitario.
- •
Los marcadores más prácticos para valorar el riesgo atribuible a la dislipidemia aterogénica son el cálculo del colesterol-no-HDL (que se comporta de forma similar o incluso mejor que el cLDL) y los triglicéridos no en ayunas (como un marcador de lipoproteínas remanentes ricas en triglicéridos).
- •
En consonancia con lo anterior, el colesterol-no-HDL es el objetivo terapéutico más acertado para el control del riego cardiovascular en pacientes con dislipidemia aterogénica. Se le reconoce como un objetivo secundario que ofrece una buena correlación con apoB (un marcador idóneo pero con falta de disponibilidad generalizada para un empleo rutinario), y que se calcula fácilmente, sin coste adicional, y con gran estabilidad para calcular el riesgo.
Finalmente, con respecto al tratamiento, el panel europeo de expertos señala los siguientes puntos de consenso:
- •
Los estudios observacionales y a largo plazo demuestran la seguridad y la eficacia clínica de la combinación de estatinas con otros fármacos hipolipemiantes al objeto de realizar un control más intensivo del factor de riesgo lipídico.
- •
En este sentido, los pacientes con hipertrigliceridemia y HDL bajo se benefician de la terapia combinada de estatina con fenofibrato.
- •
Las guías de práctica clínica y la Agencia Europea del Medicamento (EMA) señala al fenofibrato para el tratamiento de hiperlipidemia mixta junto a una estatina cuando los triglicéridos y el cHDL no se encuentran adecuadamente controlados.
- •
Las evidencias sobre el beneficio clínico y la seguridad de la asociación estatina+fenofibrato son robustas, y no está justificado emplear un régimen distinto al habitual (una dosis diaria) salvo en problemas de tolerancia.
En la figura 5 se recoge un resumen de los aspectos más destacados.
Panel europeo:
Carlos Aguiar, Eduardo Alegría, Ricardo C. Bonnadonna, Alberico L. Catapano, Francesco Consentido, Moses Elisaf, Michel Farnier, Jean Fierrières, Pasquale Perronre Filardi, Nicolae Hancu, Meral Kayikcioglu, Alberto Mello e Silva, Jesús Millán, Zeljko Reiner, Lale Tokgozoglu, Paul Valensi, Margas Viigimaa, Michal Vrablik, Alberto Zambón, José Luis Zamorano, Roberto Ferrari
Adaptación española:
Jesús Millán, Mariano Blasco, Ángel Brea, Ángel Díaz, Pedro Gonzáles Santos, Antonio Hernández Mijares, Teresa Mantilla, Juan Pedro-Botet, Xavier Pintó