A lo largo de más de un siglo, las investigaciones han demostrado que la arteriosclerosis más que un proceso infiltrativo o trombogénico es un proceso inflamatorio. Se ha demostrado epidemiológicamente y mediante técnicas de imagen que las enfermedades inflamatorias sistémicas (especialmente, pero no exclusivamente, la artritis reumatoide y el lupus eritematoso sistémico) aumentan el proceso arteriosclerótico, lo cual tiene base fisiopatológica demostrada. Además, los tratamientos para controlar las enfermedades inflamatorias pueden modificar el curso del proceso aterosclerótico. Aunque todavía no hay escalas específicas validadas para valoración del riesgo cardiovascular en los pacientes con estas enfermedades, su riesgo cardiovascular es elevado. Se están desarrollando varias escalas de riesgo específicas, considerando factores propios como el grado de actividad inflamatoria.
More than a century of research has shown that atherosclerosis is an inflammatory process more than an infiltrative or thrombogenic process. It has been demonstrated epidemiologically and by imaging techniques, that systemic inflammatory diseases (in particular, but not exclusively, rheumatoid arthritis and systemic lupus erythematosus) increase the atherosclerotic process, and has a demonstrated pathophysiological basis. Furthermore, treatments to control inflammatory diseases can modify the course of the atherosclerotic process. Although there are no specific scales for assessing cardiovascular risk in patients with these diseases, cardiovascular risk is high. A number of specific risk scales are being developed, that take into account specific factors such as the degree of inflammatory activity.
Las enfermedades autoinmunes sistémicas se consideran entidades con aumento del riesgo cardiovascular arteriosclerótico y/o trombótico, de tal forma que han suscitado la atención de la comunidad científica hasta ser incluidas en distintas guías de prevención cardiovascular. La Guía Europea sobre Prevención de la Enfermedad Cardiovascular en la Práctica Clínica del año 20121 dedica un apartado a las enfermedades autoinmunitarias, en concreto, a la psoriasis, la artritis reumatoide y el lupus eritematoso. La Guía de la ESC/EAS sobre el manejo de las dislipidemias del año 20112 también hace referencia a las enfermedades autoinmunitarias y establece que «Las enfermedades autoinmunitarias, como artritis reumatoide, lupus eritematoso sistémico (LES), psoriasis y síndrome antifosfolipídico, se caracterizan por mayor frecuencia de aterosclerosis y, consecuentemente, mayor tasa de morbimortalidad cardiovascular que en la población general>>. Las guías americanas de prevención primaria y secundaria de ictus hacen referencia a estos estados inflamatorios, considerando que los pacientes con artritis reumatoide o LES tienen un nivel de riesgo de sufrir un ictus aumentado3.
Vamos a revisar las interrelaciones entre la enfermedad arteriosclerótica y las enfermedades inflamatorias sistémicas en 4 apartados: patogenia de la arteriosclerosis, patogenia de la enfermedad autoinmunitaria, relaciones entre fármacos antiinflamatorios y riesgo cardiovascular, y valoración del riesgo cardiovascular.
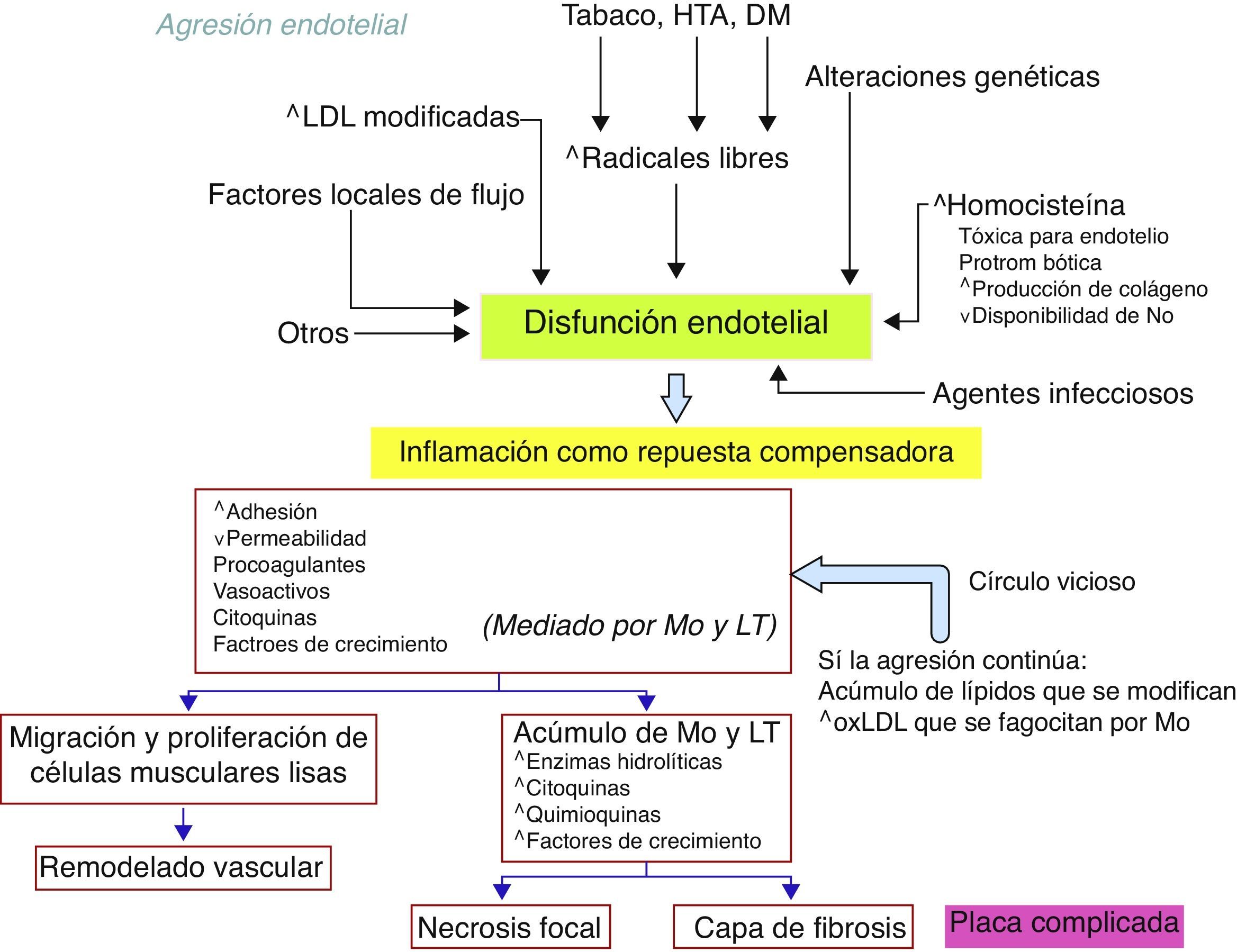
Patogenia de la enfermedad cardiovascular ateroscleróticaLos hallazgos histológicos de la aterosclerosis se conocen desde hace más de un siglo, pero la interpretación de los mismos ha sido diferente. En el siglo xix, los patólogos C. von Rokitansky and R. Virchow ya vieron los cambios celulares inflamatorios. Pero mientras que el primero consideró que tales cambios eran secundarios a las alteraciones inducidas por la fibrina (teoría incrustativa o trombogénica), el segundo consideró que la acumulación de componentes plasmáticos y de lípidos en la íntima era un proceso primario que ocasionaba inflamación (teoría infiltrativa o de la «endoarteritis deformans»)4. No obstante, la teoría de Virchow ha sido completada en el siglo xx con la teoría inflamatoria de Ross, donde la disfunción endotelial y el proceso inflamatorio van unidos debido al acúmulo de lípidos y macrófagos5-7.
No pretendemos hacer una revisión en profundidad de la patogenia, ya que es un tema tratado en otros artículos adecuadamente, pero sí recordar los 4 grupos de actores principales de la aterosclerosis: las estructuras, las células, las moléculas de adhesión y receptores y los factores químicos8.
Las estructuras que participan en la aterosclerosis pertenecen a la pared vascular, donde el endotelio de la íntima tiene el papel protagonista, pero sin olvidar a la media muscular, cuyas células musculares van a proliferar y migrar a la íntima, ni a la adventicia, que interviene de forma importante en el componente inflamatorio de la pared vascular en la aterosclerosis. La matriz de la íntima constituye un campo de batalla donde distintos factores químicos y células orquestan los ataques y las defensas en el proceso arteriosclerótico.
Las células endoteliales van a interaccionar con otras células (monocitos, linfocitos, plaquetas y células musculares lisas principalmente) gracias a las moléculas de adhesión y los ligandos o receptores (selectinas E, P y L, ICAM-1, ICAM-2, VCAM-1, VLA-4, LFA-1, MAC-1, Gp-Ib, Gp-IIb/IIIa…)9.
Finalmente, multitud de factores químicos van a mediar las interacciones celulares, las lesiones celulares, la degradación de la matriz de la íntima y la toxicidad directa o indirecta10. Las partículas LDL oxidadas y modificadas desempeñan un papel principal dentro de los agentes químicos, ya que van a ser procesadas por los macrófagos locales favoreciendo la liberación de quimiocinas, pero también especies radiales libres van a mediar la inflamación local, así como distintas quimiocinas e interleucinas (IL-1, IL-6, IL-10, TNF-alfa, interferón gamma…). La inhibición de la producción de óxido nítrico es otro elemento lesivo. Varios factores de crecimiento (factor de crecimiento transformador-beta, factor estimulante de colonias de macrófagos…) van a favorecer la proliferación de las células musculares lisas y de leucocitos, y su migración a la íntima para contribuir al remodelado vascular y constituir la placa ateromatosa. Enzimas hidrolíticas (metaloproteinasas, colagenasas, cisteinproteinasas…) van a degradar la matriz intimal favoreciendo el cambio estructural. Factores de coagulación activados por el contacto de las estructuras alteradas (lesión del endotelio, exposición de proteínas de la matriz, partículas LDL oxidadas…) ocasionarán la trombogénesis local que en un intento reparador puede constituir la trombosis local o la génesis de embolia de material aterotrombótico.
La disfunción endotelial va a ocasionar una inflamación como respuesta compensadora, generando un círculo vicioso con inmunodesequilibrio, cuyo resultado es la placa aterosclerótica constituida por un corazón lipídico, un acúmulo de células principalmente musculares lisas y diversas clases de leucocitos, un depósito de calcio y un proceso trombótico. Este proceso continuo va desde la lesión inicial o estría lipídica hasta la lesión final de placa complicada (fig. 1).
El papel que puedan desempeñar determinados agentes infecciosos (Chlamydia, Helicobacter, virus del grupo herpes…) en la patogenia de la aterosclerosis no está claro11. La identificación de antígenos de microorganismos en las placas ateroscleróticas o el aumento del título de anticuerpos frente a diversos antígenos no implica que el agente infeccioso sea el causante o iniciador del proceso ateroscleróticos. Los ensayos con tratamientos específicos no han revertido o frenado el proceso arteriosclerótico. No obstante, es posible que no sea necesaria la identificación de los antígenos en la propia placa aterosclerótica y sea el componente inflamatorio crónico el que favorezca y potencie la aterosclerosis, como ocurre en otras infecciones crónicas como la del VIH y el virus de la hepatitis C12. La supresión de los tratamientos altamente eficaces frente al VIH ocasiona un aumento de la mortalidad total y cardiovascular, y de marcadores inflamatorios13,14.
Patogenia de las enfermedades inflamatorias sistémicasUna vez revisada la patogenia de la arteriosclerosis y establecida la base inflamatoria de su origen, es fácil entender que la patogenia de las enfermedades inflamatorias sistémicas y de la aterosclerosis comparten gran cantidad de mecanismos15,16. No obstante, hay diferencias en algunos de los procesos implicados o en el determinante que inicia el desarrollo de los acontecimientos.
En la artritis reumatoide, al igual que en la aterosclerosis, hay activación de macrófagos, células cebadas y linfocitos T y aumento de expresión de TNF-alfa, metaloproteinasa, IL-6, moléculas de adhesión y otros factores15,16. No obstante, los desencadenantes pueden ser diferentes. En lugar de partículas LDL-oxidadas, en la artritis reumatoide pueden ser antígenos del cartílago o del colágeno o agentes infecciosos los causantes de la enfermedad. En cualquier caso, la actividad inflamatoria de la artritis reumatoide no solo afecta a los vasos locales, sino que los mediadores solubles de la inflamación por vía sanguínea afectan a todos los vasos favoreciendo la aterosclerosis.
En el LES, los factores de riesgo cardiovascular clásicos no explican el aumento de riesgo cardiovascular de los pacientes, por lo que factores dependientes del lupus y/o de su tratamiento deben explicar ese exceso de riesgo16,17. El grado de actividad inflamatoria del lupus medido mediante la escala Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) se ha relacionado con el aumento del riesgo cardiovascular.
Además, el 30-40% de los pacientes con LES tienen anticuerpos antifosfolípidos y el LES es la principal causa del síndrome antifosfolipídico (SAF) secundario. En el SAF existe un riesgo aumentado de trombosis de predominio en territorio venoso, pero la relación directa entre anticuerpos antifosfolípidos y la trombosis no está clara.
No todas las enfermedades autoinmunitarias inflamatorias sistémicas comparten la misma patogenia. Hay entidades con mecanismos particulares. Como ejemplo, podemos señalar que en la esclerosis sistémica existe una afectación vascular isquémica no mediada por aterotrombosis, sino por fibrosis con hipertrofia de la íntima y de la media que ocasiona disfunción orgánica e isquemia.
Con todo lo expuesto, podemos señalar algunos hechos objetivos en referencia a las interrelaciones entre enfermedad cardiovascular y enfermedades inflamatorias sistémicas.
Diversos estudios epidemiológicos confirman que las enfermedades inflamatorias sistémicas aceleran la arteriosclerosis.
Los pacientes con LES tienen más eventos cardiovasculares, con una OR de 2 que puede llegar a 50 en mujeres de mediana edad de 35 a 44 años18.
Se ha objetivado mediante ecografía carotídea que los pacientes con artritis reumatoide o con LES tienen mayor prevalencia de placas ateroscleróticas en carótidas (44% y 45%) que los sujetos control (15%) y esa tendencia se demuestra en cualquier década de edad19.
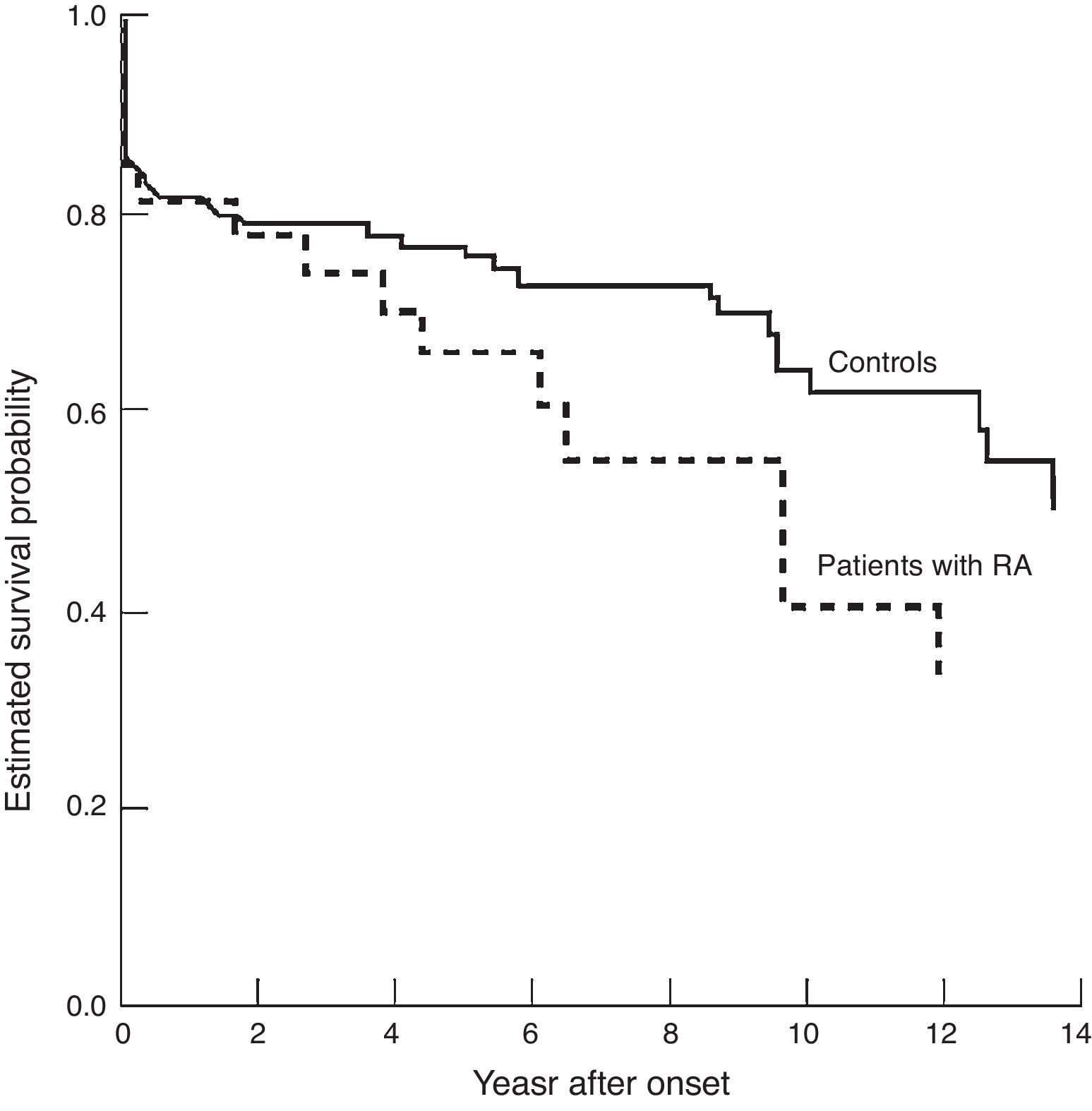
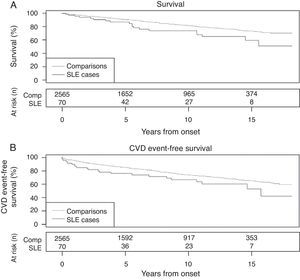
Los pacientes con LES tienen más eventos cardiovasculares en los 2 años previos a la presentación del LES que los sujetos sin LES a la misma edad (OR 3,8) y además tienen menos supervivencia libre de eventos (riesgo de mortalidad: HR=1,9)20 (fig. 2).
Supervivencia en pacientes con lupus eritematoso sistémico y controles emparejados por edad y sexo. A) Muerte por cualquier causa. B) Muerte o evento cardiovascular.
Tomado de Bartels et al.20.
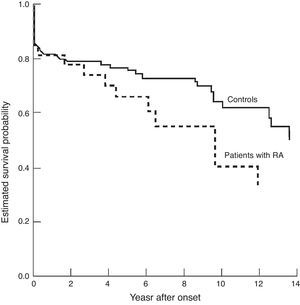
Los pacientes con artritis reumatoide tienen más infartos (HR 2,9) y con peor pronóstico, más fatalidad (HR 1,67), que los sujetos sin artritis reumatoide21 (fig. 3).
Supervivencia después de un infarto agudo de miocardio en pacientes con y sin artritis reumatoide.
Tomado de Södergren et al.21.
Las enfermedades inflamatorias sistémicas tienen más eventos cardiovasculares que la población general por la patogenia de su enfermedad, pero también los tratamientos empleados para su control pueden alterar el perfil de riesgo cardiovascular16,22.
Los corticoides tienen efecto antiinflamatorio, por lo que podrían disminuir el riesgo cardiovascular de los pacientes pero tienen efectos metabólicos bien conocidos desfavorables, por lo que el resultado global es generalmente desfavorable, especialmente a altas dosis23. Los glucocorticoides elevan la glucemia, deterioran el perfil lipídico e incrementan la presión arterial, con retención de agua y sal, además de otros efectos no relacionados directamente con el riesgo cardiovascular (facilitan las infecciones, ocasionan osteoporosis…), por lo que siempre se ha de intentar conseguir el control inflamatorio con la mínima dosis eficaz o incluso asociar o sustituirlos por otros agentes antiinflamatorios.
Los antiinflamatorios no esteroideos (AINE) también tienen efectos secundarios perjudiciales desde el punto de vista cardiovascular. Además de poder ser nefrotóxicos, pueden producir retención hidrosalina y elevar la presión arterial. Además, pueden interferir en el papel protector del ácido acetilsalicílico a dosis bajas. Aumentan el riesgo cardiovascular, como se ha demostrado en varios metaanálisis que incluyen tanto los COX-2 selectivos como los no selectivos24,25 y han sido objeto de aviso por parte de las agencias internacionales de medicamentos26. Entre los COX-2 selectivos, el que menos riesgo cardiovascular ocasiona es celecoxib, que utilizado correctamente en pacientes seleccionados presenta un beneficio supera al riesgo según la Food and Drug Administration. Considerando todos los AINE, el que tiene mejor perfil cardiovascular es el naproxeno25, aunque su riesgo hemorrágico es mayor que otros.
Respecto a los inmunosupresores, no todos se comportan de forma similar. Las mayores evidencias existentes hacen referencia a la hidroxicloroquina, y hay datos controvertidos con otros agentes. La hidroxicloroquina mejora el perfil metabólico27. En un metaanálisis se demuestra el beneficio cardiovascular total y de riesgo de infarto de miocardio del metotrexato28. En un estudio con pacientes postrasplantados de riñón con diabetes, el micofenolato mofetilo disminuyó la mortalidad cardiovascular comparado con azatioprina29. Respecto de los diversos anticuerpos monoclonales, no hay datos consistentes.
En conclusión, debemos señalar que cuando debemos utilizar antiinflamatorios o inmunosupresores, debemos valorar el riesgo cardiovascular y emplear los de mejor perfil, y si es necesario emplear corticoides o AINE, habrá que utilizar las dosis más bajas posibles.
Desde un punto de vista práctico, podemos aconsejar: 1) evitar corticoides y AINE, y si hay que usarlos, hacerlo en la menor dosis y tiempo posible. Desde el punto de vista cardiovascular, a largo plazo, es preferible el naproxeno y, en segundo lugar, celecoxib, aunque el riesgo hemorrágico del naproxeno es importante, y 2) respecto a las terapias inmunosupresoras o inmunomoduladoras, hay evidencia suficiente como para aconsejar a la hidroxicloroquina como de primera elección desde el punto de vista cardiovascular. En un segundo grupo indicaríamos micofenolato mofetilo o el metotrexato. Y hay evidencias desfavorables con azatioprina.
También hay que tener en cuenta, a la hora de elegir tratamientos para el control de los factores de riesgo, la enfermedad inflamatoria y el daño que esta provoca en órganos diana, especialmente el riñón. Por ejemplo, en caso de afectación renal los inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de la angiotensina ii serán fármacos de elección para el control de la presión arterial30. En presencia de fenómeno de Raynaud, debemos evitar los betabloqueantes y utilizar calcioantagonistas31. Si existe hipertensión pulmonar, debemos utilizar diuréticos, análogos de prostaciclina, bosentán o sildenafilo32.
Las estatinas tienen efectos pleiotrópicos independientes de la reducción de los niveles de colesterol, algunos de los cuales consisten en la reducción de marcadores de la inflamación y mejora de la función endotelial. Aunque pudiera ser un efecto de clase farmacológica, hay diferencias entre distintas estatinas. Así, se ha demostrado en un pequeño ensayo clínico comparando atorvastatina 5mg/d (n=73) con pitavastatina 1mg/d (n=73) que, a igual reducción de LDL-colesterol, pitavastatina tiene mejor perfil, reduciendo la insulinorresistencia medida con el índice HOMA-IR y reduciendo en mayor medida los niveles de TNF-alfa y MCP-133. Este efecto pleiotrópico antiinflamatorio se ha comprobado en la clínica con pacientes con artritis reumatoide y lupus. Aunque existen estudios en los que no se aprecia el efecto antiinflamatorio clínico de las estatinas34, existen metaanálisis que sí lo confirman. En concreto, en un metaanálisis con 15 ensayos clínicos (992 pacientes) aleatorizados a recibir estatina o placebo en pacientes con artritis reumatoide se demuestra que en el grupo tratado con estatinas disminuyen los parámetros biológicos de inflamación (VSG, PCR, TNF-alfa, IL-1 e IL-6) y el número de articulaciones inflamadas35. Podemos concluir que las estatinas han de utilizarse para reducir los niveles de colesterol según los criterios de manejo de dislipidemias, pero pueden tener un beneficio añadido por sus efectos pleiotrópicos, pudiendo existir diferencias en estos según las estatinas de forma similar a su diferente potencia hipolipidemiante, sin que ambos efectos sean paralelos. Debemos esperar a disponer de resultados de ensayos clínicos con mayor potencia para responder definitivamente si las estatinas tienen un efecto inmunomodulador o antiinflamatorio con interés clínico.
Valoración del riesgo cardiovascularLa valoración del riesgo cardiovascular es una piedra angular para el tratamiento de los factores de riesgo cardiovascular. El momento de inicio del tratamiento farmacológico de la presión arterial o de los niveles de colesterol depende del nivel de riesgo cardiovascular1,2,30. Además, los objetivos terapéuticos pueden ser diferentes según el nivel de riesgo, especialmente en lo que se refiere al nivel de LDL-colesterol, admitiendo que los sujetos de alto riesgo el nivel óptimo de LDL-colesterol debe ser inferior a 100mg/dl e incluso inferior a 70mg/dl si el riesgo es muy alto1,2.
Valorar el riesgo cardiovascular en los pacientes con enfermedades inflamatorias sistémicas es igualmente necesario e incluso más importante que en la población general por cuanto que, como ya hemos visto, estos pacientes tienen un mayor riesgo.
Tenemos a nuestra disposición varios sistemas para valorar el riesgo cardiovascular, aplicables en prevención primaria en población general. Estos sistemas solo consideran algunos de los factores de riesgo clásicos, por lo que su aplicación en los pacientes con enfermedades inflamatorias sistémicas está limitada.
Actualmente, no hay ningún sistema específico validado en nuestro medio para valorar el riesgo cardiovascular en este tipo de pacientes y que esté incluido en las guías de manejo de los pacientes, pero eso no implica que no debamos valorar su riesgo. Una aproximación inicial sería aplicar las escalas habituales, como la escala SCORE, sabiendo que en este caso estamos infraestimando el riesgo. En esta situación debemos ser conscientes de que el riesgo es mayor. Si el paciente con las escalas habituales es de riesgo alto o muy alto, ya tenemos una primera estimación con clara indicación de intervención farmacológica. La identificación de daño orgánico o ateromatosis mediante eco-Doppler carotídeo o la alteración del índice tobillo-brazo permite situar al sujeto en un nivel de alto riesgo independientemente del riesgo SCORE.
Entre las escalas o sistemas de valoración de riesgo existentes en otros países occidentales podemos mencionar el algoritmo anglosajón QRISK236, que incluye la variable artritis reumatoide como dicotómica (sí/no), sin considerar el grado de actividad inflamatoria. No considera otras enfermedades inflamatorias crónicas y se ha desarrollado sobre población general en prevención primaria con una prevalencia de artritis reumatoide en la muestra estudiada del 0,7%. La HR ajustada para la artritis reumatoide en mujeres es de 1,50 y en varones de 1,38. También incluye el índice de privación social de Townsend37, de difícil aplicación en nuestro medio. Estas características limitan su utilidad.
¿Cómo mejorar la estimación del riesgo en estos pacientes? La respuesta no es fácil y posiblemente haya diferentes criterios, cualquiera de ellos mejor que no valorar el riesgo por ausencia de escalas específicas.
Se acepta por la comunidad científica que los pacientes con enfermedades cardiovasculares tienen un riesgo aumentado. Algunos autores consideran que las enfermedades inflamatorias sistémicas, especialmente artritis reumatoide y lupus eritematoso, son equivalentes de riesgo alto3. Otros autores aconsejan multiplicar por 2 el riesgo calculado con las escalas habituales, lo cual supone aproximadamente aumentar una categoría de riesgo (de bajo a moderado, de moderado a alto y de alto a muy alto).
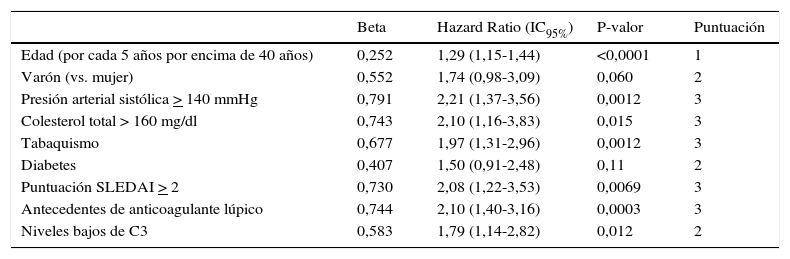
Hay diversas propuestas que tienen en cuenta el tratamiento y el nivel de actividad inflamatoria. El paciente tendría un riesgo alto si está en tratamiento con dosis moderadas o altas de corticoides o inmunosupresores de mal perfil metabólico, o si tiene actividad inflamatoria moderada. En este contexto, el índice SLEDAI-2, que mide la actividad inflamatoria en el lupus, podría identificar a los sujetos de riesgo alto, lo mismo que la presencia de los 3 tipos de anticuerpos antifosfolipídicos (anticoagulante lúpico, anti-B2GPI y anticardiolipina). Existe un modelo no validado de valoración del riesgo cardiovascular en sujetos con LES que, además de edad, género, hipertensión arterial sistólica, hipercolesterolemia, tabaquismo y diabetes, considera la puntuación SLEDAI de 2 o más puntos, la presencia de anticoagulante lúpico y los bajos niveles de C338 (tabla 1).
Ecuación de riesgo cardiovascular en pacientes con lupus
| Beta | Hazard Ratio (IC95%) | P-valor | Puntuación | |
|---|---|---|---|---|
| Edad (por cada 5 años por encima de 40 años) | 0,252 | 1,29 (1,15-1,44) | <0,0001 | 1 |
| Varón (vs. mujer) | 0,552 | 1,74 (0,98-3,09) | 0,060 | 2 |
| Presión arterial sistólica > 140 mmHg | 0,791 | 2,21 (1,37-3,56) | 0,0012 | 3 |
| Colesterol total > 160 mg/dl | 0,743 | 2,10 (1,16-3,83) | 0,015 | 3 |
| Tabaquismo | 0,677 | 1,97 (1,31-2,96) | 0,0012 | 3 |
| Diabetes | 0,407 | 1,50 (0,91-2,48) | 0,11 | 2 |
| Puntuación SLEDAI > 2 | 0,730 | 2,08 (1,22-3,53) | 0,0069 | 3 |
| Antecedentes de anticoagulante lúpico | 0,744 | 2,10 (1,40-3,16) | 0,0003 | 3 |
| Niveles bajos de C3 | 0,583 | 1,79 (1,14-2,82) | 0,012 | 2 |
| Suma de puntos | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Riesgo (%) | 1,3 | 1,6 | 2,1 | 2,6 | 3,4 | 4,3 | 5,5 | 7,0 | 8,9 | 11,3 | 14,2 |
Riesgo de evento cardiovascular en 10 años. Tomado de Petri y Magder38.
La EULAR propone en los pacientes con artritis reumatoide multiplicar por 1,5 el riesgo calculado con las escalas habituales si se cumplen 2 de los 3 criterios siguientes: duración de la enfermedad más de 10 años, positividad del factor reumatoide o de los anticuerpos antipéptido cíclico citrulinado o presencia de manifestaciones extraarticulares39.
La aplicación de estos criterios en una muestra de 201 pacientes consecutivos con artritis reumatoide eleva la proporción de sujetos con riesgo cardiovascular alto según la escala SCORE calibrada a España del 11 al 36,8%40.
Hay diversos sistemas de valoración de la actividad inflamatoria de la artritis reumatoide. En 1993 se desarrolló una escala de valoración de actividad inflamatoria articular en los pacientes con artritis reumatoide: la escala Disease Activity Score (DAS)41, que se compone de 4 parámetros: el recuento articular tipo Ritchie con gradación del dolor a la presión en 44 articulaciones, la VSG y la valoración global de la propia salud por el paciente (global health) en una escala analógico-visual. Posteriormente, se ha modificado dicha escala valorando la actividad dolorosa e inflamatoria en 28 articulaciones (DAS-28)42, convirtiéndose en una de las escalas preferidas por los reumatólogos europeos, incluida en guías de práctica clínica y utilizada para decidir el tratamiento y su respuesta. Existe una versión simplificada con PCR en lugar de VSG de Smolen (Simplified Disease Activity Index)43 y otra escala sin marcadores biológicos (Clinical Disease Activity Index [CDAI])44.
En la actualidad, hay al menos 2 consorcios con sendas bases de datos que entre sus objetivos está la obtención de una ecuación de riesgo cardiovascular en pacientes con artritis reumatoide y otras enfermedades inflamatorias crónicas. El consorcio A TransAtlantic Cardiovascular risk Calculator for Rheumatoid Arthritis (ATACC-RA) está llevando un estudio cuyo objetivo es desarrollar una ecuación de riesgo en pacientes con artritis reumatoide, pero todavía no hay datos concretos45. Este consorcio se creó en febrero del 2013 y participan 13 centros de 10 países, de Norteamérica, Europa y Sudáfrica, y ha recogido datos de 5.685 pacientes con artritis reumatoide, unos 35.000 pacientes-año de seguimiento y 476 eventos vasculares.
El consorcio Consortium Of Rheumatology Researchers Of North America (CORRONA) empezó a recoger datos en 2002, creando un registro de práctica real independiente de la industria farmacéutica con pacientes con artritis reumatoide, artritis psorásica, osteoartritis y osteoporosis. Recientemente, ha publicado una escala de predicción cardiovascular en una cohorte de 23.605 pacientes con artritis reumatoide, en los que han tenido 437 eventos cardiovasculares, con una mediana de seguimiento de 2,2 años46. En la escala se incluye índice de actividad CDAI, un índice de discapacidad funcional (Health Assessment Questionnaire-Disability Index), el uso diario de prednisona y la duración de la enfermedad, además de factores clásicos de riesgo cardiovascular. Es deseable que se valide externamente esta escala.
ConclusionesLa arteriosclerosis es una enfermedad inflamatoria en la que las partículas LDL modificadas constituyen un factor determinante en la patogenia. Las enfermedades inflamatorias sistémicas (como la artritis reumatoide y el lupus sistémico) potencian la aterosclerosis, constituyéndose en modelos de aterosclerosis acelerada.
Hay que considerar que no todos los fármacos para controlar las enfermedades inflamatorias tienen el mismo perfil de seguridad o riesgo aterosclerótico, por lo que en la elección del mismo deberíamos considerar el riesgo del paciente.
Así mismo, determinados fármacos antihipertensivos pueden ser preferibles en determinadas situaciones de daño orgánico por las enfermedades inflamatorias. Las estatinas pueden tener efectos inmunomoduladores pero la trascendencia clínica de estos debe determinarse mediante ensayos clínicos de tamaño suficiente.
Debemos valorar el riesgo cardiovascular de los pacientes con enfermedades inflamatorias y, mientras no tengamos escalas específicas para ello, debemos aplicar las escalas para población general, modificándolas con diversos criterios clínicos para una mejor estratificación del riesgo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.