La diabetes mellitus gestacional (DMG) es una de las complicaciones más comunes durante el embarazo, y está asociada con frecuentes complicaciones maternas y perinatales. El tratamiento intensivo de la hiperglucemia durante el embarazo ha demostrado reducir la morbilidad perinatal. En mujeres con diabetes pregestacional, tipo1 o 2, la hiperglucemia durante el parto es un factor importante en el desarrollo de hipoglucemia neonatal. No se dispone de recomendaciones ampliamente aceptadas para las mujeres con DMG. Estudios recientes que han evaluado a pacientes con DMG destacan que en estas mujeres se puede conseguir el control glucémico periparto sin necesidad del uso de la insulina en la mayoría de los casos. La hiperglucemia durante el parto no está relacionada con el tratamiento establecido durante el embarazo, sino más bien con el incumplimiento del seguimiento endocrinológico. Factores como el origen étnico, la hipoxemia neonatal y los niños grandes para la edad gestacional parecen jugar un papel importante en el desarrollo de la hipoglucemia neonatal.
Gestational diabetes mellitus (GDM) is common during pregnancy, and is frequently associated with maternal and perinatal complications. Intensive treatment of hyperglycaemia during pregnancy has been shown to reduce perinatal morbidity. In women with pregestational type1 or 2 diabetes, hyperglycaemia during labour and delivery is an important factor in the development of neonatal hypoglycaemia. There are no generally accepted recommendations for women with GDM. Recent studies evaluating patients with GDM show that peripartum glucose control can be achieved in these women without the need for insulin use in the majority of cases. Hyperglycaemia during labour is not related with treatment established during pregnancy but rather with non-compliance of endocrinological follow-up. Factors such as ethnic origin, neonatal hypoxaemia, and large for gestational age seem to play an important role in the development of neonatal hypoglycaemia.
La diabetes mellitus gestacional (DMG) es una de las complicaciones más comunes durante el embarazo. Su incidencia ha aumentado en las últimas décadas, hecho atribuible en parte a la epidemia paralela de obesidad y de diabetes mellitus tipo2 que afecta a las mujeres en edad de concebir y a la edad materna avanzada.
El Hyperglycemia and Adverse Pregnancy Outcomes1, estudio epidemiológico internacional a gran escala con 25.000 gestantes, demostró que el riesgo de resultados adversos maternos, fetales y neonatales aumentaba de forma lineal a medida que se incrementaba la glucemia materna en las semanas 24 a 28, incluso en rangos que inicialmente se habían considerado normales para la gestación. Además, en los últimos años se ha confirmado que una proporción importante de las mujeres que se diagnosticaban de DMG presentaban la diabetes con anterioridad al embarazo (tipo1 o 2). Estos hallazgos han conducido a un replanteamiento de los criterios diagnósticos. Después de varias deliberaciones en 2008-2009, la International Association of the Diabetes and Pregnancy Study Groups (IADPSG)2 aprobó un documento de consenso con recomendaciones más estrictas para el diagnóstico de DMG, que contempla también el de diabetes pregestacional. Estos nuevos criterios han sido incorporados en la última guía clínica de la American Diabetes Association publicada en enero de 20123; su aplicación comportará sin duda un incremento de la prevalencia de DMG, y es de esperar que afecte a un mínimo del 5 al 10% de todas las mujeres embarazadas.
Complicaciones de la diabetes mellitus gestacionalLa DMG está asociada con frecuentes complicaciones maternas y perinatales y supone un importante problema obstétrico, tanto por su elevada prevalencia como por sus consecuencias. Además, las mujeres con antecedentes de DMG tienen un riesgo aumentado de desarrollar diabetes tipo2, y estudios recientes han puesto de manifiesto un significativo incremento de otros factores de riesgo para la enfermedad cardiovascular en el posparto4.
Los resultados perinatales en mujeres con DMG continúan siendo peores que los de las mujeres no diabéticas. Aunque el riesgo de mortalidad perinatal no está aumentado en la DMG, el riesgo de macrosomía sí lo está. Otros riesgos perinatales incluyen la distocia de hombro, las lesiones en el parto tales como fracturas óseas y parálisis neurales, y las complicaciones metabólicas como la hipoglucemia5. Incluso, alteraciones límites en el metabolismo de los hidratos de carbono se han asociado a un aumento de complicaciones perinatales1. No hay que olvidar que los efectos de la DMG sobre la descendencia no se limitan al periodo neonatal. También se han descrito consecuencias a largo plazo en los hijos de madres con DMG, entre las que cabe destacar el desarrollo de obesidad y diabetes durante la infancia, la alteración en la función motora y mayor frecuencia de trastorno por déficit de atención6,7. Se ha señalado que una proporción significativa, cercana al 50%, de la diabetes y la obesidad en la edad juvenil puede atribuirse a la obesidad y a la DMG materna8.
Control glucémico intraparto en la diabetes mellitus gestacionalEn los últimos años ha quedado demostrado el beneficio de la identificación y el tratamiento intensivo de la DMG en la morbilidad fetal9. En las gestantes diabéticas, el control glucémico deficiente se acompaña de repercusiones en el feto en función de la etapa de la gestación. El hiperinsulinismo fetal debido a la hiperglucemia materna, tanto aguda durante el parto como crónica durante el tercer trimestre, es un factor determinante en el desarrollo de la hipoglucemia neonatal en los hijos de madres diabéticas10-18. En las mujeres con diabetes tipo1 se ha demostrado que el control metabólico óptimo durante el parto consigue reducir la frecuencia de hipoglucemia neonatal, y así se han establecido protocolos de manejo intraparto que utilizan perfusiones intravenosas simultáneas de insulina y glucosa con este fin10,12-20. Sin embargo, son escasos los estudios que han evaluado el impacto del control glucémico intraparto en mujeres con DMG. Este hecho se ve reflejado por la ausencia de un consenso sobre cómo se ha de afrontar el control metabólico intraparto de la DMG. En una encuesta realizada en nuestro entorno, el 25% de los centros hospitalarios optaban por no realizar ningún seguimiento específico intraparto en las pacientes con DMG, el 50% basaban la decisión en el tratamiento que seguía la paciente durante la gestación, insulina versus dieta, y solo controlaban a las pacientes que habían sido tratadas con insulina durante el embarazo utilizando los protocolos que aplicaban en las mujeres con diabetes pregestacional, y el 25% restante aplicaban a todas las pacientes los mismos protocolos que empleaban para las mujeres con diabetes pregestacional. La primera conducta podría tener como resultado un aumento del número de hipoglucemias neonatales al obviar la posibilidad de que estas pacientes presenten hiperglucemias asintomáticas durante el parto. En el segundo caso, y basándose en los resultados del estudio de Balsells et al.21 según el cual la necesidad de insulina durante el parto no parece correlacionarse con los requerimientos durante la gestación, sería erróneo decidir el manejo de la paciente en función del tratamiento seguido durante el embarazo. La tercera opción, el empleo sistemático de protocolos diseñados para pacientes con diabetes pregestacional, conlleva la necesidad de una monitorización más estrecha debido al uso de perfusiones intravenosas de insulina que probablemente no sean necesarias en la mayoría de pacientes con DMG, puesto que los requerimientos insulínicos de estas últimas no son equiparables, en la mayoría de los casos, a los de las pacientes con diabetes establecida previa al embarazo. Además, el uso de perfusiones intravenosas de insulina provoca un aumento en el número de hipoglucemias maternas que llega a alcanzar hasta el 30% en algunos estudios21, y una mayor instrumentalización y complejidad en el manejo de estas pacientes.
La falta de guías clínicas sobre el control glucémico intraparto ha quedado reflejada también en las recomendaciones del 5th Workshop Conference on Gestational Diabetes celebrado en junio 200622, que no se pronuncian sobre el tratamiento de la glucemia durante el parto debido a la ausencia de datos en pacientes con DMG. Los autores destacaban la necesidad de realizar ensayos clínicos que esclarezcan la idoneidad de monitorización de la glucemia intraparto, y que se establezcan cuáles deberían de ser los niveles de control glucémico que se asocien a un mejor resultado perinatal.
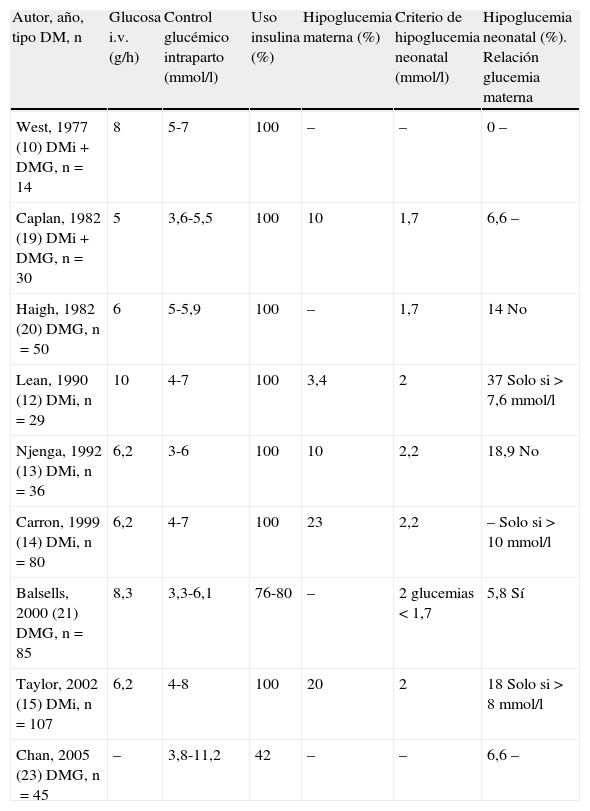
La mayoría de estudios sobre control glucémico intraparto en gestantes afectadas de diabetes pregestacional coinciden en que cifras de glucemia por debajo de 135-140mg/dl no conllevan una mayor incidencia de hipoglucemia neonatal (tabla 1)10,12,13,15,16,19-23. Un punto trascendental sobre el que no existe acuerdo es el aporte de glucosa durante el parto. Estudios realizados durante los años setenta del siglo pasado constataron que el aporte excesivo de glucosa intravenosa durante el parto (mayor a 10g/h) inducía hiperglucemia materna incluso en pacientes no diabéticas, lo que desencadenaba a su vez una mayor frecuencia de hipoglucemias en el neonato24. Por otra parte, la situación inversa, el aporte insuficiente de glucosa durante el parto, puede generar la aparición de cuerpos cetónicos en la madre, y dicha cetosis podría tener efectos deletéreos en el neonato, según apuntan estudios experimentales en modelos animales, aunque está por determinar su importancia en humanos25. Además, las necesidades de glucosa durante el parto dependen en gran medida del tipo de parto y de su duración26. En este sentido, en pacientes en las que el parto finaliza por cesárea los requerimientos de glucosa son inferiores a los de las pacientes que tienen un parto por vía vaginal, debido al consumo de glucosa que condiciona el trabajo del parto27.
Estudios sobre el control glucémico intraparto en pacientes con diabetes mellitus
| Autor, año, tipo DM, n | Glucosa i.v. (g/h) | Control glucémico intraparto (mmol/l) | Uso insulina (%) | Hipoglucemia materna (%) | Criterio de hipoglucemia neonatal (mmol/l) | Hipoglucemia neonatal (%). Relación glucemia materna |
| West, 1977 (10) DMi+DMG, n=14 | 8 | 5-7 | 100 | – | – | 0 – |
| Caplan, 1982 (19) DMi+DMG, n=30 | 5 | 3,6-5,5 | 100 | 10 | 1,7 | 6,6 – |
| Haigh, 1982 (20) DMG, n=50 | 6 | 5-5,9 | 100 | – | 1,7 | 14 No |
| Lean, 1990 (12) DMi, n=29 | 10 | 4-7 | 100 | 3,4 | 2 | 37 Solo si >7,6mmol/l |
| Njenga, 1992 (13) DMi, n=36 | 6,2 | 3-6 | 100 | 10 | 2,2 | 18,9 No |
| Carron, 1999 (14) DMi, n=80 | 6,2 | 4-7 | 100 | 23 | 2,2 | – Solo si >10mmol/l |
| Balsells, 2000 (21) DMG, n=85 | 8,3 | 3,3-6,1 | 76-80 | – | 2 glucemias <1,7 | 5,8 Sí |
| Taylor, 2002 (15) DMi, n=107 | 6,2 | 4-8 | 100 | 20 | 2 | 18 Solo si >8mmol/l |
| Chan, 2005 (23) DMG, n=45 | – | 3,8-11,2 | 42 | – | – | 6,6 – |
DMG: diabetes mellitus gestacional; DMi: diabetes mellitus insulinodependiente.
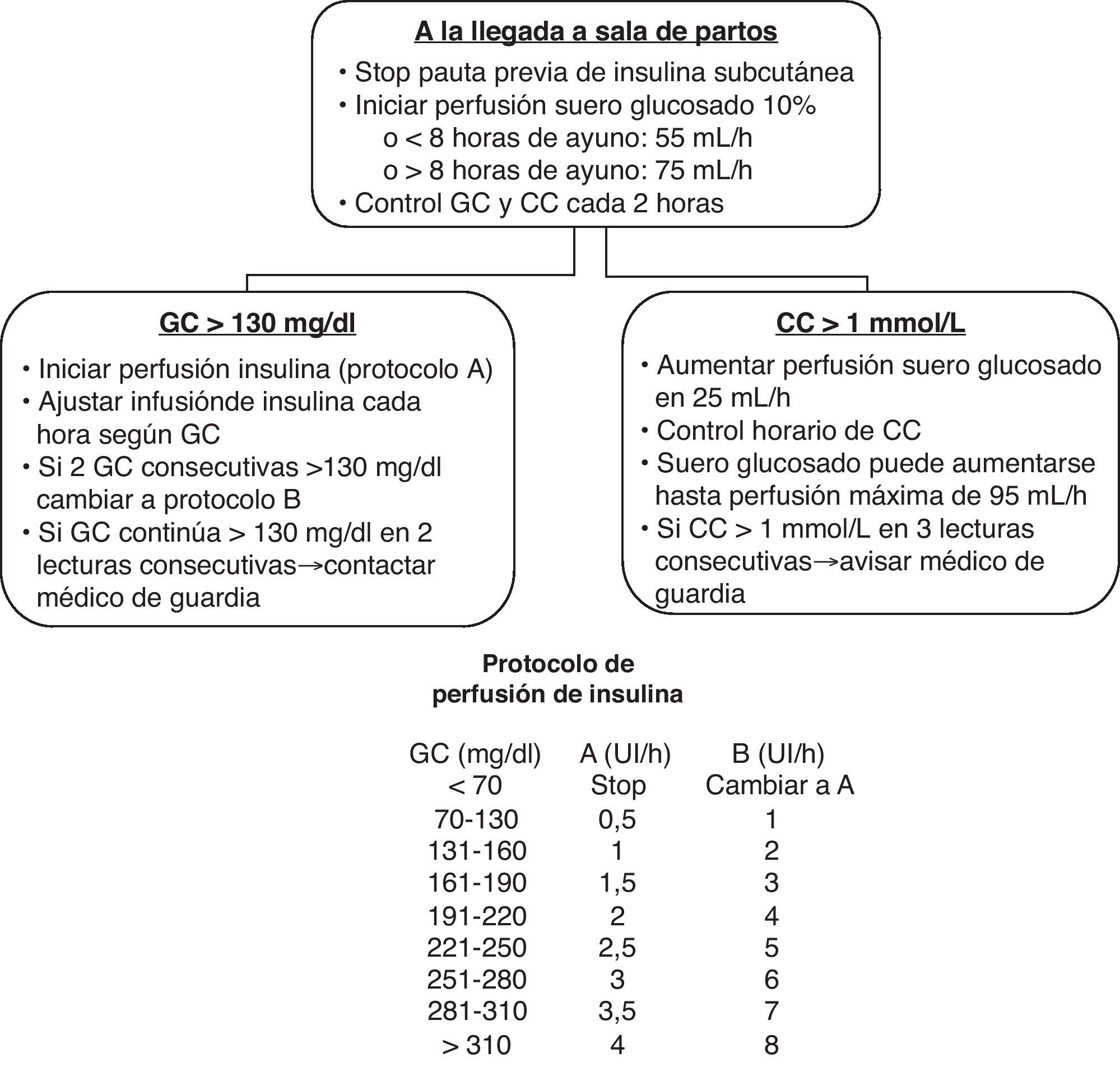
Teniendo en cuenta todas estas premisas, nuestro grupo ha evaluado la aplicación de un sencillo protocolo diseñado específicamente para estas pacientes28 (fig. 1). Cabe subrayar que se trata del estudio prospectivo con mayor tamaño muestral de acuerdo con las descripciones existentes. Una de las principales aportaciones del estudio es la constatación de que en la DMG, a diferencia de lo que sucede en la diabetes pregestacional, tanto tipo1 como tipo2, no es necesario el tratamiento intensivo de las glucemias mediante el uso sistemático de perfusiones intravenosas de insulina. En un estudio observacional que incluyó a 85 mujeres con DMG a las que se aplicó el protocolo de tratamiento intraparto diseñado para mujeres con diabetes tipo121, el control metabólico obtenido fue similar al logrado con nuestro método. Sin embargo, tuvieron que emplearse perfusiones intravenosas de insulina en el 80% de las pacientes, y la tasa de hipoglucemias maternas fue próxima al 30%. Por el contrario, en nuestro estudio no hubo ningún episodio de hipoglucemia materna y solo se utilizaron perfusiones intravenosas de insulina en el 10% de las pacientes, ya que el resto de las pacientes mantuvo durante todo el parto glucemias inferiores a 130mg/dl, sin necesidad de intervención. Estos resultados coinciden con el análisis retrospectivo de 139 pacientes con diabetes pregestacional y gestacional efectuado por Barret y Morris29 que constató que el 90% de las mujeres con DMG mantuvo glucemias durante todo el parto inferiores a 140mg/dl sin requerir tratamiento farmacológico.
Otro aspecto innovador del estudio es el referido al ajuste de la perfusión de glucosa durante el parto en función de los niveles de cetonemia. El aporte de glucosa durante el parto ha sido motivo de controversia, ya que un aporte deficiente favorece la aparición de cetosis, y por el contrario, un aporte excesivo puede ser causa de hiperglucemia materna, con el consiguiente riesgo de hipoglucemia neonatal24. Además, otro factor que añade dificultad para establecer recomendaciones generales sobre los aportes de glucosa es la variabilidad de los requerimientos en función del tipo de parto y de la fase del mismo26,27. Cabe resaltar que nuestro grupo es el primero que proporciona datos sobre valores de cetonemia capilar durante el parto, más precisos y fáciles de monitorizar que la tradicional cetonuria. La monitorización simultánea de la glucemia y la cetonemia capilar permite un fácil ajuste de la perfusión de glucosa en función de los requerimientos específicos del parto de cada mujer y evita las molestias derivadas de exploraciones adicionales. En el presente protocolo, partiendo de unos requerimientos mínimos, se ha conseguido individualizar el control de la perfusión de glucosa en función de la aparición de cetosis por aporte insuficiente de hidratos de carbono, evitando así dosificaciones excesivas que pudieran favorecer la hiperglucemia materna.
Nuestros resultados muestran una falta de relación entre el tratamiento recibido durante la gestación y el grado de control glucémico intraparto. Algunos autores han recomendado basar el manejo de la glucemia intraparto de las pacientes con DMG en función del tratamiento recibido durante la gestación. Postularon que solo aquellas que hubieran sido tratadas con insulina durante la gestación podrían requerir tratamiento insulínico intraparto. Por el contrario, para las mujeres tratadas únicamente con dieta durante la gestación recomendaban no realizar un control específico de la glucemia durante el parto. A la vista de los resultados obtenidos, este modo de proceder no parece estar justificado. No hemos hallado ninguna relación entre el tratamiento recibido durante la gestación y el desarrollo de hiperglucemia durante el parto, resultados coincidentes con los descritos por Balsells et al.21. Sin embargo, hemos objetivado una asociación entre la necesidad de tratamiento con insulina durante el parto y la falta de control endocrinológico durante la gestación. En las pacientes que acudieron a menos de 3visitas de control endocrinológico durante la gestación no se pudo confirmar la adecuación del tratamiento dietético instaurado, ni la necesidad de insulinoterapia. Por este motivo, cabe hipotetizar que el control glucémico durante el embarazo en estas pacientes fuera más deficiente que el de las mujeres que realizaron un seguimiento estricto. Este hecho parece repercutir en el grado de control glucémico intraparto.
Hiperglucemia materna intraparto e hipoglucemia neonatalOtro aspecto a considerar es la relación de la hiperglucemia intraparto con el desarrollo de hipoglucemia neonatal. La hipoglucemia es un problema neonatal habitual, y se estima que el 10% de los recién nacidos normales no pueden mantener una concentración de glucemia plasmática por encima de 30mg/dl si su primera toma se produce más de 6h después del parto. No existe una definición aceptada internacionalmente de hipoglucemia para la población neonatal debido a la ausencia de evidencias que asocien de forma concluyente los niveles sanguíneos con la sintomatología característica. Tampoco ha podido demostrarse que el manejo adecuado de los niveles de glucemia evite los daños neuronales. En el pasado, a la hipoglucemia asintomática no se le atribuía significación clínica30. Sin embargo, la observación de registros electroencefalográficos y de potenciales evocados sensoriales alterados en niños con antecedentes de hipoglucemias asintomáticas ha puesto en duda esta premisa. Asimismo, otros estudios han relacionado las hipoglucemias neonatales asintomáticas recurrentes en hijos de madres diabéticas con puntuaciones más elevadas durante la edad escolar en las pruebas de cribado de disfunción cerebral mínima31. Por el contrario, en un grupo de recién nacidos grandes para la edad gestacional que habían presentado hipoglucemias neonatales asintomáticas no se encontraron alteraciones en el desarrollo psicomotor32. Estos datos contradictorios sobre la repercusión de la hipoglucemia neonatal son responsables, al menos en parte, de la falta de uniformidad en los niveles de glucemia usados para definir la hipoglucemia. En consecuencia, es fácil comprender la gran variabilidad existente en las prevalencias descritas, con cifras que van del 25 al 76%33-37. A pesar de esta falta de consenso, la tendencia general en las unidades de neonatología a lo largo de los años ha sido aumentar el umbral para la definición de hipoglucemia. En 1965 Cornblath y Reisner38 propusieron como definición de hipoglucemia neonatal la existencia de 2 determinaciones de glucemia inferiores a 30mg/dl en neonatos a término. Posteriormente, en el año 2004, las recomendaciones de distintas sociedades científicas aumentaron el nivel de glucemia a 40mg/dl para el diagnóstico39. En tiempos más recientes, la práctica clínica más extendida ha radicado en diseñar los protocolos de tratamiento con el objetivo de mantener las glucemias del neonato por encima de 45mg/dl. En nuestro hospital, hasta el año 2009 se empleó el límite de 40mg/dl para definir la hipoglucemia neonatal, y a partir de entonces el punto de corte se elevó a 45mg/dl.
El riesgo de hipoglucemia neonatal está aumentado en hijos de madres con diabetes, y es cercano al 30-50% en el caso de diabetes tipo1 o 211,14,15,17,18. Según la hipótesis de Pedersen40, la hiperglucemia materna intermitente provoca hiperglucemia fetal. Esta conduce a su vez a una maduración prematura de los islotes pancreáticos fetales provocando una hipertrofia de las células beta e hiperinsulinismo. La hipoglucemia es resultado de la hiperinsulinemia persistente en el recién nacido tras la interrupción del aporte materno de glucosa.
En mujeres con diabetes pregestacional, tanto tipo1 como tipo2, la hiperglucemia materna intraparto se ha referido como un factor de riesgo para el desarrollo de hipoglucemia neonatal10-18. Sin embargo, en mujeres con DMG los resultados son controvertidos. Así por ejemplo, Barret y Morris29, en un análisis retrospectivo de 114recién nacidos de mujeres con DMG, no encontraron una correlación entre las concentraciones de glucemia periparto y el desarrollo de hipoglucemia neonatal. En cambio, Balsells et al.21, en mujeres con DMG que recibieron tratamiento intensivo de las glucemias durante el parto, concluyeron que la hiperglucemia materna en las últimas 2h del parto se correlacionaba con la aparición de hipoglucemia. En otro estudio de nuestro grupo diseñado para valorar la asociación de distintos factores —maternos, gestacionales y neonatales— con el desarrollo de hipoglucemia neonatal, el análisis univariante identificó la hiperglucemia materna periparto (>130mg/dl) como factor asociado a un mayor riesgo de hipoglucemia neonatal cuando el límite para la definición de hipoglucemia se establece en 45mg/dl41. Por el contrario, cuando el punto de corte se fija en 40mg/dl, esta asociación no se confirma. Estos resultados sugieren que la correlación entre el control glucémico intraparto y el desarrollo de hipoglucemia neonatal podría ser más importante en los casos leves de hipoglucemia.
Si bien los resultados del análisis univariante relacionaban el control glucémico intraparto con el desarrollo de hipoglucemia neonatal, en el análisis multivariante únicamente el origen étnico materno y el pH de cordón umbilical fueron factores predictores independientes de hipoglucemia neonatal. El hallazgo de diferencias étnicas en resultados perinatales ya ha sido descrito en la literatura42,43. Sin embargo, solo un estudio había valorado las diferencias étnicas en la incidencia de hipoglucemia neonatal. Este estudio incluía a mujeres con DMG procedentes de los 5 principales grupos étnicos de Hawai (nativas hawaianas/islas del Pacífico, japonesas, chinas, filipinas y caucásicas) y determinó que las hawaianas nativas y las mujeres caucásicas tenían hijos con un riesgo incrementado de hipoglucemia neonatal comparado con las otras etnias44. Los datos de nuestro estudio también afirman la influencia de la etnia en el desarrollo de la hipoglucemia neonatal, aunque los grupos étnicos analizados y los resultados son distintos. Nuestro estudio identificó a las mujeres pakistaníes como las que presentaban una mayor asociación con el desarrollo de hipoglucemia neonatal en el análisis multivariante. Estos hallazgos tienen gran relevancia clínica, ya que permiten plantear la adaptación de los planes de salud materno-fetal teniendo en cuenta el factor étnico, identificando grupos de alto riesgo sobre los que intensificar la vigilancia.
Tal como se ha descrito con anterioridad, los episodios de hipoglucemia fueron más frecuentes en los niños nacidos grandes para la edad gestacional. Varios estudios han puesto de manifiesto que los niños grandes para la edad gestacional, incluso hijos de madres no diabéticas, tienen una prevalencia aumentada de hipoglucemia neonatal debido a las anomalías metabólicas asociadas al crecimiento excesivo45.
Igualmente acorde con otros estudios, el pH venoso del cordón umbilical también se asoció significativa e independientemente con el desarrollo de hipoglucemia neonatal. La hipoxemia neonatal, asociada a pH bajo en cordón umbilical, es un factor de riesgo conocido para la hipoglucemia46. La utilización periférica de glucosa está aumentada durante la hipoxia debido a la ineficiencia de la glucólisis anaerobia, la hiperinsulinemia que aumenta el consumo metabólico por vía de la activación del sistema nervioso simpático y la secreción de hormona tiroidea.
ConclusionesEl control glucémico intraparto en las mujeres con DMG puede conseguirse en la mayoría de los casos sin necesidad de tratamiento con insulina. El grado de control glucémico durante el parto no se relaciona con el tipo de tratamiento establecido durante la gestación, aunque sí podría asociarse a la falta de adscripción al seguimiento endocrinológico.
Existen datos contradictorios respecto a la asociación entre la hiperglucemia materna intraparto y el desarrollo de hipoglucemia neonatal. La hiperglucemia materna intraparto podría tener cierta influencia, aunque otros factores, tales como la condición de grande para la edad gestacional, la hipoxemia perinatal y el origen étnico, parecen presentar una mayor asociación.
Queda pendiente contestar cuestiones de notable trascendencia clínica, como confirmar si la monitorización de los niveles de glucosa durante el parto se asocia a un beneficio materno-fetal, y en caso afirmativo, cuál ha de ser la frecuencia de la medición de la glucemia y cuáles son los niveles de glucemia que se asocian a un mejor resultado perinatal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.