Introducción
La definición del síndrome metabólico (SM), asociado a un riesgo cardiovascular elevado, ha sido posible gracias al conocimiento de algunos fenómenos fisiopatológicos que sirven de nexo de unión entre las alteraciones metabólicas asociadas. De entre ellos, la resistencia a la insulina es el que se considera más trascendente. Esta situación de insulinorresistencia (IR) se encuentra acompañando muy frecuentemente a un aumento de la grasa visceral, característica de la obesidad central. Así, la obesidad visceral y la resistencia a la insulina son factores de riesgo determinantes en la aparición del SM, situación clínica con un notable aumento del riesgo cardiovascular1,2. La caracterización y la definición clínica del SM ofrecen distintas perspectivas, de modo que es preciso establecer ciertos criterios que nos permitan homologar su diagnóstico en la población. El perfil aterogénico que caracteriza las alteraciones lipídicas del SM puede explicar, en gran parte, el significativo aumento del riesgo cardiovascular.
El objetivo del presente documento es señalar los aspectos fundamentales relativos a la fisiopatología, el diagnóstico y el tratamiento de la dislipemia del SM, y poder formular unas recomendaciones en el manejo de esta situación tan frecuente en la práctica clínica.
Alteraciones del metabolismo de las lipoproteínas (tabla 1)
Aumento de la apolipoproteína B y las lipoproteínas de baja densidad pequeñas y densas
La dislipemia de los pacientes con SM es más profunda que una simple alteración cuantitativa de ciertas partículas lipoproteicas. Estos pacientes tienen un marcado incremento del número de partículas portadoras de apolipoproteína B-100, especialmente de lipoproteínas de baja densidad (LDL) pequeñas y densas. El incremento de partículas LDL pequeñas y densas es una consecuencia de la hipertrigliceridemia. La llegada masiva de ácidos grasos no esterificados (AGNE) al hepatocito se convierte en un estímulo directo para la producción de lipoproteínas de muy baja densidad (VLDL). Junto a una síntesis incrementada de colesterol y la presencia de apolipoproteína (apo) B-100, que en general se suele sintetizar en exceso, se forman las citadas partículas VLDL, mediante la acción de la proteína microsomal transferidora de triglicéridos. Las VLDL resultantes de esta situación metabólica suelen ser grandes y ricas en triglicéridos. Durante el período de residencia en el plasma, las lipoproteínas sufren una importante transformación metabólica, intercambiando las VLDL, las LDL y los triglicéridos por ésteres de colesterol. Esta vía metabólica está mediada por la proteína transportadora de ésteres de colesterol (PTEC). En condiciones normales, la acción de la PTEC produce unas LDL que ceden parte de su colesterol a cambio de triglicéridos, que serán eliminados posteriormente por la acción de lipasas diversas, como la lipoproteinlipasa (LPL) y la lipasa hepática (LH). El equilibrio de este intercambio está regulado por la concentración de triglicéridos en las partículas VLDL. En situaciones de aumento de triglicéridos resultan unas partículas LDL enriquecidas en triglicéridos y empobrecidas de forma relativa en colesterol. Estas partículas LDL, después de la pérdida del exceso de triglicéridos por acción de las lipasas, pasan a ser partículas más pequeñas y densas dado que contienen un menor número de moléculas lipídicas.
El predominio de LDL pequeñas y densas se ha asociado a un mayor riesgo coronario. Esta situación, habitual en la diabetes mellitus tipo 2 (DM2), está también presente en alteraciones genéticas del metabolismo lipídico como la hiperlipemia familiar combinada o en los estados de resistencia a la insulina como es el caso del SM. La importancia de este fenómeno radica en que este fenotipo de LDL es altamente aterogénico, ya que las LDL pequeñas y densas son lesivas para la pared arterial. Se ha documentado que la disposición de la molécula de apo B-100 facilita la acción de radicales libres y, por tanto, éstos se oxidan con mayor rapidez. Además, en la diabetes estas partículas tienen una mayor tendencia a glucosilarse, aumentado su depósito en la pared vascular. También se ha observado que tienen una mayor afinidad por los glucosaminoglucanos de la matriz extracelular, siendo atrapadas durante más tiempo en la zona subendotelial, lo que aumenta su posible exposición a sustancias oxidantes.
Desde el punto de vista clínico, se puede detectar esta situación metabólica, al determinar las concentraciones plasmáticas de apo B-100. Un aumento de la apo B-100 sobre los valores normales de 120 mg/dl, aproximadamente, denota un aumento del número de partículas VLDL, lipoproteínas de densidad intermedia (IDL) y LDL, que son portadoras de una sola molécula de apo B-100. Si tenemos en cuenta que la vida media de las VLDL es de unas 12 h, mientras que la de las LDL supera los 4 días, podemos comprender que el aumento de apo B suele indicarnos sobre todo un aumento de LDL, dado que son las partículas portadoras de apo B-100 predominantes en plasma. Esto configura una situación metabólica de alto riesgo vascular independiente del incremento de colesterol. Diversos estudios poblacionales han establecido que la producción de LDL pequeñas y densas secundaria a hipertrigliceridemia se inicia con trigliceridemias iguales o superiores a 150 mg/dl. Hemos de tener en cuenta, además, que la situación del paciente con SM se acompaña también de un defecto en la lipólisis de VLDL, por una alteración funcional de LPL, lo que traduce un defecto en el catabolismo de estas partículas.
Lipoproteínas de alta densidad pequeñas
Una consecuencia directa del SM es la disminución de la formación de lipoproteínas de alta densidad (HDL), dado que una de las fuentes de estas lipoproteínas es el producto catabólico de las partículas ricas en triglicéridos. Este hecho redundará en una menor eficacia en la extracción de colesterol desde las membranas celulares. Además, las HDL también tienen una composición alterada en las situaciones de hipertrigliceridemia, por mecanismos metabólicos similares a los comentados para las LDL. El intercambio de triglicéridos por ésteres de colesterol mediado por la PTEC y la posterior acción de la LH conlleva un incremento de la concentración de HDL pequeñas (HDL3), a expensas de una reducción de las HDL2, que son las que parecen asociarse epidemiológicamente a una mayor protección vascular.
Insulinorresistencia como unión de los distintos factores lípidicos
Diversas observaciones avalan el papel patogénico de la IR en la mayoría de las alteraciones lipídicas y lipoproteicas que concurren en el SM3.
Influencia de la insulinorresistencia en las alteraciones de las lipoproteínas de muy baja densidad y los triglicéridos
La insulina tiene una acción antilipolítica en el del tejido adiposo. En consecuencia, la IR aumenta la liberación de ácidos grasos libres que llegan en gran cantidad al hígado, donde se utilizan para la síntesis de triglicéridos, que posteriormente son incorporados a las partículas VLDL. La hiperinsulinemia coexistente generalmente con la IR es también un estímulo directo para la síntesis de VLDL. La IR y la hiperinsulinemia estimulan, a su vez, la síntesis hepática de apo B-1004-8.
Otro mecanismo que puede colaborar al aumento de VLDL en plasma es la reducción de su catabolismo, como consecuencia de la disminución de la actividad de LPL, enzima regulada por la insulina. Esta disminución de la actividad lipolítica, junto con la mayor producción de VLDL, determinan un aumento de la lipemia posprandial8,9.
Efecto de la insulinorresistencia sobre las alteraciones del colesterol unido a lipoproteínas de baja densidad
El aumento de secreción hepática de VLDL predispone a una mayor formación de LDL, aunque este fenómeno está modulado por la disminución de la lipólisis. Hay, asimismo, estudios que muestran que la IR o la hiperinsulinemia estimulan la síntesis de colesterol y disminuyen su tasa de absorción intestinal en sujetos normoglucémicos. El aumento de síntesis se debe a un estímulo de la insulina sobre los receptores X del hígado (LXR), lo que, a su vez, podría determinar el aumento de la expresión de los genes intestinales ABCG5 y ABCG8, lo que explicaría la disminución de su absorción10.
Por otra parte, la hipertrigliceridemia inducida por la IR determina, como antes comentamos, una mayor proporción de LDL pequeñas y densas. La disminución del tamaño medio de las partículas tiende a reducir los valores de colesterol unido a (cLDL), puesto que el contenido de colesterol de cada partícula es variable y depende de su tamaño. Sin embargo, los valores plasmáticos de apo B, que dependen exclusivamente del número de partículas, no se modifican, por lo que se produce una reducción del cociente cLDL/apo B. En la actualidad está bien documentado el potencial aterogénico de las LDL pequeñas y densas11-14.
Influencia de la insulinorresistencia en las alteraciones de las lipoproteínas de alta densidad
La alteración fundamental es la disminución del contenido en colesterol, que se presenta de forma casi constante y que determina la conocida relación inversa entre los valores plasmáticos de triglicéridos y de colesterol unido a HDL (cHDL). Incluso se ha descrito un aumento de actividad de la LH, inducida de forma directa por la resistencia insulínica15-17.
Tato et al 18 observaron que la relación inversa entre triglicéridos y cHDL es relativamente potente cuando los valores de triglicéridos están dentro del intervalo de la normalidad, pero no cuando los triglicéridos alcanzan un valor elevado. Investigada la contribución de otros mecanismos potenciales, concretamente la actividad de PTEC, lecitil colesterol acil transferasa (LCAT), LH y LPL, se concluye que la concentración de cHDL en pacientes con hipertrigliceridemia depende en gran medida de las actividades particulares de estas enzimas, que en su conjunto determinan casi la mitad de la variación del cHDL, mientras que el propio aumento de los triglicéridos tiene una contribución modesta.
Alteraciones cuantitativas del metabolismo de las lipoproteínas en el síndrome metabólico
Hipercolesterolemia y aumento del colesterol unido a lipoproteínas de baja densidad
Los pacientes con SM presentan una mayor prevalencia de dislipemia que la población general. En los pacientes con SM suele encontrarse un perfil lipídico caracterizado por un aumento de triglicéridos y un cHDL bajo, si bien las estrategias de prevención se centran inicialmente en la reducción del cLDL. Los estudios de prevención primaria en poblaciones con grados variables de riesgo, utilizando estatinas (WOSCOPS y AF-TEX/CAPS)19,20, y los de prevención secundaria (4S, CARE, LIPID)21-23 han mostrado que también en los subgrupos de pacientes diabéticos, la mayor parte de los cuales presentan IR y SM, la reducción de las concentraciones de LDL conlleva una disminución de los episodios coronarios. El estudio VA-HIT24,25 realizado en pacientes supervivientes a un primer infarto de miocardio y que incluía a pacientes diabéticos y no diabéticos con concentraciones de cLDL normales pero de cHDL bajas, mostró que el uso de gemfibrozilo que no modificó las LDL pero que redujo de forma importante los triglicéridos y elevó discretamente las HDL producía efectos beneficiosos con disminuciones del riesgo relativo de segundos infartos en un 22%.
Aumento de colesterol no unido a lipoproteínas de alta densidad
En el ámbito clínico, la concentración de cLDL se determina mediante cálculo, con la conocida fórmula de Friedewald. Ésta no es aplicable cuando los triglicéridos superan los 400 mg/dl, como ocurre con mucha frecuencia en los pacientes con SM. En estas situaciones se aconseja utilizar el parámetro denominado colesterol no-HDL, que no es más que el valor obtenido tras sustraer a la concentración de colesterol total la correspondiente al cHDL. Los valores recomendables para las estrategias terapéuticas coinciden con los de cLDL (mg/dl) + 30.
Hipertrigliceridemia
Los efectos de los triglicéridos en la pared arterial parecen depender de la partícula lipoproteica que los contiene. Así, los sujetos afectados de déficit de LPL o su cofactor, apo C-II, presentan quilomicronemias graves, sin que la enfermedad cardiovascular sea una característica del proceso. Sin embargo, cuando el incremento de los triglicéridos se debe a la acumulación de partículas más pequeñas y parcialmente metabolizadas, como los remanentes posprandiales de quilomicrones, y especialmente de VLDL, o a IDL, como ocurre en la disbetalipoproteinemia, el riesgo de enfermedad cardiovascular aumenta. Una situación metabólica que podemos encontrar en los pacientes con SM es la acumulación de remanentes en situaciones de hiperlipemia posprandial. Esta alteración metabólica es característica de varias situaciones clínicas que cursan con resistencia a la insulina como la obesidad, especialmente la visceral, la hiperlipemia familiar combinada y la diabetes.
Concentraciones bajas de lipoproteínas de alta densidad
Está bien establecida la asociación entre las concentraciones bajas de HDL (fundamentalmente de partículas de mayor tamaño o HDL2) y el riesgo coronario aumentado. En el estudio PROCAM26 el índice LDL/HDL fue el mejor indicador de riesgo coronario, y aumentó espectacularmente cuando éste era al menos de 5. Es interesante observar que en este estudio los triglicéridos eran marcadores de riesgo si esta relación era alta; en cambio, en presencia de unas concentraciones de cHDL elevadas, dicho riesgo quedaba neutralizado. Los mecanismos de protección de las HDL parecen ser diversos. En primer lugar, tienen una función de extracción de colesterol de los tejidos periféricos para conducirlo al hígado o a otras partículas lipoproteicas para que sea eliminado. Otros mecanismos de protección frente a la aterogénesis son su capacidad antioxidante y ejercer, además, un papel antiinflamatorio.
Diagnóstico de la dislipemia en el síndrome metabólico
Tríada aterogénica
Clínicamente, puede definirse como aumento plasmático de triglicéridos (> 150 mg/l), aumento de apo B-100 (> 120 mg/dl) y disminución de cHDL (< 40 mg/dl en varones y < 50 mg/dl en mujeres). Esta alteración se conoce como dislipemia aterógena. Ante esta situación el clínico debe interpretar que el paciente presenta una alteración global de su situación metabólica, a pesar de no tener un incremento cuantitativo del cLDL. Las LDL serán pequeñas y densas, más tóxicas y oxidables, y además las HDL serán incapaces de oponerse al desarrollo de la lesión vascular. Esta situación es propia del SM y de la DM2, pero puede generalizarse tanto a la resistencia a la insulina en general como a la obesidad abdominal, a la hiperlipemia familiar combinada y a ciertos casos de hipertensión arterial.
Para el diagnóstico se requiere la determinación de colesterol, triglicéridos, cHDL y apo B. En laboratorios de investigación, puede determinarse directamente el tamaño de las LDL, por técnicas cromatográficas o mediante resonancia magnética.
Hiperlipemia posprandial
La IR provoca un aclaramiento plasmático más lento de las partículas posprandiales ricas en triglicéridos, con lo que se acumulan partículas residuales en la circulación con capacidad de toxicidad endotelial y de depósito en la pared arterial.
El diagnóstico se lleva a cabo mediante pruebas de sobrecarga grasa oral estandarizada, con extracciones periódicas de sangre para determinar, a lo largo de 6 a 12 h, las concentraciones de triglicéridos, apo B-48 o retinol añadido a la comida test. Los pacientes con SM suelen presentar una mayor área bajo la curva, mayores picos máximos y valores basales elevados. Otra forma de evaluar esta situación es la determinación de los triglicéridos en sangre capilar a lo largo del día mediante técnicas de química seca. Esto permite de forma sencilla analizar la carga de trigliceridemia diurna en un día estándar del paciente.
Objetivos terapéuticos globales
En la actualidad, no disponemos de un documento de consenso acerca del tratamiento del SM. Sin embargo, los datos disponibles sugieren que una estrategia razonable pueden ser las modificaciones del estilo de vida para evitar la obesidad y el tratamiento farmacológico adecuado para cada uno de sus componentes. De ahí la importancia de tratar no sólo la dislipemia que acompaña al SM, sino también el sobrepeso y la obesidad, la hipertensión arterial, o el trastorno del metabolismo hidrocarbonado.
Objetivos lipídicos
El objetivo fundamental es conseguir unos valores de cLDL adecuados, ya que el incremento de estas lipoproteínas es la causa fundamental de enfermedad cardiovascular. La clasificación de los valores de cLDL se expresa en la tabla 2. Además de los valores concretos de cLDL, hay otros determinantes de riesgo cardiovascular, como la presencia de cardiopatía isquémica o de otras formas de enfermedad cardiovascular y la existencia de otros factores de riesgo. Basado en estos determinantes, se han identificado 3 categorías que modifican los objetivos para los valores del cLDL (tabla 3).
La situación de mayor riego (riesgo coronario > 20% a 10 años) se asocia a la cardiopatía isquémica o sus equivalentes de riesgo, como la enfermedad arteriosclerótica, la diabetes mellitus o la coexistencia de múltiples factores de riesgo cardiovascular. A partir de la idea de que, en las condiciones indicadas, los objetivos de cLDL < 100 mg/dl es un objetivo de mínimos, recientes estudios27-31 han comprobado que la obtención de valores de cLDL < 70 mg/dl en pacientes con riesgo elevado aportan un beneficio adicional y significativo. Los pacientes incluidos en este objetivo adicional serían los que presenten cardiopatía isquémica asociada a múltiples factores de riesgo, especialmente diabetes, persistencia de tabaquismo, presencia de SM y síndromes coronarios agudos32.
Además del descenso del cLDL, hay suficiente evidencia acerca de la disminución del riesgo cardiovascular con la modificación de otros parámetros lipídicos. En el SM tenemos una serie de factores de riesgo asociados, que en conjunto incrementan el riesgo cardiovascular con independencia del valor de cLDL. Por esta circunstancia, se ha incluido la reducción del valor de triglicéridos y el aumento del cHDL como objetivos terapéuticos secundarios en el ATP III33.
Las 2 alteraciones lipídicas fundamentales asociadas al SM son el aumento de los triglicéridos y el descenso del cHDL. El aumento de triglicéridos se ha considerado un factor de riesgo cardiovascular independiente. Este aumento está relacionado con la obesidad y el sobrepeso, la falta de jercicio físico, el tabaquismo, la ingesta alcohólica, las dietas ricas en hidratos de carbono (> 60%), además de ciertas afecciones (DM2), uso de fármacos (bloqueadores beta) y alteraciones genéticas (hiperlipemia familiar combinada). En la clínica es la alteración lipídica asociada al SM con más frecuencia. Se consideran cifras normales de triglicéridos: < 150 mg/dl; límite alto: 150-199 mg/dl; elevadas: 200-499 mg/dl, y muy elevadas: $ 500 mg/dl. El ATP III33 introduce el nuevo concepto de colesterol no-HDL (colesterol total cHDL), como objetivo terapéutico secundario en sujetos con trigliceridemias por encima de 200 mg/dl.
El cHDL bajo es un factor independiente de riesgo cardiovascular. El ATP III33 considera esta categoría cuando su valor es < 40 mg/dl. El descenso de cHDL se relaciona fundamentalmente con la resistencia a la insulina, aumento de triglicéridos, sobrepeso u obesidad, vida sedentaria, tabaquismo y DM2. En todos los sujetos con cHDL bajo se deben conseguir, en primer lugar, los objetivos del cLDL. Cuando éstos se han alcanzado, se debe hacer enfasis en obtener descensos del peso e incrementos de la actvidad física. Cuando el descenso de cHDL se asocia a hipertrigliceridemia (> 200 mg/dl), el objetivo es conseguir unos valores adecuados de colesterol no-HDL. En el caso de descenso de cHDL aislado con normotrigliceridemia, puede considerarse necesaria una actitud terapéutica con fármacos, en el caso de cardiopatía isquémica establecida o equivalentes de riesgo.
Tratamiento de la dislipemia del síndrome metabólico
Fundamentos
El abordaje terapéutico del SM se apoya en 2 pilares que incluyen las medidas no farmacológicas relacionadas con los cambios del estilo de vida y las medidas farmacológicas. Las primeras se encuentran relacionadas con la intervención en la dieta y el ejercicio físico. En cuanto a las segundas, es preciso señalar que la complejidad metabólica del síndrome obliga al empleo de fármacos de distintos grupos terapéuticos. El objetivo del presente trabajo es profundizar en lo relativo al tratamiento de la dislipemia del síndrome metabólico.
Intervención sobre el estilo de vida
Todas las guías clínicas del abordaje del SM indican como tratamiento de primera elección las modificaciones del estilo de vida, la pérdida de peso y la actividad física34-36.
Dieta
Las guías clínicas para la obesidad muestran la necesidad de la reducción de peso con la disminución de la ingesta calórica y aumento de la actividad física. La dieta más efectiva a largo plazo consiste en una reducción modesta del aporte calórico, entre 500 y 1.000 kcal/día. Un objetivo adecuado es conseguir una reducción del peso entre el 7 y el 10% en un período de 6 a 12 meses. En la mayoría de los pacientes, las dietas para la pérdida de peso deberían suministrar al menos 1.000-1.200 kcal/día para las mujeres y 1.200-1.500 kcal/día para los varones32. Los hidratos de carbono deben corresponder al 50-60% del total de calorías. Las grasas deben aportar entre el 25-30% del total calórico, la grasa saturada debe ser inferior al 7% y debe sustituirse por monoinsaturada (aceite de oliva) y poliinsaturada (consumo de pescados). La ingesta de proteínas oscilará entre 0,7 y 0,8 g/kg/día, lo que corresponde al 15-20% del valor calórico total. La dieta debe tener un alto contenido en frutas y verduras para conseguir disminuir el riesgo cardiovascular37. Con el consumo de 2 g/día de estanoles y 10-25 g/día de fibra soluble se consiguen descensos apreciables del cLDL. Es beneficioso el descenso de la ingesta de sodio; una dieta con 1,6 g de Na/día tiene un efecto sobre la presión arterial similar al tratamiento farmacológico con monoterapia38.
Los cambios de comportamiento deben incluir mejoría en los hábitos alimentarios, información sobre el tipo de alimentos adecuados y sobre los que deben evitarse.
El ejercicio físico es un importante componente del estilo de vida que disminuye el riesgo cardiovascular39 e influye positivamente en la práctica totalidad de los componentes del SM. Se ha demostrado que la indicación terapéutica de la práctica del ejercicio aeróbico de forma regular y moderada, aproximadamente 30 minutos al día, retrasa considerablemente la aparición de DM y reduce su incidencia absoluta en un 20%40.
Intervención farmacológica
La dislipemia ocupa un lugar central en la fisiopatología del SM, y su corrección es un objetivo prioritario para prevenir la enfermedad cardiovascular en la numerosa población que la presenta. Las estatinas y los fibratos son los fármacos más eficaces para controlar la dislipemia asociada a la resistencia a la insulina; las primeras por su elevada potencia para disminuir el cLDL y los segundos por su eficacia para disminuir los triglicéridos y la proporción de partículas LDL pequeñas y densas, y al mismo tiempo aumentar el cHDL. La ezetimiba, un fármaco de la familia de las azetidinonas que inhibe de forma selectiva la absorción intestinal de colesterol, es muy eficaz para potenciar el efecto hipocolesterolemiante de las estatinas, y su asociación con los fibratos es una prometedora alternativa para lograr un control global de la dislipemia en el SM, aunque su uso clínico en esta indicación aún no ha sido autorizado. Las resinas, los ácidos grasos omega-3, los fitosteroles y el ácido nicotínico son otros fármacos disponibles que, por su menor eficacia o sus más frecuentes efectos secundarios, se consideran de segunda elección.
Estatinas. Son los fármacos de primera elección para disminuir el cLDL y el colesterol vehiculizado por las lipoproteínas ricas en apo B (colesterol no-HDL). Actúan inhibiendo de forma parcial, reversible y competitiva la HMG CoA-reductasa, enzima limitante del ritmo de síntesis intracelular de colesterol. Estos fármacos disminuyen el contenido celular de colesterol e inducen una mayor expresión de receptores de las LDL, lo que aumenta su aclaramiento plasmático y, en menor medida, de las IDL y VLDL. Con las dosis máximas de las estatinas más potentes puede disminuirse el cLDL más de un 50%41. El cHDL aumenta, en general, entre un 5 y un 15% y los triglicéridos disminuyen de forma muy variable en función del fenotipo de la dislipemia y de su gravedad, en general entre un 10 y un 40%. En un metaanálisis de los ensayos clínicos de tratamiento de las dislipemias con fluvastatina XL, los triglicéridos disminuyeron un 31% en los pacientes con unos triglicéridos basales $ 300 mg/dl y un 17% en los que éstos eran < 200 mg/ dl42. En el mismo sentido, el aumento del cHDL también fue más acusado en los pacientes con mayores concentraciones de triglicéridos. El efecto de las estatinas en la proporción de partículas de LDL pequeñas y densas es controvertido. Los estudios que se han llevado a cabo midiendo las subfracciones de las LDL con electroforesis no han demostrado dicho efecto, mientras que sí se ha observado en otros estudios, como el de Winkler et al43, realizado mediante la separación de las subclases de las LDL por ultracentrifugación.
Para decidir qué estatina y qué dosis emplearemos para tratar a un paciente determinado, hemos de considerar, en primer lugar, el porcentaje de descenso necesario para llegar al objetivo terapéutico del cLDL. En general, es preferible iniciar el tratamiento con dosi pravastatina y fluvastatina de liberación modificada, podría iniciarse el tratamiento con la dosis máxima de 40 mg/día y 80 mg/día, respectivamente44. Además, hay que considerar otros aspectos terapéuticos relacionados con las interacciones farmacológicas y los efectos secundarios, que se comentan en el apartado dedicado al tratamiento combinado.
En los distintos estudios de prevención primaria y secundaria de la enfermedad cardiovascular realizados con estatinas, los pacientes con diabetes mellitus se beneficiaron de forma similar a los no diabéticos45. La eficacia hipolipemiante de las estatinas en los pacientes con SM se ha demostrado en distintos ensayos clínicos, como el CHESS46, el STELAR47 y el COMETS48. En este último, el tratamiento con atorvastatina y con una estatina aún no comercializada en España (rosuvastatina), a dosis de 10 a 20 mg/día, logró descensos del cLDL superiores al 40% y cercanos al 50% en el caso de la rosuvastatina. Los triglicéridos disminuyeron cerca de un 25% y el cHDL aumentó entre un 6 y un 10%. Por otra parte, en éste y también en otros estudios, se ha observado que las estatinas inducen una acusada disminución de la proteína C reactiva (PCR), marcador de inflamación y predictor independiente del riesgo cardiovascular, que oscila entre un 20 y un 40%49,50.
La seguridad de las estatinas se ha evaluado ampliamente, y hoy se consideran unos fármacos extremadamente seguros51. Los 2 efectos secundarios más importantes son la toxicidad hepática y muscular. La primera se manifiesta por aumento de las transaminasas, en general leves, que no se acompañan de colestasis y es reversible al poco tiempo de interrumpir el tratamiento. En general, con las dosis más bajas de estatinas la incidencia de aumentos de transaminasas, 3 veces mayores que el límite máximo del intervalo de referencia, es inferior al 1%, y con las dosis máximas es inferior al 2-3%. La toxicidad muscular puede ponerse de relieve por mialgias, aumento de las enzimas musculares, o ambas; estas manifestaciones son poco frecuentes y revierten a los pocos días o semanas de interrumpir el tratamiento. Raramente puede aparecer una miopatía grave en forma de rabdomiólisis, que suele ocurrir en pacientes con factores predisponentes, en particular los tratados con combinaciones de fármacos, que pueden ocasionar un marcado aumento de las concentraciones de la estatinas, entre ellos los antifúngicos azólicos, algunos inmunodepresores y lo antibióticos macrólidos, así como ante la presencia de insuficiencia hepática o renal.
Fibratos. Los fármacos derivados del ácido fíbrico, el fenofibrato, bezafibrato y gemfibrozilo, tienen un efecto favorable sobre los 3 principales componentes de la dislipemia relacionada con el SM, es decir, la hipertrigliceridemia, la disminución del cHDL y el exceso de partículas LDL pequeñas y densas. Disminuyen también el cLDL, aunque de forma menos acusada que las estatinas, aspecto en el que el fenofibrato y el bezafibrato son más eficaces que el gemfibrozilo. Los fibratos actúan mediante la activación de los receptores nuclea res PPAR-a (peroxisome proliferator-activating receptor a) que modulan la transcripción de distintos genes, entre ellos los que intervienen en la síntesis y oxidación de los ácidos grasos y en la producción de apo A-V y de la enzima LPL. Estos fármacos inducen, así, una disminución de la síntesis y un aumento del aclaramiento de las lipoproteínas ricas en triglicéridos. Además, aumentan la expresión de los genes para la apo A I y la apo A II y, por ello, la producción de partículas de HDL y el correspondiente transporte inverso del colesterol mediante distintos mecanismos. Entre ellos está el aumento de la actividad del sistema ABCA-1, que expulsa el colesterol desde las células hacia las HDL, y de los receptores SR-B1/CLA-1, que actúan en la recogida del cHDL en los hepatocitos y de las células esteroidogénicas52,53.
Los fibratos disminuyen los valores de triglicéridos entre un 30 y un 50%54, y su efecto es tanto mayor cuanto más acusada es la hipertrigliceridemia. Aumentan el cHDL entre un 10 y un 20% y disminuyen el cLDL de forma muy variable, en general no más de un 15%55. El efecto más notable en las partículas LDL es la disminución de la proporción de LDL pequeñas y densas, con lo que se reduce su potencial aterogénico. Además, los fibratos disminuyen el riesgo trombótico por sus efectos sobre la agregación plaquetaria y las concentraciones de fibrinógeno, factor VII, inhibidor del activador del plasminógeno 1 (PAI-1) y la PCR, en algunos estudios en mayor medida que las estatinas56.
Los fibratos han demostrado su eficacia en la prevención cardiovascular de los pacientes diabéticos, en particular en los pacientes con enfermedad coronaria y cHDL disminuido57, así como en evitar la progresión de la aterosclerosis en los pacientes coronarios que presentan una dislipemia moderada58. En análisis del Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial (VA-HIT) 24,25 se observó que el beneficio del tratamiento con gemfibrozilo fue mayor entre los 627 pacientes que eran diabéticos, al igual que en los que tenían concentraciones elevadas de insulina en ayunas24; el efecto del fármaco dependió más de la presencia o la ausencia de resistencia a la insulina que de la concentración del cHDL25. En el Diabetes Atherosclerosis Intervention Study (DAIS), realizado en 731 pacientes diabéticos con alteraciones moderadas de las lipoproteínas y enfermedad cardíaca coronaria58, el tratamiento con fenofibrato durante un período de 3 años disminuyó la progresión de las lesiones coronarias valoradas con angiografía respecto a los tratados con placebo. Se observó una menor incidencia de enfermedad cardiovascular en el grupo de intervención respecto al placebo, aunque sin llegar a la significación estadística, ya que el tamaño muestral no se había calculado atendiendo a esta variable. En el Helsinki Heart Study, estudio de prevención primaria con gemfibrozilo en pacientes hipercolesterolémicos, el mayor beneficio lo obtuvieron los pacientes con mayor índice de masa corporal, con mayores concentraciones de triglicéridos y menores de cHDL59. En el mismo sentido, en el Bezafibrate Infarction Prevention Study (BIP)60, estudio de prevención secundaria con bezafibrato, se observó una disminución de la enfermedad coronaria en los pacientes con hipertrigliceridemia, pero no en los que tenían unas concentraciones de triglicéridos inferiores a 200 mg/dl.
Al igual que ocurre con las estatinas, los fibratos pueden dar lugar a aumentos de las transaminasas, en general leves, sin que se hayan documentado casos de hepatitis graves o de evolución a la cronicidad. La incidencia de miopatía es rara cuando se usan en monoterapia, salvo que coexista insuficiencia renal, situación en la que pueden producirse marcados aumentos de las concentraciones plasmáticas de estos fármacos. Los fibratos pueden potenciar, asimismo, el efecto de los anticoagulantes orales, por lo que su administración en pacientes tratados con estos agentes exige una estrecha monitorización del tiempo de protrombina55.
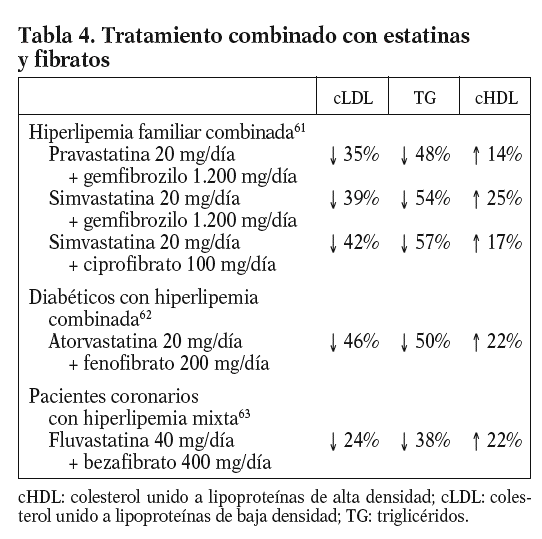
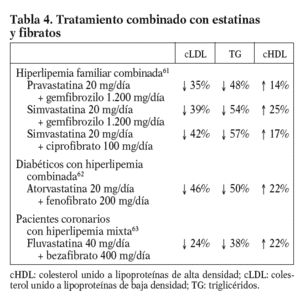
Tratamiento combinado de fármacos hipolipemiantes. La combinación de fibratos y estatinas es muy eficaz para controlar las alteraciones del metabolismo lipídico del SM y de la diabetes mellitus, cuando éstas no se corrigen con monoterapia. En la tabla 4 se detallan los efectos lipídicos de las distintas combinaciones de fibratos y estatinas61-63, entre los que destaca un descenso de los triglicéridos y un aumento del cHDL muy superior al logrado con estatinas en monoterapia; mientras que el incremento del efecto hipocolesterolemiante de las estatinas al asociar un fibrato suele ser más modesto. La combinación de fibratos con estatinas tiene un mayor riesgo de efectos secundarios, en particular de miopatía, y requiere una monitorización más estrecha del paciente. Conviene tener especial precaución en los pacientes ancianos y en los sujetos de volumen corporal pequeño, así como es conveniente seguir determinadas recomendaciones, como verificar la función renal y tiroidea, administrar las estatinas separadas 12 h de la toma de fibratos, valorar interacciones con otros fármacos, usar al inicio dosis bajas de estatinas, emplear con preferencia bezafibrato o fenofibrato, controlar periódicamente los valores de creatincinasa y vigilar aparición de síntomas de miopatía. Si se tienen en cuenta estas precauciones, el riesgo de miopatía es muy bajo.
En un metaanálisis de los estudios realizados con la combinación de fluvastatina y fibratos64,en el que se incluyó a un total de 1.018 pacientes tratados durante un período de 16 a 108 semanas, se observó que el perfil lipídico basal determinaba en gran medida la respuesta al tratamiento. Así, cuanto mayor era la concentración basal de triglicéridos, mayor era el descenso de los triglicéridos y menor el descenso del cLDL y del colesterol no-HDL. El cHDL aumentó en mayor grado en los pacientes con una marcada hipoalfalipoproteinemia (cHDL < 35 mg/dl) que en los que tenían mayores concentraciones de cHDL. En cuanto a la aparición de efectos secundarios musculares, se observó un aumento de la creatincinasa superior a 10 veces el valor máximo de referencia sólo en 2 pacientes (0,2%).
Para prevenir la miopatía debida a la combinación de estatinas y fibratos hay que tener en cuenta que hay determinados grupos farmacológicos que pueden potenciar la toxicidad de las primeras. Así, las estatinas que se metabolizan por la isoenzima 3A4 del citocromo P450 (lovastatina, simvastatina y atorvastatina) tienen interacciones con fármacos que inhiben o utilizan esta misma vía de eliminación. La pravastatina se metaboliza a través de reacciones de sulfatación, independientes del citocromo P450. El riesgo de rabdomiólisis es menor cuando las estatinas se combinan con fenofibrato que con gemfibrozilo65. Así, se ha descrito que las concentraciones plasmáticas de las estatinas aumentan de forma muy acusada cuando se administran en combinación con gemfibrozilo66, mientras que esto no ocurre cuando se asocian a fenofibrato o bezafibrato.
La combinación de ezetimiba con fenofibrato mantiene el efecto favorable del fibrato sobre los triglicéridos, el cHDL y la proporción de partículas de LDL pequeñas y densas, mientras que incrementa la disminución del cLDL y del colesterol no-HDL lograda con el fenofibrato en monoterapia67. La asociación con ezetimiba no modifica las concentraciones plasmáticas de fenofibrato, mientras que las de ezetimiba se incrementan en aproximadamente un 50%, lo que no se considera clínicamente relevante. En un estudio de pacientes con dislipemia mixta67, la administración de fenofibrato 160 mg/día con ezetimiba 10 mg/día logró una disminución del cLDL del 20% y del colesterol no-HDL del 30%. Igual que ocurre con el fenofibrato en monoterapia, esta combinación disminuyó de forma más acusada el cLDL y el colesterol no-HDL en los pacientes con triglicéridos poco elevados (< 3,1 mmol/l) que en los que presentaban hipertrigliceridemias más acusadas (un 28 frente a un 13%, respectivamente). No se observó una mayor incidencia de efectos secundarios con la combinación respecto a la monoterapia con fenofibrato. Esta pauta terapéutica aún no se ha aprobado para su uso clínico.
Combinación con otros fármacos. El ácido nicotínico es un fármaco eficaz para incrementar el cHDL y disminuir los triglicéridos y el cLDL, pero suele provocar flushing, un efecto que condiciona el abandono del tratamiento en un porcentaje muy alto de pacientes, y que puede limitarse con la administración de dosis bajas de aspirina media hora antes de su administración. En Estados Unidos están comercializadas formas de ácido nicotínico de liberación modificada con menos efectos secundarios. El ácido nicotínico puede aumentar las concentraciones séricas de glucosa, cuando se usa a dosis altas, pero ello no suele ocurrir si las dosis son inferiores a 2 g/día68. La combinación de estatinas y ácido nicotínico se ha mostrado eficaz para disminuir el cLDL y los triglicéridos, aumentar el cHDL e inducir la regresión de la arteriosclerosis y prevenir la enfermedad coronaria en estudios de seguimiento angiográfico69.
Los ácidos grasos omega-3 tienen una potencia moderada para disminuir los triglicéridos y en menor medida el cLDL. Su eficacia en prevención cardiovascular se ha demostrado en distintos estudios70, y se ha atribuido a su impacto estabilizante de membrana celular y los consiguientes efectos antitrombóticos y antiinflamatorios, además de los lipídicos, lo que aumenta su interés para el tratamiento de los pacientes con SM.
Los esteroles vegetales a dosis de hasta 2 g/día pueden disminuir el cLDL hasta un 15% y, administrados en forma de suplementos añadidos a distintos productos lácteos o a las margarinas vegetales, pueden emplearse asociados, tanto a fibratos como a estatinas para aumentar el efecto reductor del cLDL71.
Tratamiento de la hiperlipemia en el síndrome metabólico. En cuanto a la estrategia que se debe seguir en el tratamiento de la hiperlipemia en los adultos con SM, son precisas las siguientes puntualizaciones:
En los pacientes con SM y concentraciones elevadas de triglicéridos, los fármacos de primera elección son los fibratos. Las estatinas pueden ser moderadamente eficaces en la hipertrigliceridemia moderada-grave, pero en general carecen de eficacia en las hipertriglicerdemias graves (> 1.000 mg/dl) y en el síndrome de hiperquilomicronemia. En tercer lugar, el ácido nicotínico es otra alternativa más eficaz que las estatinas, pero con los inconvenientes derivados de sus efectos secundarios. Los ácidos grasos omega-3 pueden emplearse, en general, como terapia coadyuvante a otros fármacos.
Para aumentar el cHDL los fármacos de primera elección son los fibratos y, en segundo lugar, el ácido nicotínico. Resultados prometedores iniciales se han obtenido con el empleo de torcetrapib, un inhibidor de la PTEC, que puede incrementar el cHDL en más de un 50%72. No obstante, recientemente, un estudio en fase III con el uso de este fármaco ha tenido que ser suspendido al haberse detectado un incremento de mortalidad73.
Para disminuir el cLDL los fármacos de primera elección son las estatinas. La ezetimiba en monoterapia tiene una eficacia limitada y se considera de segunda elección, igual que los fibratos, los esteroles vegetales y las resinas.
Dado el alto riesgo cardiovascular de los pacientes con SM, es necesario que cuando no se alcancen los objetivos terapéuticos con la monoterapia se considere el empleo de las asociaciones farmacológicas antes mencionadas, no sólo para disminuir el cLDL sino para mejorar el metabolismo de los triglicéridos, el transporte reverso del colesterol y las alteraciones cualitativas de las lipoproteínas. En las hipertrigliceridemias que no se controlan con monoterapia puede utilizarse la combinación de fibratos y ácidos grasos omega-3 o de fibratos y ácido nicotínico, pero teniendo en cuenta los efectos secundarios de éste último. La asociación de fibratos y ezetimiba es probable que en un futuro próximo se defina como una buena alternativa terapéutica para la hiperlipemia mixta.
Recomendaciones finales
El aumento del riesgo cardiovascular asociado al SM reside, en una gran parte, en la dislipemia característica que acompaña al mismo. Se trata de una alteración del metabolismo lipídico habitualmente común a distintas situaciones clínicas, como la obesidad visceral, la resistencia a la insulina, la DM2 bien establecida y el propio SM.
La expresividad clínica de la dislipemia del SM, aun siendo variable, tiene algunos elementos definitorios, que no son otros que la hipertrigliceridemia y el cHDL bajo, y son tan relevantes que forman parte de los criterios diagnósticos establecidos comúnmente para el citado SM. Además, estos enfermos tienen un elevado número de partículas ricas en apo B-100 con un fenotipo especialmente aterogénico (LDL pequeñas y densas). Por otra parte, la riqueza en partículas ricas en triglicéridos (VLDL) se demuestra tanto en situación basal como en situación de sobrecarga grasa (hiperlipemia posprandial). De esta forma, la dislipemia "cuantitativa" (hipertrigliceridemia y cHDL bajo), la "cualitativa " (LDL ricas en apo B, pequeñas y densas), junto con la resistencia a la insulina (en el trasfondo de la dislipemia) constituyen una tríada con conocido potencial aterogénico. Por tanto, para el diagnóstico de la dislipemia del SM cabe acudir a determinaciones cuantitativas y cualitativas en el perfil lipídico. La hipertrigliceridemia (superior a 150 mg/dl) y las bajas concentraciones de cHDL (inferior a 40 mg/dl en el varón y a 50 mg/dl en la mujer) son definitorias. Junto a ello, es muy útil encontrar un incremento paralelo del colesterol no-HDL. El empleo de este último parámetro es especialmente aconsejable cuando existe, como suele ser la norma, una hipertrigliceridemia.
La terapéutica en el SM, con independencia del control del peso, la presión arterial, la hiperglucemia o la franca diabetes, se orienta hacia el mantenimiento de cifras óptimas de lípidos plasmáticos, y se establecen objetivos terapéuticos asimilables a situaciones de alto riesgo, debido a la coexistencia de múltiples factores de riesgo cardiovascular. En este sentido, la cifra de cLDL que se debe considerar como objetivo primario que alcanzar será inferior a 100 mg/ dl (o 70 mg/dl en casos de cardiopatía isquémica previa o equivalentes de ésta). Además, se configura como objetivo prioritario la elevación de las cifras de cHDL por encima de 40 mg/dl en el hombre o 50 mg/ dl en la mujeres. Dado que la hipertrigliceridemia está presente de forma habitual, se prestará atención a un objetivo para colesterol no-HDL de 130 mg/dl.
El estilo de vida, con el mantenimiento de una dieta adecuada y un programa de actividad física, forma parte esencial del tratamiento. No obstante, ante la necesidad de un tratamiento farmacológico, los fibratos y las estatinas son los fármacos más eficaces para controlar la dislipemia del SM. Los primeros, por su eficacia para disminuir los triglicéridos y aumentar el cHDL, anomalías más frecuentes, y los segundos, por su eficacia en disminuir el cLDL, aunque la hipercolesterolemia sea más infrecuente. Adicionalmente, la combinación de fibratos y estatinas es muy eficaz para controlar las alteraciones combinadas o intensas en el perfil lipídico del SM.