Introducción
Hay evidencias de la relación entre la arteriosclerosis y la enfermedad renal progresiva, que en parte se justifican por la acelerada mortalidad cardiovascular en pacientes con enfermedad renal1-3. La dislipemia contribuye al grado de progresión de la arteriosclerosis y de la enfermedad renal crónica. También la enfermedad renal crónica conduce al desarrollo de anomalías secundarias en el metabolismo lipídico que contribuyen a aumentar la mortalidad y la morbilidad cardiovascular4.
Así, la hipercolesterolemia y la hipertrigliceridemia, reconocidos contribuyentes a la arteriosclerosis, son también factores de riesgo emergentes para la progresión de la enfermedad renal5-6.
Además, la comprensión de la patogenia del daño de los vasos en la arteriosclerosis nos lleva al conocimiento de mecanismos que permiten saber que el daño renal, así como la hiperlipemia, aceleran la tasa de glomerulosclerosis, y la reducción de los valores lipídicos reduce el daño glomerular7-10.
Se precisan, sin embargo, más evidencias que sustenten claramente la hipótesis de que la corrección de los trastornos lipídicos mejora la evolución de las nefropatías. Estudios previos en el modelo experimental que utilizamos en nuestro grupo de trabajo11-14 pollos alimentados con una dieta aterogénica lo han validado como modelo para el estudio de procesos de arteriosclerosis e hígado graso. Se planteó, entonces, la idea del estudio de los efectos de esta experimentación sobre un órgano como el riñón y la posibilidad de validarlo como modelo para el estudio de la glomerulosclerosis renal inducida por una dieta hiperlipémica.
Numerosos estudios han demostrado de manera evidente que las estatinas son eficaces en la reducción del tamaño de la lesión arteriosclerótica y disminuyen el colesterol plasmático o mediante sus efectos pleiotrópicos. En diversos trabajos realizados en animales de experimentación se muestra que la hiperlipemia puede contribuir al desarrollo y la progresión de la lesión y que la corrección de las anomalías lipídicas mejora las lesiones renales15. Sin embargo, no abundan los estudios en humanos o animales en que se utilicen estatinas para valorar sus efectos sobre la lesión renal.
Por ello, nos planteamos la aplicación del citado modelo para estudiar el efecto de la atorvastatina en el depósito de lípidos en el riñón, en los siguientes desarrollos experimentales:
1. Regresión espontánea de la lesión renal inducida por una dieta hiperlipémica (grupo C, al que se le retira posteriormente la dieta hiperlipémica).
2. Papel de la atorvastatina en procesos de regresión y progresión de la lesión renal inducida por una dieta hiperlipémica (grupo D o de regresión farmacológica, al que se le retira la dieta hiperlipémica y simultáneamente se le administra atorvastatina, y grupo E o de progresión en el que se continúa con la dieta hiperlipémica y se trata también con atorvastatina).
Con el fin de demostrar los objetivos planteados estudiamos el perfil lipídico plasmático y las características histológicas de los distintos grupos experimentales. También realizamos la cuantificación de los depósitos grasos por sistemas semicuantitativos y análisis de imagen. El objetivo último fue, pues, estudiar histológicamente los efectos de la terapia con atorvastatina y la dieta, en grupos experimentales en los que se mantuvo o se retiró una dieta hiperlipémica, esto es, valoramos el efecto de este fármaco en los fenómenos de progresión y regresión de los depósitos grasos en el riñón, así como la validación del modelo experimental.
Material y método
Animales
Para la realización de los protocolos experimentales se utilizaron 100 pollos de la raza White-Leghorn, de 3 semanas de edad, aislados en una habitación con temperatura controlada (dependencias del Hospital Clínico Veterinario de la Universidad de Murcia) y alimentados con la dieta usual para este tipo de animales. Tanto las jaulas de los animales como los procedimientos de sacrificio se ajustaron a la legislación vigente en materia de bienestar y experimentación animal, y los protocolos experimentales fueron aprobados por el Comité de Bioética de la Universidad de Murcia.
Grupos experimentales
A los 21 días de edad se separaron de forma arbitraria en 2 grupos, para iniciar la fase de inducción, mediante distintos regímenes de alimentación.
Grupo A: 20 pollos alimentados con dieta normal (pienso estándar).
Grupo B: 80 pollos alimentados con dieta grasa compuesta por pienso estándar más colesterol puro (un 2% del total de la mezcla) y un 20% del total de aceites saturados (aceite de palma crudo). Estas dietas se mantuvieron durante 3 meses y a continuación el grupo B fue dividido en 4 grupos al azar, en una segunda fase, para los estudios de progresión y regresión, según el esquema presentado en la figura 1.
Grupo B: control con dieta grasa.
Grupo C: animales que recibieron una primera fase descrita de dieta grasa (3 meses) y una segunda fase con dieta normal (3 meses).
Grupo D: primera fase de 3 meses de inducción con dieta grasa seguida de retirada de la dieta grasa con administración de atorvastatina durante 3 meses.
Grupo E: inducción con dieta grasa durante 3 meses y segunda fase de 3 meses de mantenimiento de la dieta grasa, junto con administración de atorvastatina.
La estatina empleada, atorvastatina (Zarator®, Parke-Davis Pfizer, Madrid) se administró por vía oral a una dosis de 3 mg/ kg/día diluida en 2 ml de polietilenglicol. Se emplearon, como placebo, 2 ml de polietilenglicol en los grupos a los que no se administró el fármaco.
Previamente a la obtención del material de estudio, los animales se dejaron 12 h en ayunas. Posteriormente, se les extrajo muestras de sangre de la vena axilar o yugular, para las determi naciones bioquímicas, centrifugando a 3.000 rpm, durante 20 min, para obtener el plasma. El colesterol se determinó mediante el test color-enzimático (método CHOD-PAP). Los triglicéridos se determinaron por reacción colorimétrica, mediante la hidrólisis enzimática de los triglicéridos y la determinación enzimática subsiguiente del glicerol formado. Para ello, se emplearon los analizadores automáticos D2400 y P800 (Hitachi Ltd., Tokio, Japón) y reactivos de Roche Diagnostics (Barcelona).
Obtención del material
En cada una de las sesiones se anestesiaron 10 animales de cada grupo con una inyección intraperitoneal de pentobarbital (150 mg). En la disección, se obtuvieron las muestras de riñón de 10 animales por grupo experimental. Todo el proceso de anestesia, disección y fijación del material no excedió de los 30 min.
Histología
Para el estudio histológico se tomó una muestra de riñón por animal siempre de la misma región, que fueron fijadas por inmersión en un 10% de formaldehído en tampón fosfato salino con un pH de 7,4 (PBS), durante 10 h a temperatura ambiente. Posteriormente, se procesaron para su inclusión en parafina. Se obtuvieron cortes de 5 mm en un microtomo de rotación Microm (HM310).
Las secciones se depositaron en un portaobjetos impregnado con poli-L-lisina para evitar su desprendimiento16 y posteriormente se dejaron secar hasta el momento de la tinción. Se realizaron tinciones con hematoxilina-eosina, Periodic Acid Schiff (PAS)17 y tricrómico de Masson17.
Análisis de imagen
Posteriormente, se realizó una descripción de los riñones de cada animal según sus características histológicas y análisis cuantitativo de grasa. Los análisis cuantitativos se llevaron a cabo mediante una cámara Sony DXC151-AP acoplada a un microscopio Zeiss Axioskop conectado a un ordenador, con el software de análisis de imagen MIP-4.5 (Microm Image Processing Software, Digital Image System, Barcelona).
Valoración de la grasa
En la evaluación de la grasa se recogieron 3 tipos de datos:
1. Ausencia/presencia de grasa.
2. Tipo de depósito.
3. Tamaño y forma de la acumulación grasa.
1 y 2. Ausencia/presencia de grasa y tipo de depósito. Para la valoración de la ausencia/presencia de grasa y el tipo de depósito se realizó una valoración semicuantitativa, asignando puntuaciones numéricas con finalidad estadística a cada campo de observación, en un total de 100 campos (cuadrados de 134 mm de lado) por un grupo experimental. Se corresponde con 10 campos de observación por animal en muestras teñidas con hematoxilina-eosina.
Las puntuaciones asignadas fueron las siguientes:
Ausencia/presencia de grasa: 0, ausencia; 1, presencia.
Tipo de depósito: 0, inclusión lipídica aislada; 1, acumulación grasa y 2 mixto, combinación de los 2 anteriores.
Se analizó la media, el error estándar y el porcentaje de observaciones con presencia de grasa de cada grupo.
3. Tamaño y forma de la acumulación grasa. Las grandes acumulaciones grasas se valoraron por análisis de imagen. Tras la digitalización de la imagen, se seleccionaron interactivamente las acumulaciones, empleando el software MIP4.5. Se evaluaron el área, el diámetro máximo y la forma circular. El factor de forma circular correspondiente al círculo fue 1, mientras que 0 correspondió a una línea.
Estudio estadístico
Se realizó el análisis estadístico de los datos mediante el software SPSS 11, realizando una prueba ANOVA y un test de comparaciones múltiples, con una p < 0,05.
Resultados
Tras la obtención del plasma, se analizaron los valores de colesterol y triglicéridos (tabla 1). En los resultados analíticos de colesterol y triglicéridos destacan los altos valores de éstos en el grupo B (dieta aterogénica) en contraste con las concentraciones obtenidas del grupo control A (animales sanos con alimentación estándar). Estos valores disminuyen en los grupos de regresión, en el caso del grupo C y en el grupo D, de regresión e intervención. También disminuyen en el grupo E, de progresión con intervención. Tras el análisis estadístico, se observaron diferencias significativas en los valores de colesterol y triglicéridos entre el grupo B y el resto de los grupos experimentales.
Figura 1. Esquema del diseño experimental empleado en el suministro de las dietas.
Descripción microscópica cualitativa
Esta descripción se ha realizado atendiendo a las características morfológicas indicativas de afectación renal: depósitos de grasa, focos inflamatorios, daño glomerular y fibrosis.
A continuación se detallan las características encontradas en cada grupo experimental.
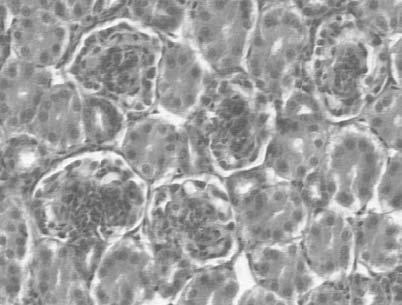
Figura 2. Imágenes histológicas características de cada grupo experimental: a) grupo A; b y c) grupo B; d) grupo C; e) grupo D; f) grupo E. CR: corpúsculo renal; fi: focos inflamatorios; flechas: grasa; barra en a, b, d, e, f: 30 mm; barra en c: 50 mm.
En el grupo A, grupo control o de individuos sanos, no se observaron depósitos de grasa, focos inflamatorios ni daño glomerular. Tampoco se observó fibrosis (fig. 2a).
En el grupo B, grupo control con dieta aterogénica, destacaban numerosas acumulaciones de grasa, que en muchas ocasiones ocupaban prácticamente todo el citoplasma en varias células contiguas, formando grandes acumulaciones grasas. En algunos cortes se observaban focos inflamatorios difusos rodeando las acumulaciones grasas. El mesangio de los glomérulos aparecía habitualmente denso y, en ocasiones, algunos casos obliterando la luz, características indicativas de daño glomerular (fig. 2b).
En el grupo C, grupo de regresión con dieta normal sin intervención con atorvastatina, se observaron numerosos depósitos grasos, aunque de menor tamaño y en menor cantidad. No eran destacables los focos inflamatorios. Los glomérulos presentaban un aumento del mesangio, aunque en menor cantidad que el grupo B. No se observaba fibrosis (fig. 2c).
En el grupo D, grupo de regresión con dieta normal e intervención administrando atorvastatina, las acumulaciones grasas prácticamente eran inexistentes y se asemejaban a las características del grupo control A. No se observaban focos inflamatorios. No destacaba daño glomerular ni fibrosis (fig. 2d).
En el grupo E, grupo de progresión con dieta aterogénica e intervención con atorvastatina, se describieron también grandes acumulaciones grasas y pequeños depósitos intracelulares aislados. Se observaron pequeños focos inflamatorios, daño glomerular moderado y no destacó fibrosis (fig. 2e).
Valoración microscópica cuantitativa
La valoración microscópica cuantitativa se llevó a cabo por análisis de imagen.
Valoración semicuantitativa de ausencia/presencia de grasa
Los resultados de la valoración de ausencia-presencia de grasa se exponen en la tabla 2. En el grupo control sano (grupo A) no se observó la existencia de grasa intracelular aislada ni grandes acumulaciones grasas confluyentes. Los grupos B, C y E presentaron una destacada presencia de grasa en el riñón sin que hubiera diferencias significativas entre ellos. El grupo D, de regresión e intervención, presento una menor presencia de grasa que los anteriores, lo que supuso una diferencia significativa con todos los grupos.
Tras el análisis de la frecuencia de ausencia/presencia de grasa en cada grupo experimental (tabla 2), encontramos que todos los campos de observación del grupo A carecían de grasa mientras que los mayores porcentajes se encontraban en los grupos B y C, y fueron menores en los 2 grupos de intervención del estudio (grupos D y E); el grupo D, de regresión con intervención, mostró los porcentajes más bajos de presencia de grasa, diferencia que fue significativa. Los animales del grupo E, de progresión con intervención, también mostraron un bajo porcentaje de presencia de grasa, aunque esta diferencia no fue significativa.
Valoración del tipo de depósito graso
Dentro de los riñones que presentaban grasa encontramos que las muestras del grupo B mostraban un tipo de depósito mixto y el menor valor de puntuación se encontraba en el grupo D, y puso de manifiesto el menor contenido graso en forma de pequeños depósitos o inclusiones aisladas (tabla 2).
Además, se estudió qué porcentaje representaba cada tipo de depósito (tabla 3). En la observación de las muestras de riñón del grupo B, el 100% de las observaciones se clasificaron como tipo 2, es decir de tipo mixto, y presentaron acumulaciones grasas de gran tamaño y células con pequeñas inclusiones lipídicas, lo que supuso una diferencia estadísticamente significativa con el resto de los grupos. En el grupo C, el porcentaje de pequeños y grandes depósitos grasos fue muy similar, mientras que en el grupo D el mayor porcentaje correspondía a los pequeños depósitos de grasa. Por último, cabe destacar que en el grupo E predominaron las grandes acumulaciones lipídicas.
Valoración del tamaño y la forma de las acumulaciones grasas
Los resultados se exponen en la tabla 3.
Diámetro máximo. El mayor diámetro máximo de las acumulaciones grasas se encontró en el grupo B, con diferencias significativas en todos los grupos. También, en el grupo D, de regresión e intervención con atorvastatina, se encontró que el diámetro de la acumulación grasa es significativamente menor respecto al resto de los grupos.
Área y forma circular. Al igual que con el diámetro máximo, se apreciaron diferencias significativas entre el grupo control de dieta aterogénica (grupo B) y el resto de los grupos. En el grupo D, se encontró que el área de la acumulación grasa fue significativamente menor y presentó la mayor tendencia a la forma circular (fig. 3).
Figura 3. Representación gráfica del área de las acumulaciones grasas en los distintos grupos experimentales.
Discusión
Los valores de colesterol del grupo control de dieta aterogénica superan de forma significativa a los obtenidos en el grupo control sano y se observa un descenso de colesterol y triglicéridos en los de regresión espontánea, más potenciado en el grupo de intervención y regresión. Estos resultados coinciden con los encontrados por otros investigadores usando atorvastatina y otras estatinas12,18.
En nuestro estudio se han valorado los depósitos grasos en el riñón en los distintos grupos experimentales en las muestras histológicas. En el riñón, de forma paralela a lo que ocurre a escala sistémica en la arteriosclerosis, en este caso glomerulosclerosis, el proceso se inicia con el depósito de grasa y la formación de células espumosas en distintas zonas, lo que representa la fase xantomatosa o de lesión inicial. El significado de depósitos grasos en el riñón y su relación con la enfermedad renal progresiva son un tema de creciente interés19.
En revisiones bibliográficas, no hemos encontrado estudios similares en los que se cuantifique mediante análisis de imagen la cantidad, la morfología, así como la distribución de los depósitos grasos en distintos grupos de estudio.
En la valoración semicuantitativa de la ausencia o la presencia de grasa renal, en el grupo D encontramos diferencias significativas en el análisis del factor presencia de grasa. Por ello, podemos decir que la atorvastatina acompañada de una dieta adecuada en nuestro modelo de estudio produce una regresión de la enfermedad. Ni la dieta por sí sola ni la atorvastatina en el grupo de progresión provocan beneficios significativos en la presencia de grasa en parénquima renal en el tiempo empleado en este experimento.
Aunque el grupo E de progresión con estatinas muestra una menor presencia de grasa que los grupos B, grupo de dieta aterogénica, y C, grupo de regresión sin intervención, no podemos decir que la atorvastatina en el tiempo empleado impida la progresión de forma significativa.
En la observación de las muestras de riñón que contenían grasa del grupo B (control con dieta aterogénica), el 100% presentaban pequeñas inclusiones y grandes acumulaciones grasas, lo que interpretamos como una característica de una mayor afectación grasa en el riñón. En cambio en el grupo D, con retirada de la dieta aterogénica e intervención con atorvastatina, que era el que menor cantidad de grasa renal había presentado, predominaban las pequeñas inclusiones lipídicas. Según lo observado, se podría sugerir que la enfermedad en su inicio presenta pequeñas inclusiones lipídicas y cuando esta avanza la grasa ocupa todo el citoplasma celular en varias células contiguas formando acumulaciones grasas de gran tamaño.
El efecto de la atorvastatina sobre la eliminación de los acúmulos grasos comienza por una disminución en las grandes acumulaciones y, en este caso y en el tiempo empleado, hemos observado una disminución significativa de la grasa renal en el grupo de progresión con intervención (grupo E) en comparación con el grupo B de dieta aterogénica, por lo que podemos decir que frena la progresión. En el mismo sentido, Vázquez Pérez et al20 describieron la reducción del contenido lipídico renal, usando atorvastatina en conejos alimentados con una dieta hiperlipémica.
Al encontrar diferencias significativas entre el grupo B, y el resto de los grupos tanto en el área como en el diámetro máximo, la atorvastatina acelera la regresión del depósito de grasa e impide de forma significativa la progresión de la enfermedad renal por depósito graso.
Del estudio de los depósitos grasos, cabe destacar que el suministro de una dieta aterogénica indujo en los animales la aparición de acumulaciones de mayor tamaño y, de forma irregular. Sin embargo, al añadir atorvastatina y de forma más destacada, si realizamos a la vez una retirada de la dieta aterogénica, el tamaño y la cantidad del depósito graso disminuye y aumenta la dispersión de la grasa, que se sitúa en células aisladas, tomando forma circular los pequeñas acumulaciones restantes.
Junto con estos hallazgos, que indican el papel de la atorvastatina en la disminución de acumulaciones grasos en el riñón, otros autores han demostrado también que las estatinas reducen la inflamación y la fibrosis en el tejido renal y aumentan la perfusión, asociada a un descenso del estrés oxidativo, en un estudio con cerdos sometidos a una dieta hipercolesterolémica y tratados con simvastatina21; previenen la expresión del receptor de la lipoproteína de baja densidad oxidada en la arteria renal (estudios con fluvastatina en conejos sometidos a dieta hipercolesterolémica22), o preservan la función endotelial (modelo de ratas Sprague Dawley tratadas con pravastatina23). Todos estos hallazgos reflejan el efecto nefroprotector de los inhibidores de la HMG-CoA-reductasa.
En resumen, podemos concluir que nuestro modelo experimental constituye para el estudio del riñón graso un modelo homogéneo y de fácil manejo y cuyos resultados se pueden contrastar con los de otras especies. La retirada de la dieta grasa y administración simultánea de atorvastatina da lugar a los índices más bajos en la cuantificación de depósitos grasos renales. La retirada por sí sola de la dieta no produce efectos tan marcados. En los animales que mantenían una dieta grasa y, además, se les administraba atorvastatina sí se observó un bajo (aunque no significativo) porcentaje de depósitos grasos renales. Del estudio conjunto de los diferentes parámetros se deduce que la atorvastatina acelera la regresión y frena la progresión de las acumulaciones grasas renales.
Agradecimientos
Agradecemos la colaboración de la empresa Hijos de Juan Pujante, S.A. y Avícola Levantina, S.A. y de su veterinario, Dr. D. Juan Pablo Pérez Ruzafa. También queremos expresar nuestro reconocimiento a Pfizer España por el suministro de los fármacos.