El síndrome metabólico (SM) determina un estado proinflamatorio y protrombótico que contribuye al desarrollo de la enfermedad arteriosclerótica. La dieta y, particularmente, el tipo de grasa tienen un papel importante en la inflamación y, por lo tanto, en el desarrollo de este síndrome.
ObjetivoEstudiar el efecto posprandial de diferentes dietas en la proteína C reactiva (PCR) en pacientes con SM.
MétodosSe aleatorizó a 39 pacientes con SM, del estudio LIPGENE, para recibir una de estas dietas: una rica en SFA, una rica en MUFA y dos dietas bajas en grasa y ricas en hidratos de carbono complejos, una de ellas con PUFA n-3 de cadena larga (1,24g/día) y la otra con placebo. Antes y después de cada período de intervención dietética, los pacientes se sometieron a una sobrecarga grasa con iguales tipo y composición de grasa que la dieta consumida durante las 12 semanas. Se determinaron las concentraciones plasmáticas de PCR a las 0, 1, 2, 3, 4, 5, 6 y 8h durante el estudio posprandial.
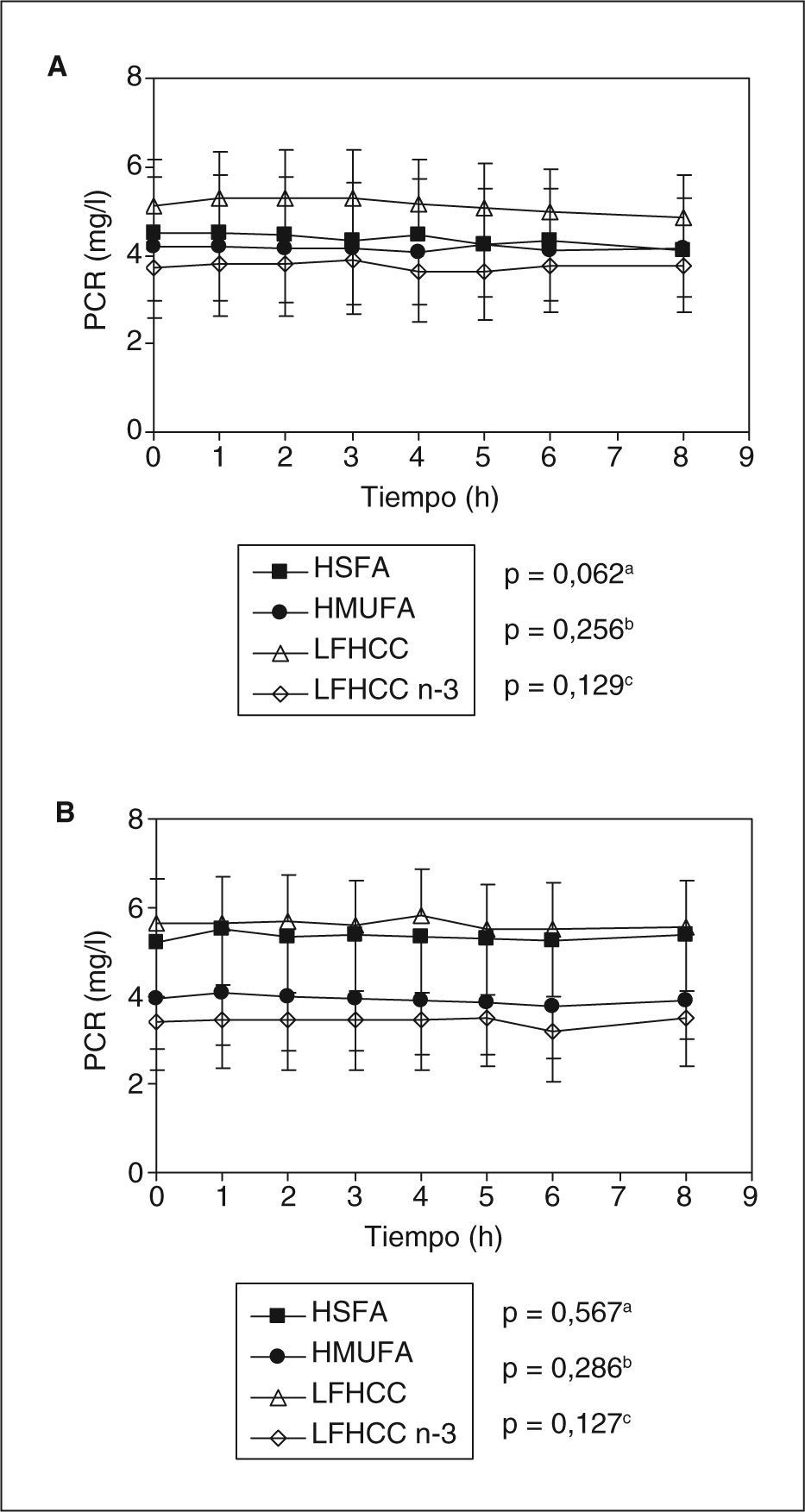
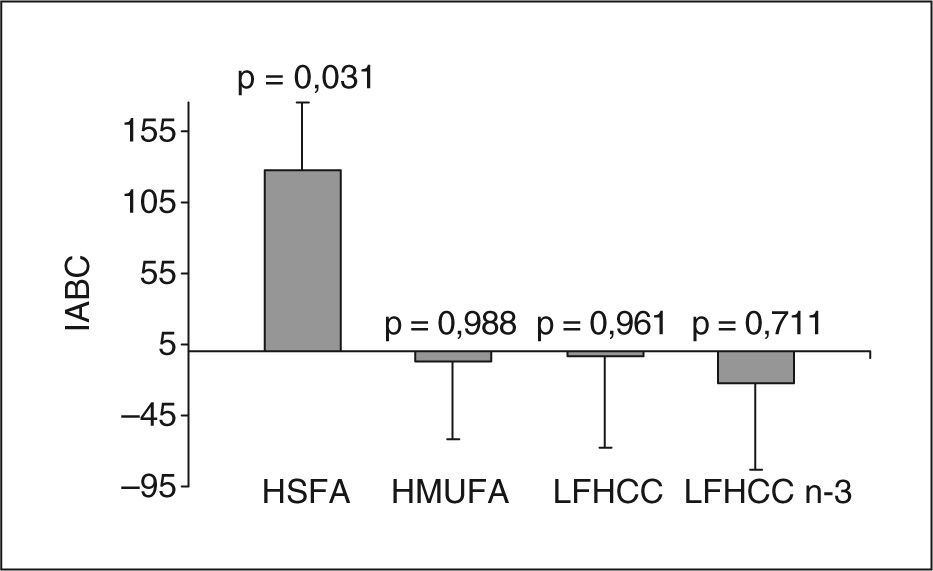
ResultadosNo se observaron diferencias significativas en las concentraciones plasmáticas de PCR, entre los pacientes que consumieron las cuatro dietas, en ninguno de los estudios posprandiales. Tras el consumo a largo plazo, cuando se comparó la fase preintervención con la postintervención, al estudiar el incremento del área bajo la curva de la PCR, se observó un aumento significativo en el grupo que consumió la dieta rica en SFA (p=0,031).
ConclusionesEl consumo a largo plazo de una dieta rica en SFA, y no de una rica en MUFA o pobre en grasa con/sin PUFA n-3, produce un aumento posprandial de la PCR en comparación con el consumo agudo, lo que indica un aumento a largo plazo de la respuesta inflamatoria en pacientes con SM que consumen una dieta rica en grasa saturada.
The metabolic syndrome (MS) promotes a proinflammatory and prothrombotic state that contributes to the development of atherosclerosis. The diet and particularly the type of fat, plays an important role in the inflammation and therefore in the development of this syndrome.
ObjectiveTo study the postprandial response of different diets on C-reactive protein in MS patients.
MethodsThirty nine patients with MS from the LIPGENE study were randomized to receive one of the following four diets over a period of 12 weeks: a diet rich in SFA, a diet rich in MUFA, and two low-fat, high complex carbohydrate diets, one of them supplemented with long chain n-3 PUFA (1.24g/day) and the other with placebo. Previously (pre) and after (post) the dietary intervention period, patients consumed a fat meal with the same type and composition of fat as in the diet consumed during the 12 weeks. The C reactive protein (CRP) plasma concentration was determined before and 1, 2, 3, 4, 5, 6 and 8h after the fat meal consumption.
ResultsNo significant differences in CRP plasma levels were found among the patients who consumed each diet, neither in the pre- or post-intervention postprandial studies. Nevertheless, we did find that the differences in the area under the curve for the CRP during the postprandial state was significantly increased in the group who consumed the SFA-rich diet (p=0.031), when compared the pre- and post-intervention postprandial studies owing to the long-term consumption of this diet, but not in the MUFA-rich or low fat with or without n-3 PUFA diet.
ConclusionsThe chronic intake of a SFA-rich diet, but not the MUFA-rich or low fat with or without long chain n-3 PUFA diet, produces a postprandial increase of the CRP plasma levels when compared with the acute intake, which suggests a long-term increase in the inflammatory response in patients with MS who consumed a SFA-rich diet.
El síndrome metabólico (SM) está caracterizado por diferentes combinaciones de alteraciones metabólicas y condiciones físicas que producen una aterosclerosis acelerada y un aumento del riesgo de diabetes mellitus tipo 21,2. Es una enfermedad con una prevalencia elevada y muy dependiente de la edad. La etiología del SM aún no está definida, aunque probablemente sea la consecuencia de una compleja interacción entre factores genéticos, metabólicos y ambientales, entre los que destacan la dieta y, sobre todo, el tipo de grasa3.
El proceso inflamatorio, uno de los factores asociados y que más contribuye al SM, desempeña un papel muy importante en el desarrollo de la enfermedad arteriosclerótica y sus complicaciones4,5. Este hecho ha generado un enorme interés en la identificación de marcadores que pueden ser detectados en la sangre y que podrían reflejar el estado de la inflamación subyacente en la pared vascular.
Recientemente, se ha propuesto que la proteína C reactiva (PCR) de alta sensibilidad es un buen candidato como marcador de riesgo cardiovascular, por varias razones: es un factor de predicción independiente de eventos cardiovasculares en personas con o sin enfermedad cardiovascular y, además, diversas intervenciones que disminuyen el riesgo también reducen la PCR6.
Desde hace tiempo se sabe que la dieta y, concretamente, los ácidos grasos pueden modular la respuesta inflamatoria. Recientemente, se ha apuntado a que el consumo de una dieta rica en aceite de oliva virgen está asociado a una reducción de los marcadores de inflamación en pacientes con SM7,8. Por otro lado, también hay estudios que demuestran los efectos antiinflamatorios de los ácidos grasos poliinsaturados n-39. La mayoría de estos hallazgos se han obtenido en situación de ayunas, aunque la situación fisiológica habitual del ser humano es el estado posprandial.
Se ha demostrado que la situación posprandial induce una respuesta inflamatoria caracterizada por una activación tanto de los leucocitos como de los mediadores plasmáticos inflamatorios. En un estudio realizado en personas sanas, se ha observado que cambios agudos en el contenido de ácidos grasos saturados e insaturados no afectaron las concentraciones plasmaticas de PCR durante el período posprandial10.
La respuesta inflamatoria en pacientes con SM ha sido poco estudiada en el estado posprandial. Por ello, nos hemos propuesto investigar el efecto agudo y a largo plazo del tipo y la cantidad de grasa de la dieta en las concentraciones plasmaticas de PCR, en situación posprandial, en una población con SM.
Pacientes y métodosPoblación y diseño del estudioSe aleatorizó a una población de 39 pacientes con SM, procedentes de la cohorte del estudio LIPGENE (Diet, genomics and the metabolic syndrome: an integrated nutrition, agrofood, social and economic analysis), con edades entre 30 y 70 años, para recibir uno de los cuatro períodos de intervención dietética de 12 semanas de duración. Se definió SM según los criterios publicados11,12, que coincidieron con los criterios de inclusión y exclusión del LIPGENE13. Todos los voluntarios firmaron un consentimiento informado y fueron examinados física y clínicamente antes de comenzar. El estudio se ha realizado en la Unidad de Lípidos y Arteriosclerosis del Hospital Universitario Reina Sofía de Córdoba, y fue aprobado por el comité ético local.
La composición de las cuatro dietas fue la siguiente:
- 1.
Dieta rica en grasa (38%, energía), rica en grasa saturada (16%, SFA o ácidos grasos saturados; 20%, MUFA o ácidos grasos monoinsaturados; 6%, PUFA o ácidos grasos poliinsaturados) (HSFA).
- 2.
Dieta rica en grasa (38%, energía), rica en grasa monoinsaturada (8%, SFA; 20%, MUFA; 6%, PUFA) (HMUFA).
- 3.
Dieta pobre en grasa (28%, energía), rica en hidratos de carbono complejos (8%, SFA; 11%, MUFA; 6%, PUFA) con 1,24g/día de PUFA n-3 de cadena larga (LFHCC n-3).
- 4.
Dieta pobre en grasa (28%, energía), rica en hidratos de carbono complejos (8%, SFA; 11%, MUFA; 6%, PUFA) con 1g/día de aceite de girasol alto oleico (placebo) (LFHCC).
Antes y después del período de intervención dietética, todos los voluntarios se sometieron a un estudio de lipemia posprandial: tras 12h de ayuno, los pacientes tomaron un desayuno graso de igual composición que el que consumían en el período de dieta. Esta comida consistió en la mitad y dos tercios de las calorías diarias ingeridas habitualmente por el individuo, y compuesta de grasa (0,7g/kg de peso), colesterol (5mg/kg de peso) y vitamina A (60.000 U/m2 de superficie corporal), con la siguiente distribución calórica: el 65% de grasa, el 10% de proteínas y el 25% de hidratos de carbono. Se realizaron extracciones sanguíneas en el tiempo 0 y a las 1, 2, 3, 4, 5, 6 y 8h después de consumir el desayuno graso. La composición de estas comidas fue la siguiente: desayuno HSFA: SFA (38%), MUFA (21%), PUFA (6%); desayuno HMUFA: SFA (12%), MUFA (43%), PUFA (10%); desayuno LFHCC con cápsulas placebo: SFA (21%), MUFA (28%), PUFA (16%); desayuno LFHCC con PUFA n-3 de cadena larga: SFA (21%), MUFA (28%), PUFA (16%) con 1,24g/día de PUFA n-3.
DeterminacionesLa sangre se recogió en tubos con ácido etilendiaminotetracético (EDTA) a una concentración final del 0,1%, e inmediatamente después se procedió a separar el plasma mediante centrifugación a 1.500 × g durante 15min a 4°C. Las muestras de plasma se conservaron a –80°C hasta la realización de las determinaciones. Los parámetros lipídicos se determinaron mediante un analizador modular DDPPII Hitachi (Roche, Basilea, Suiza), utilizando reactivos de Boehringer-Mannheim (Mannheim, Alemania). Las concentraciones de triglicéridos (TG) y colesterol en plasma y en lipoproteínas se analizaron mediante procedimientos enzimáticos14,15. Las apolipoproteínas A-1 y B se determinaron mediante turbidimetría16. El colesterol de las lipoproteínas de alta densidad (cHDL) se determinó mediante la precipitación de una alícuota de plasma con dextrano sulfato-Mg2+, como describieron Warnick et al17. El colesterol de las lipoproteínas de baja densidad (cLDL) se calculó mediante la siguiente fórmula: colesterol en plasma – (cHDL + colesterol de las lipoproteínas ricas en triglicéridos [cLRT] grandes + cLRT pequeñas).
La determinación de la PCR de alta sensibilidad se realizó en plasma mediante turbidimetría con un analizador DDPP-800 (Roche-Hitachi, Basilea, Suiza).
Análisis estadísticoLos datos presentados en tablas y figuras expresan medias ± error típico. Para el análisis estadístico se ha utilizado el programa SPSS 15 para Windows (SPSS, Inc., Chicago). La distribución normal de las variables para caracterizar la respuesta posprandial se analizó mediante el test de Kolmogorov-Smirnov. Las variables que no fueron normales se transformaron a logarítmicas antes de realizar la estadística. El área bajo la curva (ABC), definida como el área entre la concentración basal y la posprandial, se calculó mediante una regla trapezoidal. El efecto agudo de la composición grasa de la comida se determinó antes de la intervención mediante ANOVA de un factor. Sin embargo, el efecto crónico de la dieta y de la composición grasa de la comida se determinó mediante ANOVA para medidas repetidas, con la intervención dietética como variable independiente. El análisis estadístico se completó post hoc para detectar diferencias significativas entre los distintos tratamientos dietéticos. Para comparar el incremento del ABC (IABC) entre las fases preintervención y postintervención de cada período de dieta se utilizó la prueba de la t para muestras relacionadas. Se consideraron significativos los valores de p < 0,05.
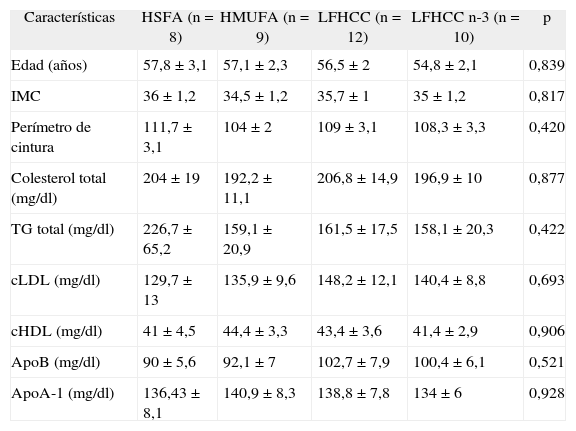
ResultadosEn la tabla 1 se muestran las características basales de los 39 pacientes con SM, aleatorizados para cada período de intervención dietética. Se puede observar que, en el estado de ayunas antes de la realización de la intervención dietética, los parámetros presentados en la tabla no fueron significativamente diferentes entre los distintos grupos de dietas. Cuando analizamos las concentraciones basales de PCR tampoco se encontraron diferencias significativas al comparar los cuatro modelos de alimentación.
Características basales de los pacientes con síndrome metabólico asignados a cada dieta
| Características | HSFA (n = 8) | HMUFA (n = 9) | LFHCC (n = 12) | LFHCC n-3 (n = 10) | p |
| Edad (años) | 57,8 ± 3,1 | 57,1 ± 2,3 | 56,5 ± 2 | 54,8 ± 2,1 | 0,839 |
| IMC | 36 ± 1,2 | 34,5 ± 1,2 | 35,7 ± 1 | 35 ± 1,2 | 0,817 |
| Perímetro de cintura | 111,7 ± 3,1 | 104 ± 2 | 109 ± 3,1 | 108,3 ± 3,3 | 0,420 |
| Colesterol total (mg/dl) | 204 ± 19 | 192,2 ± 11,1 | 206,8 ± 14,9 | 196,9 ± 10 | 0,877 |
| TG total (mg/dl) | 226,7 ± 65,2 | 159,1 ± 20,9 | 161,5 ± 17,5 | 158,1 ± 20,3 | 0,422 |
| cLDL (mg/dl) | 129,7 ± 13 | 135,9 ± 9,6 | 148,2 ± 12,1 | 140,4 ± 8,8 | 0,693 |
| cHDL (mg/dl) | 41 ± 4,5 | 44,4 ± 3,3 | 43,4 ± 3,6 | 41,4 ± 2,9 | 0,906 |
| ApoB (mg/dl) | 90 ± 5,6 | 92,1 ± 7 | 102,7 ± 7,9 | 100,4 ± 6,1 | 0,521 |
| ApoA-1 (mg/dl) | 136,43 ± 8,1 | 140,9 ± 8,3 | 138,8 ± 7,8 | 134 ± 6 | 0,928 |
Apo: apolipoproteína; cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; HMUFA: dieta rica en grasa monoinsaturada; HSFA: dieta rica en grasa saturada; IMC: índice de masa corporal; LFHCC: dieta pobre en grasa y rica en hidratos de carbono complejos; LFHCC n-3: dieta pobre en grasa y rica en hidratos de carbono complejos con 1,24g/día de PUFA n-3 de cadena larga; TG: triglicéridos.
Los datos expresan media ± error típico de cada grupo de dieta.
Para investigar el efecto posprandial de la dieta en los valores de PCR se realizaron dos estudios: uno en el período preintervención (fig. 1A) y otro en el de postintervención (fig. 1B). En ambos casos, las concentraciones plasmáticas de PCR no fueron significativamente diferentes entre los distintos grupos de dietas durante la etapa posprandial. Sin embargo, al representar el incremento del área bajo la curva entre el estudio posprandial realizado antes y después de la intervención dietética (efecto a largo plazo de la dieta) (fig. 2), observamos que sólo los pacientes que consumieron la dieta HSFA presentaron un incremento significativo de la respuesta posprandial en las concentraciones plasmáticas de PCR (p = 0,031). Por el contrario, no se observaron diferencias significativas en el incremento del área bajo la curva de las concentraciones plasmáticas de PCR tras el consumo a largo plazo de las dietas HMUFA, LFHCC y LFHCC n-3.
Concentraciones plasmáticas de proteína C reactiva (PCR) en mg/l, durante el estado posprandial, en el periodo preintervención (A) y postintervención (B). Los resultados son expresados como medias ± error típico. Los valores fueron transformados a logarítmicos y después analizados mediante ANOVA para medidas repetidas. aEfecto de la dieta. bEfecto del tiempo. cInteracción dieta y tiempo. HMUFA: dieta rica en grasa monoinsaturada; HSFA: dieta rica en grasa saturada; LFHCC: dieta pobre en grasa y rica en hidratos de carbono complejos; LFHCC n-3: dieta pobre en grasa y rica en hidratos de carbono complejos con 1,24g/día de PUFA n-3 de cadena larga.
Diferencias entre los incrementos del área bajo la curva (IABC) de la proteína C reactiva de la fase postintervención menos la preintervención, para cada una de las dietas. Los resultados son expresados como medias ± error típico. El valor de p compara la fase preintervención con la postintervención en cada dieta. HMUFA: dieta rica en grasa monoinsaturada; HSFA: dieta rica en grasa saturada; LFHCC: dieta pobre en grasa y rica en hidratos de carbono complejos; LFHCC n-3: dieta pobre en grasa y rica en hidratos de carbono complejos con 1,24g/día de PUFA n-3 de cadena larga.
La dieta y, concretamente, los ácidos grasos pueden modular diversos factores de riesgo cardiovascular y los mecanismos relacionados con la formación y el desarrollo de las placas de ateroma. Por otro lado, el estado posprandial es importante porque, además de producir alteraciones en las lipoproteínas plasmáticas, también induce modificaciones de otros sistemas involucrados en la patogenia de la arteriosclerosis (disfunción del endotelio, estado procoagulante y respuesta inflamatoria), que favorece el desarrollo de enfermedad coronaria.
En este trabajo, realizado en pacientes con SM, hemos investigado el efecto posprandial de diferente cantidad y tipo de grasa en un importante marcador inflamatorio, como la PCR, pues se sabe que la inflamación tiene un papel muy importante en el desarrollo de la diabetes y está relacionada con diversos componentes del SM. Nosotros hemos encontrado que, tanto a corto como a largo plazo, no hay cambios significativos en esta proteína cuando comparamos el consumo de dietas ricas en grasa (SFA o MUFA) y dietas pobres en grasa pero ricas en hidratos de carbono con/sin PUFA n-3 de origen marino. Nuestros resultados coinciden con los obtenidos en varios estudios realizados en personas sanas, obesos y pacientes con SM, en los que una comida rica en grasa no produjo cambios posprandiales agudos en las concentraciones plasmáticas de PCR18–20.
El hecho de que no hayamos encontrado diferencias al comparar dietas ricas en grasas con dietas pobres es consistente con otro estudio donde se ha demostrado que la reducción de la grasa en la dieta, así como la sustitución isocalórica de hidratos de carbono por grasas, no afectó a las concentraciones plasmáticas de PCR21. Sin embargo, nosotros hemos observado que el consumo a largo plazo de una dieta rica en SFA indujo un aumento de la respuesta posprandial de PCR cuando se comparó con la ingesta aguda de esta misma dieta. Esto nos indica que los efectos de los SFA en la PCR no se observan a corto plazo (efecto agudo de una comida aislada), pero sí probablemente después de consumir durante varias semanas este tipo de grasa. Esta variación de la PCR, que se observa con la dieta rica en SFA y no con la rica en MUFA o la pobre en grasa con/sin PUFA n-3, no podemos atribuirla a cambios en el peso corporal porque el estudio se diseñó para mantener el peso de los pacientes durante la intervención dietética. En el denominado estudio JUPITER, se ha observado recientemente que la PCR también puede ser modificada por rosuvastatina, y produce la reducción de eventos cardiovasculares en personas aparentemente sanas, pero con valores de PCR de 2mg/l o más22.
Como han propuesto diversos autores, la producción hepática de PCR está regulada principalmente por interleucina 6 (IL-6), una citocina proinflamatoria producida por el tejido adiposo. Se ha demostrado in vitro un posible papel de los ácidos grasos saturados en la inflamación, de forma que la estimulación de células humanas con ácido palmítico incrementó la expresión génica y la producción de IL-6, mientras que el ácido linoleico impidió el aumento en la expresión de IL-6 inducida por el ácido palmítico, actuando así como antiinflamatorio23,24. Los mecanismos exactos de estos efectos aún son desconocidos, pero se ha propuesto que las moléculas involucradas son el factor nuclear-κB (NFκB)23,26 y la proteincinasa C24. Es posible que la ruta pueda ser diferente según el tipo celular. Nuestro grupo demostró recientemente que un desayuno rico en mantequilla, en comparación con uno rico en aceite de oliva o nueces, produce un aumento de la expresión del factor de necrosis tumoral alfa (TNFα) y la IL-6 en células mononucleares de personas sanas25. En nuestro estudio, el aumento posprandial de la PCR, después de consumir durante 12 semanas una dieta rica en SFA, puede deberse a un incremento de citocinas proinflamatorias por una activación de NF-κB causada por este tipo de grasa, como ya demostramos previamente en otro estudio realizado en personas sanas26.
La relación que hay entre citocinas y PCR es aún confusa. Aunque es cierto que ambas están normalmente incrementadas en situaciones de inflamación, como la enfermedad aterosclerótica, hay un estudio en pacientes con diabetes mellitus tipo 2 donde una comida grasa aumenta la PCR pero no la IL-627, mientras que en obesos encontramos ambos casos, incremento28 y falta de efecto29 de una comida grasa en la PCR.
Por otro lado, la composición de ácidos grasos en suero también se ha relacionado con la PCR. Se sabe que dicha composición no sólo está afectada por la calidad de la grasa de la dieta, sino también por la elongación y la desaturación endógena catalizada por enzimas, como la desaturasa estearoil coenzima A-1 (SCD-1), que convierte los SFA en MUFA. En un estudio muy reciente realizado en ancianos, se ha demostrado que una composición de ácidos grasos en suero que refleje un alto consumo de SFA y un alto índice de SCD-1 está independientemente relacionada con las concentraciones de PCR y no con otros marcadores de inflamación30. Estos resultados también podrían explicar el aumento de la PCR que observamos en el grupo de nuestra población que consumió la dieta rica en SFA.
A partir de nuestro estudio, se puede concluir que el consumo a corto plazo de dietas con diferentes cantidad y tipo de grasa no tiene efectos posprandiales significativos en las concentraciones plasmáticas de la PCR en esta población con SM. Sin embargo, el consumo a largo plazo de una dieta rica en SFA produce un aumento posprandial de este marcador de inflamación en estos pacientes, fenómeno que no se observa tras el consumo de otras dietas (rica en MUFA o pobre en grasa con/sin PUFA n-3). Este fenómeno puede estar involucrado en el mayor riesgo cardiovascular que se observa tras el consumo de dietas ricas en grasa saturada.