La hemostasia es un proceso complejo que regula la integridad del lecho vascular. La dieta modula la concentración de ciertos marcadores de hemostasis, aunque no está claro si el grado de resistencia a la insulina influye en esta relación. Nuestro objetivo fue investigar si la sensibilidad a la insulina influye en la concentración en ayunas y posprandial de ciertos marcadores de hemostasia (factor VII coagulante [FVIIc]), en el activador tisular del plasminógeno (tPA) y en el inhibidor del activador del plasminógeno (PAI-1), independientemente de la dieta consumida.
MétodosEstudio con diseño aleatorizado y cruzado, en el que 20 varones sanos recibieron 3 dietas, durante 4 semanas cada una, ricas en ácidos grasos monoinsaturados (Medit), saturados (Occid) e hidratos de carbono enriquecida con N3 (HC/N3). Posteriormente, se distribuyó a los participantes en 2 grupos: HOMA elevado (HE) o HOMA bajo (HB), dependiendo de las medianas para cada período de dieta. Se extrajeron determinaciones de FVIIc, tPA y PAI-1 en ayunas y 4 h después de una comida con la misma composición grasa que la seguida en el período previo, y se compararon los 2 grupos anteriores (HB frente a HE).
ResultadosHemos encontrado una concentración mayor, tanto de tPA como de PAI-1, en ayunas en el grupo HE, en relación con el grupo HB. El tPA también mostró una concentración mayor en el posprandio en el grupo HE.
ConclusiónNuestros datos indican una activación mayor de la coagulación en varones jóvenes con un índice HOMA mayor a la mediana poblacional, independientemente de la composición de la dieta seguida.
Haemostasis is a complex process that regulates the integrity of the circulatory system. It has been shown that diet can modulate the concentration of some haemostatic markers, but it is not clear if there is regulation of haemostasis depending on insulin sensitivity. We investigated whether insulin sensitivity influences fasting and postprandial concentration of haemostatic markers (FVIIc, PAI-1, tPA).
MethodsTwenty healthy young men were submitted to three dietary intervention periods (rich in monounsaturated, saturated or n3 fatty acids) for four weeks each. The participants were separated into two groups (High-HOMA or Low-HOMA) depending on the median for the HOMA score after each period. Fasting and postprandial samples were drawn for the determination of the haemostatic markers.
ResultsHigh-HOMA group showed higher tPA and PAI-1 concentration levels in the fasting state compared with Low-HOMA group (p<9.05). The tPA mean was also higher in the postprandial determination in the High-HOMA group. The type of diet received did not affect these results.
ConclusionIn our study, the participants with higher HOMA score had a higher fasting concentration of tPA and PAI-1, and a higher postprandial concentration of tPA compared with the Low-HOMA group. These data suggest a higher activation of the coagulation cascade in healthy people with a HOMA score greater than the median for each population.
La hemostasia es el proceso que regula la integridad del sistema circulatorio. El medio interno vascular está continuamente en un equilibrio dinámico entre factores que favorecen la agregación y la coagulación, y aquéllos que los contrarrestan. En condiciones normales, el endotelio vascular y los mediadores humorales deben mantener nuestro medio interno en una situación de antiagregación y anticoagulación. Sin embargo, ante una situación de emergencia, como la ruptura de la integridad de los vasos, nuestro sistema hemostático debe ser capaz de responder con el aumento de la agregabilidad plaquetaria y la coagulación. No obstante, hay factores que alteran el equilibrio natural que hemos comentado. Está demostrado que el consumo a largo plazo de ciertos tipos de dieta, sobre todo las ricas en ácidos grasos saturados, puede incrementar la concentración de ciertos mediadores proagregantes o procoagulantes1–4. Por el contrario, el empleo de grasas más saludables, como los N3 o el aceite de oliva, no inducen estos cambios. Sin embargo, los mecanismos exactos por los que determinados tipos de grasa pueden influir en los marcadores hemostáticos no están del todo claros5,6. La sustitución de las grasas saturadas por aceite de oliva de forma crónica parece disminuir la concentración posprandial de factor VII coagulante (FVIIc)7–10. Este hecho parece estar en relación con un aumento de la capacidad total de transporte de triglicéridos (TG) por parte de las lipoproteínas ricas en TG (TRL)7. Por otra parte, la conformación estructural de las TRL que contienen ácidos grasos monoinsaturados y poliinsaturados les permiten un intercambio más fluido de los TG que aquéllos con predominio de saturados, con lo que hay una hipertrigliceridemia menor, y, por tanto, una activación menor de los marcadores procoagulantes11. Hay otros factores que influyen en la hemostasia. Nuestro grupo ha demostrado previamente que la mayor sensibilidad a la insulina conseguida tras una dieta rica en aceite de oliva se correlaciona con un descenso en los valores del inhibidor del activador de plasminógeno (PAI-1), frente a una dieta rica en ácidos grasos saturados4,12–14. Recientemente, hemos demostrado que la activación posprandial de la cascada de la coagulación se atenúa cuando la grasa presente en la comida es mayoritariamente monoinsaturada o poliinsaturada, en comparación con la saturada15. Sin embargo, no hay estudios que cuantifiquen la influencia del grado de sensibilidad a la insulina con la concentración de marcadores hemostáticos tras distintos períodos de intervención dietética.
Material y métodosPoblación y dietasEl estudio se realizó en 20 varones normolipémicos y sanos, procedentes de la Universidad de Córdoba. A todos se realizó una historia clínica con un análisis clínico antes del inicio del estudio. Los seleccionados eran < 30 años de edad (edad media ± desviación estándar [DE], 23,31 ± 2,17), con concentraciones de colesterol total plasmático < 200mg/dl y sin evidencia de enfermedades crónicas (insuficiencia hepática, renal, cardíaca o disfunción tiroidea) o grados altos de actividad física. Ninguno de ellos tenía historia familiar de enfermedad cardiovascular y ninguno había recibido medicación ni suplementos dietéticos o vitamínicos durante los 6 meses previos al estudio. Durante 7 días consecutivos se recogió la información dietética, incluido el consumo de alcohol. Los requerimientos de energía individual se calcularon teniendo en cuenta la actividad física de cada individuo. Se animó a los participantes a mantener su actividad física regular y estilo de vida, y se les pidió que anotaran en un diario cualquier acontecimiento que lo modificara, como estrés, cambios en el hábito tabáquico y el consumo de alcohol o comidas no incluidas en el diseño experimental.
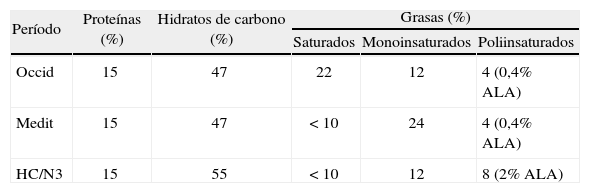
Todos recibieron 3 períodos de dieta de 4 semanas de duración, isocalóricos en relación con su consumo previo habitual, con el objeto de mantener el peso estable. El orden de las dietas se estableció de forma aleatorizada, en un diseño cruzado. Las 3 dietas fueron: a) dieta rica en ácidos grasos saturados (Occid), con un 15% de energía en forma de proteínas, un 47% en hidratos de carbono y un 38% en forma de grasa (22% grasa saturada, 12% monoinsaturada y 4% poliinsaturada); b) dieta rica en monoinsaturados (Medit) con un 15% de proteínas, un 47% de hidratos de carbono y un 38% de grasa total (< 10% saturada, 24% monoinsaturados y 4% poliinsaturados) (tabla 1), y c) posteriormente se administró una dieta rica en hidratos de carbono (dieta HC/N3) con un 15% de proteínas, un 55% de hidratos de carbono y < 30% de grasa (< 10% saturada, 12% monoinsaturados y 8% poliinsaturados, de los cuales el 2% era ácido linolénico N3). No transcurrió ningún período entre las intervenciones dietéticas, ya que éstas tenían una duración de 4 semanas cada una. La ingestión de colesterol durante los 3 períodos dietéticos fue < 300mg/día durante todo el estudio.
Composición de las dietas utilizadas en los 3 períodos
| Período | Proteínas (%) | Hidratos de carbono (%) | Grasas (%) | ||
| Saturados | Monoinsaturados | Poliinsaturados | |||
| Occid | 15 | 47 | 22 | 12 | 4 (0,4% ALA) |
| Medit | 15 | 47 | < 10 | 24 | 4 (0,4% ALA) |
| HC/N3 | 15 | 55 | < 10 | 12 | 8 (2% ALA) |
ALA: ácido alfalinolénico; HC/N3: dieta rica en hidratos de carbono y enriquecida en N3; Medit: dieta rica en monoinsaturados; Occid: dieta rica en saturados.
La composición de las dietas experimentales se calculó por medio de las tablas de alimentos del United States Department of Agriculture16 o las de composición de alimentos españoles correspondientes a los alimentos locales17. En el diseño experimental del presente trabajo, utilizamos 20 menús rotatorios, previamente establecidos, en los que se emplearon alimentos naturales y calibrados para administrar las proporciones establecidas en cada período de dieta. El aporte de grasa monoinsaturada en la dieta mediterránea se consiguió utilizando aceite de oliva virgen en el cocinado de las comidas, aliño de las ensaladas y añadido en las tostadas. Los almuerzos y las cenas se administraron y consumieron en el comedor del Hospital Universitario Reina Sofía de Córdoba, bajo nuestra supervisión y la de un dietista del equipo. Los desayunos y las meriendas se sirvieron según nuestras instrucciones en las cafeterías de las facultades de Medicina y de Ciencias de la Universidad de Córdoba. Se recogieron muestras dobles de cada menú, que se homogeneizaron y almacenaron a −80°C. Los contenidos en proteínas, grasas e hidratos de carbono de la dieta se analizaron mediante métodos estándar. El seguimiento dietético de los ácidos grasos en los ésteres de colesterol unido a lipoproteínas de baja densidad (cLDL) se recogió al final de cada período dietético18. El comité ético de investigación clínica del Hospital Universitario Reina Sofía aprobó el estudio. Otros resultados procedentes de este estudio se han publicado previamente19,20.
Estudio posprandialA la finalización de cada uno de los períodos de intervención dietética, se sometió a todos los individuos a un estudio de lipemia posprandial. Para ello, tras 12h de ayunas, se les administró en el tiempo 0 una comida grasa de composición igual a la que consumía cada individuo en cada período de intervención dietética, consistente entre la mitad y dos tercios de las calorías diarias ingeridas habitualmente por el individuo y compuesta de un gramo de grasa, 7mg de colesterol y 40 equivalentes de retinol por kilogramo de peso, con la siguiente distribución calórica: 60% grasa, 15% proteínas y 25% de hidratos de carbono. Las comidas grasa se basaron en aceite de oliva para la dieta Medit (22% saturados, 38% monoinsaturados y 4% poliinsaturados, de los cuales 0,7% alfalinolénico), mantequilla para la Occid (35% saturados, 22% monoinsaturados y 4% poliinsaturados, de los cuales 0,7% alfalinolénico), y nueces para la HC/N3 (20% saturados, 24% monoinsaturados, 16% poliinsaturados, de los cuales 4% alfalinolénico). Se realizaron extracciones de 20ml de sangre venosa en tubos, que contenían 1mg/ml de ácido etilendiaminotetraacético en el tiempo 0 y a las 4h de la administración de la comida grasa para el estudio de los factores de coagulación.
Determinaciones de fracciones lipídicasSe utilizaron métodos enzimáticos para hallar las concentraciones plasmáticas de colesterol total y los TG. El colesterol unido a lipoproteínas de alta densidad se determinó mediante precipitación con ácido fosfotúngstico. El cLDL se calculó según la fórmula de Friedewald21.
Determinaciones de los marcadores de hemostasiaLa determinación cuantitativa de activador tisular de plasminógeno (tPA) se realizó por un ensayo inmunoenzimático mediante el equipo comercial (Roche, Diagnostica Stago, USA). La actividad del PAI-1 se determinó mediante un ensayo enzimático indirecto por el equipo comercial Spectrolyse PL PAI-1 (Biopool, Trinity biotech, Ireland). El FVII coagulante se analizó por un ensayo cromogénico en 2 etapas que contenía tromboplastina de placenta humana (COASET FVII, Chromogenics AB, Molndal [Sweden]).
Análisis estadísticoTras cada período de intervención dietética, se dividió a los participantes en 2 grupos a partir de la mediana del HOMA obtenida en ese período. Los 2 grupos se denominaron HOMA elevado (HE) o HOMA bajo (HB).
Para evaluar el efecto de HOMA en los marcadores hemostáticos, se usó un test de ANOVA para medidas repetidas usando el tiempo de extracción como factor intrasujeto, y el valor de HOMA como valor intersujeto. Cuando se encontraron diferencias significativas, se realizó un estudio de comparaciones múltiples usando el método de corrección de Bonferroni. Todos los análisis estadísticos se realizaron con el programa informático SPSS (versión 15.0; SPSS Inc. Chicago [Estados Unidos]). Se consideraron significativos los valores de p < 0,05. Los datos se presentan como media ± DE. Para la comparación del efecto del tipo de grasa en el HOMA al final de cada período dietético, también se utilizó un test ANOVA para medidas repetidas.
ResultadosLos medias ± DE de HOMA alcanzadas por los participantes al final de las 3 dietas fueron de 1,42 ± 0,67 después de la dieta Occid; de 1,13 ±0,54 tras la dieta Medit, y de 1,29 ±0,82 tras la dieta rica en N3. No hubo diferencias significativas (p = 0,404). Los resultados de los estudios de los distintos marcadores hemostáticos se exponen a continuación y se muestran en la tabla 2.
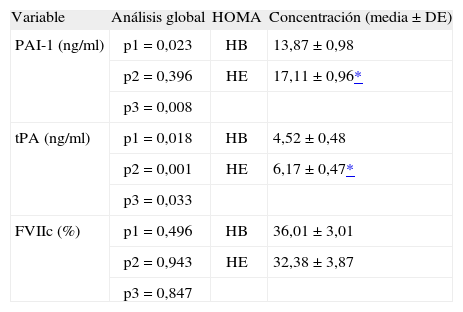
Comparación de las medias de los factores de coagulación entre los participantes con índice HOMA mayor (HE) o menor (HB) que la mediana poblacional
| Variable | Análisis global | HOMA | Concentración (media ± DE) |
| PAI-1 (ng/ml) | p1 = 0,023 | HB | 13,87 ± 0,98 |
| p2 = 0,396 | HE | 17,11 ± 0,96* | |
| p3 = 0,008 | |||
| tPA (ng/ml) | p1 = 0,018 | HB | 4,52 ± 0,48 |
| p2 = 0,001 | HE | 6,17 ± 0,47* | |
| p3 = 0,033 | |||
| FVIIc (%) | p1 = 0,496 | HB | 36,01 ± 3,01 |
| p2 = 0,943 | HE | 32,38 ± 3,87 | |
| p3 = 0,847 |
DE: desviación estándar; FVIIc: factor VII coagulante; HB: HOMA menor que la mediana de HOMA poblacional; HE: HOMA mayor que la mediana de HOMA poblacional; p1: Efecto de HOMA; p2: efecto del tiempo de extracción (basal o posprandial); p3: interacción entre HOMA y tiempo de extracción; PAI-1: inhibidor del activador del plasminógeno; tPA: activador tisular del plasminógeno.
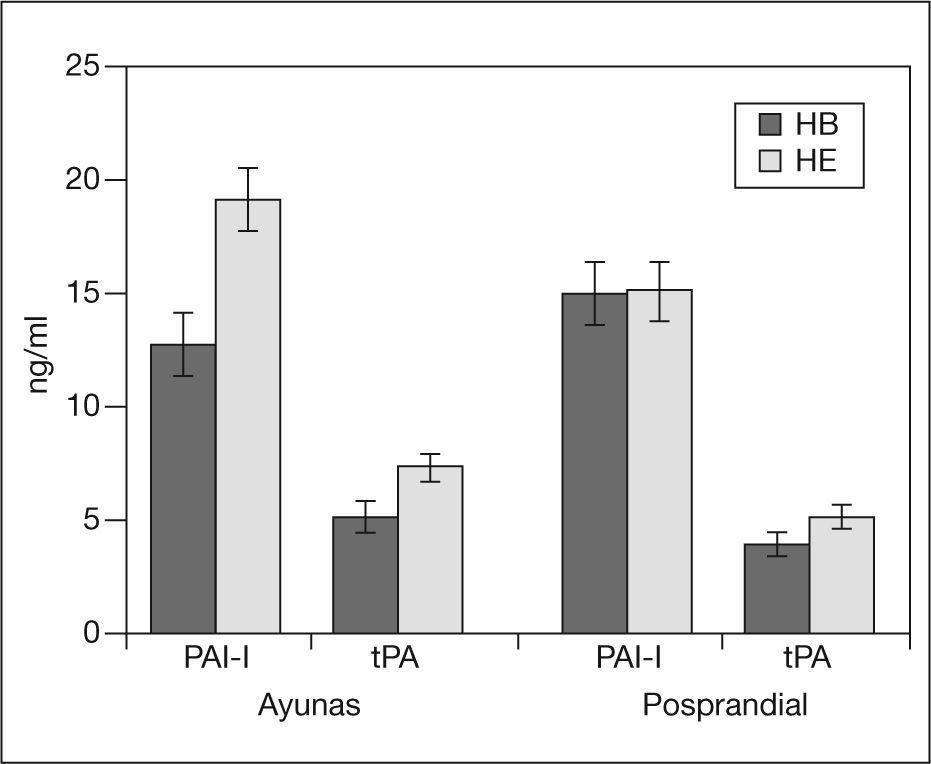
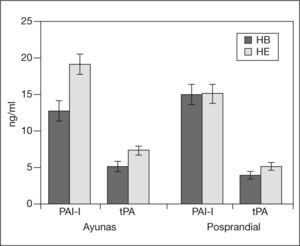
El grupo HB mostró una concentración media ± DE de PAI-1 menor que HE (HB 13,87 ± 0,98 frente a HE 17,11 ± 0,96ng/ml) en la determinación global (ayunas + posprandio) (p = 0,023). Hubo interacción entre el HOMA y el tiempo de extracción (p = 0,008). En las comparaciones post hoc, se observó que las diferencias obtenidas entre HB y HE se debían a los valores de PAI-1 en ayunas (HB 12,76 ± 1,32 frente a HE 19,21 ± 1,25ng/ml; p = 0,001), pero no las había en el período posprandial (p = 0,976) (fig. 1).
tPAEn el ANOVA global hubo efecto del HOMA (p = 0,018), en que la media de tPA en HE fue mayor que en HB (6,17 ± 0,47 frente a 4,52 ± 0,48ng/ml). Hubo interacción entre el tiempo y el HOMA (p = 0,033). En las comparaciones post hoc, las diferencias entre el HB y el HE se mantuvieron tanto en ayunas (HB 5,08 ± 0,64 frente a HE 7,28 ± 0,60ng/ ml; p = 0,015) como en las determinaciones posprandiales (HB 3,95 ± 0,38 frente a HE 5,06 ± 0,37ng/ml; p = 0,042) (fig. 1).
FVIIcNo encontramos diferencias significativas entre los grupos HB y HE en el FVIIc en el ANOVA global (p HOMA = 0,496), ni hubo interacción entre HOMA y tiempo de extracción (p = 0,765).
DiscusiónNuestros resultados indican que el grado de resistencia a la insulina (medida por HOMA) de varones sanos influye en ciertos marcadores hemostáticos, fundamentalmente en ayunas (tPA y PAI-1).
La primera consideración que hay que tener en cuenta al valorar nuestros resultados es que el presente estudio no pretende comparar los efectos del consumo de distintos tipos de dieta en los marcadores hemostáticos, sino si el grado de resistencia a la insulina influye en los marcadores hemostáticos de igual manera tras haber recibido distintos tipos de dieta. En otras palabras, hemos querido investigar si el HOMA es un factor independiente de la dieta consumida en su influencia en la hemostasia.
En estudios previos en personas diabéticas, obesas y en ancianos, se ha mostrado un aumento de marcadores hemostáticos en las personas con HOMA elevado22–24. Incluso se ha indicado un origen común de resistencia a la insulina y el aumento de factores procoagulantes debido a una regulación génica común25. Sin embargo, nosotros hemos demostrado que, aun en personas jóvenes con HOMA poblacional relativamente bajo, la puntuación de este test se correlaciona con una concentración mayor de tPA y PAI-1 cuando los individuos se ajustan a la mediana poblacional de HOMA.
En estudios previos se ha demostrado que el tipo de grasa de la dieta altera la sensibilidad a la insulina. Así, el consumo de una dieta rica en aceite de oliva disminuye la resistencia a la insulina y reduce los valores de PAI-1 frente a una dieta rica en saturados4. Con el presente estudio demostramos que, independientemente del tipo de grasa consumida, las personas sanas con un HOMA por encima de la mediana de cada población tienen un aumento de los valores de PAI-1. Este aumento lo hemos constatado en ayunas, pero no hemos observado los mismos resultados a las 4h de la ingesta. Durante el período posprandial se producen cambios en la regulación de la inflamación y la hemostasia que pueden reducir el impacto del HOMA en la concentración de PAI-1 posprandial.
No hemos encontrado influencia del HOMA en el FVIIc, ni en ayunas, ni durante el período posprandial, en ninguno de los modelos dietéticos utilizados. Aunque hay evidencias científicas de que el FVIIc disminuye en el posprandio tras dietas ricas en aceite de oliva, especialmente tras un período de consumo previo9,10, este efecto parece independiente de la sensibilidad a la insulina. En este sentido, los efectos observados anteriormente parecen dependientes de la conformación espacial que toman las TRL ricas en TG que contienen ácidos grasos monoinsaturados, que facilitan el intercambio de los ácidos grasos, reduciendo el tiempo de permanencia de las partículas TRL en sangre, que son factores activadores de FVIIc. Por otra parte, el consumo de dietas ricas en ácidos grasos monoinsaturados provoca la creación de quilomicrones (QM) más grandes y con más capacidad de transporte de TG, lo que limita el número de partículas QM necesarias para el transporte de los TG posprandiales, y asimismo reduce la activación de FVIIc dependiente de TRL7. Otra posible explicación a la ausencia de resultados significativos es que el HOMA de nuestra muestra poblacional sea demasiado bajo para apreciar diferencias.
En relación con los hallazgos encontrados en el tPA, nuestros resultados indican una elevación del tPA en personas sanas con HOMA por encima de la mediana poblacional, aunque los valores absolutos de HOMA sean bajos. Como hemos expuesto anteriormente, en este grupo hemos detectado asimismo un aumento de PAI-1, factor estimulante de tPA, por lo que el aumento de PAI-1 podría ser el causante del incremento de tPa por un mecanismo de retroalimentación positiva. Por otra parte, hay que tener en cuenta que nuestro punto de corte para catalogar a un participante como de HOMA elevado estaba situado en torno a 1,5. La mayoría de los estudios que demuestran efectos de la resistencia a la insulina en marcadores biológicos emplean a individuos con HOMA más elevados que el nuestro. En nuestro entorno, podemos utilizar un punto de corte de 3,8 puntos HOMA para establecer diagnóstico de resistencia a la insulina26. En nuestra muestra, hemos observado que las personas que tienen un HOMA entre 1,5 y 2,5 tienen una concentración mayor de tPA que los que están por debajo de 1,5. Una posible explicación a este fenómeno podría ser que estas personas tienen una “activación” parcial del sistema procoagulante, que a su vez activa el tPA. La novedad de nuestro estudio es que la población que hemos estudiado son varones jóvenes sanos con índices HOMA relativamente bajos, y, aún así, hemos encontrado datos que indican una “activación” mayor de los factores procoagulantes en relación con los individuos con HOMA mayor. Este dato abre una interrogante sobre los efectos en la hemostasis que pueden derivarse de un HOMA mayor que la mediana poblacional en personas sana de distintos grupos étnicos, diferentes edades y sexo, y resulta un buen punto de partida para la realización de estudios posteriores, con un tamaño de muestra mayor.