Evaluar la relación entre la presión arterial y el perfil circadiano y el grosor de la íntima media de la carótida.
MetodologíaEstudio descriptivo transversal. Se evaluó a 284 pacientes con hipertensión en atención primaria, de los cuales el 62% eran varones, y tenían una edad media de 57,86 años. Mediciones: edad, sexo, presión arterial clínica, presión de pulso, monitorización ambulatoria de presión arterial y patrón circadiano. Se calculó el aumento del grosor de la capa íntima-media (GIM) de la carótida mediante ecografía con protocolo de 12 medidas, utilizando el grosor medio y máximo. Se considera patológico si el GMI medio>0,9mm o hay presencia de placas según la Guía Europea de Hipertensión de 2007.
ResultadosLa presión arterial clínica fue de 138,7/75,01mmHg y la presión de pulso 50,6mmHg. La presión arterial de 24h fue de 122,9/76,3mmHg; en actividad, 126,7/79,7mmHg, y en descanso, 112,8/67mmHg. El descenso nocturno fue del 10,8% en la presión arterial sistólica y del 15,8% en la diastólica, y la presión de pulso de 24h fue de 46,7mmHg en actividad, 46,9mmHg, y en descanso, 45,8mmHg. El 46,5% de los pacientes presenta patrón dipper; el 35,9%, non-dipper; el 10,9%, extreme dipper, y el 6,7%, riser. El GIM medio fue de 0,765 mm y el GIM máximo, 0,943mm. Cuarenta y seis (16,2%) pacientes tenían GIM medio>0,9mm o placas. En el patrón riser, el GIM fue de 0,831mm; en non-dipper, de 0,765mm; en dipper, de 0,762mm, y en extreme dipper, de 0,738mm (p<0,05).
Encontramos correlación positiva (p<0,05) entre GIM medio y máximo con presión arterial sistólica clínica (r=0,27), presión de pulso (r=0,38), presión arterial sistólica de 24h (r=0,26), en actividad (r=0,24) y descanso (r=0,28) y negativa con presión arterial díastólica de 24 h (r=−0,18) y en actividad (r=−0,21).
ConclusionesEl GIM de carótida se correlaciona positivamente con la presión arterial sistólica y la presión de pulso, tanto clínica como ambulatoria, y negativamente con la presión arterial diastólica ambulatoria y con el descenso nocturno de la presión arterial. El patrón riser está asociado con GIM mayor y extreme dipper menor.
To assess relationships between blood pressure and circadian pattern and carotid intima-media thickness (IMT).
MethodsCross-sectional study. We included 284 hypertensive patients evaluated in primary care. Men 62%, aged 57.86 years. Measurements: Age, sex, office blood pressure, pulse pressure, ambulatory monitoring blood pressure and circadian pattern. Intima-media thickness (IMT) by ultrasound with protocol of 12 measurements, using mean maximum values. It is considered pathological if IMT>0.9mm or presence of plaques in accordance with European hypertension guidelines 2007.
ResultsOffice blood pressure was 138.7/75.01mmHg and pulse pressure 50.6mmHg. Blood pressure 24hours was 122.9/76.3, in activity: 126.7/79.7 and at rest: 112.8/67mmHg. Systolic decrease in blood pressure was 10.8% and diastolic 15.8%. pulse pressure 24hours was 46.7mmHg, in activity 46.9mmHg and at rest 45.8mmHg. Circadian pattern was: 46.5% dipper, 35.9% non-dipper, 10,9% extreme dipper and 6.7% riser. IMT mean value was 0.765 mm and mean maximum 0.943 mm. A total of 46 (16.2%) patients had IMT>0.9 mm or plaque. IMT in riser was 0.831mm, non-dipper 0.765, dipper 0.762 and extreme dipper 0.738 mm (p<9.05). We found a positive correlation (p<9.05) between mean and maximum IMT with Office blood pressure (r=0.27), pulse pressure (r=0.38), systolic blood pressure 24hours (r=0.26), day (r=0.24), night (r=0.28) and a negative correlation with diastolic blood pressure 24 hours and daytime (r=−0.18, r=−0.21).
ConclusionsCarotid intima-media thickness correlates positively with clinic and ambulatory systolic blood pressure and pulse pressure and negatively with diastolic blood pressure and decrease in night blood pressure. Riser pattern is associated with intima-media thickness higher and extreme dipper lower.
La hipertensión arterial (HTA) es el principal factor de riesgo para las enfermedades cardiovasculares en los países desarrollados. Se estima que la HTA está relacionada con el 46,4% de las muertes por enfermedad cerebrovascular, con el 42% de las muertes por cardiopatía isquémica y con el 25,5% de las muertes totales1. Este incremento de riesgo de episodios cardiovasculares suele estar asociado a la aparición de lesión de órganos diana, como la lesión renal (microalbuminuria)2, la hipertrofia ventricular izquierda3 o el incremento del grosor de la capa íntima-media (GIM)4 de la carótida como marcadores subrogados de arteriosclerosis.
En la población general, la relación entre la morbimortalidad cardiovascular con la presión arterial (PA) sistólica (PAS) y diastólica (PAD) es continua, tanto para enfermedades cerebrovasculares, como para cardiopatía isquémica5. Sin embargo, en estudios observacionales, especialmente en ancianos, se ha visto una relación directa de la morbimortalidad con la PAS, pero inversa con la PAD, manteniendo una relación directa e intensa con la presión de pulso (PP) o presión diferencial6,7. El aumento de la PP indica aumento de la rigidez de las grandes arterias y, en consecuencia, lesión de órgano diana8.
Actualmente, la PA clínica (PAC) en consulta sigue siendo la técnica de referencia, pero cada vez hay más evidencias de que la automedida de la PA del paciente en su domicilio y, sobre todo, la monitorización ambulatoria de la PA (MAPA) se correlacionan mejor con la lesión de órganos diana y con los episodios cardiovasculares9–13. El valor pronóstico de la PA nocturna parece ser mayor que la diurna, especialmente el descenso nocturno de la PAS. Los individuos con menor descenso nocturno de la PA presentan una prevalencia mayor de lesión de órganos diana y una evolución menos favorable14–16; asimismo, se ha encontrado un peor pronóstico asociado a la mayor variabilidad de la PA17,18. Sin embargo, el descenso nocturno de la PAD, el porcentaje de tiempo y medidas que superan los límites de buen control, tanto en la PA de 24h, diurna y nocturna, y la PP estimada con la MAPA, han sido poco estudiadas y no está completamente definido su valor como predictores de lesión de órganos diana.
La arteriosclerosis es una enfermedad difusa que afecta a todo el árbol vascular y, dentro de éste, al territorio coronario y a la circulación arterial periférica. La evaluación del GIM de carótida permite evaluar la estructura vascular y detectar lesión de órganos diana de forma temprana. Varios estudios prospectivos han demostrado que el GIM de carótida es un factor de riesgo independiente en la incidencia de enfermedad cardíaca coronaria y accidente cerebrovascular19–21. Un GIM aumentado y/o la detección de placas de ateroma incrementan el riesgo relativo de complicaciones clínicas de la arteriosclerosis hasta 4 veces en los individuos sin esta lesión22.
El propósito de este estudio es analizar la PAC y el perfil circadiano de la PA, así como otros parámetros que proporciona la MAPA, y la relación de éstas con la estructura vascular evaluada con el GIM de carótida en pacientes hipertensos.
MétodosDiseño del estudio y ámbitoEs un estudio observacional y transversal, con análisis cruzados, en el que se ha incluido de forma consecutiva a pacientes con HTA clínica enviados a la unidad de investigación para confirmar el diagnóstico con MAPA o para evaluación de lesión de órganos diana en hipertensos conocidos. El estudio se ha desarrollado en el ámbito de atención primaria urbano.
Población de estudioLos individuos del estudio proceden de 2 centros de salud con una población de 46.000 habitantes. En el estudio se ha incluido a 284 pacientes hipertensos, conocidos o de nuevo diagnóstico, de 18–85 años, con o sin enfermedad isquémica previa, mediante muestreo consecutivo de los pacientes derivados a la unidad de investigación de atención primaria para confirmar el diagnóstico y para valorar el riesgo cardiovascular y la lesión de órganos diana. El tamaño de la muestra se ha estimado para detectar las diferencias entre los individuos con patrón dipper y non-dipper en el GIM de carótida. Si se acepta un riesgo alfa de 0,05 y un riesgo beta de 0,20 en un contraste bilateral, se precisan 214 pacientes, 107 individuos en el primer grupo y 107 en el segundo, para detectar una diferencia igual o superior a 0,05mm. Se asume que la desviación estándar (DE) común es de 0,13, por lo que se ha incluido a los 284 pacientes evaluados entre enero y diciembre de 2007.
Mediciones básicas realizadasLa información se ha obtenido de la entrevista clínica, la exploración física y las exploraciones complementarias realizadas. Las variables estudiadas han sido: edad y sexo, antecedentes familiares de enfermedad cardiovascular prematura (varón menor de 55 años y mujer menor de 65 años), antecedentes personales de enfermedades cardiovasculares, cardiopatía isquémica (angina o infarto de miocardio), accidente cerebrovascular, enfermedad arterial periférica, (diagnóstico clínico o índice tobillo/brazo inferior a 0,9) hipertrofia ventricular izquerda diagnosticada con criterios electrocardiográficos (producto duración-voltaje de Cornell), antecedentes de HTA, dislipemias y diabetes mellitus, consumo de tabaco y actividad física, y se ha considerado activo a quien declara realizar actividad física de intensidad moderada al menos 30min al día 5 días a la semana.
Las exploraciones físicas realizadas han sido: determinación de la PA y frecuencia cardíaca en consulta y con MAPA, talla y peso para estimar el índice de masa corporal (IMC) y perímetro de la cintura abdominal, medido según las recomendaciones de la Sociedad Española para el Estudio de la Obesidad 2007.
Las exploraciones analíticas se han realizado con una extracción de sangre en ayunas de al menos 8h y orina de la primera hora de la mañana, en las que se determinaron hemoglobina, glucemia, hemoglobina glucosilada, insulinemia, micro albuminuria, creatinina en sangre y orina, lípidos (colesterol total, colesterol unido a lipoproteínas de alta densidad, colesterol unido a lipoproteínas de baja densidad, triglicéridos) fibrinógeno y proteína C reactiva (PCR) de alta sensibilidad. La lesión renal se evaluó con la creatinina plasmática, la tasa de filtrado glomerular estimada con la fórmula MDRD (Modification of Diet in Renal Disease) y la proteinuria estimada con el índice albúmina/creatinina siguiendo los criterios de la Guía europea de hipertensión arterial de 20076.
Medida de la presión arterialLa medida de PA se obtuvo realizando 3 mediciones de PAS y PAD, y utilizando la media de las 2 últimas, con un esfigmomanómetro modelo OMRON M7 validado según el protocolo de la Sociedad Europea de Hipertensión23, realizadas por el/la enfermero/a de la unidad de investigación, separadas al menos un minuto y siguiendo las recomendaciones de la Sociedad Europea de Hipertensión23. Se estimó la PP con los valores medios de segunda y tercera tomas.
La MAPA se efectuó en un día de actividad normal, con un manguito adecuado para el tamaño del brazo del paciente. Se empleó un sistema de control modelo SpaceLabs 90207, que había sido previamente validado. La validación se realizó siguiendo el protocolo para la evaluación de los mecanismos de medida de la PA de la British Hypertension Society24. Se consideraron registros válidos aquéllos en los que el porcentaje de lecturas válidas fue ≥ 66% del total y no hubiera ninguna hora sin ninguna lectura. Igualmente, para la validez del registro, se requiere un mínimo de 14 medidas durante el período de actividad o un mínimo de 7 durante el período de descanso. El monitor se programó para obtener medidas de PA cada 20min durante el período de actividad y cada 30min en el período de descanso. Se computaron los estimadores medios y de dispersión de la PAS y la PAD durante los períodos de 24h, diurno o de actividad y nocturno o de descanso, definidos ambos en función del diario referido por el paciente.
Se valoró, además de la PAS y PAD en cada período, la PP, el descenso nocturno de la PAS y la PAD, y la variabilidad de la tomas mediante la desviación estándar de las medidas en cada período. También se analizó el porcentaje de tiempo y de lecturas de la PA por encima de los valores de referencia: PA de 24h < 130/80mmHg, en actividad < 135/85mmHg y en reposo < 120/70mmHg para la PAS y PAD, respectivamente6.
Se clasificó a los pacientes según el patrón circadiano estimado con el descenso nocturno de la PAS y la PAD. Se consideró patrón dipper si el descenso fue entre el 10 y el 20%, extreme dipper si fue mayor del 20%, no dipper si fue entre 0 y el 10% y riser menor del 0%, tanto para la PAS como para la PAD.
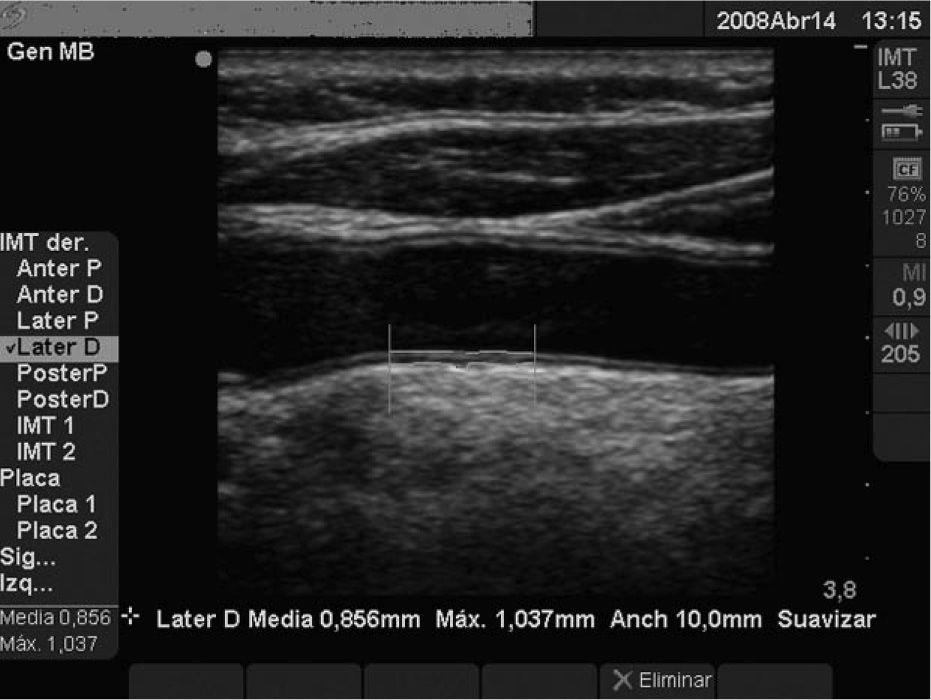
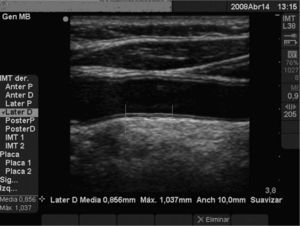
Evaluacion del grosor íntima-mediaLa ecografía de carótida para valorar el GIM la realizaron 2 investigadores entrenados previamente y entre ellos evaluaron la concordancia antes del inicio del estudio. Se utilizó un ecógrafo Sonosite Micromax, con un transductor lineal de alta resolución multifrecuencia 5–10MHz, y en la medición se utilizó el software Sonocal, que realiza mediciones automáticas del GIM para mejorar la reproducibilidad. Se ejecutaron mediciones en la carótida primitiva explorada una sección longitudinal de 10mm a una distancia de 1cm de la bifurcación, realizando medidas en la pared anterior o proximal y en la pared posterior o distal en proyecciones lateral, anterior y posterior, siguiendo un eje perpendicular a la arteria para diferenciar 2 líneas: una correspondiente a la interfaz íntima-sangre y la otra a la interfaz media-adventicia. Se realizaron un total de 6 mediciones en carótida derecha y otras 6 en carótida izquierda, utilizando valores medios promedio (GIM medio) y máximos promedio (GIM áximo) calculados automáticamente por el software. Las mediciones se obtuvieron con el individuo en decúbito supino, con la cabeza extendida y ligeramente rotada en dirección contraria a la carótida examinada, siguiendo las recomendaciones del Manheim Carotid Intima-Media Thickness Consensus25. Se consideró patológico si el GIM medio era superior a 0,9mm, la presencia de placas arterioscleróticas de diámetro mayor de 1,5mm, o un incremento focal de 0,5mm o 50% del GIM adyacente25 (fig. 1).
Análisis estadísticoLas variables continuas se han expresado como media ± DE. Las variables discretas se expresaron en porcentajes. En el análisis estadístico, se ha utilizado la estimación de medias y proporciones para valorar las variables estudiadas en los diferentes grupos. Para analizar la relación entre variables cualitativas independientes y cuantitativas de 2 categorías, se utilizó la t de Student. Para analizar la relación entre variables cualitativas de más de 2 categorías y cuantitativas, se utilizó el ANOVA, y para el análisis de contrastes a posteriori (post hoc) se utilizó el método de LSD, con alfa < 0,05. La correlación de Pearson se utilizó para estimar la asociación entre variables cuantitativas independientes. Finalmente, se utilizó el análisis multivariante mediante regresión múltiple con el método paso a paso (stepwise) para analizar las variables determinantes del GIM. Se consideró como variable dependiente en primer lugar el GIM medio y, posteriormente, el GIM máximo, y se incluyeron en la ecuación como variables independientes la edad, el sexo, el perímetro abdominal, el IMC, la glucemia, la creatinina, el colesterol total, la PCR ultrasensible, el fibrinógeno, el cociente albúmina/creatinina, la tasa de filtrado glomerular, el producto duración-voltaje de Cornell y los parámetros de PA.
Para el contraste de hipótesis, se fija un riesgo α de 0,05 como límite de significación estadística. El programa estadístico utilizado es el SPSS/PC+, versión 15.0 ®.
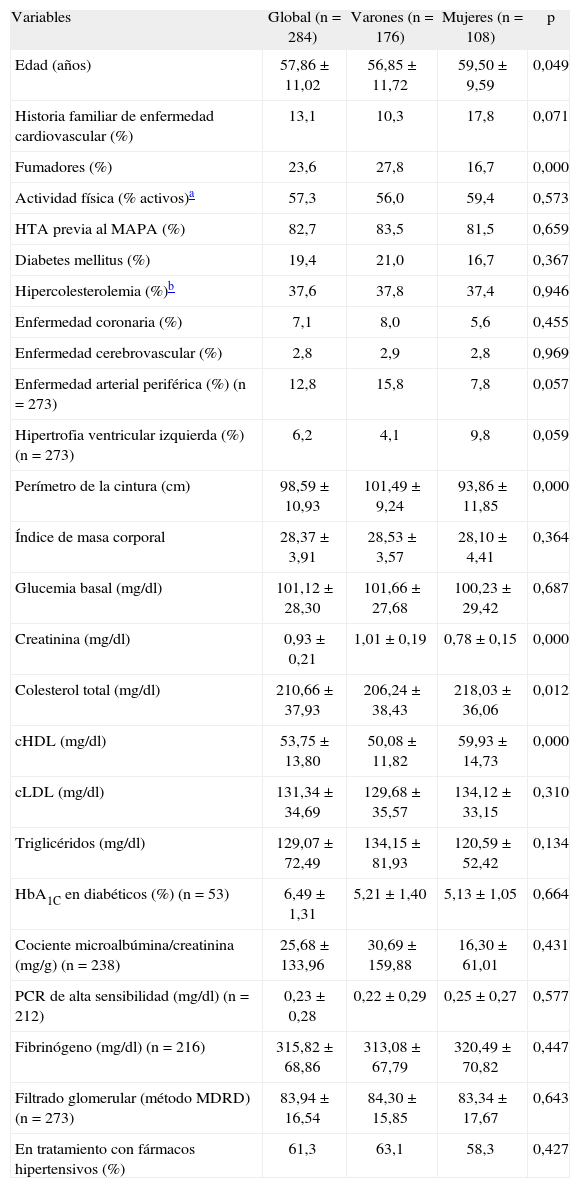
ResultadosDatos demográficos y biohumorales basalesLa edad media ± DE de los pacientes fue de 57,8 ± 11 años, el 62% de los cuales fueron varones. El 82,7% estaba diagnosticado de HTA clínica antes de la realización de la MAPA y el 61,3%, en tratamiento farmacológico para la HTA. El 19,4% eran diabéticos, el 7,1% tenía antecedentes de enfermedad coronaria y el 2,8%, de enfermedad cerebrovascular. En la tabla 1 se pueden observar el resto de parámetros biohumorales de la muestra.
Datos demográficos y biohumorales basales en la población de estudio
| Variables | Global (n = 284) | Varones (n = 176) | Mujeres (n = 108) | p |
| Edad (años) | 57,86 ± 11,02 | 56,85 ± 11,72 | 59,50 ± 9,59 | 0,049 |
| Historia familiar de enfermedad cardiovascular (%) | 13,1 | 10,3 | 17,8 | 0,071 |
| Fumadores (%) | 23,6 | 27,8 | 16,7 | 0,000 |
| Actividad física (% activos)a | 57,3 | 56,0 | 59,4 | 0,573 |
| HTA previa al MAPA (%) | 82,7 | 83,5 | 81,5 | 0,659 |
| Diabetes mellitus (%) | 19,4 | 21,0 | 16,7 | 0,367 |
| Hipercolesterolemia (%)b | 37,6 | 37,8 | 37,4 | 0,946 |
| Enfermedad coronaria (%) | 7,1 | 8,0 | 5,6 | 0,455 |
| Enfermedad cerebrovascular (%) | 2,8 | 2,9 | 2,8 | 0,969 |
| Enfermedad arterial periférica (%) (n = 273) | 12,8 | 15,8 | 7,8 | 0,057 |
| Hipertrofia ventricular izquierda (%) (n = 273) | 6,2 | 4,1 | 9,8 | 0,059 |
| Perímetro de la cintura (cm) | 98,59 ± 10,93 | 101,49 ± 9,24 | 93,86 ± 11,85 | 0,000 |
| Índice de masa corporal | 28,37 ± 3,91 | 28,53 ± 3,57 | 28,10 ± 4,41 | 0,364 |
| Glucemia basal (mg/dl) | 101,12 ± 28,30 | 101,66 ± 27,68 | 100,23 ± 29,42 | 0,687 |
| Creatinina (mg/dl) | 0,93 ± 0,21 | 1,01 ± 0,19 | 0,78 ± 0,15 | 0,000 |
| Colesterol total (mg/dl) | 210,66 ± 37,93 | 206,24 ± 38,43 | 218,03 ± 36,06 | 0,012 |
| cHDL (mg/dl) | 53,75 ± 13,80 | 50,08 ± 11,82 | 59,93 ± 14,73 | 0,000 |
| cLDL (mg/dl) | 131,34 ± 34,69 | 129,68 ± 35,57 | 134,12 ± 33,15 | 0,310 |
| Triglicéridos (mg/dl) | 129,07 ± 72,49 | 134,15 ± 81,93 | 120,59 ± 52,42 | 0,134 |
| HbA1C en diabéticos (%) (n = 53) | 6,49 ± 1,31 | 5,21 ± 1,40 | 5,13 ± 1,05 | 0,664 |
| Cociente microalbúmina/creatinina (mg/g) (n = 238) | 25,68 ± 133,96 | 30,69 ± 159,88 | 16,30 ± 61,01 | 0,431 |
| PCR de alta sensibilidad (mg/dl) (n = 212) | 0,23 ± 0,28 | 0,22 ± 0,29 | 0,25 ± 0,27 | 0,577 |
| Fibrinógeno (mg/dl) (n = 216) | 315,82± 68,86 | 313,08 ± 67,79 | 320,49 ± 70,82 | 0,447 |
| Filtrado glomerular (método MDRD) (n = 273) | 83,94 ± 16,54 | 84,30 ± 15,85 | 83,34 ± 17,67 | 0,643 |
| En tratamiento con fármacos hipertensivos (%) | 61,3 | 63,1 | 58,3 | 0,427 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1C: hemoglobina glucosilada; HTA: hipertensión arterial; MAPA: monitorización ambulatoria de la presión arterial; MDRD: Modification of Diet in Renal Disease; PCR: proteína C reactiva.
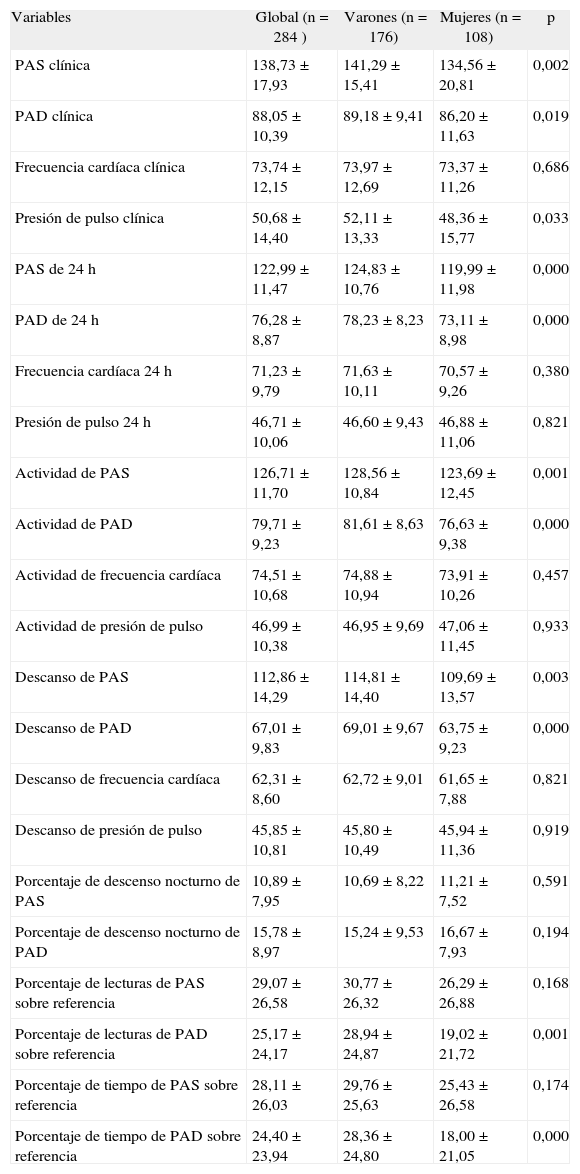
En la tabla 2 se muestran los resultados de la PAC y la MAPA. Destaca una PAC de 138,7/88mmHg, significativamente superior a la obtenida con MAPA, tanto en 24h (122,9/76,3), como en actividad (126,7/79,7) y descanso (112,8/86). La PP también es mayor en la toma de PAC 50,68mmHg que con la MAPA, 46,7mmHg en 24h, 46,9mmHg en actividad y 45,8mmHg en descanso.
Análisis descriptivo de la presión arterial y variables derivadas de la monitorización ambulatoria de la presión arterial
| Variables | Global (n = 284 ) | Varones (n = 176) | Mujeres (n = 108) | p |
| PAS clínica | 138,73 ± 17,93 | 141,29 ± 15,41 | 134,56 ± 20,81 | 0,002 |
| PAD clínica | 88,05 ± 10,39 | 89,18 ± 9,41 | 86,20 ± 11,63 | 0,019 |
| Frecuencia cardíaca clínica | 73,74 ± 12,15 | 73,97 ± 12,69 | 73,37 ± 11,26 | 0,686 |
| Presión de pulso clínica | 50,68 ± 14,40 | 52,11 ± 13,33 | 48,36 ± 15,77 | 0,033 |
| PAS de 24h | 122,99 ± 11,47 | 124,83 ± 10,76 | 119,99 ± 11,98 | 0,000 |
| PAD de 24h | 76,28 ± 8,87 | 78,23 ± 8,23 | 73,11 ± 8,98 | 0,000 |
| Frecuencia cardíaca 24h | 71,23 ± 9,79 | 71,63 ± 10,11 | 70,57 ± 9,26 | 0,380 |
| Presión de pulso 24h | 46,71± 10,06 | 46,60 ± 9,43 | 46,88 ± 11,06 | 0,821 |
| Actividad de PAS | 126,71± 11,70 | 128,56± 10,84 | 123,69 ± 12,45 | 0,001 |
| Actividad de PAD | 79,71 ± 9,23 | 81,61 ± 8,63 | 76,63 ± 9,38 | 0,000 |
| Actividad de frecuencia cardíaca | 74,51 ± 10,68 | 74,88 ± 10,94 | 73,91 ± 10,26 | 0,457 |
| Actividad de presión de pulso | 46,99 ± 10,38 | 46,95 ± 9,69 | 47,06 ± 11,45 | 0,933 |
| Descanso de PAS | 112,86 ± 14,29 | 114,81 ± 14,40 | 109,69 ± 13,57 | 0,003 |
| Descanso de PAD | 67,01 ± 9,83 | 69,01 ± 9,67 | 63,75 ± 9,23 | 0,000 |
| Descanso de frecuencia cardíaca | 62,31 ± 8,60 | 62,72 ± 9,01 | 61,65 ± 7,88 | 0,821 |
| Descanso de presión de pulso | 45,85 ± 10,81 | 45,80 ± 10,49 | 45,94 ± 11,36 | 0,919 |
| Porcentaje de descenso nocturno de PAS | 10,89 ± 7,95 | 10,69 ± 8,22 | 11,21 ± 7,52 | 0,591 |
| Porcentaje de descenso nocturno de PAD | 15,78 ± 8,97 | 15,24 ± 9,53 | 16,67 ± 7,93 | 0,194 |
| Porcentaje de lecturas de PAS sobre referencia | 29,07 ± 26,58 | 30,77 ± 26,32 | 26,29 ± 26,88 | 0,168 |
| Porcentaje de lecturas de PAD sobre referencia | 25,17 ± 24,17 | 28,94 ± 24,87 | 19,02 ± 21,72 | 0,001 |
| Porcentaje de tiempo de PAS sobre referencia | 28,11 ± 26,03 | 29,76 ± 25,63 | 25,43 ± 26,58 | 0,174 |
| Porcentaje de tiempo de PAD sobre referencia | 24,40 ± 23,94 | 28,36 ± 24,80 | 18,00 ± 21,05 | 0,000 |
PAD: presión arterial diastólica; PAS: presión arterial sistólica.
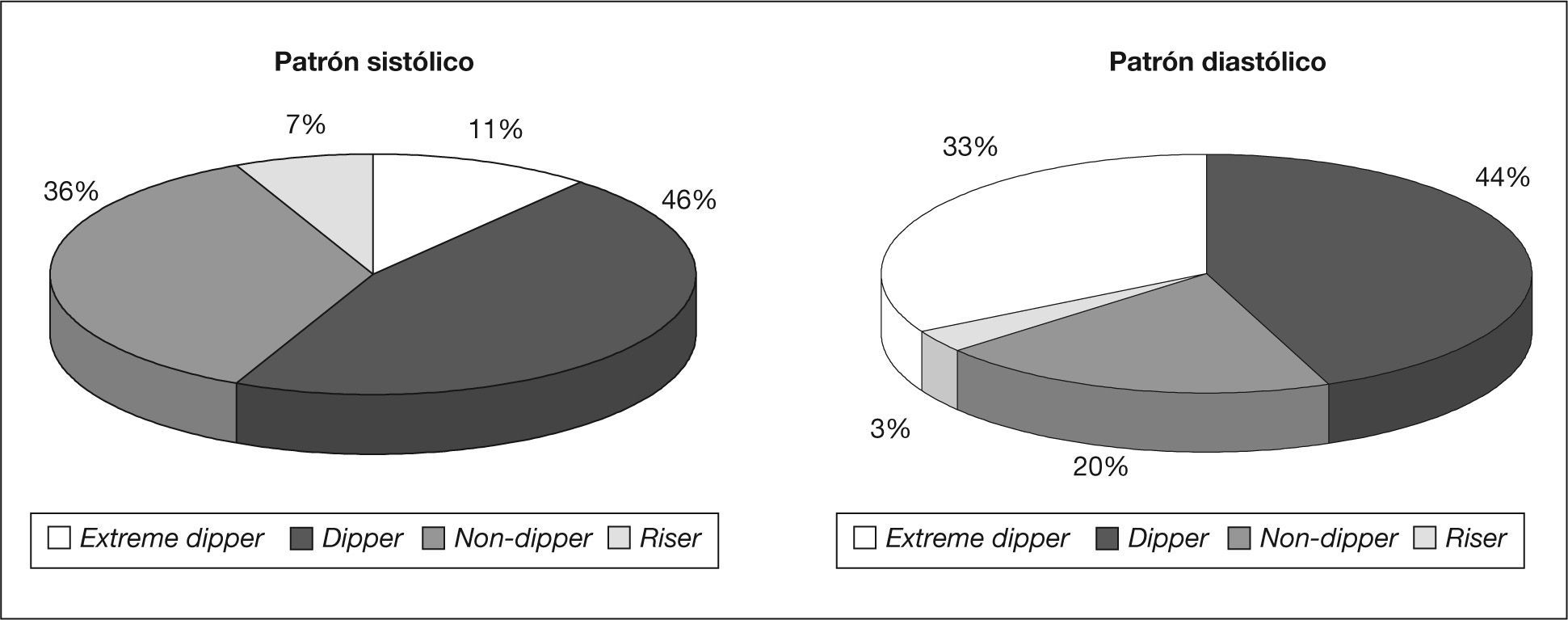
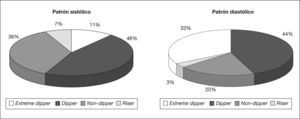
El descenso nocturno de la PA es significativamente menor en la PAS (10,89%) que en la PAD (15,78%) (p < 0,05). Por lo tanto, como podemos observar en la figura 2, la proporción de pacientes riser es mayor si utilizamos los criterios de PAS del 7% frente al 3% con la PAD, y la proporción de los extreme dipper es mayor con criterios de PAD del 33% frente al 11% con PAS. También el non-dipper es mayor, considerando la PAS (36%), que la PAD (20%). Sin embargo, la proporción de dipper se mantiene similar, el 46 y el 44% en PAS y PAD, respectivamente.
Análisis del grosor íntima-media de carótidaSe ha valorado el GIM medio promedio (GIM medio) de las 12 mediciones y el máximo promedio (GIM máximo), es decir, la media del valor máximo obtenido en cada una de las 12 mediciones. En la tabla 3 se puede observar que el valor medio promedio (media ± DE) es de 0,765 ± 0,115mm y el valor máximo promedio es de 0,943 ± 0,136mm. El 16,2% de los pacientes presenta el GIM medio promedio superior a 0,9mm o placas de ateroma en carótida común.
Grosor íntima-media de carótida en mm
| Variables | Global (n = 284) | Varones (n = 176) | Mujeres (n = 108) | p |
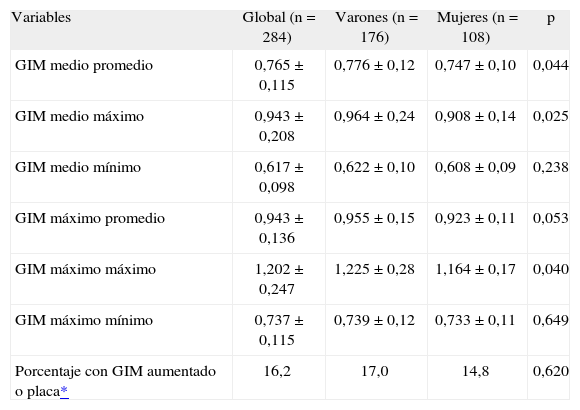
| GIM medio promedio | 0,765 ± 0,115 | 0,776 ± 0,12 | 0,747 ± 0,10 | 0,044 |
| GIM medio máximo | 0,943 ± 0,208 | 0,964 ± 0,24 | 0,908 ± 0,14 | 0,025 |
| GIM medio mínimo | 0,617 ± 0,098 | 0,622 ± 0,10 | 0,608 ± 0,09 | 0,238 |
| GIM máximo promedio | 0,943 ± 0,136 | 0,955 ± 0,15 | 0,923 ± 0,11 | 0,053 |
| GIM máximo máximo | 1,202 ± 0,247 | 1,225 ± 0,28 | 1,164 ± 0,17 | 0,040 |
| GIM máximo mínimo | 0,737 ± 0,115 | 0,739 ± 0,12 | 0,733 ± 0,11 | 0,649 |
| Porcentaje con GIM aumentado o placa* | 16,2 | 17,0 | 14,8 | 0,620 |
GIM: grosor íntima-media en mm; GIM máximo máximo: máximo valor de las máximas mediciones; GIM máximo mínimo: mínimo valor de las máximas mediciones; GIM máximo promedio: media del valor máximo de las 12 mediciones.; GIM medio máximo: máximo valor de las medias; GIM medio mínimo: mínimo valor de las medias; GIM medio promedio: media del valor medio de las 12 mediciones.
En la tabla 4 se puede observar el GIM según el patrón circadiano, a partir de criterios de descenso de la PAS y la PAD.
Patrón circadiano y grosor íntima-media (GIM) de carótida
| Patrón circadiano | GIM medio | GIM máximo | ||||||
| Patrón sistólico | Patrón diastólico | Patrón sistólico | Patrón diastólico | |||||
| M | DE | M | DE | M | DE | M | DE | |
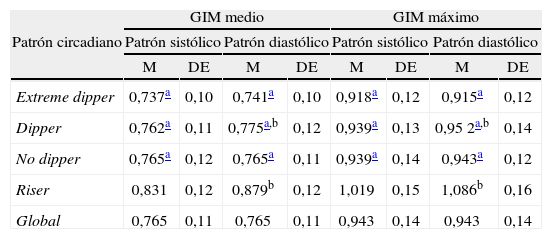
| Extreme dipper | 0,737a | 0,10 | 0,741a | 0,10 | 0,918a | 0,12 | 0,915a | 0,12 |
| Dipper | 0,762a | 0,11 | 0,775a,b | 0,12 | 0,939a | 0,13 | 0,95 2a,b | 0,14 |
| No dipper | 0,765a | 0,12 | 0,765a | 0,11 | 0,939a | 0,14 | 0,943a | 0,12 |
| Riser | 0,831 | 0,12 | 0,879b | 0,12 | 1,019 | 0,15 | 1,086b | 0,16 |
| Global | 0,765 | 0,11 | 0,765 | 0,11 | 0,943 | 0,14 | 0,943 | 0,14 |
DE: desviación estándar; M: media.
ANOVA de patrón sistólico: IMT medio p = 0,046, IMT máximo p = 0,063.
ANOVA de patrón diastólico: IMT medio p = 0,003, IMT máximo p = 0,002 Contrastes post hoc LSD:
El patrón riser es el que tiene un GIM mayor (p < 0,05), tanto en medio promedio (0,831 y 0,879mm), como en máximo promedio (1,019 y 1,086mm) y utilizando criterios tanto de PAS como de PAD. Por otro lado, el extreme dipper es el que tiene un GIM menor tanto en medio promedio (0,737 y 0,741mm), como en máximo promedio (0,918 y 0,915mm), con diferencias significativas con los patrones dipper y non-dipper únicamente en los valores máximos.
Con la clasificación dicotómica de los patrones riser o reductor y no riser o no reductor, aunque el patrón no reductor, tanto sistólico como diastólico, tiene un GIM mayor que el reductor, no se alcanza la significación estadística, ni en el GIM medio ni en el máximo.
Correlaciones de grosor íntima-media y presión arterialEn la tabla 5 se pueden observar las correlaciones del GIM medio y GIM máximo con la PA y otros parámetros biológicos evaluados. Destaca una correlación mayor con la edad que con el resto de parámetros (r = 0,570 y 0,546; p = 0,000). Encontramos una correlación positiva significativa del GIM medio y máximo con la PAS, tanto clínica (r = 0,272 y 0,264; p = 0,000), como de MAPA en 24h (r = 0,265 y 0,259; p = 0,000), en actividad (r = 0,236 y 0,230; p = 0,000) y en descanso (r = 0,285 y 0,275; p = 0,000), y negativa con la PAD estadísticamente significativa en 24h (r = −0,185 y −0,192; p < 0,001) y en actividad (r = −0,213 y −0,218; p = 0,000).
Correlaciones de grosor íntima-media (GIM) medio y máximo con presión arterial y otras variables biológicas
| Variables | GIM medio | GIM máximo | ||
| r | p | r | p | |
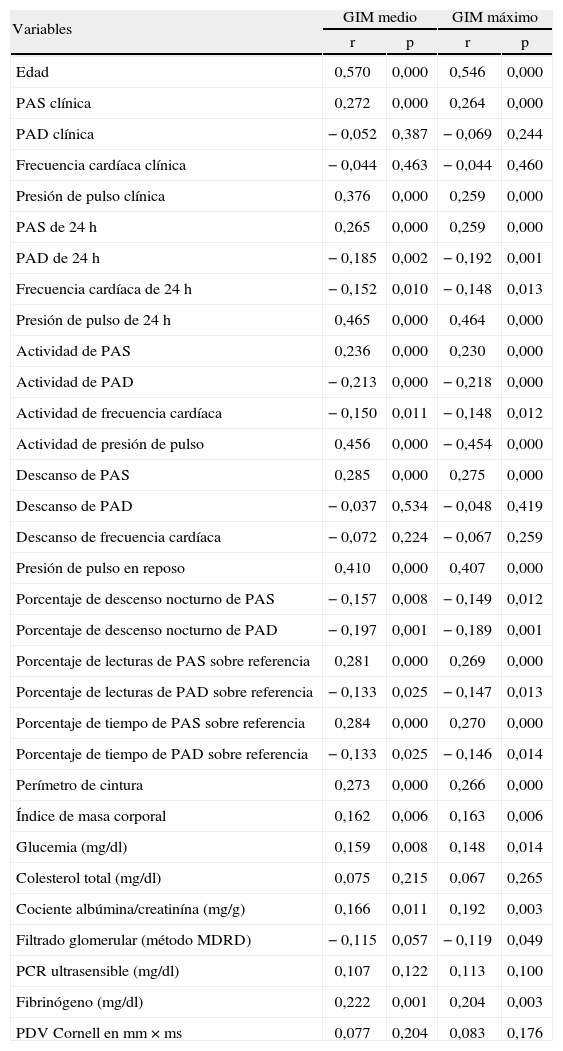
| Edad | 0,570 | 0,000 | 0,546 | 0,000 |
| PAS clínica | 0,272 | 0,000 | 0,264 | 0,000 |
| PAD clínica | −0,052 | 0,387 | −0,069 | 0,244 |
| Frecuencia cardíaca clínica | −0,044 | 0,463 | −0,044 | 0,460 |
| Presión de pulso clínica | 0,376 | 0,000 | 0,259 | 0,000 |
| PAS de 24h | 0,265 | 0,000 | 0,259 | 0,000 |
| PAD de 24h | −0,185 | 0,002 | −0,192 | 0,001 |
| Frecuencia cardíaca de 24h | −0,152 | 0,010 | −0,148 | 0,013 |
| Presión de pulso de 24h | 0,465 | 0,000 | 0,464 | 0,000 |
| Actividad de PAS | 0,236 | 0,000 | 0,230 | 0,000 |
| Actividad de PAD | −0,213 | 0,000 | −0,218 | 0,000 |
| Actividad de frecuencia cardíaca | −0,150 | 0,011 | −0,148 | 0,012 |
| Actividad de presión de pulso | 0,456 | 0,000 | −0,454 | 0,000 |
| Descanso de PAS | 0,285 | 0,000 | 0,275 | 0,000 |
| Descanso de PAD | −0,037 | 0,534 | −0,048 | 0,419 |
| Descanso de frecuencia cardíaca | −0,072 | 0,224 | −0,067 | 0,259 |
| Presión de pulso en reposo | 0,410 | 0,000 | 0,407 | 0,000 |
| Porcentaje de descenso nocturno de PAS | −0,157 | 0,008 | −0,149 | 0,012 |
| Porcentaje de descenso nocturno de PAD | −0,197 | 0,001 | −0,189 | 0,001 |
| Porcentaje de lecturas de PAS sobre referencia | 0,281 | 0,000 | 0,269 | 0,000 |
| Porcentaje de lecturas de PAD sobre referencia | −0,133 | 0,025 | −0,147 | 0,013 |
| Porcentaje de tiempo de PAS sobre referencia | 0,284 | 0,000 | 0,270 | 0,000 |
| Porcentaje de tiempo de PAD sobre referencia | −0,133 | 0,025 | −0,146 | 0,014 |
| Perímetro de cintura | 0,273 | 0,000 | 0,266 | 0,000 |
| Índice de masa corporal | 0,162 | 0,006 | 0,163 | 0,006 |
| Glucemia (mg/dl) | 0,159 | 0,008 | 0,148 | 0,014 |
| Colesterol total (mg/dl) | 0,075 | 0,215 | 0,067 | 0,265 |
| Cociente albúmina/creatinína (mg/g) | 0,166 | 0,011 | 0,192 | 0,003 |
| Filtrado glomerular (método MDRD) | −0,115 | 0,057 | −0,119 | 0,049 |
| PCR ultrasensible (mg/dl) | 0,107 | 0,122 | 0,113 | 0,100 |
| Fibrinógeno (mg/dl) | 0,222 | 0,001 | 0,204 | 0,003 |
| PDV Cornell en mm × ms | 0,077 | 0,204 | 0,083 | 0,176 |
MDRD: Modification of Diet in Renal Disease; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva.
Después de la edad, la variable con más correlación con el GIM, tanto en GIM medio, como en GIM máximo, es la PP, tanto de la PAC (r = 0,376 y 0,259; p = 0,000), como de 24h (r = 0,465 y 0,464; p = 0,000), de actividad (r = 0,456 y 0,454; p = 0,000) y en descanso (r = 0,410 y 0,407; p = 0,000). Encontramos también una correlación negativa con el descenso nocturno de la PAS, tanto sistólico (r = −0,157 y −0,149; p < 0,01), como diastólico (−0,197 y −0,189; p = 0,001). Asimismo, se puede observar una correlación positiva con el porcentaje de tiempo y lecturas por encima de los límites de la PAS y negativa con la PAD.
Finalmente, encontramos una correlación positiva con el perímetro de cintura (r = 0,273 y 0,266; p = 0,000) e IMC (r = 0,162 y 0,163; p = 0,006). Respecto a datos de laboratorio, únicamente se encuentra asociación positiva con la glucemia y el fibrinógeno, así como con el cociente albúmina creatinina y la tasa de filtrado glomerular estimada por el método MDRD como indicadores de lesión renal, pero no se encuentra relación con el producto duración-voltaje de Cornell como indicador de lesión cardíaca.
Análisis multivarianteEn el análisis multivariante, considerando GIM medio como variable dependiente, la R2 ajustada es de 0,459, y las variables que se mantienen en la ecuación han sido la edad (beta 0,499; p = 0,000), la PP de 24h (beta 0,327; p = 0,000), el sexo varón (beta 0,147; p = 0,006) y la frecuencia cardíaca en descanso (beta 0,145; p = 0,007). Si consideramos el GIM máximo como variable dependiente, la R2 ajustada es de 0,430 y las variables que se mantienen en la ecuación han sido la edad (beta 0,462; p = 0,000), la PP de 24h (beta 0,308; p = 0,000), el cociente albúmina creatinina (beta 0,128; p = 0,020), el sexo varón (beta 0,132; p = 0,016) y la frecuencia cardíaca en descanso (beta 0,123; p = 0,028).
DiscusiónLa MAPA es una herramienta cada vez más accesible y ofrece una información importante de lo que acontece en el árbol vascular durante las 24h del día. En este estudio, hemos encontrado una asociación directa entre la elevación de la PAS, así como de la PP, tanto clínica como ambulatoria, con el incremento del GIM de carótida y una asociación inversa con la PAD. A menor PAD, mayor GIM. Asimismo, hemos hallado mayor GIM en los pacientes que presentan patrón circadiano de la PA no reductores.
Patrón circadiano y grosor íntima-mediaEl descenso nocturno de la PA, principalmente la PAS12, se ha asociado de forma directa con el riesgo vascular, y sirve para clasificar a los pacientes en las categorías de dipper o patrón normal, non-dipper, extreme dipper y riser, fin para el que la PAD se utiliza menos. Este hecho se confirma en este estudio con la asociación inversa encontrada entre el porcentaje de descenso nocturno de la PA, tanto sistólica como diastólica, y el GIM, como marcador de riesgo vascular. El descenso nocturno de la PAD encontrado (15,78%) ha sido mayor que el de la PAS (10,89%), aunque el porcentaje de individuos con patrón dipper fue similar, utilizando cualquiera de los 2 criterios para clasificarlos (46 y 44%). Sin embargo, la proporción de los otros 3 patrones experimenta un cambio importante, en que si utilizamos la diastólica, el extreme dipper aumenta mucho, y si usamos la sistólica, los riser y non-dipper. Estos datos no concuerdan con otros publicados por Tatasciore et al18, los cuales encontraron un 48% de patrón dipper con la PAS y un 73% con la PAD. Las implicaciones pronósticas del uso de la PAD para clasificar los patrones reductores están todavía por definir correctamente, pero el rango mayor de descenso la puede hacer más sensible que la sistólica, a la hora de clasificar a los pacientes en función del grado de riesgo vascular.
Se han utilizado diferentes protocolos y metodologías para estimar el GIM. Nosotros hemos optado por estimarlos en carótida común, que ha mostrado una reproducibilidad mayor que en bulbo y carótida interna, por la mayor dificultad y el número mayor de valores missing encontrados en estas otras localizaciones. Los valores medios promedio (0,765mm) y máximos promedio (0,943mm) concuerdan con los hallados por otros autores en pacientes hipertensos y dislipémicos26–29, así como en población general30,31. Hemos encontrado una asociación clara entre el patrón circadiano de la PA y el GIM, tanto el valor medio como el promedio de máximos valores. Destaca el hecho que quien marca la diferencia estadística es el patrón riser, en el que el GIM medio, como el máximo, son mayores que el resto, tanto si se utiliza el patrón sistólico, como el diastólico. Sin embargo, el extreme dipper, en el que el GIM es inferior a los otros patrones, sólo alcanza la diferencia estadísticamente significativa si utilizamos la PAD para clasificar el patrón circadiano, posiblemente debido a que la muestra de este patrón es mayor si se utiliza el criterio de la PAD, lo cual aumenta la potencia estadística del contraste post hoc. Para concretar, hemos encontrado un GIM mayor en los riser y menor en los extreme dipper, siendo similar en los patrones dipper y non-dipper. Cuspidi et al32 encontraron resultados similares, donde los individuos con patrón reductor tenían un GIM ligeramente inferior (0,7mm) a los no reductores (0,8mm), con una prevalencia de placas superior a las encontradas en este trabajo (33-35%), pero sin diferencia entre los patrones.
Variables que se relacionan con el GIMEl GIM, tanto medio como máximo, presenta una correlación positiva intensa, especialmente con la edad y con determinados parámetros de la MAPA. La PAS, tanto la clínica como la ambulatoria en 24h, actividad y descanso, tiene una correlación positiva con el GIM. Sin embargo, la PAD tiene un comportamiento inverso, la correlación es negativa, pero sólo alcanza la significación estadística en el período de actividad y en 24h. Estos hallazgos son concordantes con el trabajo de Arnett et al33 en el estudio ARIC, en el que encuentra una correlación positiva del GIM con la PAS, y no encontraba, o era negativa, con la PAD, dependiendo de la etnia, tanto en pacientes en tratamiento antihipertensivo como sin él. Por otra parte, el parámetro que presenta más asociación con el GIM es la PP, tanto clínica como ambulatoria, y especialmente en el período de actividad. Zanchetti et al34 y Su et al35 han encontrado resultados similares, pero con una correlación de menor intensidad que la nuestra. La única excepción es que, en la PAD, Zanchetti et al34 no hallaron significación estadística en la asociación. Estos datos indican que los pacientes con mayor PP tendrán mayor GIM y, por tanto, un riesgo cardiovascular mayor. También se ha observado una asociación clara entre el porcentaje de tiempo y el porcentaje de lecturas de PA que están por encima de los límites de referencia de buen control y el GIM, pero positivo en el caso de la sistólica y negativo en el caso de la diastólica.
En resumen, hemos encontrado una íntima media de carótida de mayor grosor cuando la PAS y la PP son más elevadas y la PAD es más baja, y cuando el descenso nocturno de la PA, tanto PAS como PAD, es menor.
Con el resto de parámetros biológicos analizados, solamente se ha encontrado asociación con el perímetro de cintura y el IMC, en el caso de la exploración física, y con el cociente albúmina/creatinina y fibrinógeno, en los analíticos, hechos explicables por la asociación ya conocida entre obesidad y GIM, en el primer caso, y la asociación de lesión de órganos diana vasculares y renales, en el segundo. Pero la relación con el fibrinógeno, aunque algunos autores36 ya la han descrito, no está totalmente establecida.
Análisis multivarianteEn el análisis multivariante, aparte de la edad y el sexo, las variables que se relacionan tanto con el GIM medio, como con el máximo, son la PP de 24h y la frecuencia cardíaca en descanso, lo cual refuerza la importancia que actualmente se está dando a la PP y al análisis de la onda de pulso en la predicción de riesgo cardiovascular. La inclusión en la ecuación de la frecuencia cardíaca en reposo, cuando no se ha encontrado asociación en el análisis univariante, no tiene una explicación clara, hecho que habrá que seguir investigando en el futuro. Aunque se ha encontrado relación entre la frecuencia cardíaca y la morbimortalidad cardiovascular37, todavía hay cierta discusión sobre el valor pronóstico de la frecuencia cardíaca38. Existe aún más controversia en la relación entre la frecuencia caríaca y la lesión de órganos diana. En un estudio reciente, Cuspidi et al39 no encuentran datos concluyentes que apoyen esta asociación.
LimitacionesEste estudio puede tener algunas limitaciones, como por ejemplo, en la selección de los individuos, ya que el muestreo ha sido consecutivo con unos criterios pragmáticos y amplios de inclusión, y no se trata de un muestreo aleatorizado. Por lo tanto, en la muestra hay individuos hipertensos, diabéticos e hiperlipémicos, algunos presentan ya enfermedades arterioscleróticas diagnosticadas y muchos de ellos están en tratamiento farmacológico; en consecuencia, es una muestra heterogénea que puede originar algunas limitaciones a la hora de interpretar los resultados, aunque se aproxima a la distribución de la población general con algún factor de riesgo cardiovascular. El hecho de que se haya analizado sólo la carótida común infraestima la existencia de placas que son más frecuentes en el bulbo y en la carótida interna, pero a cambio garantiza más la fiabilidad y la comparabilidad de los resultados.
En conclusión, podemos decir que el GIM medio y máximo es mayor en los individuos con patrón riser que en los otros. Asimismo, encontramos una asociación positiva entre el GIM medio y máximo con la PAS y la PP, tanto clínica como ambulatoria, y negativa con la PAD ambulatoria y con el descenso nocturno de la PA.