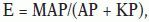Se desconocen los efectos directos de la cafeína en arterias con disfunción endotelial y aterosclerosis.
ObjetivoEvaluar los efectos vasoactivos in vitro de la cafeína en anillos de aorta de conejos ateroscleróticos.
MetodologíaLa aterosclerosis fue inducida en conejos (n=10) alimentados con dieta aterogénica (1% colesterol, durante 16 semanas) (grupo 1). El grupo control (n=10) recibió una dieta estándar libre de colesterol (grupo 2). Al final de las 16 semanas, se sacrificó a los animales y se determinó el colesterol sérico. Los estudios de reactividad vascular y análisis morfométrico se llevaron a cabo en anillos de aorta torácica. Se estudió la reactividad vascular en respuesta a la acetilcolina, la nitroglicerina y la cafeína a 3 dosis correspondientes al contenido de esta sustancia de 1, 2 y 3 triples cafés expresso.
ResultadosLa relajación máxima a la acetilcolina en arterias de conejos sanos (22,5±16,8%) fue mayor que en arterias de conejos ateroscleróticos (3,6±3,7%; p=0,006). Aunque el efecto vasodilatador de la cafeína fue dependiente de la concentración (p<0,001), no se encontraron diferencias entre las arterias provenientes de conejos sanos (75,73±11,20%) y las de conejos ateroscleróticos (68,19±15,07%; p=0,238). La nitroglicerina produjo una relajación menor que la cafeína, tanto en arterias de conejos sanos (32,78±12,30%), como en las de conejos enfermos (73,48±18,93%; p<0,001). El EC50 (concentración del agente vasodilatador que causa un 50% de relajación) fue similar para los 2 vasodilatadores (p=0,178). Las lesiones aórticas en el grupo 1 consistieron en placas tempranas. El recubrimiento endotelial (CD31) fue del 92,2±5,6% y el 92±4,8%, respectivamente (p=0,927).
ConclusionesLa cafeína ejerce un potente efecto vasodilatador arterial in vitro, independiente de la presencia o la ausencia de aterosclerosis.
The effects of caffeine on arteries with endothelial dysfunction and atherosclerosis are unknown.
ObjectiveTo evaluate the in-vitro vasoactive effects of caffeine on aortic rings from atherosclerotic rabbits. Methodology. Atherosclerosis was induced in rabbits (n=10) fed an atherogenic diet (1% cholesterol) (group 1). The control group (n=10) received a cholesterol-free diet (group 2). At 16 weeks we evaluated serum cholesterol, and all the animals were sacrificed. Thoracic aorta rings were obtained for vasoreactivity studies and morphometric analyses. Agonists were nitroglycerine, acetylcholine, and caffeine at 3 doses corresponding to one, 2 and 3 triple espressos.
ResultsArterial relaxation with acetylcholine in arteries from healthy rabbits (22.5±16.8%) was greater than in arteries from atherosclerotic rabbits (3.6±3.7%; p=0.006). Although the vasodilator effect of caffeine was dependent on the concentration (p<0.001), no differences were found between arteries from healthy rabbits (75.73±11.20%) and those from diseased rabbits (68.19±15.07%; p=0.238). Nitroglycerine generated less relaxation than caffeine, both in arteries from healthy rabbits (32.78±12.30%) and from diseased rabbits (73.48±18.93%; p<0.001). The EC50 (half maximal effective concentration) was similar for both vasodilators (p=0.178). The aortic lesions in group 1 consisted of early plaques. The endothelial covering (CD31) was 92.2±5.6% and 92±4.8% respectively (p=0.927).
ConclusionsCaffeine exerts a potent arterial vasodilator effect in-vitro regardless of the presence or absence of atherosclerosis.
El café es la bebida estimulante más consumida en el mundo actualmente. La cafeína (CAF) (1, 3,7trimetilxantina) es el principio activo más conocido del café y se ha estudiado en diferentes condiciones de salud física y mental1,2. La relación entre el consumo de café y la salud cardiovascular ha sido motivo de interés durante décadas, y ha arrojado resultados contradictorios. Se ha descrito que el consumo de café podría afectar de manera adversa a la presión arterial3,4, el perfil de lípidos4, los valores de homocisteína5, así como favorecer la presencia de taquicardia y arritmias cardíacas6,7 e inducir más incidencia de enfermedad coronaria sintomática8. En contraparte a esta información, otros estudios indican que el consumo de café podría tener efectos beneficiosos, o al menos no nocivos, en el sistema cardiovascular9,10, y que los efectos adversos adjudicados a la CAF pueden deberse a otros ingredientes del café diferentes a la CAF11.
En distintas enfermedades vasculares o condiciones patológicas, la relajación vascular dependiente del endotelio está anormalmente reducida12 y la reactividad vascular arterial anormal se ha observado en presencia de una afectación de la función endotelial13. Se ha comprobado que la relajación vascular en respuesta a la acetilcolina (Ach) está disminuida en conejos hipercolesterolémicos14. Se ha demostrado que la aplicación de CAF tiene un efecto vasodilatador en arterias de ratas sanas15–17 e hipertensas17; adicionalmente, se ha encontrado que este efecto es independiente de la denudación in vitro del endotelio15–17.
En todas sus etapas, la aterosclerosis se asocia a disfunción endotelial e inflamación, que en conjunto podrían afectar a la reactividad arterial18. Como se desconoce el efecto vascular directo de la CAF en presencia de factores de riesgo, disfunción endotelial y aterosclerosis, en el presente estudio realizamos un análisis de los efectos in vitro de la CAF en la relajación vascular de arterias de conejos con aterosclerosis, y comparamos su efecto vasodilatador con el de la nitroglicerina (NTG).
MetodologíaAnimalesEl Comité de Ética en Investigación Animal (CEIA) de la Fundación CardioInfantil aprobó este proyecto. Se realizó un estudio experimental, aleatorizado y controlado. Se utilizó un modelo experimental de aterosclerosis, en conejos machos de raza Nueva Zelanda, tal como está descrito en estudios previos19,20. Diez animales (grupo 1) recibieron una dieta controlada con suplemento de colesterol al 1% por períodos de 4 semanas, alternada con una dieta normal (Purina SA) para un total de 16 semanas. Se alimentó a otros 10 animales (grupo 2) con dieta normal durante todo el período experimental.
Medición del colesterol séricoDespués de un período de aclimatación de 1 semana, se midieron los valores séricos de colesterol de cada animal en estado basal. Para esto, bajo los efectos de anestesia con ketamina (50mg/kg intramuscular [i.m.]), a todos los animales se extrajeron 5μl de sangre periférica en estado de ayuno. Posteriormente, en la semana 16, se obtuvo una segunda muestra sanguínea de control.
Eutanasia y preparación del tejido vascularLa eutanasia se desarrolló al final de la semana 16 de seguimiento. Se utilizó anestesia general con ketamina (50mg/kg i.m.) e inyección letal de tiopental sódico (Penthotal®, USP) 150mg/kg por vía intravenosa. Inmediatamente después, la aorta fue cuidadosamente aislada y disecada. El segmento proximal de la aorta torácica se aisló y dividió en 8 anillos para el estudio de relajación vascular in vitro. El segmento de aorta torácica restante se mantuvo y perfundió manualmente con formaldehído en solución de fosfato al 10% a presión de 80mmHg durante 10min. De este segmento, la porción distal de la aorta torácica, por encima de la arteria renal derecha, se cortó de modo cuidadoso en un segmento de 2cm para realizar los análisis histomorfométricos.
Reactividad arterial in vitroLa preparación del segmento de aorta torácica, para el estudio de relajación vascular in vitro, se realizó como se ha descrito previamente21. Cada segmento se transfirió al laboratorio para someterlo a disección y limpieza del tejido conectivo exuberante. Se colocaron 8 anillos obtenidos de cada segmento en baños de órgano con solución de Krebs-Henseleit con la composición siguiente (en mM): cloruro sódico 117; cloruro de potasio 4,7; cloruro de clacio 6,1; sulfato de magnesio 1,17; bicarbonato de sodio 24,9; D-glucosa 11, y pH 7,40 ± 0,05. El tiempo entre la obtención del tejido aórtico y su preparación fue inferior a 30min.
Preparación de anillos vasculares aisladosLos anillos se suspendieron entre 2 asas de alambre en una cámara de vidrio en el equipo de baño de órganos, con 25ml de solución de Krebs-Henseleit a 37°C, aireada con oxígeno al 95% y dióxido de carbono al 5%. Se conectaron las asas de alambre a un transductor de fuerza (Kent-Scientific Corporation, Litchfield, CT), y los cambios de tensión isométrica se registraron utilizando el sistema PowerLab/4SP (ADInstruments, Mountain View, CA). Se definió una tensión en reposo de 2g en observaciones preliminares y, después de obtenerlo, el tejido se sometió a un período de estabilización de 60min.
Evaluación de la relajación vascularCada segmento de aorta obtenido de cada animal se dividió en 8 anillos, cada uno de los cuales se precontrajo con norepinefrina (NE) 3,16 × 10-6M, y se utilizó de la manera siguiente: en 3 anillos se evaluó la relajación independiente de endotelio (RIE) utilizando NTG en dosis acumulativas (10-8 a 10-4M); en 2 anillos se evaluó la relajación dependiente de endotelio (RDE) con el uso de Ach 3,16 × 10-6M; y en 3 anillos se evaluó la relajación con cafeína (CAF) utilizando CAF en 3 dosis acumulativas de 2,4 × 10-5M, 4,6 × 10-5M y 6,9 × 10-5M; concentraciones que corresponden a 1, 2 y 3 veces el valor plasmático de CAF reportado en bebedores no habituales después de la ingesta de un “café triple expresso”11. Sólo se administró un tratamiento en cada anillo (NTG, Ach o CAF) y se realizó el promedio de los resultados para cada uno de estos agentes vasoactivos y por cada animal.
A partir de los resultados obtenidos para cada vasodilatador, se calculó el EC50, el cual se define como la concentración del agente vasodilatador que causa un 50% de relajación. El EC50 se determinó para cada curva contracción-relajación por la ecuación siguiente (ajuste logístico de una curva)22:
donde E es la respuesta, M es la máxima contracción (o relajación), A es la contracción, K es la concentración EC50 y P es la pendiente del parámetro. A partir de esta ecuación, el valor medio EC50 ± desviación estándar se calculó en cada grupo y para cada fármaco.Agentes vasoactivosNE sal bitartrato, Ach cloridra y CAF anhidra se obtuvieron de Sigma Aldrich, Inc. (St. Louis, MO, USA). La NTG se obtuvo de American Regents Laboratories, Inc. (Shirley, NY, EE.UU.).
Análisis histomorfométricoProcesamiento del tejido. Después de la fijación tisular en formalina, los segmentos se embebieron en parafina a 56–58°C. Las secciones se realizaron a 4μm y se teñiron con el método de tricrómico de Masson y elástica e inmunohistoquímica con anticuerpos monoclonales contra macrófagos de conejo RAM-11, y anticuerpos monoclonales para células endoteliales CD31 (DAKO® Corporation, Carpintería, CA) para documentar la presencia de macrófagos/células espumosas y cobertura luminal por células endoteliales, respectivamente. Se realizó un análisis individual de los segmentos utilizando un microscopio de luz (Olympus BX50). Los segmentos se midieron usando morfometría digital y planimetría computarizada (Media Cybernetics® Image-Pro PlusTM).
Morfometría. Cada segmento de aorta examinado se localizó sistemáticamente en el centro del campo del objetivo, con magnificación 2×. El área del vaso corresponde al área comprendida dentro de la lámina elástica externa (mm2), el área del lumen corresponde al área dentro de la superficie endotelial (mm2) y el área de la placa aterosclerótica corresponde al área comprendida entre la lámina elástica interna y el lumen arterial cuantificado en μm2. Los macrófagos/células espumosas se definieron por células positivas a anticuerpos RAM-11 en la íntima arterial, con magnificación 40×. Las células endoteliales se definieron como la presencia de células positivas a anticuerpos CD31 en la luz de la arteria y las cuantificamos en porcentaje de cobertura de la superficie luminal en forma ciega, con una magnificación 60×, tanto en los segmentos de aorta del grupo control, como del grupo enfermo, con el método que Fonseca et al23 describieron previamente.
Análisis estadísticoLos datos se presentan como media ± desviación estándar. Para determinar si hubo diferencias en el peso y en el colesterol sérico entre el grupo 1 y el grupo 2, se realizaron pruebas de la t de Student. Para determinar si hubo diferencias en la relajación con Ach entre las arterias de los conejos del grupo 1 y del grupo 2, se realizó una prueba U de Mann Whitney.
Para realizar los análisis estadísticos, los valores de EC50 se normalizaron a partir de la transformación –log molar. Se realizó análisis de medidas repetidas para: a) determinar el efecto de las dosis de CAF y las diferencias entre los 2 grupos de conejos en la vasorreactividad obtenida con CAF, y b) evaluar si hubo diferencias debidas al fármaco (CAF y NTG) y a la dieta (normal y aterogénica) en la reactividad vascular (relajación máxima y EC50). Con el fin de determinar si hubo diferencias morfométricas en los segmentos de los 2 grupos asociadas con el tipo de dieta, se realizaron pruebas de la t de Student. El valor de significación estadística se estableció con una significación estadística de p ≤ 0,05. Para realizar los análisis estadísticos, utilizamos el software SPSS, versión 10.5.
ResultadosDe los 20 animales que comenzaron el estudio, un animal falleció por neumonía. Diecinueve terminaron la observación durante las 16 semanas (grupo 1, n = 10; grupo 2, n = 9). El peso al final de la observación fue de 4,3 ± 0,3kg en el grupo 1 y 4,0 ±0,5kg en el grupo 2 (p = 0,01).
Valores de colesterol séricoLa cifra de colesterol total basal al comienzo del estudio fue de 53,1 ±5,3mg/dl para el total de los animales. Al finalizar el estudio, la cifra de colesterol total en el grupo 1 fue de 221,8 ± 29,1mg/dl, y en el grupo 2, de 54,9 ± 7,3mg/dl (p = 0,002).
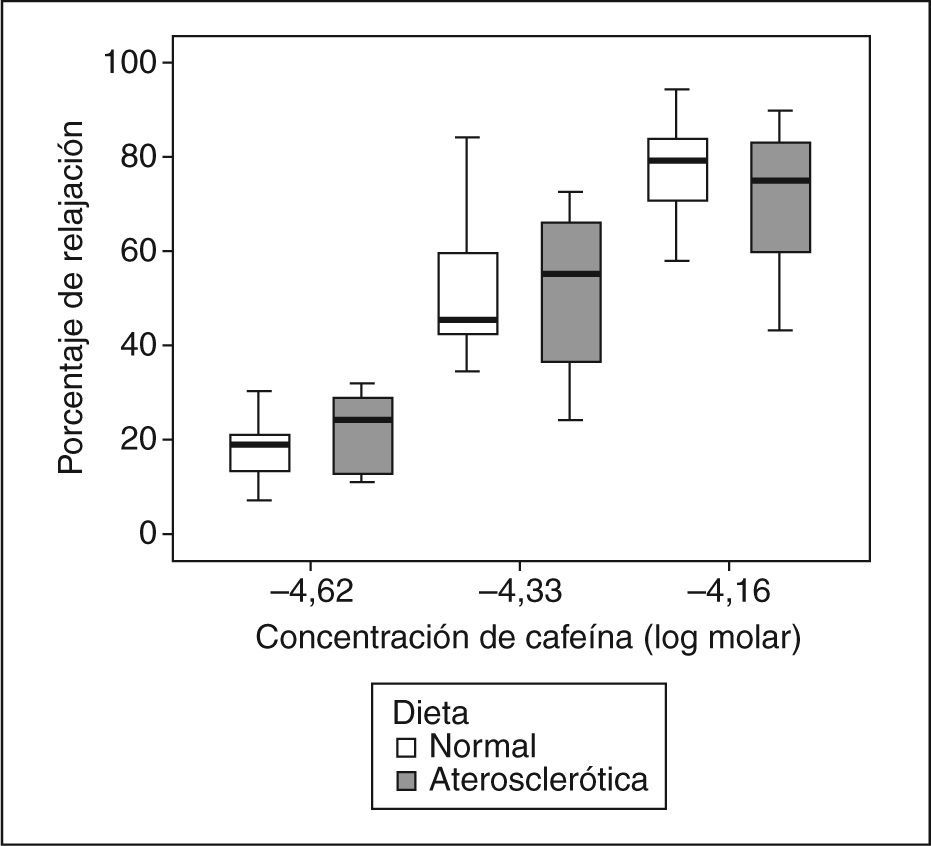
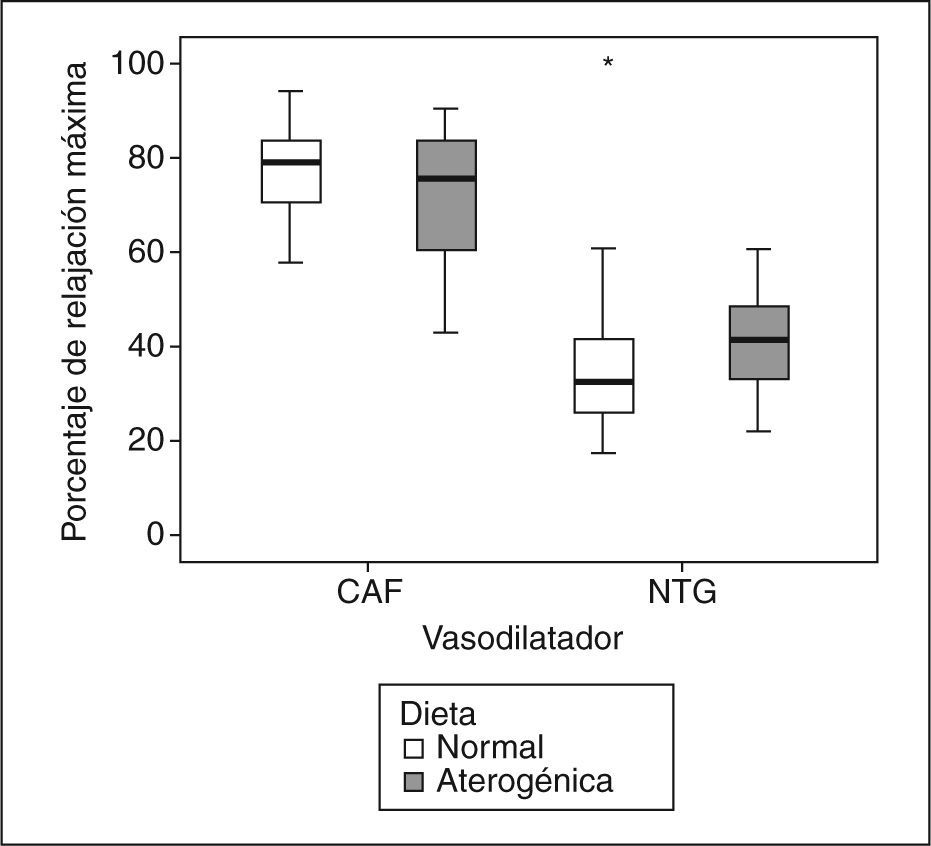
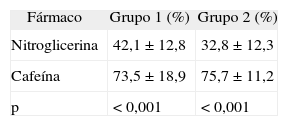
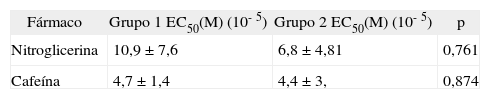
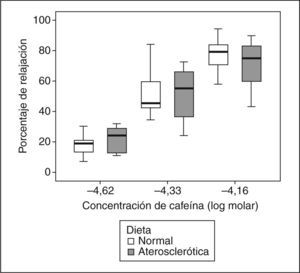
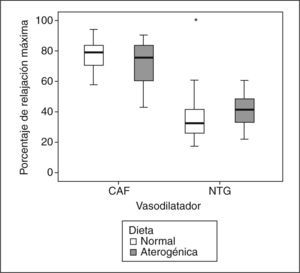
Relajación vascularEn el grupo 1, la Ach indujo una relajación vascular máxima de 3,6 ± 3,7%, y en el grupo 2, de 22,5 ± 16,8% (p = 0,006). La relajación vascular obtenida con CAF fue dependiente de la concentración (fig. 1), sin que se observaran diferencias significativas entre los grupos en la relajación máxima alcanzada (tabla 1). Al comparar los efectos de la NTG y la CAF, encontramos que la CAF indujo más relajación que la NTG (p < 0,001) (tabla 2; fig. 2), sin que se obtuvieran diferencias significativas entre los 2 grupos de conejos (p = 0,238). Los valores de EC50 obtenidos con los 2 vasodilatadores no mostraron diferencias significativas entre los 2 fármacos (NTG frente a CAF), ni entre los 2 grupos (tabla 3).
Porcentaje de relajación vascular inducido por cafeína en anillos de aorta precontraídos con norepinefrina (−5,5 log molar), procedentes de conejos ateroscleróticos después de la administración de una dieta rica en colesterol al 1% durante 16 semanas (cajas de color gris) y de conejos sanos (cajas de color blanco). Se ilustra la vasodilatación arterial inducida por cafeína con dosis correspondientes a 1 (−4,62M), 2 (−4,33M) y 3 triples expresos (−4,16M).
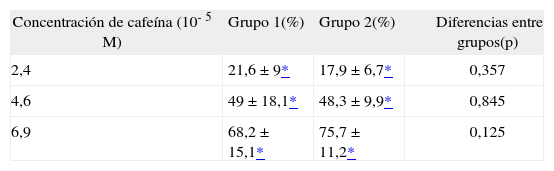
Porcentajes de relajación vascular máxima obtenidos con cafeína
| Concentración de cafeína (10-5M) | Grupo 1(%) | Grupo 2(%) | Diferencias entre grupos(p) |
| 2,4 | 21,6 ±9* | 17,9 ± 6,7* | 0,357 |
| 4,6 | 49 ± 18,1* | 48,3 ± 9,9* | 0,845 |
| 6,9 | 68,2 ± 15,1* | 75,7 ± 11,2* | 0,125 |
Datos presentados como media ± desviación estándar.
Porcentaje de relajación máxima inducida por cafeína (CAF) o nitroglicerina (NTG) en anillos de aorta precontraídos con norepinefrina (−5,5 log molar), procedentes de conejos con aterosclerosis (color gris) y de conejos sanos (color blanco). Se ilustra la mayor vasodilatación ocasionada por la CAF con respecto a la NTG (p < 0,001) y la ausencia de diferencias entre los 2 grupos de conejos en la respuesta a los vasodilatadores (p = 0,238).
Valores de EC50 obtenidos con la relajación vascular obtenida con cafeína y nitroglicerina
| Fármaco | Grupo 1 EC50(M) (10-5) | Grupo 2 EC50(M) (10-5) | p |
| Nitroglicerina | 10,9 ±7,6 | 6,8 ±4,81 | 0,761 |
| Cafeína | 4,7 ± 1,4 | 4,4 ± 3, | 0,874 |
Los valores de EC50 (concentración del agente vasodilatador que causa un 50% de relajación) son presentados en M, y los análisis estadísticos se realizaron a partir de la transformación a log molar. Datos presentados como media ± desviación estándar.
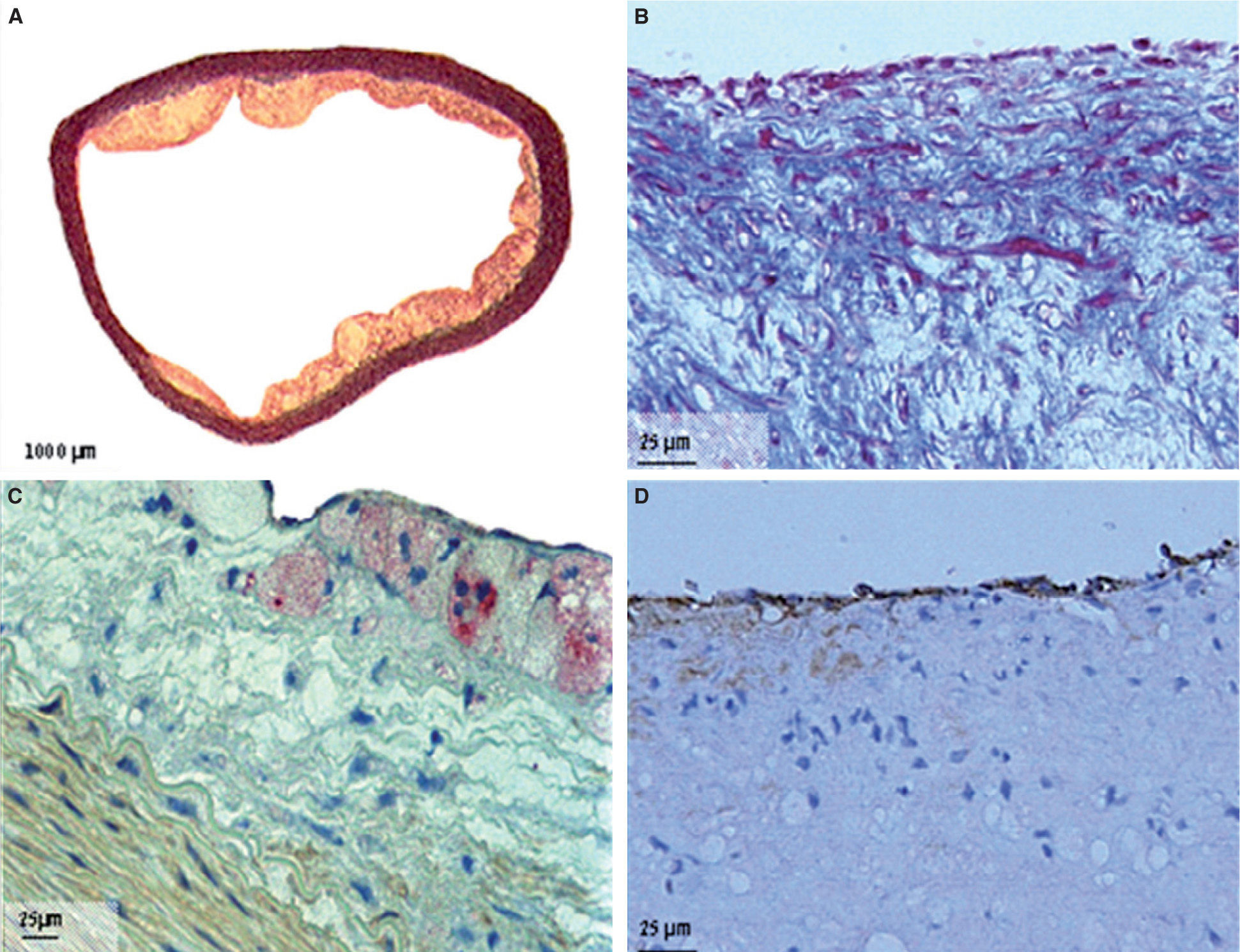
En el grupo 1, las lesiones ateroscleróticas consistían principalmente en placas arterioscleróticas no muy elevadas, ricas en macrófagos/células espumosas, con escasa matriz extracelular y ausencia de cápsula fibrosa. No se observó ninguna placa de fibroateroma en este modelo. El análisis de inmunohistoquímica mostró también presencia de células endoteliales teñidas con CD31 en el 92,22 ± 5,65% de la superficie luminal del grupo 1, y en el 92 ± 4,83% del grupo 2 (p = 0,927). Las características histomorfométricas de las lesiones en el grupo 1 fueron: área del vaso 6,8 ±1,4mm2, área del lume 5,2 ± 1,4mm2 y área de placa 207 ± 22,7μm2. Las características histomorfométricas de las lesiones en el grupo 2 fueron: área del vaso, 6,3 ±1,6mm2 (p = 0,572), área del lumen 4,8 ± 1,4mm2 (p = 0,561), y área de la placa 0,0μm2 (p < 0,001) (fig. 3).
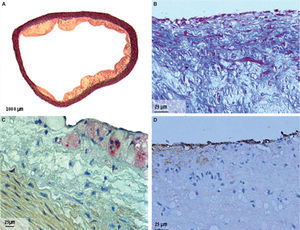
Cortes histológicos de aortas torácicas de conejos con aterosclerosis. A. Segmento de aorta, coloración tricrómico elástica; magnificación 2×. B. Segmento de aorta con tinción tricrómico elástica; magnificación 60×. C. Segmento de aorta con tinción de macrófagos/células espumosas; RAM-11 (anticuerpos monoclonales contra macrófagos de conejo); magnificación 40×. D. Sección de aorta con tinción de endotelio; CD31 (anticuerpos monoclonales para células endoteliales); magnificación 60×.
En este estudio se demostró que la CAF induce un efecto vasodilatador in vitro dependiente de la dosis, con dosis semejantes a las de consumo habitual en humanos, en segmentos de aorta torácica provenientes de conejos sanos, como también en conejos con dislipemia, disfunción endotelial y aterosclerosis. Adicionalmente, se encontró que la CAF indujo un porcentaje mayor de vasodilatación que la NTG, aunque no se observaron diferencias en el EC50. Estos resultados implican que la CAF es un vasodilatador potente en arterias de aorta provenientes de conejos y que podría desempeñar un papel vasculoprotector, lo que puede explicarse por los mecanismos de acción molecular de la CAF, los cuales son tanto independientes de la integridad del endotelio (al igual que la NTG), como dependientes del endotelio. Los efectos vasodilatadores arteriales in vitro de la CAF en modelos animales se han descrito previamente15–17; en estos estudios se ha denudado el endotelio y los efectos se han explicado por la acción directa en las células del músculo liso vascular. El mecanismo de acción vascular directo de la CAF en las células de músculo liso vascular (efecto independiente de endotelio), se ha atribuido a la capacidad de la CAF para inhibir la fosfodiesterasa cíclica24,25, haciendo que las concentraciones de nucleótidos cíclicos (monofosfato de adenosina cíclico [AMPc] y monofosfato de guanosina cíclico [GMPc]) aumenten, ocasionando vasodilatación26, a través de sus acciones en reducir las concentraciones de calcio sérico (Ca++) intracelular27–29.
Asimismo, diversos estudios han demostrado que la CAF puede inducir vasodilatación arterial por mecanismos dependientes de endotelio, y aumentar las concetraciones de Ca++ disponibles procedentes del retículo sarcoplásmico15,30. El Ca++ liberado forma un complejo con la calmodulina, lo que activa la acción del óxido nítrico (NO) sintasa endotelial, para producir NO mediante la degradación de L-arginina a citrulina31. El NO producido es no polar, por lo que cruza las membranas celulares sin necesidad de un transportador32. Al entrar el NO a la célula del músculo liso vascular, éste se une al grupo heme de la guanilato ciclasa33, y activa la producción y la concentración de GMPc, causando vasodilatación arterial.
Los resultados de nuestro estudio demuestran el efecto vasodilatador de la CAF en arterias sanas (endotelio normal), y en arterias en las cuales la relajación arterial dependiente del endotelio secundaria a la aplicación de Ach estuvo significativamente disminuida, con los análisis histopatológicos que corroboran la presencia de lesiones ateroscleróticas tempranas ricas en macrófagos/células espumosas. En este caso, la disfunción endotelial se debe a una alteración en la señalización de membrana, debida a alteraciones de la función de la proteínas G34, o a un incremento en la degradación oxidativa del NO, como ya se ha demostrado previamente35.
Adicionalmente, nuestros resultados indican que con concentraciones similares al consumo de un triple café expresso, la CAF induce una vasodilatación leve a moderada, mayor que la inducida por la NTG. A concentraciones mayores correspondientes a 2 triples cafés expresso, induce una respuesta de vasodilatación un 127% mayor, y con 3 triples expresso, un 216% superior a la primera dosis, con lo que se obtiene una relación dosis-respuesta que triplica el efecto vasodilatador tanto en arterias sanas como enfermas. Los porcentajes más elevados de relajación obtenidos con CAF podrían deberse a que la CAF actúa en 2 vías metabólicas diferentes para generar la vasodilatación arterial15: a) una mediada directamente por las células del músculo liso vascular, y b) otra mediada por las células endoteliales que, aunque con algún grado de disfunción, podrían contribuir a la liberación de NO.
Como la enfermedad cardiovascular es la principal causa de muerte e incapacidad en el mundo occidental36, el café, la bebida caliente más consumida en el mundo, y a partir de nuestros resultados, es de interés prioritario realizar estudios clínicos que validen el efecto vasodilatador arterial de la CAF en pacientes con factores de riesgo, disfunción endotelial y aterosclerosis.
En conclusión, los resultados de este estudio demuestran una potente relajación vascular inducida por la CAF en segmentos aislados de aorta de conejos sanos e hipercolesterolémicos, con disfunción endotelial y aterosclerosis. Su efecto vasodilatador arterial puede obtenerse con dosis de consumo comunes desde 1 a 3 triples cafés expresso. Los diferentes mecanismos de acción para inducir relajación vascular, tanto en arterias sanas, como en arterias enfermas, podrían indicar un efecto “vasculoprotector” de la CAF.
Los autores quieren expresar su agradecimiento de manera amplia a las Dras. Ingrid Mejía y María del Pilar González por el cuidado diario de los animales. Asimismo, a la Facultad de Veterinaria de la Universidad de La Salle, por su ayuda en el mantenimiento de los animales.