Introducción
La resistencia a la insulina precede y predice la aparición de diabetes mellitus tipo 2 (DM2), y se asocia a obesidad, hipertensión y enfermedad cardiovascular1. El músculo esquelético es el tejido más importante en la captación de glucosa estimulada por insulina y, en consecuencia, es el tejido más importante afectado por la resistencia a la insulina. El desarrollo de esta resistencia a la insulina en el músculo esquelético disminuye la utilización de glucosa y la sensibilidad a la insulina, lo que se ha relacionado con la presencia de valores plasmáticos elevados de ácidos grasos libres (AGL). Existen diferentes evidencias que sugieren que el aumento de los valores de AGL es causante de la resistencia a la insulina presente en los pacientes con DM2. Por ejemplo, diversos estudios han demostrado de forma consistente que valores elevados de AGL plasmáticos producen resistencia a la insulina tanto en personas diabéticas como no diabéticas2-5. Además, el aumento de los AGL provoca la activación, a través del diacilglicerol, de la proteincinasa C (PKC)6,7, una enzima que se ha asociado a la resistencia a la insulina en una amplia variedad de modelos8-10, incluidos ratas perfundidas con soluciones lipídicas11 y humanos con obesidad mórbida12,13. Asimismo, uno de estos AGL, el palmitato, una vez activado a palmitoil-CoA por la acil-CoA sintasa, es el precursor de la síntesis de novo de ceramidas, que pueden atenuar las vías de señalización de la insulina provocando resistencia a la insulina14. A pesar de estos datos, los mecanismos causantes de la aparición de resistencia a la insulina mediada por ácidos grasos no son bien conocidos.
Existen numerosas evidencias que sugieren la existencia de una relación entre inflamación y DM2. Diversos marcadores inflamatorios, entre los que se incluyen citocinas proinflamatorias (tales como el factor de necrosis tumoral * [TNF-*], interleucina [IL] 1, interferón-* y IL-6), aparecen elevados en la DM215,16. De estas citocinas, la IL-6 es la que presenta una mayor correlación con la resistencia a la insulina y la DM215-17 y sus valores plasmáticos son de 2 a 3 veces mayores en pacientes con obesidad y DM2 comparados con los de sujetos no obesos16. Hasta hace poco tiempo se creía que la principal fuente de producción de la IL-6 eran los macrófagos y las células mononucleares periféricas. Sin embargo, datos recientes han demostrado que las células musculares esqueléticas y los adipocitos son importantes focos de producción de IL-6. Esta citocina se expresa en el músculo esquelético humano en estado de reposo y la contracción aumenta rápidamente su expresión génica18,19. Además, estudios recientes han demostrado que la insulina aumenta la expresión de la IL-6 en el músculo esquelético resistente a esta hormona, pero no en el sensible, lo que sugiere que la expresión de esta citocina depende de cambios asociados a la resistencia a la insulina20. En cuanto a las posibles vías moleculares causantes de la inducción de la expresión del gen de la IL-6 en el músculo esquelético, se ha demostrado que tanto las especies reactivas al oxígeno21 como el lipopolisacárido22 incrementan la expresión de la IL-6 en el músculo esquelético, probablemente a través de un mecanismo que implica la activación del factor nuclear (NF)-*B. También existen evidencias que sugieren que un aumento en la transcripción de la IL-6 se produce por activación de la proteincinasa activada por mitógenos (MAPK)23.
El objetivo de este estudio ha sido estudiar los mecanismos causantes de la aparición de la resistencia a la insulina inducida por AGL. Utilizando células musculares esqueléticas C2C12 de ratón, examinamos los efectos del AGL saturado palmitato sobre la expresión del gen y la secreción de proteína de la IL-6. La preincubación de las células con palmitato causó un incremento de la expresión del gen de la IL-6 y de su secreción mediante mecanismos que implicaban la activación de NF-*B y de la PKC. Además, mediante un anticuerpo que neutraliza la actividad biológica de la IL-6 de ratón, se demostró que la IL-6 era causante de la reducción de los valores del transportador de glucosa 4 (GLUT4) en células musculares esqueléticas incubadas con palmitato. Estos resultados sugieren que la secreción de la IL-6 está implicada en la resistencia a la insulina inducida por ácidos grasos en el músculo esquelético.
Material y método
Materiales
El anticuerpo contra IL-6, la C2-ceramida, el ISP1 y la pirrolidina ditiocarbamato (PDTC) fueron obtenidos de Sigma (St. Louis, MO). El PD98059 y la calfostina C fueron obtenidos de Biomol Researh Labs Inc. (Plymouth Meeting, PA). Las otras sustancias químicas utilizadas procedían de Sigma.
Cultivos celulares
Los mioblastos C2C12 de ratón (ATCC) fueron mantenidos en DMEM (Invitrogen) suplementado con un 10% de suero fetal bovino (FBS), 50 unidades/ml de penicilina y 50 µg/ml de estreptomicina. Cuando las células alcanzaron la confluencia, se cambió el medio de cultivo a medio de diferenciación que contenía DMEM y 2% de suero de caballo, que se renovaba cada día. Después de 4 días, las células C2C12 diferenciadas se fusionaban a miotubos. El medio que contenía los ácidos grasos se preparó por conjugación de éstos con albúmina sérica bovina (BSA) libre de ácidos grasos, según el método modificado de Chavez et al24. De forma breve, los AGL se disolvieron en etanol y fueron diluidos en DMEM que contenía un 2% (p/v) de BSA libre de ácidos grasos. Los miotubos fueron incubados durante 16 h en DMEM y 2% de BSA libre de ácidos grasos tanto en presencia como en ausencia de AGL. Después de la incubación, se procedió a la extracción del ARN de los miotubos tal como se describe más adelante.
Determinación de la IL-6
Los valores de ARNm de la IL-6 fueron valorados por la reacción de la transcriptasa inversa asociada a la reacción en cadena de la polimerasa (RT-PCR)25 tal como se describió previamente26. El ARN total se aisló mediante el reactivo Ultraspec® (Biotecx, Houston). El ARN total aislado por este método no estaba degradado y se encontraba libre de proteínas y de contaminación de ADN. Las secuencias de los oligonucleótidos utilizados para la amplificación fueron: IL-6, 5'- TCCAGCCAGTTGCCTTCTTGG-3' y 5'-TCTGACAGTGCATCATCGCTG-3'; GLUT4, 5'-GATGCCGTCGGGTTTCCAGCA-3' y 5'-TGAGGGTGCCTTGTGGGA TGG-3'; y APRT (adenosil fosforribosil transferasa), 5'-GCCTCTTGGCCAGTC ACC TGA-3' y 5'-CCAGGCTCACACACTCCACCA-3'. La amplificación de cada gen proporcionó una única banda del tamaño esperado (IL-6: 229 pb, GLUT4: 232 pb y APRT: 329 pb). Se realizaron experimentos preliminares con diferentes cantidades de ADNc para determinar las condiciones no saturantes de la amplificación de PCR para todos los genes estudiados. Por tanto, en estas condiciones, el método de RT-PCR empleado en este estudio permitió una cuantificación relativa de los valores de ARNm27. Las bandas radiactivas fueron cuantificadas por densitometría (Vilbert Lourmat Imaging). Los resultados de la expresión de los valores de ARNm se presentan siempre en relación con el gen control (aprt).
Los sobrenadantes del medio de cultivo se utilizaron para determinar la secreción de IL-6 por ELISA (Amersham Biosciences). Todas las determinaciones se realizaron por triplicado.
Obtención de extractos nucleares
Los extractos nucleares se aislaron según Andrews et al28. Las células se recogieron en 1,5 ml de tampón fosfato salino (PBS) frío, se centrifugaron durante 10 s y se resuspendieron en 400 µl de tampón A frío (Hepes-KOH 10 mM pH 7,9 a 4 °C, MgCl2 1,5 mM, KCl 10 mM, DTT 0,5 mM, PMSF 0,2 mM, aprotinina 5 µg/ml y leupeptina 2 µg/ml). La lisis celular se consiguió manteniendo las células en hielo durante 10 min. A continuación, las muestras se centrifugaron durante 10 s y la fracción del sobrenadante se descartó. Tras resuspender en 50 µl de tampón C (Hepes-KOH 20 mM pH 7,9 a 4 °C, glicerol 25%, NaCl 420 mM, MgCl2 1,5 mM, EDTA 0,2 mM, DTT 0,5 mM, PMSF 0,2 mM, aprotinina 5 µg/ml y leupeptina 2 µg/ml) se incubó en hielo durante 20 min. Los restos celulares se eliminaron por centrifugación durante 2 min a 4 °C y la fracción del sobrenadante (que contenía las proteínas de unión al ADN) se guardó a 80 °C. La concentración de los extractos nucleares se determinó utilizando el método de Bradford.
Ensayo de retardación de la movilidad electroforética (EMSA)
Los estudios de EMSA se realizaron utilizando oligonucleótidos de doble cadena para NF-*B (Promega, Madison, WI): 5'-AGTTGAGGGGACTTTCCCAGGC-3'; y Oct-1 (Santa Cruz Biotechnologies): 5'-TGTCGAATGCAAATCACTAGAA-3'. Los oligonucleótidos se marcaron siguiendo la reacción: 2 µl de oligonucleótido (1,75 pmol/l), 2 µl de 5X tampón quinasa, 1 µl T4 polinucleótido cinasa (10 U/l), y 2,5 µl de [*-32P] ATP (3.000 Ci/mmol) a 10 mCi/ml incubados a 37 °C durante 2 h. La reacción se paró añadiendo 90 µl de tampón TE (Tris-HCl 10 mM pH 7,5 y EDTA 1 mM). Para separar la sonda marcada del ATP no unido, la mezcla de la reacción se eluyó a través de una columna Nick (Pharmacia, Sant Cugat, España) según las instrucciones del fabricante; 5 µg de extracto nuclear se incubaron durante 10 min en hielo con tampón de unión (Tris-HCl 10 mM pH 8,0, KCl 25 mM, DTT 0,5 mM, EDTA 0,1 mM pH 8,0, glicerol 5%, BSA 5 mg/ml, tARN 100 µg/ml y poly [dI-dC]), 50 µg/ml, en un volumen final de 15 µl. La sonda marcada (aproximadamente 60.000 cpm) se añadió a la reacción y se incubó durante 15 min a 4 °C para NF-*B y a temperatura ambiente para Oct-1. El competidor específico de cada oligonucleótido se añadió antes de la sonda marcada y se incubó durante 10 min, mientras que el anticuerpo contra p65 se incubó al mismo tiempo durante 15 min a 4 °C. Los complejos ADN-proteína se separaron por electroforesis a 4 °C en un gel de poliacrilamida al 5% y fueron sometidos a autorradiografía.
Inmunodetección
Para obtener las proteínas totales de los miotubos C2C12, éstos se homogeneizaron en tampón de lisis a 4 °C (Tris-HCl 5 mM pH 7,4, EDTA 1 mM, PMSF 0,1 mM, ortovanadato sódico 1mM, aprotinina 5,4 µg/ml). El homogenado se centrifugó a 10.000 * g durante 30 min a 4 °C. Para obtener las membranas totales, las células C2C12 fueron recogidas en 10 ml de tampón HES a 4 °C (sacarosa 250 mmol/l, EDTA 1 mmol/l, PMSF 1 mmol/l, pepstatina 1 µmol/l, aprotinina 1 µmol/l, leupeptina 1 µmol/l y Hepes 20 mM pH 7,4) y posteriormente homogeneizadas a 4 °C. Después de centrifugar a 1.000 * g durante 3 min a 4 °C para eliminar los restos celulares y las células no lisadas, se centrifugó el sobrenadante a 245.000 * g durante 90 min a 4 °C para precipitar las membranas celulares totales. La concentración de proteína se determinó mediante el método de Bradford. Las proteínas (30 µg) se separaron por SDS-PAGE en un gel de separación al 10% y se transfirieron a membranas de difluoruro polivinilideno Immobilon (Millipore, Bedford, MA). El análisis de inmunodetección se realizó utilizando anticuerpos contra I*B* y I*Bß (Santa Cruz Biotechnology, Inc.). La detección se consiguió utilizando el kit de quimioluminiscencia EZ-ECL (Biological Industries, Beit Haemek Ltd, Israel). El tamaño de las proteínas se estableció utilizando estándares de masa molecular (Invitrogen, Barcelona, España).
Análisis estadístico
Los resultados se expresan como la media ± DE de 3 experimentos realizados por separado. Las diferencias entre los grupos se determinaron por ANOVA de una vía y una prueba posterior (Tuckey) mediante el programa GraphPad Instad (GraphPad Software V2.03) (GraphPad Software Inc., San Diego, CA). Las diferencias se consideraron estadísticamente significativas a partir de p < 0,05.
Resultados
El palmitato, pero no el oleato, induce la expresión y la secreción de la IL-6 en células musculares esqueléticas
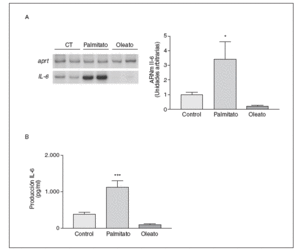
Para estudiar los efectos de los AGL sobre la producción de la IL-6 en las células musculares esqueléticas C2C12, seleccionamos el ácido graso saturado palmitato (16:0) y el monoinsaturado oleato (18:1 n-9), ya que se encuentran entre los ácidos grasos más comunes en el músculo esquelético29. Concentraciones de hasta 2 mM de AGL están dentro de los márgenes presentes en la especie humana. Las células C2C12 fueron tratadas con oleato 0,5 mM o palmitato 0,5 mM durante 16 h. Cuando analizamos los efectos de estos AGL sobre la expresión de la IL-6, observamos una inducción de 3,5 veces (p < 0,05) de los valores de ARNm de la IL-6 después del tratamiento con palmitato, mientras que el oleato disminuyó la expresión de esta citocina, aunque las diferencias no llegaron a ser significativas (fig. 1A). De forma similar, la incubación de los miotubos C2C12 con palmitato causó una inducción de 3 veces en los valores de proteína IL-6 secretada al medio de cultivo (control 375 ± 57 frente a palmitato 1.129 ± 177 pg/ml; p < 0,001) (fig. 1B), mientras que el oleato disminuyó su secreción (control 375 ± 57 frente a oleato 196 ± 25 pg/ml) (fig. 1B).
Figura 1. El palmitato, pero no el oleato, induce la expresión y la secreción de la interleucina (IL) 6 en las células musculares esqueléticas. Los miotubos C2C12 fueron incubados en presencia o en ausencia de los ácidos grasos libres (AGL) indicados (16 h, 0,5 mM). A) Análisis de los niveles de ARNm de la IL-6. 0,5 µg de ARN total fueron analizados mediante RT-PCR. Se muestra una autorradiografía representativa y la cuantificación normalizada respecto de los valore de ARNm de la APRT. B) Determinación por ELISA de la secreción de la IL-6 al medio de cultivo.
Las ceramidas no están implicadas en la inducción de la expresión y secreción de la IL-6 por palmitato en células musculares esqueléticas
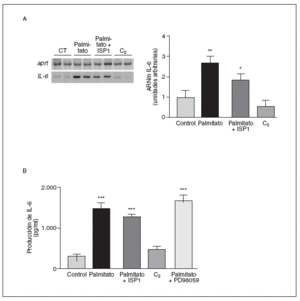
Puesto que el palmitoil-CoA es un precursor de la síntesis de esfingolípidos, el tratamiento con palmitato puede producir un incremento de la síntesis de ceramidas y de la apoptosis30. Por ello, para profundizar en el mecanismo causante del incremento de los niveles de ARNm y la secreción de IL-6 tras tratamiento con palmitato, determinamos los efectos de un inhibidor de la síntesis de novo de ceramidas. El paso inicial de esta síntesis es la formación de 3-cetodihidroesfingosina a partir de palmitoil-CoA y L-serina. Este paso inicial es inhibido por el análogo de la esfingosina ISP1 a concentraciones picomolares31. El tratamiento con ISP1 no modificó ni los valores de ARNm (fig. 2A) ni la secreción (fig. 2B) de la IL-6 alcanzados por el palmitato (fig. 2A). Además, el tratamiento de las células musculares esqueléticas C2C12 con C2-ceramida (50 µM), un análogo de ceramida permeable a la célula, no modificó ni los valores de ARNm (fig. 2A) ni la secreción de la IL-6 (fig. 2B). Estos datos sugieren que la síntesis de novo de ceramidas no está implicada en los efectos del palmitato en la producción de la IL-6. Por otra parte, puesto que la activación de la MAPK se ha asociado a un incremento en la expresión de la IL-6, estudiamos los efectos del PD98059, un conocido inhibidor de la vía de señalización ERK(extracellular signal-regulated kinase)-MAPK, sobre la secreción de la IL-6. En presencia de PD98059 100 µM, no se observaron cambios en la secreción al medio de cultivo de esta citocina.
Figura 2. Las ceramidas no están implicadas en la inducción por palmitato de la expresión y la secreción de la interleucina (IL-6) en células musculares esqueléticas. Los miotubos C2C12 fueron incubados (16 h) con palmitato 0,5 mM en presencia o en ausencia de ISP1 100 nM, un inhibidor de la síntesis de novo de ceramidas, o con PD98059 100 µM. Las células también se trataron con la C2-ceramida, un análogo de ceramida permeable a la célula. A) Análisis de los valores de ARNm de la IL-6. Fueron analizados 0,5 µg de ARN total mediante RT-PCR. Se muestra una autorradiografía representativa y la cuantificación normalizada respecto de los valores de ARNm de la APRT. B) Determinación por ELISA de la secreción de la IL-6 al medio de cultivo.
La expresión y la secreción de la IL-6 inducida por palmitato es mediada a través de la activación de NF-*B
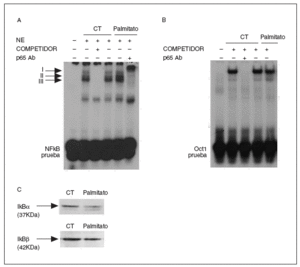
Estudios recientes han demostrado que la activación del factor de transcripción redox NF-*B desempeña un papel importante en la producción de la IL-6 en miocitos21. Para verificar si la incubación de células C2C12 con palmitato incrementaba la actividad NF-*B, se realizaron estudios de EMSA. La sonda NF-*B utilizada formó 3 complejos con las proteínas nucleares (complejos I-III) (fig. 3A). La especificidad de estos 3 complejos de unión al ADN fue verificada mediante experimentos de competición añadiendo un exceso de oligonucleótido NF-*B no marcado. La actividad de unión de NF-*B, principalmente del complejo específico II, aumentó en los extractos nucleares de las células tratadas con palmitato. La adición de un anticuerpo contra la subunidad p65 de NF-*B retardó completamente el complejo II, indicando que esta banda estaba constituida, principalmente, por esa subunidad. No se observaron cambios en la unión del ADN a las proteínas nucleares de las células control y las tratadas con palmitato a una sonda Oct-1, lo que indicaba que el incremento observado para la sonda de NF-*B era específico (fig. 3B).
Figura 3. El tratamiento con palmitato induce la activación de factor nuclear (NF)-*B en miotubos C2C12. Los miotubos C2C12 fueron incubados en presencia o en ausencia de palmitato 0,5 mM durante 16 h. A) Autorradiografía del ensayo de retardación de la movilidad electroforética (EMSA) realizado con el nucleótido NF-*B marcado con 32P y extractos de proteína nucleares (EN). Se muestran tres complejos específicos (I a III), basados en la competición con un exceso molar de sonda no marcada. También se muestra un análisis de retardación, que se realizó incubando los EN con un anticuerpo contra la subunidad p65 de NF-*B. B) Autorradiografía del EMSA realizada con el nucleótido Oct-1 marcado con 32P. C) Se analizaron extractos de proteína de miotubos C2C12 con anticuerpos contra I*B* y I*Bß mediante la técnica de inmunodetección.
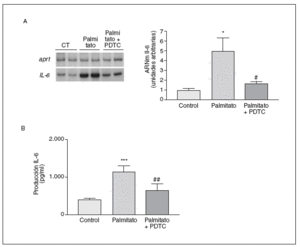
El NF-*B se localiza en el citosol unido al inhibidor *B (I*B), pero la presencia de señales inflamatorias causan fosforilación y ubiquitinación de I*B*, liberando y activando NF-*B. Por esta razón estudiamos si el palmitato afectaba al contenido de I*B* (fig. 3C). La adición de palmitato a las células causó una disminución del 50%, aproximadamente, en los valores de I*B*, mientras que I*Bß no resultó modificada. Para evaluar si la activación de NF-*B estaba implicada en la inducción de la IL-6 por el palmitato, utilizamos la PDTC, un inhibidor de NF-*B32. La inducción de 5 veces en la expresión de los valores de ARNm de la IL-6 alcanzada por el palmitato se evitó en presencia de PDTC (inducción de 1,7 veces; p < 0,05 frente a control) (fig. 4A). Igualmente, la secreción de la IL-6 al medio de cultivo causada por palmitato disminuyó tras la coincubación de las células con PDTC (inducción de 1,7 veces; p < 0,01 frente a control) (fig. 4B). Estos resultados sugerían que la expresión y la secreción de la IL-6 eran reguladas por la activación de NF-*B.
Figura 4. La inducción de la expresión de la interleucina (IL) 6 por palmitato es mediada a través de la activación del factor nuclear (NF) *B. Los miotubos C2C12 fueron incubados (16 h) con palmitato 0,5 mM en presencia o en ausencia de PDTC 5 mM. A) Análisis de los valores de ARNm de la IL-6. Fueron analizados 0,5 µg de ARN total mediante RT-PCR. Se muestra una autorradiografía representativa y la cuantificación normalizada respecto de los niveles de ARNm de la APRT. B) Determinación por ELISA de la secreción de la IL-6 al medio de cultivo.
La expresión y la secreción de la IL-6 inducida por palmitato son mediadas por la activación de PKC
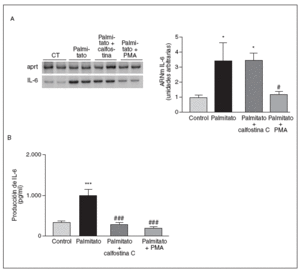
Puesto que los valores elevados de AGL en plasma provocan la activación de la PKC6, enzima capaz de activar NF-*B33, determinamos si la inducción de la IL-6 producida por el palmitato implicaba la activación de esta enzima. Para confirmar esta posibilidad utilizamos dos estrategias. Primero, verificamos el efecto de la calfostina C, un potente inhibidor de la PKC34, sobre la expresión y secreción de la IL-6 en miotubos C2C12. Las células se preincubaron con calfostina C (100 µM) durante 30 min y posteriormente se estimularon con palmitato 0,5 mM durante 16 h. Además, se pretrataron las células con PMA 0,5 µM durante 24 h antes de la estimulación con palmitato. Este largo tratamiento con PMA produce una desensibilización de la PKC y, por tanto, una reducción de su actividad35,36. Como se muestra en la figura 5, la calfostina C no afectó a los valores de ARNm de la IL-6 alcanzados por el palmitato, mientras que sí suprimió la secreción de la IL-6 al medio de cultivo. El pretratamiento de las células C2C12 con PMA abolió tanto la expresión como la secreción de la IL-6. Estos datos indicaban que la activación de PKC estaba implicada en la secreción de la IL-6 inducida por el palmitato.
Figura 5. La inducción de la expresión de la interleucina (IL) 6 por palmitato es mediada a través de la activación de proteincinasa C (PKC). Los miotubos C2C12 fueron incubados (16 h) con palmitato 0,5 mM en presencia o en ausencia de calfostina C 100 µM o PMA 500 nM. A) Análisis de los niveles de ARNm de la IL-6. Fueron analizados 0,5 µg de ARN total mediante RT-PCR. Se muestra una autorradiografía representativa y la cuantificación normalizada respecto de los niveles de ARNm de la APRT. B) Determinación por ELISA de la secreción de la IL-6 al medio de cultivo.
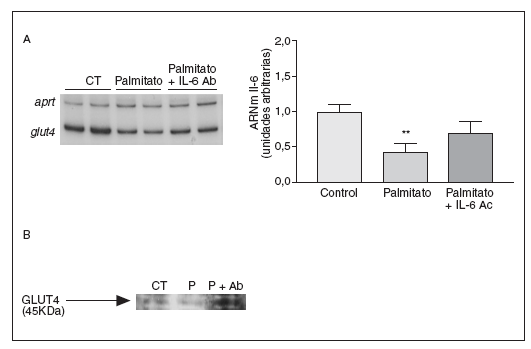
La secreción de la IL-6 es causante de la reducción de los valores de GLUT4 inducida por palmitato
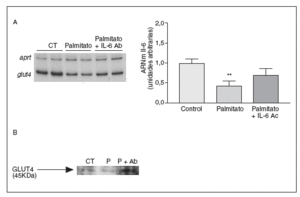
Finalmente, examinamos si algunos efectos metabólicos causados por los niveles elevados de AGL en células musculares esqueléticas eran mediados por la secreción de la IL-6. Para verificar la contribución de la IL-6 a los efectos causados por los AGL elevados, utilizamos un anticuerpo contra la IL-6. Estudios previos habían demostrado que la IL-6 inducía resistencia a la insulina en adipocitos 3T3-L1, causando una reducción en la expresión de GLUT437. En las células C2C12 el tratamiento con palmitato causó una disminución del 57% en los valores de ARNm de GLUT4 (p < 0,001), pero la coincubación con el anticuerpo contra la IL-6 evitó esta reducción (fig. 6). Asimismo, el palmitato causó una caída en los valores de expresión de la proteína GLUT4, pero la presencia del anticuerpo contra la IL-6 evitó la reducción de los valores de este transportador de glucosa. Estos datos demuestran que la disminución de GLUT4 inducida por palmitato en células musculares esqueléticas es mediada por la IL-6.
Figura 6. La secreción de la interleucina (IL) 6 inducida por palmitato es causante de la disminución de la expresión de GLUT4. Los miotubos C2C12 fueron incubados (16 horas) con palmitato 0,75 mM en presencia o en ausencia de 5 µg/ml de anticuerpo contra la IL-6. A) Análisis de los valores de ARNm de la IL-6. Fueron analizados 0,5 µg de ARN total mediante RT-PCR. Se muestra una autorradiografía representativa y la cuantificación normalizada respecto de los valores de ARNm de la APRT. **p < 0,01 frente a control. B) Extractos de proteína de membrana total de miotubos C2C12 incubados con palmitato en presencia o en ausencia de 5 µg/ml de anticuerpo contra la IL-6 se analizaron con el anticuerpo contra GLUT4 a través de la técnica de inmunodetección.
Discusión
La resistencia a la insulina en el músculo esquelético es la característica principal de la DM21. Los mecanismos causantes de la reducción de la sensibilidad del músculo a la insulina no están totalmente establecidos, pero se conoce la existencia de una fuerte correlación entre la resistencia a la insulina y el aumento de los AGL en plasma. Además, diversas evidencias sugieren una relación entre la inflamación y la DM2. La citocina proinflamatoria IL-6 presenta una estrecha correlación con la presencia de resistencia a la insulina y la DM216,17. Estudios recientes han sugerido que la IL-6 altera la sensibilidad a la insulina y la regulación de la glucosa en adipocitos38,39 y hepatocitos40-42. En este estudio hemos utilizado la línea celular de mioblastos C2C12, que desarrolla propiedades bioquímicas y morfológicas características del músculo esquelético y ha demostrado su utilidad para realizar estudios sobre el metabolismo en el músculo esquelético43. La exposición de estas células a palmitato causó un incremento en la expresión y la secreción de la IL-6. Los resultados presentados muestran que la secreción de la IL-6 puede ser causante de parte de los efectos del ácido graso saturado palmitato sobre la resistencia a la insulina en células musculares esqueléticas. Además, los resultados obtenidos indican que la activación de la PKC y de NF-*B está implicada en la producción de la IL-6 inducida por palmitato. Cabe destacar que, a diferencia del palmitato, el oleato no aumentó la expresión ni la secreción de la IL-6. Estos resultados sugieren que los efectos del palmitato en la IL-6 son específicos de este ácido graso saturado.
El aumento de los AGL probablemente incrementa su recaptación, excediendo la capacidad de oxidación del músculo, hecho que puede provocar un incremento de los triglicéridos intramusculares y del diacilglicerol, un potente activador alostérico, tanto de las isoformas nuevas como de las convencionales, de la PKC. La activación de la PKC puede producir resistencia a la insulina por diferentes mecanismos. Esta enzima puede fosforilar el receptor de la insulina13,44 y el sustrato del receptor de la insulina-137, dando lugar a una alteración de la señal de la insulina; o puede aumentar el estrés oxidativo y activar el NF-*B. Los resultados presentados en este trabajo muestran que un tratamiento largo con PMA, que produce una disminución de la expresión de la PKC35,36, anuló completamente tanto la expresión como la secreción de la IL-6 inducida por palmitato. El pretratamiento con calfostina C, un inhibidor potente y específico de PKC34, también evitó la secreción de la IL-6 al medio de cultivo inducida por palmitato. Estudios previos han demostrado la supresión de la expresión de la IL-6 por calfostina C en células osteoblásticas después de 3 h36, sugiriendo que, en nuestro estudio, la falta de efecto inhibitorio de la calfostina C en las células C2C12 después de 16 h de tratamiento podría atribuirse a una recuperación de la actividad PKC que provocaría un aumento de la expresión de ARNm de la IL-6, pero no de la proteína, ya que la secreción de esta citocina continuaba aún bloqueada.
Como ya se ha comentado, la activación de la PKC puede incrementar el estrés oxidativo y la activación de NF-*B. Itani et al45 publicaron que la infusión de lípidos en humanos aumentaba la actividad de la PKC y producía una disminución de la masa del inhibidor de NF-*B, I*B*. La activación de la PKC puede conducir a una activación de este factor de transcripción directamente por fosforilación de la I*B*46 o causando la generación de especies reactivas al oxígeno, que secundariamente pueden activar la I*B-cinasa (IKK-ß). De hecho, la fosforilación de la IKK-ß se considera la principal vía por la cual la I*B* se libera de NF-*B y posteriormente sufre ubiquitinación y degradación proteasómica. El resultado es una disminución de la masa de I*B* y una translocación de NF-*B desde el citosol al núcleo. En este estudio, el palmitato incrementó la activación de NF-*B, tal como demostraron los estudios de EMSA. La activación de este factor de transcripción proinflamatorio parece estar mediado por la degradación de I*B*. El promotor de IL-6 de ratón contiene una secuencia consenso para el factor de transcripción redox NF-*B, respaldando el papel de NF-*B en la inducción de la IL-6 provocada por el palmitato. Este papel fue confirmado por el pretratamiento de las células con PDTC, un potente antioxidante e inhibidor de NF-*B, que evitaba la inducción de los niveles de ARNm y la secreción de IL-6 al medio de cultivo mediada por palmitato.
Los datos que se aportan en este estudio también descartan la implicación de diferentes procesos en la producción de la IL-6 inducida por palmitato en células musculares esqueléticas. Las ceramidas, metabolitos lipídicos derivados del palmitato, parecen no estar implicadas en la inducción de la IL-6 en las células musculares esqueléticas. Además, a pesar de que existen evidencias que indican que la activación de la cascada de señalización de las MAPK incrementa la transcripción de la IL-620,23, la coincubación de las células expuestas a palmitato con PD98059, un potente inhibidor de la vía ERK-MAPK, no afectó a la secreción de la IL-6, lo que hace poco probable la participación de esta cascada de señalización en los cambios de la IL-6 mediados por el palmitato.
Finalmente, evaluamos los efectos metabólicos causados por la secreción de la IL-6 inducida por palmitato. Para distinguir claramente entre los efectos producidos por el palmitato o por la IL-6 utilizamos un anticuerpo contra esta citocina. Un estudio previo realizado en adipocitos mostró una reducción en la expresión de GLUT4 tras un tratamiento con la IL-639. En las células musculares esqueléticas utilizadas en este estudio, la adición de palmitato al medio de cultivo provocó una reducción en la expresión de GLUT4 que se evitaba en presencia de un anticuerpo contra la IL-6, implicando claramente a esta citocina en este efecto del palmitato. Los resultados presentados en este estudio no permiten establecer cuál es el mecanismo dependiente de la IL-6 causante de la reducción de la expresión de GLUT4. Puesto que el palmitato altera la fosforilación de la Akt24, se podría especular que la IL-6 podría mediar cambios en la fosforilación de esta cinasa, que promueve la translocación del transportador de glucosa GLUT4 a la membrana plasmática. No obstante, la reducción en los valores de ARNm de GLUT4 alcanzados después del tratamiento con palmitato también sugieren que la IL-6 puede producir cambios transcripcionales de este transportador de glucosa.
En resumen, en este estudio mostramos que el tratamiento de células musculares esqueléticas con palmitato induce la expresión y la secreción de la IL-6 a través de mecanismos que parecen implicar la activación de la vía PKC-NF-*B. Además, la producción de la IL-6 parece ser causante de la reducción de la expresión de GLUT4 en las células del músculo esquelético expuesto a palmitato. Estos resultados confirman recientes estudios que muestran que la IL-6 está implicada en la resistencia a la insulina convirtiendo a esta citocina, y a los mecanismos causantes de esta inducción, en una diana para el tratamiento de la resistencia a la insulina inducida por lípidos.