La apolipoproteína (apo) A-V es clave en la regulación de los valores plasmáticos de los triglicéridos (TG) y se expresa en el hígado, donde se postula que dificulta el proceso de síntesis y/o ensamblaje de las lipoproteínas de muy baja densidad. Por esto, si participa en el proceso de formación de las lipoproteínas ricas en TG, también debería expresarse en el intestino delgado, porque en humanos es, junto al hígado, el otro órgano encargado de la biosíntesis de estas partículas.
Material y métodosHemos analizado la expresión génica mediante rectro-transcripción de la reacción en cadena de la polimerasa (RT-PCR) a tiempo real de apo A5, apo B y MTP (genes clave en el proceso de síntesis y secreción de partículas ricas en TG, tanto en el hígado como en el intestino), y de apo C3 (otro gen importante en el metabolismo de los TG) en un modelo celular de intestino humano (células TC-7) y en muestras de hígado e intestino humanos.
ResultadosLa apo A5 se expresa en los ámbitos génico y proteico en el modelo de células intestinales, y al confirmar el resultado en las muestras de intestino humano hemos visto que se expresa principalmente en el duodeno y en el colon, y, por el contrario, la apo B se expresa principalmente en el duodeno, el yeyuno y el ileoceco; la proteína MTP principalmente en el duodeno y en el yeyuno, y la apo C3, en el yeyuno. Al analizar su relación con la expresión hepática, hemos visto que todos estos genes se expresan más en el hígado que en el intestino.
ConclusionesLa apo A5 se expresa a valores bajos en el intestino delgado humano y está correlacionado inversamente con la expresión de los genes clave en el proceso de síntesis de lipoproteínas.
Apolipoprotein A-V is a key gene regulating plasmatic levels of TG, that is expressed in the liver where it has been postulated that affects the synthesis and/or assembly process of VLDL particles. Therefore, we hypothesise that if it is involved in TG rich lipoproteins’ formation it should also be expressed in the small intestine, since in humans, together with the liver, is the other organ responsible on the biosynthesis of such particles.
Material and methodsWe have analysed the gene expression, using real time RT-PCR, of apo A5, apo B and MTP (key genes in the synthesis and secretion of TG rich lipoproteins in the liver and intestine), and apo C3 (another key gene regulating TG metabolism) in a cellular model of human intestine cells (TC-7) and in human liver and intestine samples.
ResultsWe have detected apo A5 gene expression and protein expression in the intestinal cellular model, and when confirming this result in human intestine samples we have found that is mainly expressed in duodenum and colon, and on the contrary, apo B is expressed mainly in duodenum, jejunum and ileocecum, MTP mainly in duodenum and jejunum, and apo C3 in jejunum. When analysing its relation with their hepatic expression levels, we have found that all these genes are more expressed in the liver than in the intestine.
ConclusionsApo A5 is expressed at low levels in human small intestine and is inversely correlated with the expression of the key genes in the lipoproteins’ synthesis and secretion process.
La síntesis y la secreción de lipoproteínas ricas en triglicéridos (TG) es un proceso compleJo que tiene lugar principalmente en el intestino delgado y en el hígado, y por ello, son órganos cruciales en el control de la homeostasis de los lípidos. En ambos teJidos, la proteína microsomal transferidora de triglicéridos (MTP) y la apolipoproteína (apo) B son proteínas esenciales en el proceso de ensamblaje y secreción de las lipoproteínas1. El hígado expresa sólo apo B100, mientras que el intestino puede sintetizar apo B100 y apo B482. El proceso de síntesis de lipoproteínas se inicia con la traducción de la apo B, que es lipidada por la MTP y que resulta en una partícula lipoproteica. Además, ambos órganos son diana para los principales fármacos hipolipemiantes: inhibidores de la enzima 3-hidroxi-3-metil glutaril coenzima A (HMGCoA) reductasa (hígado) e inhibidores de la absorción de colesterol (intestino)3.
Los lípidos y las vitaminas liposolubles de la dieta los absorbe el intestino delgado, donde se incorporan en las lipoproteínas para su transporte en circulación y posterior distribución a los tejidos. Las células intestinales sintetizan y secretan varios tipos de lipoproteínas que pueden clasificarse como quilomicrones (Q), lipoproteínas de muy baja densidad (VLDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL)4, aunque principalmente secretan Q.
El hígado es el principal lugar de movilización de lípidos endógenos. Secreta VLDL que contienen lípidos provenientes de las partículas remanentes que el hígado capta, o lípidos que se sintetizan de novo.
No obstante, aún no están totalmente claros los mecanismos que regulan el ensamblaje y la secreción de lipoproteínas en hígado e intestino. En los últimos años, ha emergido un nuevo gen como candidato a participar en este proceso. El gen apo A5 se descubrió cuando se compararon las secuencias de ADN genómico entre humanos y ratones5, y también en relación con el estudio de genes implicados en el proceso de regeneración hepática en ratas6. Ambos trabajos describieron que la apo A5 se expresa exclusivamente en el hígado. Los resultados tanto en modelos animales como en estudios de asociación, indican que la apo A5 tiene una gran influencia en las concentraciones circulantes de TG6–12. También se ha propuesto que regula la síntesis y/o la secreción de lipoproteínas requeridas durante el proceso de regeneración hepática6.
Aún no se conoce bien el mecanismo por el que la apo A5 ejerce esta influencia. Datos in vitro indican que puede participar en la síntesis y/o secreción de partículas VLDL en el hígado13, y también que puede estimular la actividad de la lipoproteína lipasa (LPL)14–16, e indirectamente facilitar el aclaramiento de las lipoproteínas ricas en TG del compartimiento plasmático17–19. En circulación, apo AV se encuentra en las lipoproteínas ricas en TG y en las partículas HDL a concentraciones muy bajas20, y mientras en modelos animales la expresión de la apo A5 se correlaciona inversamente con las concentraciones de TG, la mayoría de estudios en humanos muestran que las concentraciones circulantes de apo A-V se correlacionan positivamente con las concentraciones de TG20–23.
Últimamente se debate si puede desempeñar un papel importante en circulación, teniendo en cuenta las concentraciones bajas. En vista de los resultados existentes, nuestra hipótesis es que la apo A-V desempeña un papel en la síntesis de las lipoproteínas. Si ello es así, puede estar presente no sólo en el hígado, sino también en el intestino. Para demostrarlo, hemos analizado la expresión de la apo A5 en muestras de intestino delgado humano, y la de otros genes clave en el proceso de síntesis y ensamblaje de lipoproteínas ricas en TG (apo B y MTP) y otro gen clave en la regulación de los valores circulantes de TG (apo C3).
Material y métodosMuestrasCultivo de células TC-7. Las células TC-7 de carcinoma de colon humano (subclones de las células Caco-2) se obtuvieron de Celltec (Barcelona). Las células se cultivaron en frascos de plástico de 75 cm2, a una densidad de 1,25 × 104 células/cm2 en medio de Eagle modificado por Dulbecco, suplementado con 20% (v/v) de suero bovino fetal inactivado por calor, 100 U/ml de penicilina y 100 μg/ml de estreptomicina (Invitrogen [Carlsbad, Estados Unidos]), a 37 °C en una atmósfera húmeda de dióxido de carbono al 5%. Después de llegar a un 80% de confluencia (4–5 días después de sembrarlas), las células fueron tripsinizadas. Los experimentos de expresión de ácido ribonucleico (ARN) mensajero (ARNm) se llevaron a cabo con células cultivadas en placas de cultivo de 6 pocillos de Nunc (Wiesbaden, Alemania) y para los experimentos de expresión de proteínas las células se cultivaron en placas de cultivo de 10 cm2. En todos los experimentos, después de llegar a la confluencia (6–7 días después de sembrarlas), las células crecieron 21 días adicionales para alcanzar la diferenciación. En todos los casos el medio se cambiaba 3 veces por semana.
Poli A+ ARN. Las muestras de ARN poli A+ humano de hígado, intestino delgado, duodeno, yeyuno, íleo, ileoceco y colon se obtuvieron de BD Biosciences Clontech (Franklin Lakes, Estados Unidos).
Extracción del ARN y reacción en cadena de la polimerasa a tiempo real semicuantitativaLa extracción de ARN total de las células cultivadas se llevó a cabo utilizando el equipo de extracción ABI PRISM 6100 Nucleic Acid PrepStation de Applied Biosystems (Foster City, Estados Unidos) siguiendo las instrucciones del fabricante. La pureza y la concentración del ARN se han estimado mediante la relación de absorbancia 260 nm/280 nm. Se retrotranscribió 1 μg de ARN a ADNc utilizando random hexamers con la transcriptasa inversa SuperScript II siguiendo las instrucciones del fabricante (Invitrogen, Carlsbad, Estados Unidos) y utilizando el termociclador PE Biosystems 2400 (Foster City, Estados Unidos).
La expresión del ARNm de los genes a estudio se cuantificó mediante reacción en cadena de la polimerasa (PCR) a tiempo real utilizando el equipo ABI Prism 5700 Sequence Detector System (Applied Biosystems, Foster City, Estados Unidos), combinado con la utilización de oligonucleótidos y sondas Taqman® obtenidos de Applied Biosystems como productos Assays-on-Demand validados y prediseñados. El gen GAPDH se utilizó como control endógeno y los valores de expresión se calcularon de acuerdo con el método de ¿¿ct (ABI Prism 7700 Sequence Detection System. User bulletin n.° 2. Revisión A. Foster city [CA]: Applied Biosystems, 1997).
Extracción de proteínas y Western blot de apo A5Los lisados totales de las células TC-7 se obtuvieron mediante repetidas congelaciones y descongelaciones en un tampón de homogeneización que contenía PBS a pH 7,4 e inhibidores de la proteasa Complete-Mini Protease (Roche, Manheim, Alemania). Las muestras se dejaron a −80 °C hasta su posterior utilización. La proteína total se determinó utilizando el método Bradford24. La electroforesis y el blotting se llevaron a cabo utilizando el sistema de análisis de proteínas NUPAGE® de Invitrogen (Carlsbad, Estados Unidos). La membrana de blotting se bloqueó con un 4% de reactivo ECL Advance Blocking Reagent de Amersham Biosciences (Bucks, Reino Unido) y después se incubó con anticuerpo anti-apo A5 a una dilución de 1:2.500 de Novus Biologicals (Littleton, Estados Unidos). Los complejos antígeno-anticuerpo se detectaron incubando la membrana con inmunoglobulinas policlonales de cabra antirratón/HRP a una dilución de 1:20.000 de Dako (Glostrup, Dinamarca). Las señales se detectaron con una mezcla de ECL Advanced Reagent y las bandas se visualizaron con un film de autorradiografía.
ResultadosExpresión génica de apo A5 en células TC-7 y en intestino humanoUtilizando retro-transcripción de la reacción en cadena de la polimerasa (RT-PCR) a tiempo real semicuantitativa con el gen GAPDH como control endógeno detectamos la expresión de apo A5 en células intestinales en cultivo TC-7 en los últimos ciclos de amplificación, lo cual indica que se expresa a valores bajos.
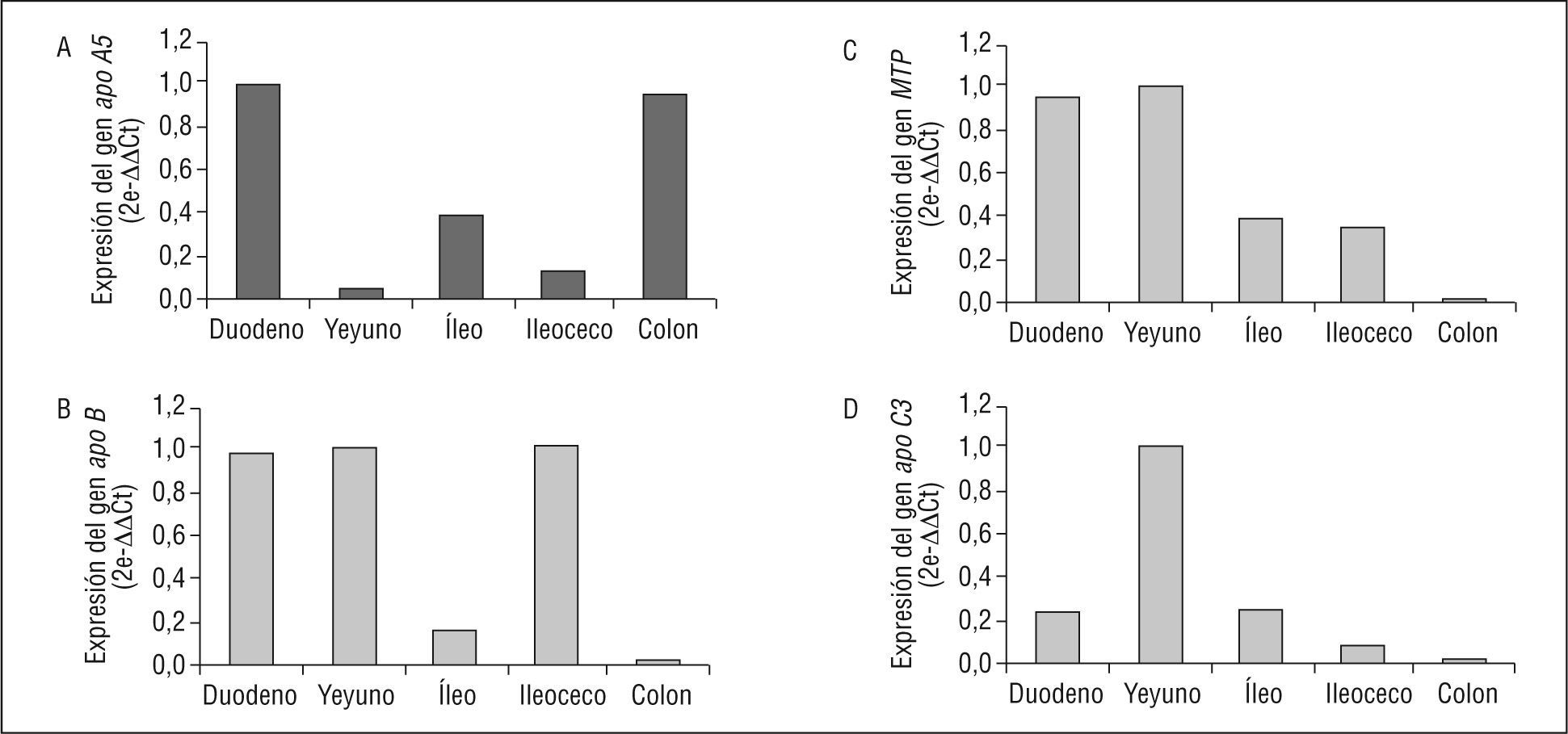
El resultado positivo obtenido de las células TC-7 se confirmó en muestras de ARN de intestino delgado humano obtenidas de BD Biosciences Clontech (Franklin Lakes, Estados Unidos). Analizamos la expresión génica de apo A5, apo B, MTP y apo C3 en las muestras de ARN poli A+ humano de duodeno, yeyuno, íleo, ileoceco y colon. Utilizando RT-PCR a tiempo real semicuantitativa y cogiendo como valor de referencia la expresión obtenida en el segmento intestinal con los mayores valores de expresión para cada gen, confirmamos la presencia de expresión de apo A5 y encontramos que está principalmente expresada en duodeno y colon, y por contra, apo B y MTP están principalmente expresadas en el duodeno, el yeyuno y el ileoceco y en el duodeno y el yeyuno, respectivamente; por su parte, apo C3 se expresa principalmente en yeyuno. A excepción del duodeno, la expresión de apo A5 se correlaciona inversamente con la expresión de apo B (fig. 1).
Niveles de expresión de los genes apo A5 (A), apo B (B), MTP (C) y apo C3 (D) determinados mediante retro-transcripción de la reacción en cadena de la polimerasa a tiempo real, utilizando el gen GAPDH como control endógeno de expresión, en muestras de ácido ribonucleico poli A+ humano de diferentes secciones de intestino delgado, que se obtuvieron de BD Biosciences Clontech.
Analizamos los valores bajos de expresión del gen apo A5 respecto a una muestra de ARN poli A+ de hígado humano también obtenida de BD Biosciences Clontech (Franklin Lakes, Estados Unidos). A su vez, también determinamos la expresión de los otros genes implicados en la regulación del proceso de síntesis y ensamblaje de lipoproteínas ricas en TG y de los valores de TG circulantes (MTP, apo B y apo C3, respectivamente) tanto en muestras de intestino delgado completo como de hígado.
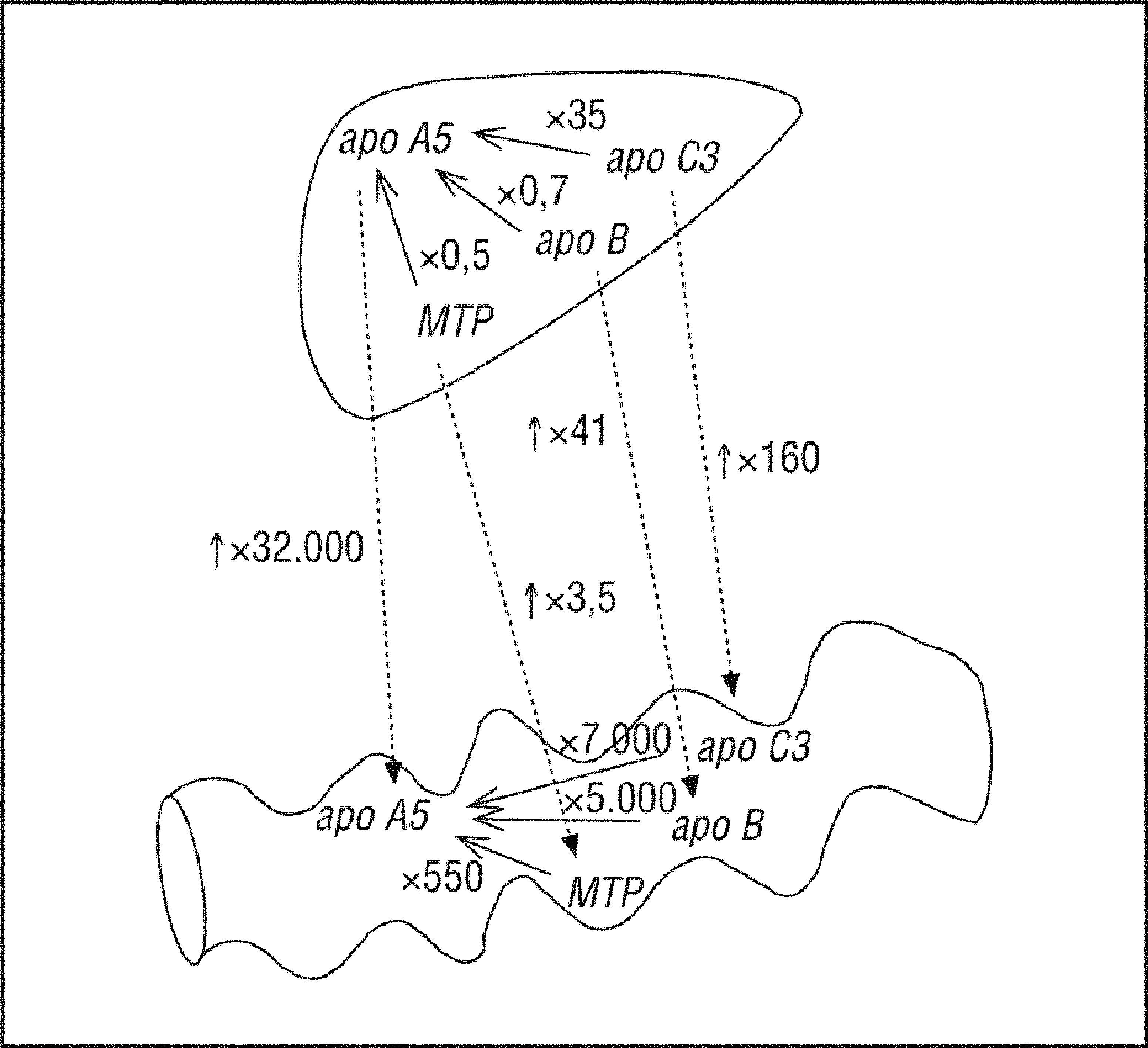
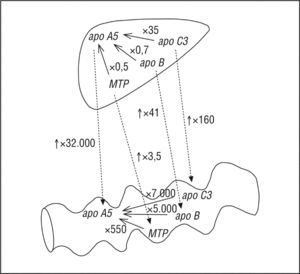
Todos los genes estudiados presentan valores mayores de expresión en hígado que en intestino, donde destaca el gen apo A5 que se expresa 32.000 veces más en el hígado que en el intestino delgado, y 3,5 veces más en el caso de MTP; 41 veces más en el caso de apo B, y 160 en el caso de apo C3 (fig. 2).
Al comparar la expresión de los genes entre ellos en los 2 órganos, vemos que, en el hígado, apo C3 se expresa 35 veces más que apo A5; apo B se expresa casi al mismo nivel que apo A5 (0,7 frente a 1,2-¿¿ct), y apob se expresa la mitad en relación con apo A5. En el intestino delgado, encontramos que apo C3 se expresa 7.000 veces más que apo A5, el gen MTP se expresa 5.000 veces más, y MTP lo hace 550 veces más que apo A5 (fig. 2).
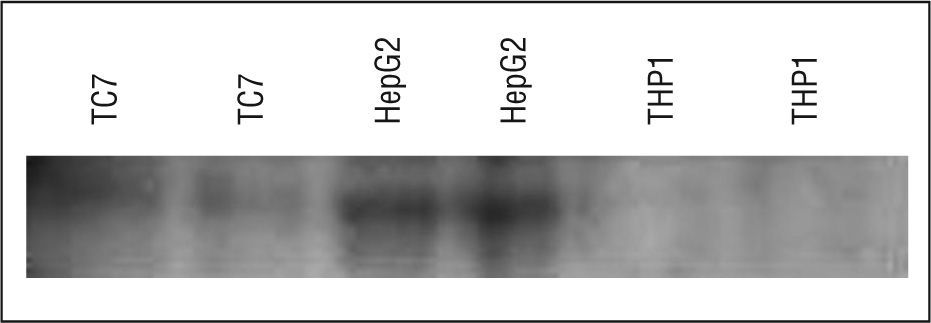
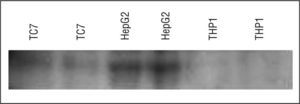
Expresión proteica de apo A-V en células TC-7El Western blot se mejoró para detectar apo A-V en lisados totales obtenidos de células TC-7, y también de células hepáticas HepG2, como control positivo, y de monocitos THP-1, como control negativo. Esto confirmó los resultados obtenidos con la expresión génica, es decir, la existencia de apo A-V en células intestinales TC-7 a menor concentración que la encontrada en las células hepáticas (fig. 3).
DiscusiónSiguiendo nuestra hipótesis, que la apo A-V participa en el proceso de síntesis y secreción de partículas ricas en TG (Q y VLDL), además de en el hígado, también debería expresarse en el intestino delgado (que es el otro tejido en humanos implicado en la síntesis de lipoproteínas ricas en TG). Los resultados presentados en este artículo muestran que el gen apo A5 se expresa en células intestinales TC-7 y en intestino delgado humano, aunque sus valores de expresión son significativamente más bajos que en hígado.
Estos resultados se han obtenido en células TC-7 (subclones de las células Caco-2), que son uno de los modelos celulares más utilizados para estudiar los procesos de absorción, transporte y metabolismo de lípidos y lipoproteínas24, y también, en muestras de intestino delgado humano. Aunque hemos detectado expresión del gen y proteína de apo A5 en las células intestinales, con estos resultados no podemos afirmar si esta proteína es funcional, ni cuál podría ser su papel en el intestino, pero resultados preliminares (datos no presentados), nos muestran que la expresión de apo A5 en el modelo de células intestinales responde a estímulos ambientales. La expresión de apo A5 se ve modificada por la incubación de las células TC-7 con diferentes tipos de ácidos grasos (de cadena larga y de cadena corta), y por la incubación con un compuesto agonista del receptor activado por proliferadores peroxisómicos alfa (PPARα), que es el receptor nuclear que se activa durante el tratamiento hipolipemiante con fibratos en humanos. Una vez activado, el PPARα regula la expresión de genes clave en el metabolismo de los lípidos, como la expresión de apo A5 en hepatocitos humanos25,26.
Aún sin poder afirmar cuál es la función de la apo A-V intestinal, a partir de los resultados publicados13,15,20, podemos plantear 2 posibilidades: la primera, que en el intestino la proteína se secrete junto con las HDL, para posteriormente transferirse a las partículas ricas en TG, o la segunda, que participe en el proceso de formación de partículas ricas en TG de la dieta, para luego ser secretada junto con estas partículas, y así facilitar la hidrólisis de los TG que contienen. Nuestros datos indican un vínculo con esta última opción. Por un lado, la apo A-V, en intestino delgado humano, se expresa principalmente en el duodeno, donde tiene lugar la absorción intestinal de lípidos de la dieta, que serán empaquetados en las lipoproteínas que pasarán a la circulación, para distribuirse por el organismo, y además, la secuencia génica de apo A5, tanto humana como de roedores, es altamente homóloga a la de la apo A45,6, que participa en el proceso de absorción de lípidos en intestino. Nuestros resultados también muestran que, globalmente, hay una correlación inversa entre la expresión del gen apo A5, y la de los genes apo B y MTP (implicados en la síntesis y la secreción de partículas ricas en TG). Ello indica que una expresión relativamente alta de apo A5 puede estar acompañada de una baja actividad relativa de la maquinaria de síntesis de lipoproteínas.
Al detectar que los valores de expresión intestinal eran bajos, los comparamos con la expresión del gen en hígado, hasta la fecha el único órgano de expresión de apo A5 en humanos. Hemos visto que el valor de expresión del gen apo A5 entre ambos órganos es muy distinto, aunque los análisis de Western blot han indicado que, a pesar de las grandes diferencias en el grado de expresión, las concentraciones finales de proteína en las células intestinales pueden no ser tan bajas, ya que calculamos que representan aproximadamente un tercio en relación con los valores de proteína en las células hepáticas. Además, creemos que una cierta diferencia entre los valores de apo A5 entre intestino delgado e hígado, a favor del hígado, es esperable, si tenemos en cuenta que el hígado es el principal órgano de movilización de lípidos endógenos, y que a su vez controla la homeostasis lipídica del organismo. El hígado secreta las VLDL que contienen lípidos derivados de las partículas remanentes que ha captado de la circulación, o que contienen lípidos sintetizados de novo.
Por tanto, los resultados de este estudio parecen ampliar el campo de acción de la apo A-V dentro del metabolismo lipídico. Esta proteína ganó mucho interés con su descubrimiento en 2001, debido a la contundencia y la fuerza de los resultados de los primeros trabajos en modelos animales y en estudios de asociación, y se planteó como el principal modulador genético de los valores de TG. Últimamente se pone en entredicho su papel. Ello se debe a que los resultados de los primeros estudios, que han determinado los valores de proteína circulante, no muestran la misma fuerte relación con los valores de TG. Por ello, creemos que serán necesarios futuros estudios que profundicen sobre el papel de la proteína intestinal, para ayudar a esclarecer si el gen es clave en la regulación de los valores de TG, tal como se afirmó en un principio.
Este estudio se ha llevado a cabo gracias al apoyo del CIBERDEM.
Todos los autores han contribuido a la idea del diseño, interpretación de resultados y revisiones críticas del borrador hasta su versión final.