El neuron-derived orphan receptor-1 (NOR-1) es un receptor nuclear que está sobreexpresado en las lesiones ateroscleróticas humanas y que participa en la proliferación de las células endoteliales (CE) en respuesta al factor de crecimiento del endotelial vascular (VEGF) y a otros mitógenos. Nuestro objetivo fue analizar la regulación del NOR-1 por la hipoxia en las CE.
ResultadosLa hipoxia indujo la expresión del NOR-1 de forma dosis y tiempo dependiente. El BAPTA-AM (un quelante de calcio) previno la inducción del NOR-1 por la hipoxia, pero no así los inhibidores de la p38 MAPK, de la MEK1/2 o de la proteína quinasa C. Ni los anticuerpos contra el VEGF ni SU5614 (un inhibidor del receptor-2 del VEGF) afectaron a la inducción del NOR-1 por la hipoxia. La hipoxia no activó la proteína de unión al elemento de respuesta a adenosín monofosfato-3', 5' cíclico, CAMP un factor de transcripción que participa en la inducción del NOR-1 por el VEGF. Por el contrario, al reducir los niveles de proteína del factor inducido por hipoxia HIF-1α con inhibidores de la vía PI3K/Akt/mTOR o mediante siRNA contra HIF-1α, se previno el aumento de los niveles del RNA mensajero del NOR-1 en respuesta a la hipoxia. En los ensayos de transfección transitoria, la actividad del promotor del NOR-1 fue incrementada por la hipoxia o por la cotransfección con un plásmido de expresión del HIF-1α. Identificamos un elemento de respuesta a la hipoxia en el promotor del NOR-1 responsable de su regulación por la hipoxia, como demostramos mediante análisis de deleciones seriadas y de construcciones mutagenizadas. Por último, la sobreexpresión del NOR-1 (con un plásmido recombinante bicistrónico) disminuyó la proporción de células apoptóticas (anexina V positivas/yoduro de propidio negativas), mientras que la inhibición del NOR-1 (utilizando siRNA específicos) incrementó la tasa de apoptosis celular.
ConclusionesPor tanto, el factor inducido por hipoxia-1 modula la expresión del NOR-1, un factor de transcripción que regula la respuesta de supervivencia de las CE a la hipoxia.
NOR-1 is a nuclear receptor that is overexpressed in human atherosclerotic plaques. This receptor is involved in endothelial cell (EC) growth induced by vascular endothelial growth factor (VEGF) and other mitogens. Our aim was to analyze NOR-1 regulation by hypoxia in EC.
ResultsHypoxia increased NOR-1 mRNA levels in a time- and dose-dependent manner. Hypoxia-induced NOR-1 expression was prevented by BAPTA-AM (a calcium chelator) but not by inhibitors of p38 MAPK, MEK1/2 or protein kinase C (PKC) pathways. Incubation of EC with blocking antibodies against VEGF or SU5614 (a VEGF-R2 inhibitor) did not prevent hypoxia-induced NOR-1 expression. Hypoxia did not significantly induce early activation of cAMP response element binding protein (CREB), a key transcription factor involved in the up-regulation of NOR-1 expression by VEGF. In contrast, reduction of hypoxia-induced HIF-1α protein levels by inhibitors of the PI3K/Akt/mTOR pathway or by siRNA against HIF-1, significantly counteracted hypoxia-induced NOR-1 up-regulation. In transient transfection assays, the activity of the NOR-1 promoter construct was increased by hypoxia or by co-transfection with an HIF-1α expression plasmid. We identified a hypoxia response element in the NOR-1 promoter responsible for this hypoxia-mediated effect as shown by site-directed mutagenesis and serial deletions. Finally, over-expression of NOR-1 (using a bicistronic recombinant plasmid) decreased the rate of cells undergoing apoptosis (annexin V positive/propidium iodide negative), while inhibition of NOR-1 (using specific siRNA) increased cell apoptosis.
ConclusionsTherefore, HIF-1 modulates the expression of NOR-1, a transcription factor that regulates the survival response of EC to hypoxia.
Las células de los mamíferos requieren un suplemento constante de oxígeno (O2) para mantener el equilibrio energético. Los niveles bajos de O2 (hipoxia) conducen a una reducción de la fosforilación oxidativa y a una depleción de ATP celular que puede provocar la muerte celular. Para adaptarse a la hipoxia, las células han desarrollado mecanismos complejos que involucran cerca de un 2% del transcriptoma1. De hecho, las proteínas moduladas por la hipoxia intervienen en múltiples procesos relacionados, además de en la supervivencia celular, el metabolismo, el crecimiento y la motilidad celular, y la regulación de funciones como la eritropoyesis y la homeostasis vascular2. En respuesta a la hipoxia, las células secretan el factor de crecimiento del endotelial vascular (VEGF)3, una citoquina que modula la expresión de un importante número de genes y de actividades biológicas, como la supervivencia celular y la angiogénesis5. Estos efectos del VEGF están mediados por varios factores de transcripción, entre ellos el adenosín monofosfato-3', 5' cíclico (cAMP) response element binding protein (CREB, ‘proteína de unión al elemento de respuesta a cAMP’) o los receptores nucleares de la subfamilia NR4A5–8. Sin embargo, la respuesta transcripcional a la hipoxia está mediada primariamente por la familia de factores de transcripción factor inducido por hipoxia (HIF). El HIF-1, el prototipo de esta familia, es un heterodímero compuesto por el HIF-1β (subunidad constitutiva) y el HIF-1α (subunidad sensible al O2)9,10. En condiciones de normoxia, el HIF-1α se degrada a través de un mecanismo en el que es clave la hidroxilación de dos residuos de prolina por parte de prolin-hidroxilasas específicas11, posteriormente tiene lugar su ubiquitilación y, finalmente, su degradación proteosomal12,13. En condiciones de hipoxia, la subunidad HIF-1α es más estable y dimeriza a nivel nuclear con el HIF-1β, regulando la transactivación de genes que en su región promotora contienen elementos de respuesta a la hipoxia (HRE). Actualmente no se conoce por completo la red factores de transcripción que cooperan en la respuesta a la hipoxia de las células endoteliales (CE) vasculares.
El neuron-derived orphan receptor-1 (NOR-1) es un receptor nuclear identificado originariamente como un gen de respuesta temprana en neuronas apoptóticas. El NOR-1 junto con el Nur77 y el Nurr1 forman la subfamilia NR4A de receptores nucleares huérfanos14. Estos receptores muestran una estructura modular compuesta por un dominio de transactivación N-terminal, un dominio de unión al DNA y un dominio de unión de los ligandos al C-terminal. A diferencia de otros receptores nucleares, los genes NR4A no parecen requerir de la unión de un ligando para su activación14, y se comportan como genes de inducción temprana cuya expresión se activa en respuesta a diferentes estímulos14. Estudios previos han demostrado que el NOR-1 juega un papel en la proliferación celular y en la apoptosis. De hecho, el NOR-1 está implicado en la apoptosis de células neuronales, células T y MCF-715,16. A nivel vascular, el NOR-1 se induce en respuesta a la angioplastia coronaria17 y está sobreexpresado en las lesiones ateroscleróticas de los pacientes con enfermedad de la arteria coronaria17,18. En células vasculares en cultivo, la expresión del NOR-1 es inducida por factores de crecimiento, citoquinas y lipoproteínas de baja densidad6–8,17–23 y parece ser un factor de transcripción clave en la proliferación de las células musculares lisas vasculares17–21 y de las CE7,22,23. La implicación del NOR-1 en la proliferación celular ha sido ratificada en modelos animales deficientes en NOR-124,25 y por su papel crítico en la embriogénesis26. Además, ha sido descrita una transformación oncogénica dependiente del NOR-1 y resultante de su fusión con la región N-terminal de varias proteínas, como EWS, TAF2N y TFG27. El NOR-1 está involucrado en la supervivencia de las neuronas del hipocampo de ratones en desarrollo28 y, recientemente, se ha demostrado que se induce de forma transitoria y específica en regiones cerebrales resistentes a isquemia global transitoria29. El objetivo de este estudio fue analizar si el NOR-1 juega un papel en la respuesta adaptativa de las CE a la hipoxia. Hemos demostrado que la hipoxia modula el NOR-1 a través del HIF-1, y que el NOR-1 parece ser clave para la supervivencia de las CE sometidas a hipoxia.
Materiales y métodosCultivos celularesSe utilizaron CE humanas de la vena del cordón umbilical (Advancell) y CE humanas de microvasos de la piel (HDMEC) (Cambrex) según se ha descrito previamente7,22. Ambos tipos celulares se cultivaron en medio 199 (Kibbutz Industries) suplementado con 20mM de HEPES, pH 74(Gibco), el 20% de FCS (Biological Industries), 30μg/ml de suplemento de crecimiento para CE (Sigma), glutamina, 1mM de piruvato (Gibco), 100μg/ml de heparina (Sigma) y antibióticos (100U/ml de penicilina y 0,1mg/ml de estreptomicina [Gibco]).
Se utilizaron células entre los pases 2 y 5. Las células se sembraron en placas multipocillo hasta la subconfluencia y se incubaron en un medio pobre en mitógenos durante 16h (medio 199 suplementado con 2mM de glutamina, antibióticos y el 10% de FCS). Las células se trataron con deferoxamina (DFO) (Calbiochem), cloruro de cobalto (CoCl2) (Sigma), VEGF-A165 (R&D) o se sometieron a hipoxia (nitrógeno atmosférico con 1% de O2, 5% de CO2 y 90% de humedad relativa). Cuando se utilizaron inhibidores, éstos se añadieron 30 min antes de someter las células a hipoxia. Los inhibidores utilizados fueron SU5614 (un inhibidor de VEGF; Calbiochem), BAPTA-AM (15μM, un quelante de Ca2+; Sigma), GF10933X (5μM, un inhibidor de la proteína quinasa C [PKC]; Sigma), Gö6976 (3μM, un inhibidor de la PKC dependiente del calcio; Biomol), SB203580 (5μM, un inhibidor de p38 MAPK; Oxford Biomedical Research Inc.), U0128 (10μM, un inhibidor de MEK; Calbiochem), LY294002 (25μM, un inhibidor de PIK3/Akt; Calbiochem) o rapamicina (100nM, un inhibidor de mTOR; Sigma). Para bloquear el VEGF secretado por las CE se utilizaron anticuerpos neutralizantes (200ng/ml) y SU5614 (10μM; Calbiochem) para bloquear el receptor-2 del VEGF.
PCR a tiempo realEl ácido ribonucleico (RNA) celular se aisló mediante el kit RNAeasy (Qiagen) de acuerdo con las recomendaciones del fabricante, y se hizo una transcripción inversa con hexámeros utilizando el kit High Capacity cDNA Archive (Applied Biosystems). La PCR en tiempo real se llevó a cabo mediante Assay-on-DemandTMTaqManTM (Applied Biosystems) para el NOR-1 (Hs00175077_m1) y el RNA ribosomal 18S (4319413E), que se utilizó como control endógeno.
Análisis de proteínas (western blot)Las CE se incubaron en condiciones de normoxia o se expusieron a hipoxia según se ha indicado previamente. Las monocapas de células se lavaron con tampón fosfato salino y se lisaron con buffer de lisis (1% de dodecil sulfato sódico en 10mM Tris-HCl [pH 7,4], 1mM de ortovanadato). La concentración de proteína se determinó mediante el método del ácido bicinconínico (BCA Protein AssayTM, Pierce) y se analizaron mediante western blot según el procedimiento descrito previamente17. Las membranas se incubaron con anticuerpos contra el HIF1-α (Novus Biologicals). Los anticuerpos primarios unidos se detectaron utilizando un anticuerpo secundario acoplado a peroxidasa (Dako) y un sistema de detección quimioluminiscente (Supersignal West DuraTM, Pierce). Se realizó un control de carga tiñendo la membrana con Ponceau e incubándola con anticuerpo anti-β-actin a (Sigma).
Inhibición de la expresión: transfección con siRNAEn los experimentos de bloqueo de la expresión se emplearon siRNA prediseñados (Ambion) contra HIF-1α, NOR-1 o SilencerTMNegative Control 1♯ (Ambion). Las células se transfectaron con siRNA utilizando el sistema NuclefectorTM (Amaxa) siguiendo las recomendaciones del fabricante22. Se electroporaron 1×106 células en 100μl de buffer con 1μg de siRNA. Posteriormente, las células se sembraron en un medio completo durante 24h, se incubaron en un medio pobre en mitógenos durante 16h y, finalmente, se sometieron a hipoxia.
Construcciones del promotor del neuron-derived orphan receptor-1El inserto del plásmido pNOR-1α/-1703, cedido por el Dr. N. Ohkura (Growth Factor Division, National Cancer Center Research Institute, Tokyo, Japan), que contenía el promotor del NOR-1 (de -1703 a +264), se clonó en el vector pGL3-Luciferase (Promega) (pNOR/-1703). Mediante la PCR se generaron las deleciones del promotor del NOR-1. Se mutagenizó la secuencia putativa reconocida por el HIF-1 (HRE) mediante mutagénesis dirigida utilizando el kit QuikChange Site-Directed Mutagenesis (Stratagene) y los siguientes oligonucleótidos: 5′-GTT AAG AAA CCC ACG CCG TAC cTc TAA AGA AAT CAA ACC TTA TC-3′ y 5′-GAT AAG GTT TGA TTT CTT TAg AgG TAC GGC GTG GGT TTC TTA AC-3′ (el HRE está subrayado y los cambios introducidos se destacan en minúscula). También se mutagenizaron los elementos de respuesta a CREB (CRE) como se ha descrito previamente19. Las secuencias resultantes se analizaron mediante programas de análisis de secuencias promotoras para confirmar que no se había generado ningún nuevo elemento de respuesta.
Ensayo de transfección transitoria y actividad luciferasaLas CE se transfectaron con el plásmido reportero de luciferasa (pNOR/-1703) y con las construcciones delecionadas y mutagenizadas generadas utilizando el sistema LipofectinTM (Invitrogen)17,22. Las células transfectadas se incubaron en un medio pobre en mitógenos durante 16h y, posteriormente, se sometieron a hipoxia durante 6h. La actividad luciferasa se determinó en los lisados celulares utilizando el kit Luciferase Assay (Promega). Como control interno se utilizó el pSVβ-gal (Promega). En los experimentos de cotransfeccion se utilizó el plásmido pCDNA3-HIF-1α, cedido por Dr. E. Huang (Department of Health & Human Service, NIH; Bethesda, Maryland).
Sobreexpresión del neuron-derived orphan receptor-1El cDNA del NOR-1 fue clonado en el plásmido pIRES2-GFP (Clontech) a partir del cDNA obtenido en la librería de cDNA en λZAPII17. El pIRES2-GFP es un vector bicistrónico que permite expresar el cDNA de la proteína verde fluorescente (EGFP) y el cDNA de interés clonado después de la secuencia IRES y bajo el control del promotor del citomegalovirus. Las células se transfectaron con el plásmido recombinante que expresaba la GFP (pIRES2-GFP) y el NOR-1 (pGFP-NOR) empleando el sistema NuclefectorTM (Amaxa), siguiendo las recomendaciones del fabricante. Se verificó la expresión de la GFP mediante microscopia de fluorescencia (Vanox AHBT3, Olympus).
Índice de apoptosis: ensayos de unión de anexina VLas células se transfectaron con pGFP-NOR o pIRES2-GFP (control) según se ha indicado previamente, se incubaron en un medio completo durante 36h y, posteriormente, se incubaron en un medio pobre en mitógenos en condiciones de normoxia o se expusieron a hipoxia durante 16h. Finalmente, las monocapas de células se tripsinizaron, se combinaron con las células no adheridas recuperadas de los sobrenadantes celulares y se incubaron con anexina V marcada con R-ficoeritrina (anexina V-R-PE; Molecular Probes) y con yoduro de propidio. En las células GFP-positivas transfectadas con el pGFP-NOR o el pIRES2-GFP, se determinó la proporción de células apoptóticas (anexina V-R-PE positivas/yoduro de propidio negativas) mediante fluorescence activated cell sorting (Coulter Epics XL, Beckman Coulter). También se analizó la unión de anexina V-R-PE en experimentos de bloqueo del NOR-1. Las células se trataron con 1μg de siRNA contra NOR-1, según se ha indicado anteriormente, y se analizó la proporción de células apoptóticas mediante fluorescence activated cell sorting. Alternativamente, y con fines cualitativos, se analizó la unión de anexina V-R-PE mediante un análisis con microscopia confocal (DMIRE2, Leica) de las células transfectadas con los vectores de expresión, o bien con los siRNA, expuestas a hipoxia en placas especiales (Willco Wells B.V.) y que permanecieron adheridas a las placas de cultivo. En este caso, se realizó la cotinción de los núcleos con el colorante Hoechst n.o 33342 (Molecular Probes).
Análisis estadísticoLos resultados se expresan como la media±error estándar de la media. Se utilizó el programa STAT VIEW II (Abacus Concepts) para todos los análisis estadísticos. Múltiples grupos se compararon mediante la prueba ANOVA de un factor, seguida por la prueba PLSD de Fisher para evaluar las diferencias específicas entre grupos.
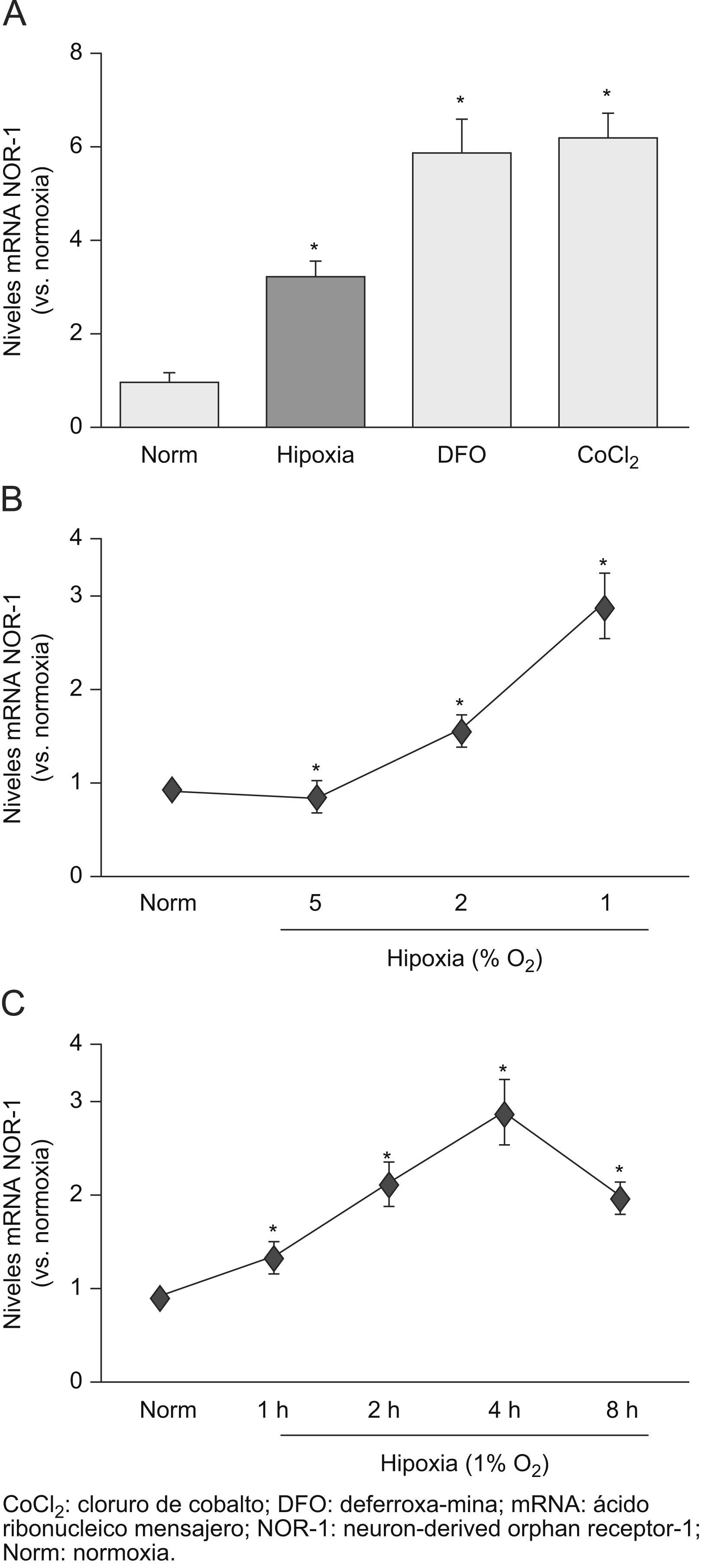
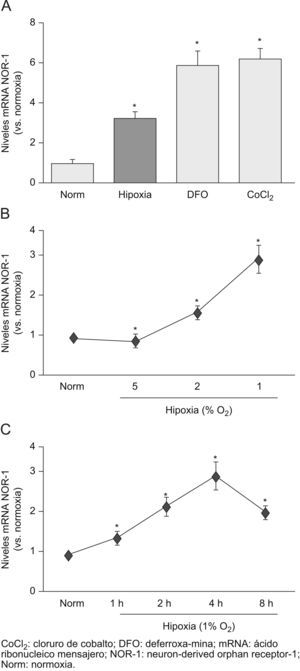
ResultadosLa hipoxia induce la expresión del neuron-derived orphan receptor-1 en células endotelialesPreviamente, hemos demostrado que el VEGF-A, una citoquina clave en situaciones de hipoxia y que está involucrada en la supervivencia y proliferación de las CE, es un potente inductor del NOR-17. En este trabajo, analizamos el efecto de la hipoxia sobre la expresión del NOR-1 en las CE vasculares. La exposición de las CE humanas de la vena del cordón umbilical a hipoxia (el 1% de O2) aumentó la expresión del NOR-1 (fig. 1A). Dos compuestos que mimetizan el efecto de la hipoxia (DFO y CoCL2) porque inhiben la dioxigenasa dependiente del Fe(II)-2-oxoglutarato y en consecuencia estabilizan el HIF-1α también aumentaron la expresión del NOR-1 (fig. 1A). La hipoxia indujo la expresión del NOR-1 de forma dosis y tiempo dependiente (fig. 1B y C). El máximo nivel de expresión del NOR-1 se alcanzó a las 4h del estímulo para disminuir transcurridas 8h. Resultados similares se obtuvieron en HDMEC (datos no mostrados).
La hipoxia induce la expresión del neuron-derived orphan receptor-1 (NOR-1) de forma dosis y tiempo dependiente. A) Niveles de ácido ribonucleico (RNA) mensajero (mRNA) del NOR-1 en células endoteliales humanas de la vena del cordón umbilical (HUVEC) cultivadas en condiciones de normoxia (Norm) o expuestas a hipoxia (el 1% de O2, 4h) o incubadas con deferroxamina o cloruro de cobalto durante 4h. B) Niveles de mRNA del NOR-1 en HUVEC cultivadas en Norm o expuestas a condiciones crecientes de hipoxia durante 4h. C) Niveles de mRNA del NOR-1 en HUVEC cultivadas en Norm o expuestas a hipoxia (1% de O2) durante diferentes tiempos. Los resultados se normalizaron por los niveles del RNA ribosomal 18S. Se muestran datos de tres experimentos independientes realizados por triplicado. *p<0,05 respecto a normoxia.
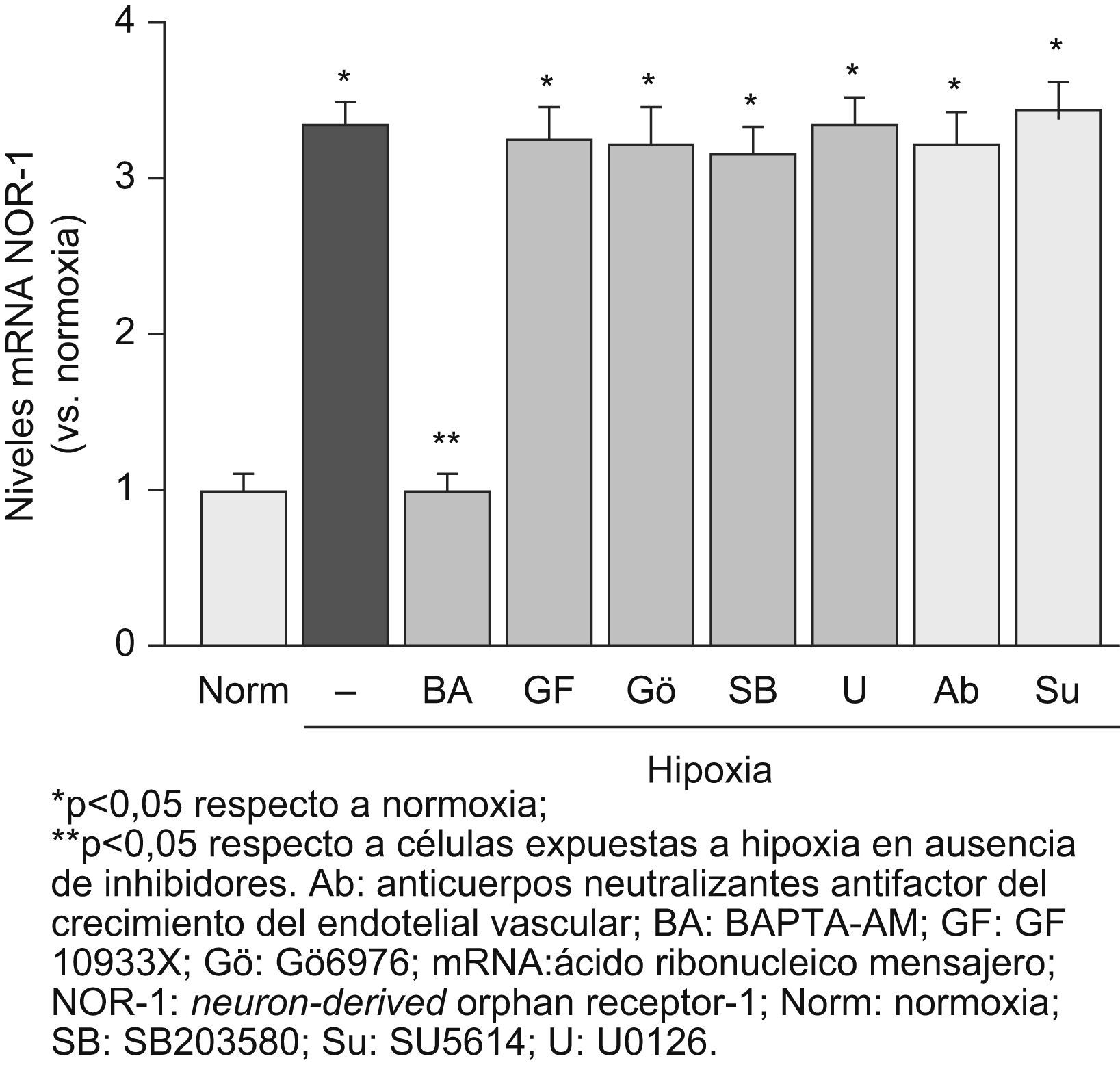
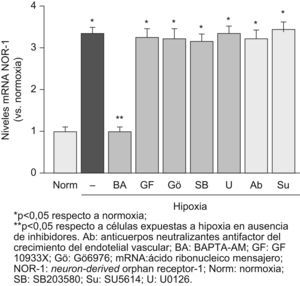
La hipoxia activa diferentes vías de señalización en CE, entre otras, vías dependientes de la PKC y de las quinasas activadas por mitógenos (MAPK: ERK1/2 y p38 MAPK), y aumenta los niveles intracelulares de Ca2+ libres9. Para identificar el mecanismo a través del cual la hipoxia promueve la expresión del NOR-1, utilizamos inhibidores específicos de diferentes vías de señalización. Los resultados mostrados en la figura 2A indican que el aumento la inducción del NOR-1 por hipoxia es dependiente de la movilización de calcio (inhibida por un quelante de calcio [BAPTA-AM]), pero independiente de otras vías en las que participan la MAPK o la PKC. Resultados similares se obtuvieron con HDMEC (datos no mostrados).
La inducción del neuron-derived orphan receptor-1 (NOR-1) por la hipoxia es dependiente de la movilización del calcio intracelular y en ella no interviene el factor de crecimiento del endotelial vascular (VEGF). Niveles de ácido ribonucleico mensajero del NOR-1 en células endoteliales humanas de la vena del cordón umbilical cultivadas en condiciones de normoxia o expuestas a hipoxia (1% de O2, 4h) en ausencia (barras negras) o presencia de diferentes inhibidores de vías de señalización (barras grises): BAPTA-AM (un quelante intracelular de calcio), GF10933X (un inhibidor general de la proteína quinasa C), Gö6976 (un inhibidor de las proteínas quinasas C dependientes del calcio), SB203580 (un inhibidor de la p38 MAPK) y U0126 (un inhibidor de MEK y de la vía dependiente de ERK1/2). También se muestra que el bloqueo del VEGF secretado por las células (con anticuerpos neutralizantes anti-VEGF) o del receptor-2 del VEGF (con SU5614) no afecta a la inducción del NOR-1 por la hipoxia. Los resultados fueron normalizados por los niveles del ácido ribonucleico ribosomal 18S. Se muestran datos de tres experimentos independientes realizados por triplicado.
Para averiguar si el VEGF secretado por las CE en respuesta a la hipoxia juega un papel en la estimulación de la expresión del NOR-1 por hipoxia, bloqueamos el VEGF (utilizando un anticuerpo anti-VEGF) o inhibimos la función de su receptor-2 con SU5614. En ningún caso se vio afectada la inducción del NOR-1 por la hipoxia (fig. 2B). Por el contario, en los experimentos control, al bloquear el VEGF o su receptor se previno la inducción del NOR-1 por el VEGF (datos no mostrados).
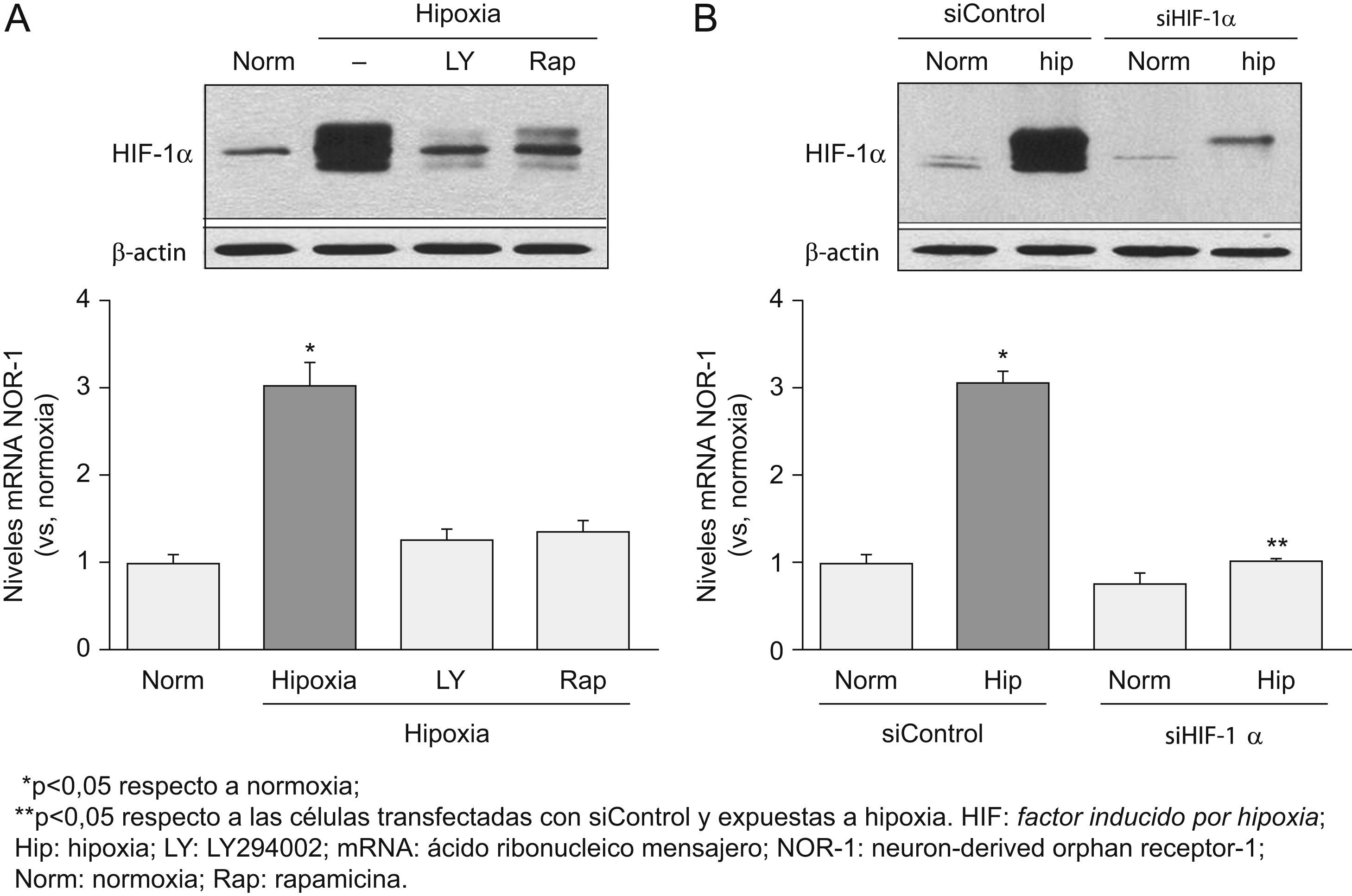
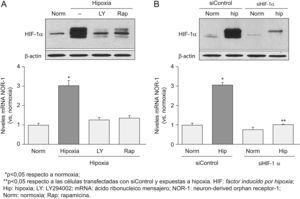
La inhibición del factor inducido por hipoxia reduce la expresión del neuron-derived orphan receptor-1 inducida por hipoxiaLa inhibición de la vía PI3K/Akt (mediante LY294002), o la inhibición mediante rapamicina de su diana mTOR, redujo significativamente los niveles de proteína del HIF-1α y, de forma concomitante, disminuyó los niveles de RNA mensajero del NOR-1 inducidos en respuesta a la hipoxia (fig. 3A). La inhibición directa del HIF-1α utilizando siRNA específicos (siHIF-1α) también redujo significativamente los niveles de proteína del HIF-1α en respuesta a la hipoxia y, concomitantemente, disminuyó significativamente la inducción del NOR-1 producida por la hipoxia (fig. 3B).
La inhibición de los niveles del factor inducido por hipoxia (HIF) 1α en respuesta a la hipoxia previene la inducción del neuron-derived orphan receptor-1 (NOR-1). A) Células endoteliales humanas de la vena del cordón umbilical (HUVEC) que fueron cultivadas en condiciones de normoxia (Norm) o expuestas a hipoxia (1% de O2, 4h) en ausencia (barras negras) o presencia (barras grises) de inhibidores de la vía PI3K/Akt (LY294002) o de su diana mTOR (rapamicina). Parte superior: western blot representativo en el que se aprecia la reducción que el LY294002 y la rapamicina producen en los niveles de proteína HIF-1α. Como control de carga se muestran los niveles de β-actina. Parte inferior: niveles de ácido ribonucleico mensajero (mRNA) del NOR-1 en HUVEC cultivadas como se ha indicado anteriormente. B) Células HUVEC que fueron transfectadas con un siRNA frente a una secuencia de control (siControl) o siRNA contra HIF-1α (siHIF-1α) y se cultivaron en condiciones de Norm o se expusieron a hipoxia (1% de O2, 4h). Parte superior: western blot representativo en el que se aprecia la reducción que el siHIF-1α produce sobre los niveles de proteína HIF-1α. Como control de carga se muestran los niveles de β-actina. Parte inferior: niveles de mRNA del NOR-1 en HUVEC transfectadas con el siControl o el siHIF-1α y cultivadas en condiciones de Norm o hipoxia (1% de O2, 4h). Los resultados fueron normalizados por los niveles del RNA ribosomal 18S. Se muestran datos de tres experimentos realizados por triplicado.
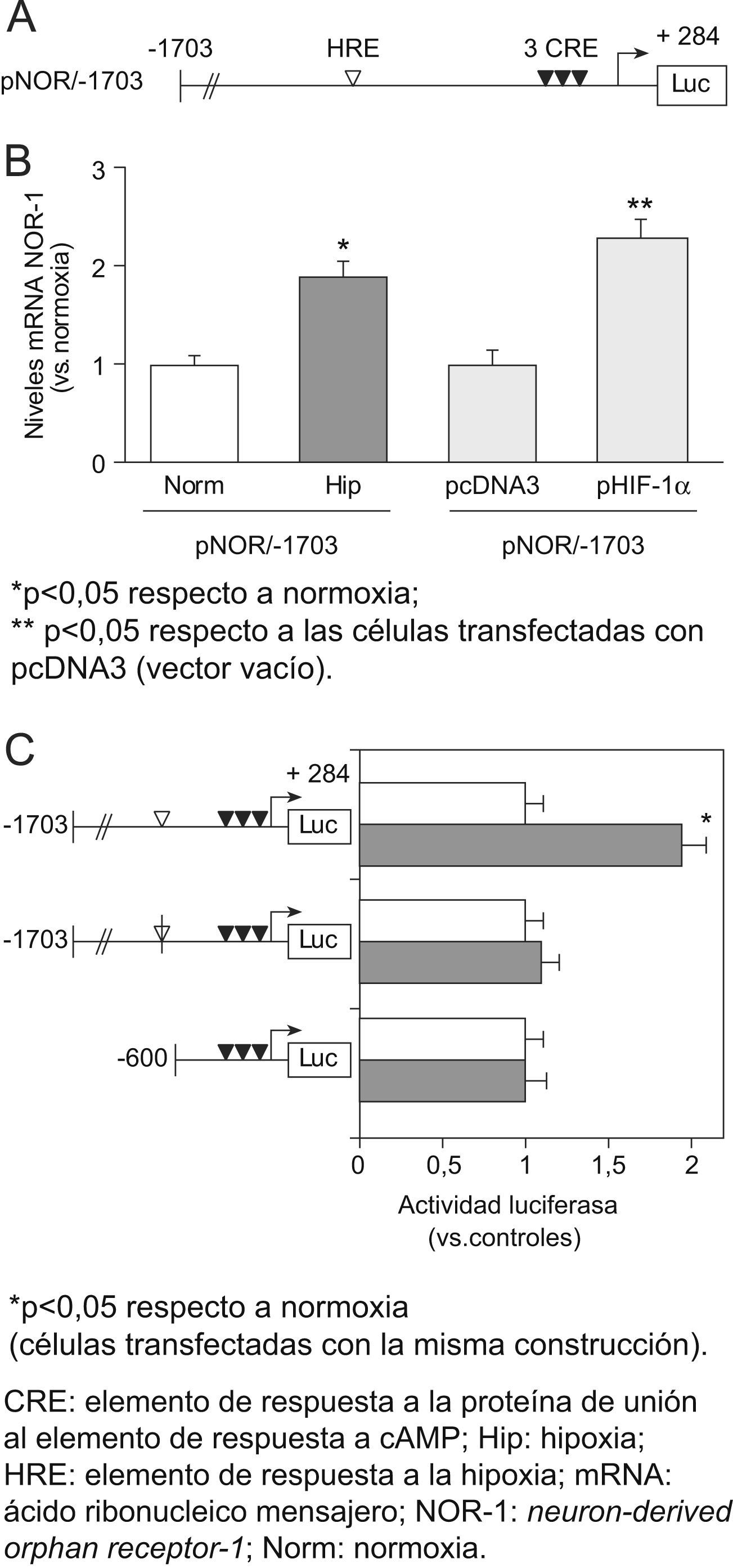
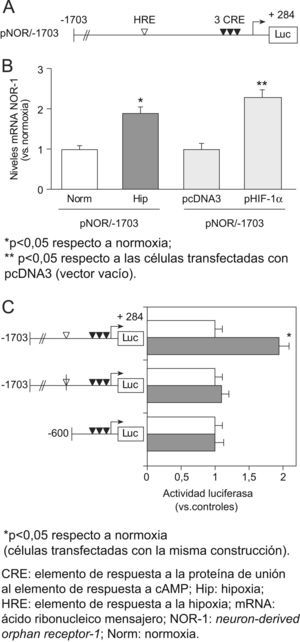
En los experimentos de transfección transitoria, la hipoxia incrementó la actividad transcripcional de un plásmido reportero de luciferasa que lleva 1703 pares de bases del promotor del NOR-1, el pNOR/-1703 (fig. 4A y B). Además, en experimentos de cotransfección, la expresión del HIF-1α aumentó la actividad transcripcional del promotor del NOR-1 en condiciones de normoxia (fig. 4B). Mediante deleciones seriadas del promotor del NOR-1 localizamos un posible HRE (posición −683/−678), cuya mutagénesis previno el aumento de la actividad transcripcional del promotor del NOR-1 producido por la hipoxia (fig. 4C). Por el contrario, al mutagenizar las secuencias CRE, aunque decreció la actividad basal del promotor, no se vio afectada la inducción por la hipoxia. Por tanto, la inducción del NOR-1 por hipoxia se produce a través de un HRE y no depende de los CRE.
El factor inducido por hipoxia (HIF) CRE: elemento de respuesta a la proteína de unión al elemento de respuesta a cAMP; Hip: hipoxia; HRE: elemento de respuesta a la hipoxia; mRNA: ácido ribonucleico mensajero; NOR-1: neuron-derived orphan receptor-1; Norm: normoxia. 1 regula la actividad transcripcional del neuron-derived orphan receptor-1 a través de un elemento de respuesta a la hipoxia (HRE) presente en su promotor. A) Esquema del promotor del neuron-derived orphan receptor: construcción pNOR/-1703 en pGL3 (vector reportero de luciferasa). Se muestra la posición del HRE (HRE; posición −683/−678; diamante blanco) y de los tres elementos de respuesta a la proteína de unión al elemento de respuesta a cAMP (diamantes negros). B) Células endoteliales humanas de la vena del cordón umbilical que fueron transfectadas con un pNOR/−1703 y fueron cultivadas en condiciones de normoxia o expuestas a hipoxia (1% de O2, 6h). En otro grupo de experimentos se analizó el efecto de cotransfectar el vector pNOR/−1703 con un vector de expresión del HIF-1α (pHIF-1α) o un vector vacío (pcDNA3, control). Se muestra la actividad luciferasa relativa a las condiciones control (normoxia o cotransfección con pcDNA3, respectivamente). Se muestran datos de tres experimentos independientes realizados por cuadruplicado. C) Análisis comparativo de la actividad transcripcional pNOR/-1703 y de varias construcciones delecionadas de pNOR/-1703, así como las correspondientes a la mutagénesis del HRE (diamante blanco suprimido) o a la mutagénesis de los tres elementos de respuesta a la proteína de unión al elemento de respuesta a cAMP (diamantes negros suprimidos).
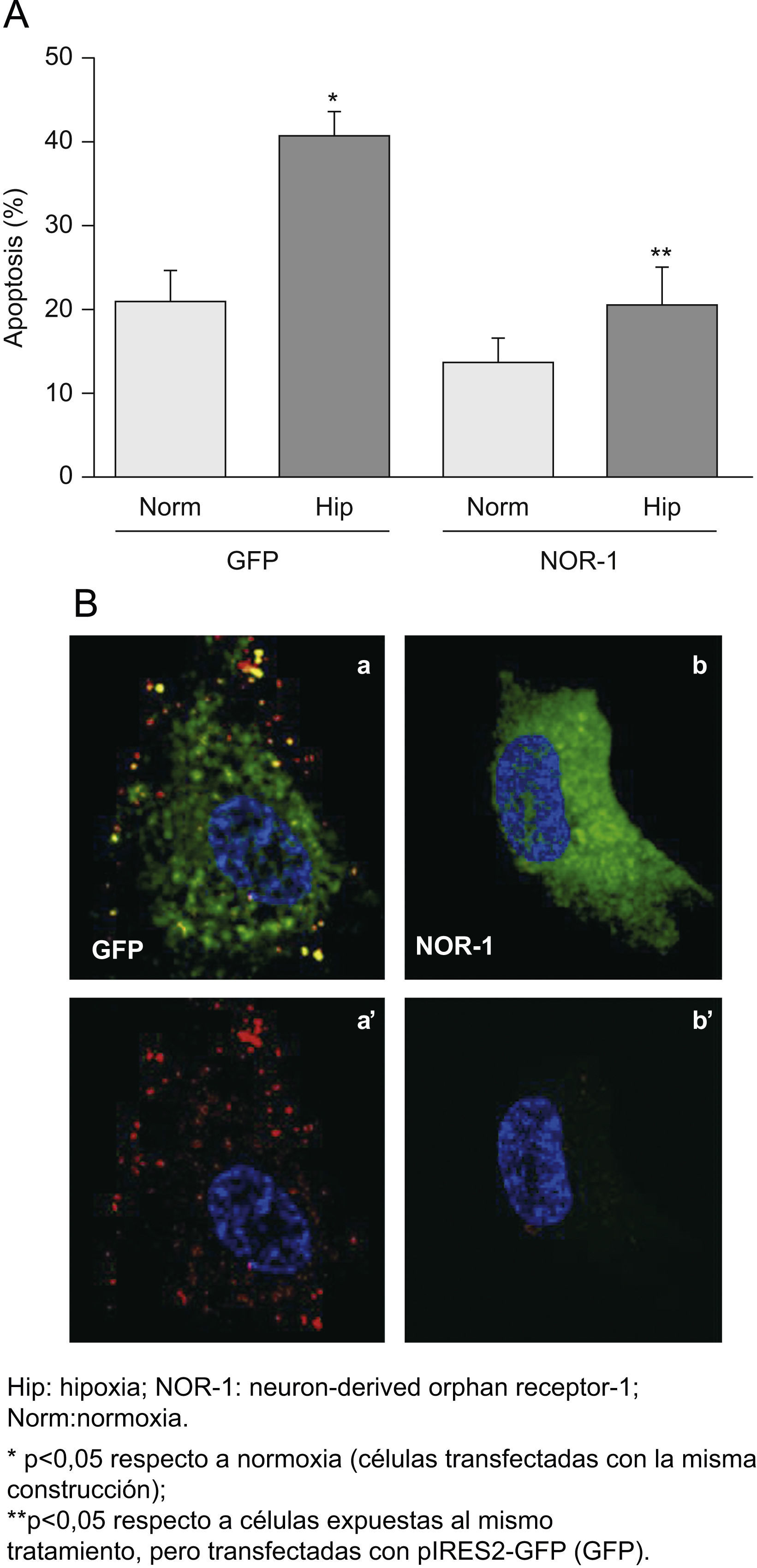
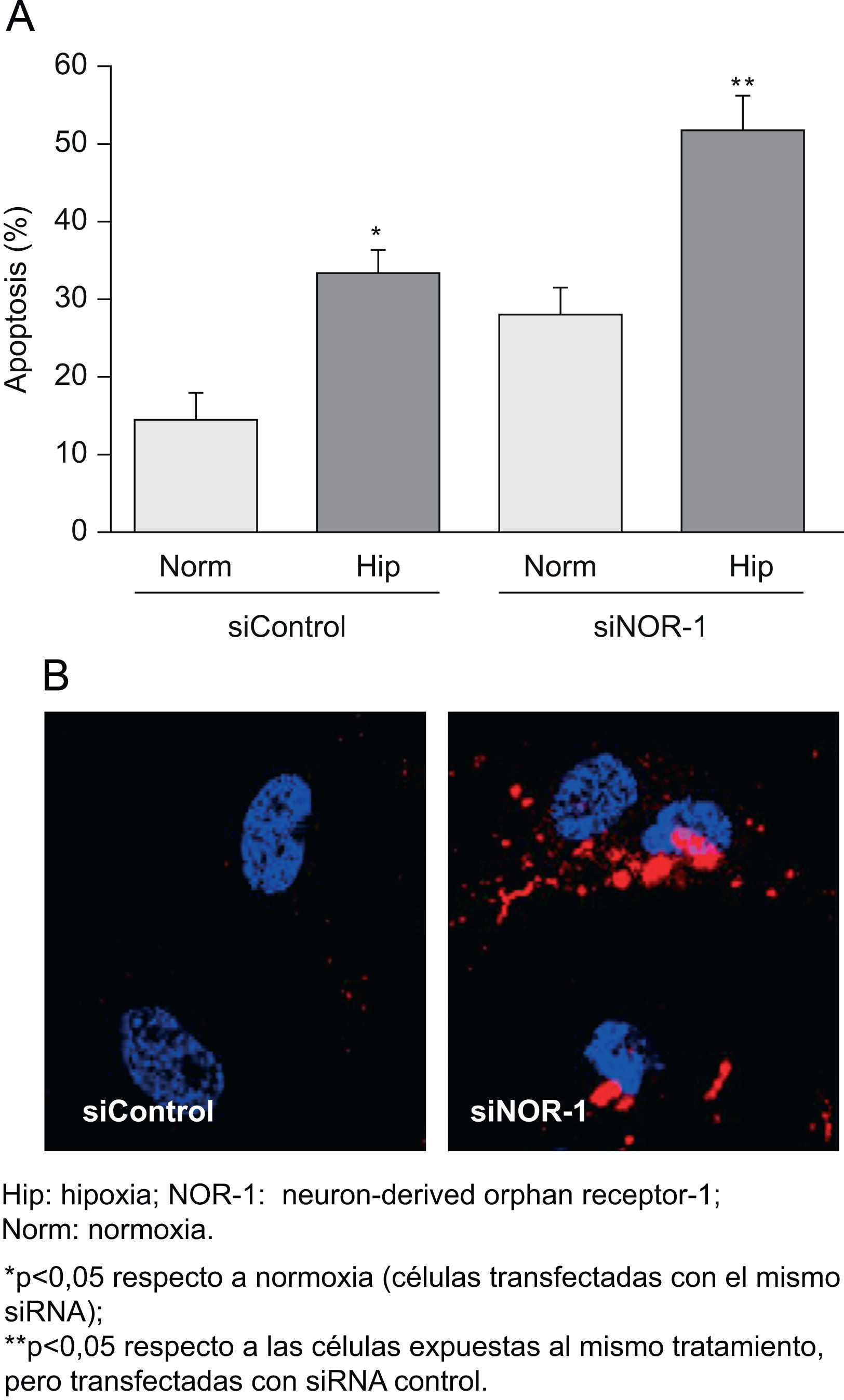
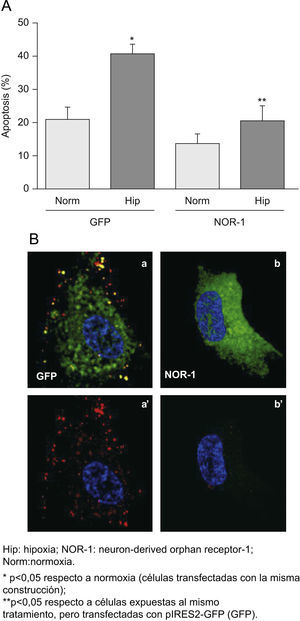
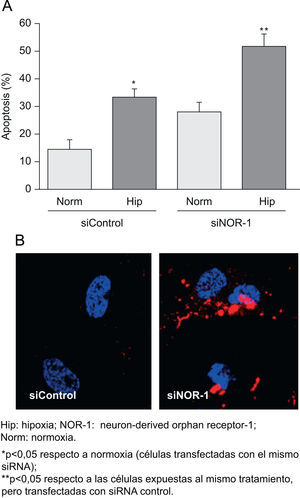
Al sobreexpresar el NOR-1 en CE transfectadas mediante un vector bicistrónico codificante para la EGFP y el NOR-1, se redujo la proporción de células apoptóticas en los cultivos expuestos a hipoxia (fig. 5A). En la figura 5B se muestra una imagen representativa de la microscopia confocal, en la que se aprecia cualitativamente la reducción del marcaje con anexina V en células que sobreexpresan el NOR-1 respecto a las que sólo sobreexpresan la GFP. Por el contrario, al inhibir el NOR-1 mediante siRNA (siNOR-1) incrementó la proporción de CE que experimentaron apoptosis al exponerlas a hipoxia (fig. 6A). En la figura 6B se muestra una imagen representativa de la microscopia confocal en la que se aprecia cualitativamente el aumento del marcaje con anexina V en células en las que se inhibió la expresión del NOR-1 (siNOR-1) respecto a células control transfectadas con si RNA control (siControl).
La sobreexpresión del neuron-derived orphan receptor (NOR-1) reduce la apoptosis de las células expuestas a hipoxia. Células endoteliales humanas de la vena del cordón umbilical que fueron transfectadas con pIRES2-GFP o con el plásmido recombinante que expresa GFP y NOR-1 (pGFP-NOR). A) Porcentaje de células apoptóticas determinada por fluorescence activated cell sorting en células GFP positivas transfectadas con pIRES2-GFP (GFP) o pGFP-NOR (GFP-NOR) y cultivadas en condiciones de normoxia o expuestas a hipoxia (1% de O2) durante 16h. B) Imágenes representativas de la microscopia confocal de células transfectadas con pIRES2-GFP (GFP; a, a’) o pGFP-NOR (NOR-1; b, b’) y expuestas a Hip. Las imágenes a’ y b’ muestran únicamente la unión de anexina v-R-PE (rojo).
La inhibición Hip: hipoxia; NOR-1: neuron-derived orphan receptor-1; Norm: normoxia. de la expresión del neuron-derived orphan receptor-1 (NOR-1) incrementa la apoptosis de las células expuestas a hipoxia (Hip). A) Porcentaje de células apoptóticas en células transfectadas con el siControl o el siNOR-1 y cultivadas en condiciones de normoxia o expuestas a Hip (Hip, 1% de O2) durante 16h. B) Imágenes representativas de la microscopia confocal de las células transfectadas con siControl o siNOR-1 y expuestas a Hip.
Estudios clínicos y experimentales indican que la hipoxia juega un papel relevante en una variedad de patologías como las cardiovasculares, los trastornos hematológicos y pulmonares, y el cáncer9,10. Las lesiones ateroscleróticas presentan áreas con una menor presión parcial de O2, como se ha demostrado utilizando marcadores de hipoxia30. La inmunorreactividad para el HIF-1α en la pared vascular es proporcional al engrosamiento de la íntima arterial31, y tratamientos farmacológicos que reducen el engrosamiento intimal atenúan la presencia del HIF-1α en las lesiones ateroscleróticas32. Por tanto, la hipoxia podría ser crítica en el remodelado vascular asociado al desarrollo de las lesiones ateroscleróticas33. La respuesta transcripcional de las células de los mamíferos a la hipoxia está mediada en gran medida por el HIF2,10, que modula la expresión de múltiples genes que actúan conjuntamente para facilitar el suministro de O2 y de nutrientes y regular la supervivencia y el crecimiento celular. Sin embargo, otros factores de transcripción cooperan en la compleja respuesta de las células a la hipoxia34,35. En los últimos años, se han identificado nuevos genes regulados por la hipoxia36; sin embargo, todavía no se conoce toda la red de factores de transcripción que intervienen en la respuesta celular a la hipoxia. En este trabajo, hemos investigado el papel que juega el factor de transcripción NOR-1 en CE sometidas a hipoxia. El NOR-1 es un receptor nuclear huérfano inducido por diferentes factores de crecimientos y por el VEGF, que modula la actividad y la proliferación de células vasculares7,17–23. En este estudio, mostramos que la hipoxia induce la expresión del NOR-1 mediante un mecanismo dependiente del HIF-1α. Los estudios del aumento de la expresión del NOR-1 y de la inhibición de su expresión sugieren que éste podría ser un factor de transcripción clave para la supervivencia de las CE sometidas a estrés hipóxico.
Hemos observado que la hipoxia induce el NOR-1 en CE vasculares. Un quelante de hierro (DFO) y el CoCl2, dos inhibidores de enzimas dependientes del hierro utilizados habitualmente para analizar la respuesta celular a la hipoxia, también promueven la expresión del NOR-1. La hipoxia aumenta la expresión del NOR-1 de forma dosis y tiempo dependiente a través de un mecanismo en el que interviene el calcio intracelular y en el que no participa la activación de la PKC o la MAPK, mecanismos implicados en la inducción del NOR-1 por otros estímulos como las lipoproteínas de baja densidad7,17–23. Estudios recientes indican que el Ca2+ es crucial en la respuesta celular a la hipoxia37. De hecho, la hipoxia aumenta los niveles de Ca2+ intracelular y se ha demostrado que un ionóforo de calcio A23187 es capaz de inducir la expresión de genes sensibles a la hipoxia38. En células vasculares, la expresión del NOR-1 también es inducida por A23187 y MCF-716,17, y la quelación del calcio intracelular mediante BAPTA-AM revierte el efecto de la hipoxia sobre la expresión del NOR-1. Además, se ha comunicado que la vía de la proteína quinasa iv dependiente de Ca2+/calmodulina (CaM-KIV) regula la actividad transcripcional del NOR-139. En conjunto, estos resultados indican que la movilización de calcio es la clave del aumento de la expresión del NOR-1 por diferentes estímulos, incluida la hipoxia.
La respuesta celular a la hipoxia está mediada, al menos en parte, por el VEGF, una citoquina inducida por la hipoxia3 que modula la expresión de un gran número de genes, entre ellos NOR-16–8, y que regula múltiples actividades biológicas4,10. Sin embargo, la incubación de CE con anticuerpos contra el VEGF o el SU5614 (un inhibidor del receptor-2 del VEGF) no previno la inducción del NOR-1 por hipoxia. Además, en nuestras condiciones experimentales, la hipoxia no activó significativamente al CREB (datos no mostrados), un factor de transcripción clave en la estimulación de la expresión del NOR-1 por el VEGF7. Por tanto, en la inducción del NOR-1 por hipoxia no interviene CREB, ni participa la secreción autocrina del VEGF. Por el contrario, tanto la inhibición de la vía PI3K/Akt o de su diana mTOR, vía que conduce a la activación del HIF-140, como la inhibición directa del HIF-1α mediante siRNA específicos disminuyeron significativamente el aumento de los niveles de RNA mensajero del NOR-1 en respuesta a la hipoxia. La hipoxia incrementó la actividad del promotor del NOR-1, lo que también se observó en condiciones de normoxia al cotransfectar con el plásmido de expresión HIF-1α. Mediante deleciones seriadas del promotor de NOR-1 y mutagénesis dirigida, demostramos que el HIF-1 incrementa la actividad transcripcional del NOR-1 a través de un HRE. Finalmente, analizamos si el NOR-1 intervenía en la respuesta de supervivencia-apoptosis desencadenada por la hipoxia en las CE. Para ello determinamos la proporción de células apoptóticas en los experimentos en los que incrementamos la expresión del NOR-1 mediante un plásmido bicistrónico recombinante, o bien inhibimos su expresión con siRNA específicos (siNOR-1)22. De este modo, demostramos que el aumento de la expresión del NOR-1 disminuye la proporción de CE que experimentan apoptosis al exponerlas a hipoxia, mientras su inhibición aumenta la tasa de apoptosis. Por tanto, el NOR-1 parece ser un factor de transcripción relevante para prevenir la apoptosis de las CE expuestas a hipoxia.
Se ha relacionado al NOR-1, como a los otros miembros de la subfamilia NR4A (Nurr1 y Nur77), con distintos procesos celulares como la apoptosis15, la diferenciación28,41 y la proliferación celular7,17–23. A pesar de que estos receptores son muy homólogos entre sí y de que parecen ser redundantes en algunos sistemas15, estudios recientes sugieren que podrían jugar papeles opuestos. De hecho, la inhibición o ablación genética del NOR-1 reduce la proliferación de células vasculares7,17–23; por el contrario, el Nur77 se ha asociado tanto con la promoción como con la inhibición de la proliferación de las células vasculares8,21,25,42. De igual modo, se ha descrito que el Nur77, que participa en la inducción de la activación de la apoptosis en timocitos inmaduros y en hibridomas de células T43,44, también regula la supervivencia de los fibroblastos de embriones de ratón45. Respecto a la isquemia-hipoxia, se ha descrito el aumento de la expresión del NOR-1, el Nurr1 y el Nur77 después de un evento isquémico cerebral29,46. El Nur77, el receptor de la subfamilia NR4A más estudiado, se induce por hipoxia/HIF-1 en varias líneas celulares cancerígenas47–49 y es capaz de interaccionar y estabilizar a HIF-1α48. También se ha descrito que la activación del Nur77 por la 6-mercaptopurina aumenta la actividad transcripcional del HIF-1α que conduce a la formación de nuevos vasos49. Nuestros resultados preliminares indican que la inhibición del NOR-1 no afecta significativamente a la formación de angiotubos (resultados no publicados). Por tanto, aunque tanto el NOR-1 como el Nur77 pueden ser esenciales en la respuesta de las CE a la hipoxia, probablemente juegan papeles diferentes.
En resumen, nuestros resultados indican que el NOR-1 es un factor de transcripción relevante para la supervivencia de las CE sometidas a hipoxia. Actualmente, se dispone de poca información acerca de los genes controlados por los receptores de la subfamilia NR4A y no se conocen los genes regulados por el NOR-1 en las CE sometidas a hipoxia. Se necesitan más estudios para determinar cómo el NOR-1 y los demás miembros la subfamilia NR4A cooperan con el HIF-1 en el complejo mecanismo por el que se controla la respuesta adaptativa de las células de los mamíferos a la hipoxia.
FinanciaciónEste trabajo ha sido posible gracias a las subvenciones del Ministerio de Educación y Ciencia (SAF2006-07378), el Ministerio de Sanidad-Instituto de Salud Carlos III (Red Temática de Investigación Cardiovascular RECAVA [RD06/0014/0027] y PI061480) y la Fundación Española de Arteriosclerosis-Sociedad Española de Arteriosclerosis (beca de investigación básica 2006). Una comunicación referente a esta línea de trabajo, titulada «El eje NOR-1-HIF-1 regula la supervivencia de las CE sometidas a hipoxia» fue presentada en el XXII Congreso Nacional de la Sociedad Española de Arteriosclerosis Madrid 2008 y galardonada con una mención especial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Dr. Naganari Ohkura y al Dr. L. Eric Huang por su generosidad al proporcionarnos los plásmidos pNORα/-1703 y pCDNA3-HIF-1α, respectivamente. También damos las gracias a Esther Peña por su ayuda con la microscopia confocal.