Evaluar los cambios ultraestructurales de los vasos coriorretinianos en conejos hipercolesterolémicos tratados con estatinas.
MétodosSe utilizaron conejos New Zealand que fueron divididos en 4 grupos: control (G0; n=10), conejos alimentados con una dieta estándar durante 8 meses. Grupo hipercolesterolémico (G1, n=8), conejos alimentados con una dieta enriquecida con 0,5% de colesterol durante 8 meses. Grupo hipercolesterolémico más Fluvastatina sódica (G2A, n=4). Grupo hipercolesterolémico más Pravastatina sódica (G2B, n=4).
Grupo estatinas (G2A y B, n=8), conejos alimentados con una dieta enriquecida con 0,5% de colesterol durante 8 meses más la administración de fluvastatina sódica o pravastatina sódica a una dosis de 2mg/kg/d. Los ojos fueron procesados para microscopía electrónica de trasmisión.
ResultadosG1 tenía una gran cantidad de lípidos en la supracoroides que comprimían las capas vasculares coroideas. En G2 las células espumosas y los lípidos de la supracoroides y de las capas vasculares coroideas habían disminuido de forma considerable, aunque había más fibras de colágeno. Las luces de los vasos coroideos estaban más abiertas en G2 que en G1, estando en estos últimos casi colapsadas debido a la compresión y a la hipertrofia de las células musculares lisas y de las células endoteliales. La apariencia normal del endotelio vascular en G2 contrastaba con la necrosis observada en G1. En G2 el espesor de la membrana de Bruch y de las membranas basales de los vasos retinianos y coroideos estaba reducido en comparación con G1.
ConclusionesEl tratamiento con estatinas reduce la cantidad de lípidos y de macrófagos de la coroides. Además, protege a las células endoteliales y mantiene abiertas las luces de los vasos coroideos.
To evaluate the ultra-structural changes of the chorioretinal vessels in hypercholesterolemic rabbits after treatment with statins.
MethodsNew Zealand rabbits were divided into four groups: Control (G0; n=10), and fed a standard diet for 8 months; Hypercholesterolemic (G1, n=8), were fed a 0.5% cholesterol-enriched diet for 8 months. Statins group (G2A y B, n=8), were each fed a 0.5% cholesterol-enriched diet for 8 months plus administration of fluvastatin sodium (G2A) or pravastatin sodium (G2B) at a dose of 2mg/Kg/day. Eyes were processed by transmission electron microscopy.
ResultsG1 had a buildup of lipids at the suprachoroidea that compressed the vascular layers. G2 had a substantial decrease in the number of foam cells and lipids but more collagen fibres in the suprachoroidea and vascular layers. The lumen of the choroidal vessels was opened more in G2 in comparison with G1, which had a reduction in the capillary lumen to the point of collapse due to compression and hypertrophy of endothelial and vascular smooth muscle cells. The normal appearance of endothelial cells in G2 was in contrast with the endothelial necrosis observed in G1. In G2, the thickness of the Bruch membrane and the basal membrane of the choroidal and retinal vessels were reduced in comparison with G1.
ConclusionsTreatment with statins reduces the build up of lipids and the number of macrophages in the choroid. Additionally, they preserve the endothelial cells and open the vascular lumens of choroidal vessels.
Las enfermedades crónicas son la principal causa de muerte en los países desarrollados, constituyendo su problema de salud más prevalente y el origen de la mayor parte de las discapacidades y por consiguiente, de las necesidades asistenciales de los individuos que las padecen. En este sentido, y en relación con los problemas oculares en el mundo occidental, los casos de ceguera en la edad adulta obedecen a la retinopatía diabética y las enfermedades del nervio óptico; y entre los mayores, a la degeneración macular asociada a la edad (DMAE), el glaucoma y la catarata.
Todas las enfermedades crónicas se hallan vinculadas a determinados factores de riesgo, siendo de gran interés conocer su magnitud y evolución, en especial para los de carácter modificable, por ser el objetivo principal de las estrategias preventivas.
Los estudios epidemiológicos muestran una asociación entre las lesiones vasculares retinianas y la incidencia de lesiones a otro nivel que parecen estar ligadas, más que a las lesiones macrovasculares, a factores comunes de afectación microvascular, cuyo papel, tanto en la cardiopatía isquémica como en el ictus, podría ser mayor del sospechado.
Son bien conocidas las consecuencias de la hipercolesterolemia en la cardiopatía isquémica y la patología cerebrovascular, pero no ocurre lo mismo con las repercusiones funcionales que de ella se derivan a nivel ocular, entre otras cosas, porque tampoco son muy conocidos los cambios estructurales a que puede dar lugar. Estudios clínicos han sugerido que la hiperlipemia, por sí misma, podría generar cambios estructurales en el sistema vascular coroideo y retiniano que secundariamente con el tiempo, podrían originar disfunción retiniana1,2.
En recientes trabajos se ha demostrado la posible relación entre la degeneración DMAE, la principal causa de ceguera en mayores de 65 años en los países industrializados, y los niveles altos de colesterol3,4. Además, durante los últimos 10 años se han señalado los beneficios del uso de fármacos hipolipemiantes para disminuir el riesgo de desarrollar una DMAE5. Entre ellas, destacan las que además de reducir los niveles de colesterol, poseen la capacidad de mejorar la función vascular6.
La retina de los mamíferos posee una doble vascularización: la retiniana propiamente dicha y la derivada de los vasos coroideos. La coroides es un tejido vascular situado entre la esclera y la retina. La supracoroides la separa de la esclera y la membrana de Bruch, una estructura formada fundamentalmente por tejido elástico y colágeno la separa de la retina externa avascular. La coroides está formada por vasos de calibre decreciente desde la capa de grandes vasos, junto a la supracoroides, hasta la coriocapilar formada por capilares fenestrados adyacentes a la membrana de Bruch.
El objetivo del presente trabajo fue demostrar, en un modelo experimental de conejos hiperlipémicos, cómo el uso de estatinas puede disminuir las alteraciones vasculares oculares. Con ese fin se analizó la ultraestructura de la coroides y la retina en dichos animales.
Material y métodosAnimales de experimentaciónPara la realización de este trabajo se utilizaron como animales de experimentación 26 conejos machos New Zealand White, de 2,5±0,5kg de peso (3 meses de edad). Los animales, suministrados por Biocentre S.A. (Barcelona, España), fueron mantenidos en jaulas individuales y en una habitación acondicionada bajo un ciclo de luz-oscuridad de 12h. Todos los conejos fueron alimentados con una dieta estándar (Panlab S.L. Barcelona, España) durante al menos 7 días antes de comenzar el experimento. El agua estaba disponible «ad libitum» y la ingestión de alimentos fue monitorizada diariamente en todos los grupos.
Los animales se subdividieron en 4 grupos: grupo control (G0, n=10), alimentado con una dieta estándar durante 8 meses, tras los cuales fueron sacrificados; grupo hipercolesterolémico (G1, n=8) alimentados con una dieta estándar enriquecida con 0,5% de colesterol (UAR, París, Francia) durante 8 meses; grupo estatinas (G2A y B, n=8) alimentados con una dieta estándar enriquecida con 0,5% de colesterol (UAR, París, Francia) más la administración de Fluvastatina sódica (G2A, n=4) (Novartis; Farmaceútica, Barcelona, España) o Pravastatina sódica (G2B, n=4) (Bristol-Myers Squibb, Madrid, España), a la dosis de 2mg/kg/d durante 8 meses siendo sacrificados tras dicho periodo de tiempo.
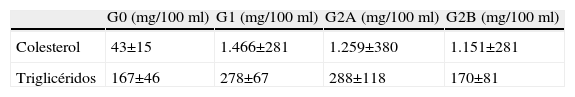
El peso de los animales se determinó antes de comenzar el tratamiento y posteriormente una vez al mes durante el estudio. El consumo de la dieta fue controlado diariamente. Al comienzo del experimento y 1 vez al mes hasta la finalización del mismo, se tomaron muestras de sangre de la vena marginal de la oreja para determinar las concentraciones sanguíneas de colesterol total, lipoproteínas de alta densidad (HDL) y lipoproteínas de baja densidad (LDL). Dicha cuantificación se realizó mediante una reacción colorimétrica utilizando un equipo enzimático comercial (BioMerieux, Francia) (tabla 1).
Valores séricos de lípidos en los grupos de estudio
| G0 (mg/100ml) | G1 (mg/100ml) | G2A (mg/100ml) | G2B (mg/100ml) | |
| Colesterol | 43±15 | 1.466±281 | 1.259±380 | 1.151±281 |
| Triglicéridos | 167±46 | 278±67 | 288±118 | 170±81 |
G0: Control (n=10); G1: Grupo hipercolesterolémico (n=8) alimentados con una dieta estándar enriquecida con 0,5% de colesterol; G2: Grupo estatinas (n=8) alimentados con una dieta estándar enriquecida con 0,5% de colesterol más la administración de Fluvastatina sódica (G2A, n=4) o Pravastatina sódica (G2B, n=4).
Todos los experimentos fueron aprobados por el comité para la experimentación animal (CEA) de la Universidad Complutense, de acuerdo con el Real Decreto 223/198 sobre protección de los animales utilizados para experimentación y otros fines científicos.
Fijación y procesamiento de los tejidosLos animales fueron anestesiados con pentobarbital sódico (25mg/kg i.v.) y perfundidos a través de la carótida interna con glutaraldehido al 2% en tampón fosfato 0,1M pH 7,4.
Tras el sacrificio de los animales se extrajeron los globos oculares. Inmediatamente tras la extracción se eliminó la córnea y el cristalino y se fijaron por inmersión durante 5h en glutaraldehido al 2% en tampón fosfato 0,1M pH 7,4 a 4°C. A continuación, los globos oculares se lavaron en tampón fosfato 0,1M y se cortaron en piezas muy pequeñas que incluían esclera, coroides y retina para su estudio a microscopía electrónica. Los fragmentos fueron posfijados en tetróxido de osmio en tampón fosfato 0,1M durante 2h a 4°C. Las piezas se deshidrataron en acetonas de concentración creciente y finalmente fueron incluidas en araldita. Una vez tallados los bloques, se procesaron para la realización de cortes semifinos y finos mediante el ultramicrotomo Reichert OM-V3 (Leica Microsystem, Alemania). Los cortes semifinos se tiñeron con azul de toluidina. Los cortes finos fueron contrastados con acetato de uranilo y citrato de plomo, para su posterior observación en el Microscopio Electrónico ZEISS 902 del Centro de Microscopía Electrónica «Luis Brú» de la Universidad Complutense de Madrid.
ResultadosLos conejos hipercolesterolémicos (G1) presentaban unos altos niveles plasmáticos de lípidos con respecto al grupo control (G0). Los animales tratados con estatinas (G2A y B) presentaban unos niveles plasmáticos de lípidos semejantes a los del grupo hipercolesterolémico (G1) (tabla 1).
En los animales tratados con estatinas (fluvastatina sódica y pravastatina sódica) los hallazgos encontrados fueron similares. Por este motivo, los resultados de este grupo de estudio se describen de forma conjunta.
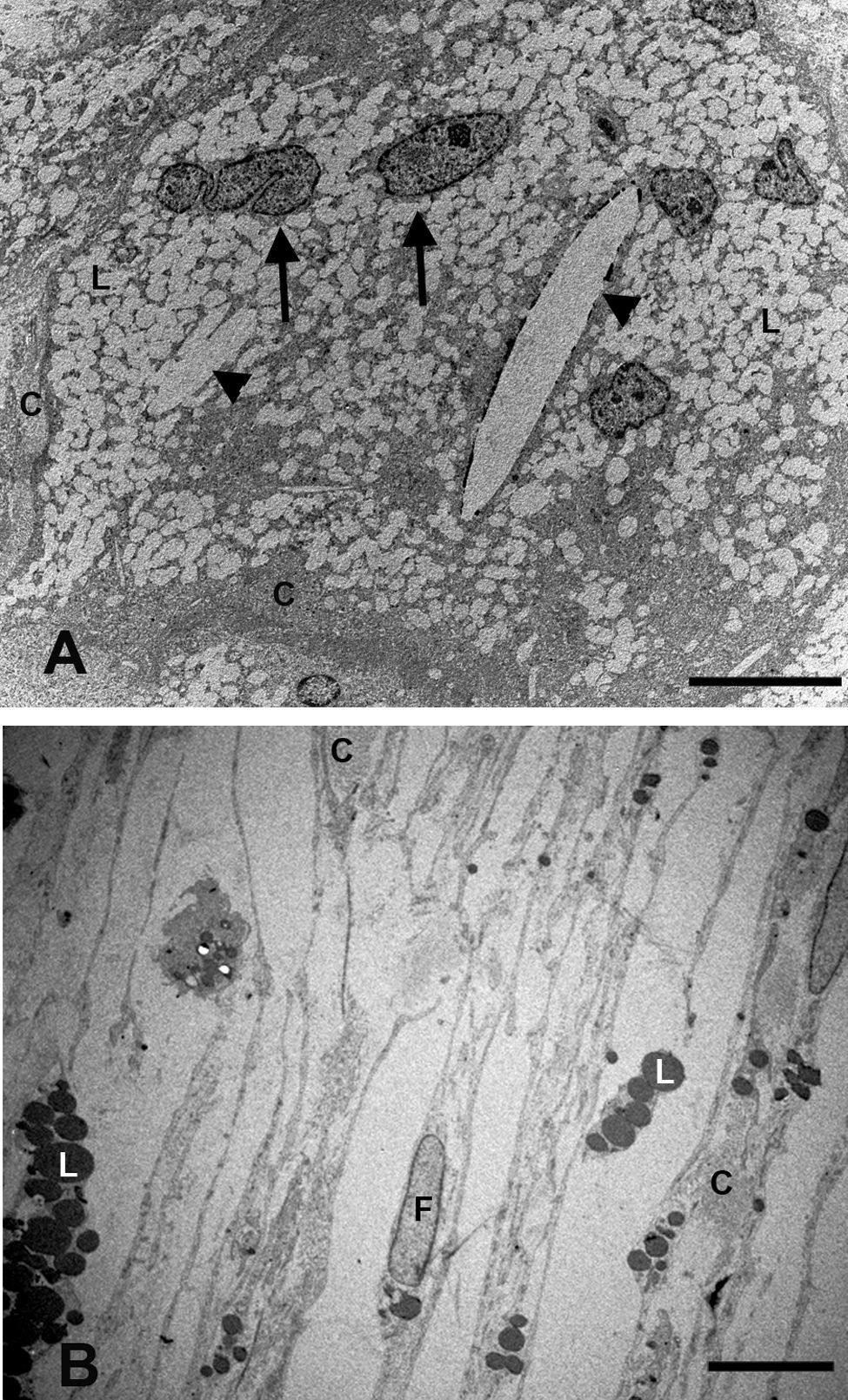
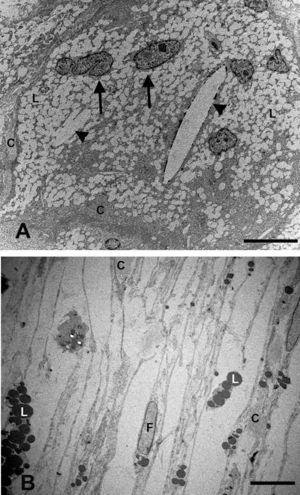
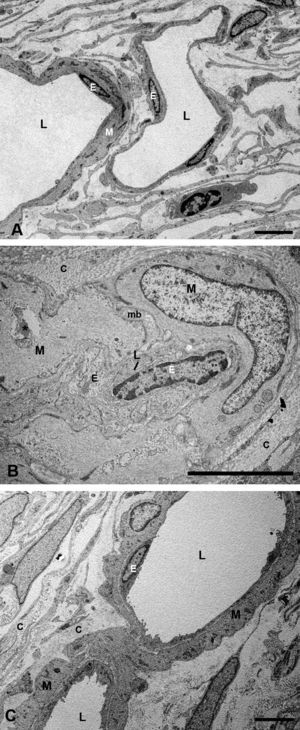
Ultraestructura de la coroidesSupracoroidesEn los conejos del grupo G1 (hipercolesterolémicos) la zona de transición entre esclera y la capa vascular coroidea sufrió grandes cambios con respecto al grupo G0 (control). La supracoroides mostraba una gran distensión debido al acúmulo de lípidos. Se observa una gran cantidad de células espumosas en cuyo citoplasma se acumula una gran cantidad de lípidos. Entre las células se observan fibras de colágeno y cristales de colesterol (fig. 1A). Sin embargo en los animales tratados con estatinas (G2A y B, experimentales) en general había menos lípidos en esta capa, observándose escasas células espumosas y pocos cristales de colesterol. Dichos hallazgos contribuían a una menor distensión de este espacio y por lo tanto, a una menor compresión de las capas vasculares de la coroides (fig. 1B). Este acúmulo en el G1 ejercía un desplazamiento de las estructuras vecinas que se traducía en una compresión de los espacios supracoroideos contra la esclera y un rechazo de toda la capa vascular de la coroides contra la membrana de Bruch (fig. 2B).
Microscopía electrónica de la supracoroides. A) conejos hipercolesterolémicos. Se observa una gran cantidad de células espumosas (flechas) en cuyo citoplasma se acumula una gran cantidad de lípidos. Entre las células se observan fibras de colágeno y cristales de colesterol (cabeza de flecha). B) En los animales tratados con estatinas, disminuyen las células espumosas y los lípidos se localizan principalmente dentro de los fibroblastos (F). (L: lípidos; C: colágeno) (B: animal tratado con Fluvastatina sódica). Barra: 10μm.
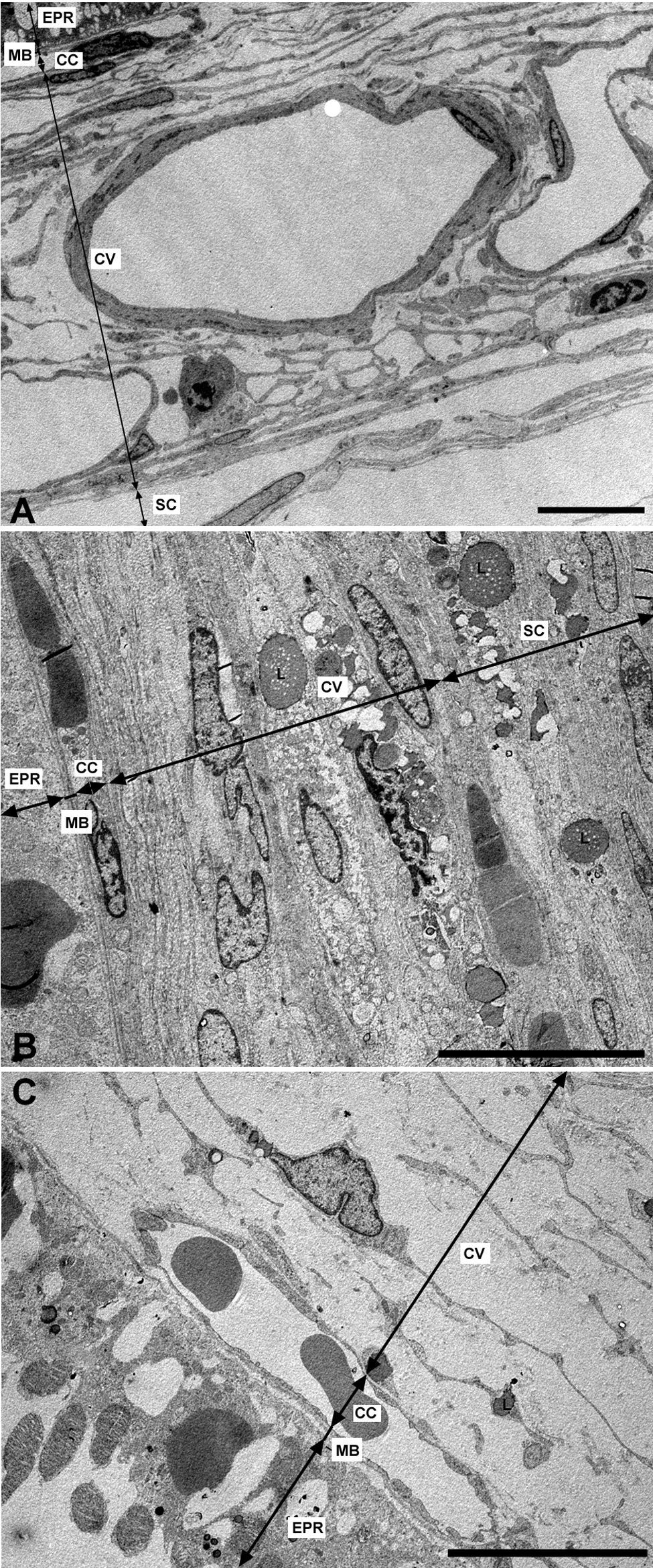
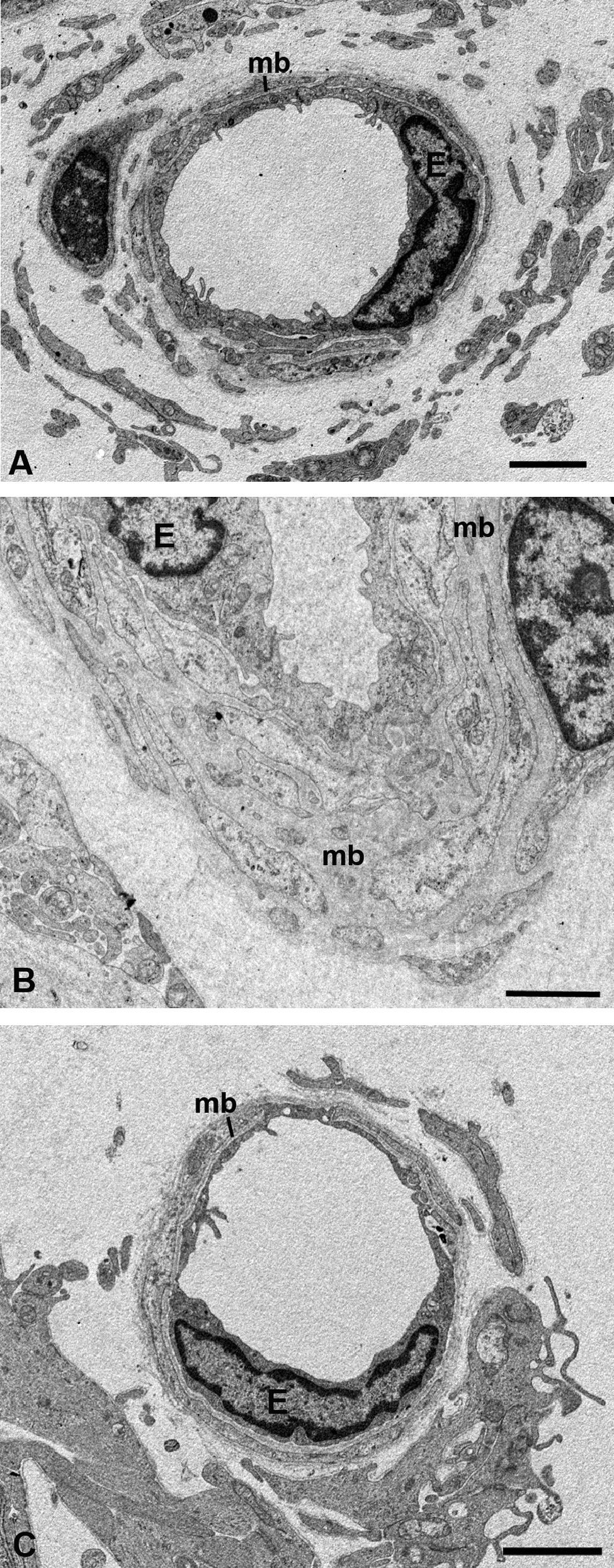
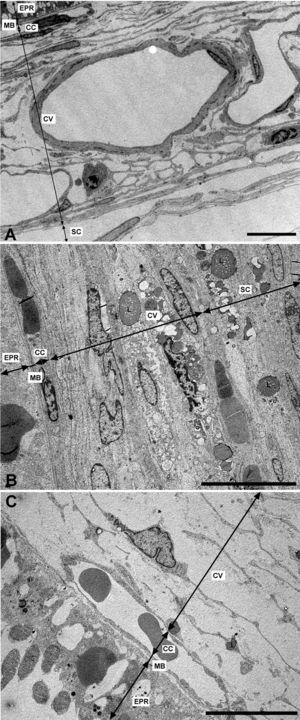
Microscopía electrónica de las capas de los grandes vasos, vasos medianos y coriocapilar. A) Estructura esponjosa de la coroides en los animales control. B) En el grupo de conejos hipercolesterolémicos las luces de los vasos sanguíneos están reducidas hasta el punto de colapsarse en algunas zonas. C) En los animales tratados con estatinas las luces vasculares están abiertas. (CC: coriocapilar; CV: capa de grandes vasos y medianos; EPR: epitelio pigmentario de la retina; L: lípidos; MB: membrana de Bruch; SC: supracoroides. (C: animal tratado con Fluvastatina sódica). Barra: 10μm.
En los conejos del G1 en la supracoroides y cerca de la zona de los grandes vasos coroideos, se apreciaba la existencia de células que por las características de la cromatina nuclear y el contenido de su citoplasma, podrían corresponder a macrófagos cargados de lípidos (células espumosas) (fig. 1A). Entre estas células se observaron fibrillas de colágeno que se agrupaban formando lamelas y fibras elásticas. Además, había estructuras alargadas, más o menos fusiformes y perfectamente delimitadas, que podrían corresponderse con cristales de colesterol (fig. 1A).
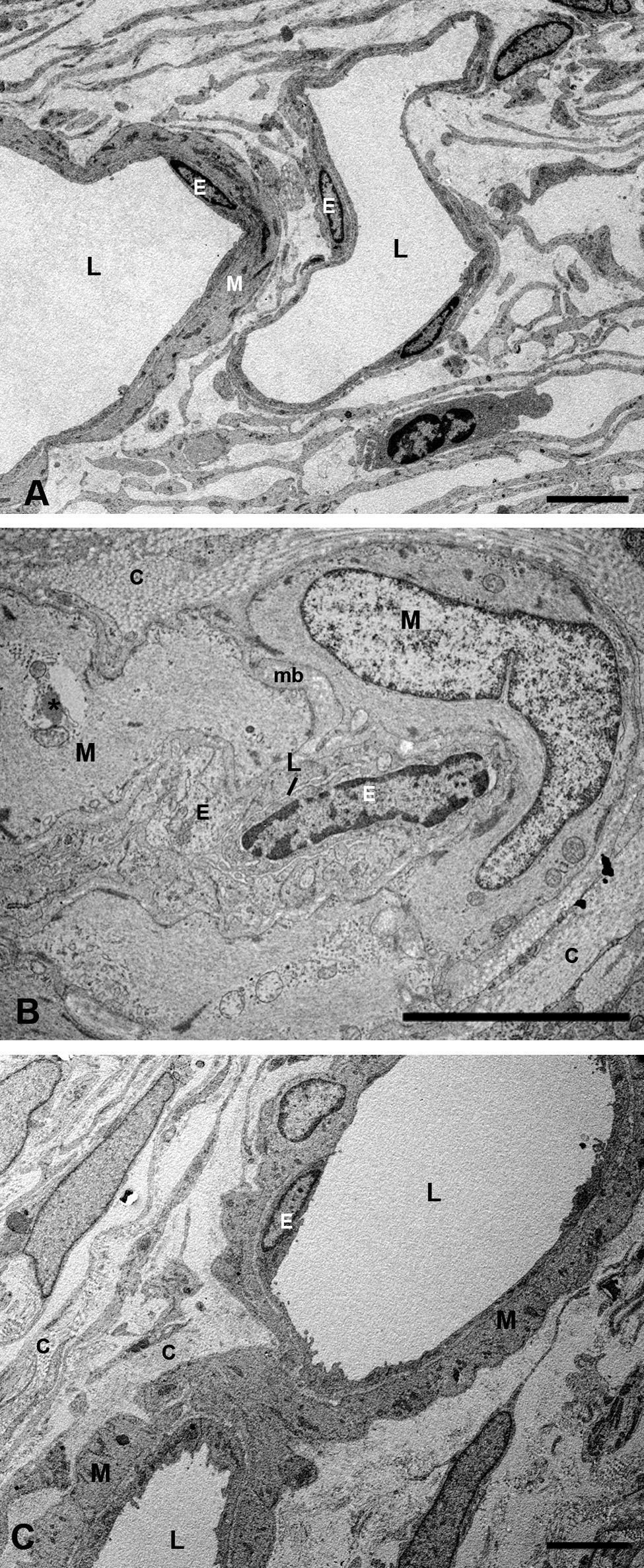
Capa de vasos grandes y medianosEn los conejos del G1 estos vasos presentaban un gran estrechamiento de su luz, que era irregular y estaba totalmente colapsada en algunas zonas (figs. 2B y 3B). Mientras que en los animales tratados con estatinas (G2A y B) las luces vasculares eran semejantes a las del GO (figs. 2C y 3A,C), así las luces vasculares están abiertas (fig. 2C y 3C). En los animales del G1 se encontró que algunas células endoteliales y musculares estaban hipertrofiadas mientras que otras estaban necróticas y contenían material lipídico. Sin embargo en los animales tratados con estatinas (G2A y B) el endotelio se encontraba muy conservado desapareciendo los signos de necrosis casi por completo (fig. 3C). Las células musculares estaban muy parecidas a las del G0 aunque se apreciaba alguna inclusión de lípidos (fig. 3A,C). En la adventicia los lípidos habían disminuido con respecto al grupo G1, observándose, sin embargo, una mayor cantidad de fibras de colágeno que en el G0 (fig. 3A,C) las luces vasculares, las musculares lisas, las endoteliales y la membrana basal eran más parecidas a las del grupo control que a la de los animales hipercolesterolémicos (fig. 3A–C). En el G1 la membrana basal estaba engrosada, presentando lípidos en su interior (fig. 3B). En este grupo en el espacio intervascular, también se apreciaba mayor contenido en colágeno y fibroblastos así como la presencia de células espumosas (figs. 2B y 3B).
Microscopía electrónica de las capas de los grandes vasos y vasos medianos. A) Animales control. B) En los conejos hipercolesterolémicos las luces vasculares están estrechadas, se observa la hipertrofia de las células musculares lisas y necrosis o hipertrofia de las células endoteliales. La membrana basal está engrosada. C) En los animales tratados con estatinas las luces vasculares, las musculares lisas, las endoteliales y la membrana basal eran más parecidas a las del grupo control que a la de los animales hipercolesterolémicos. (C: colágeno; E: célula endotelial; M: célula muscular lisa; mb: membrana basal; L: luz vascular; *: Lípido). (C: animal tratado con Fluvastatina sódica). Barra: 5μm.
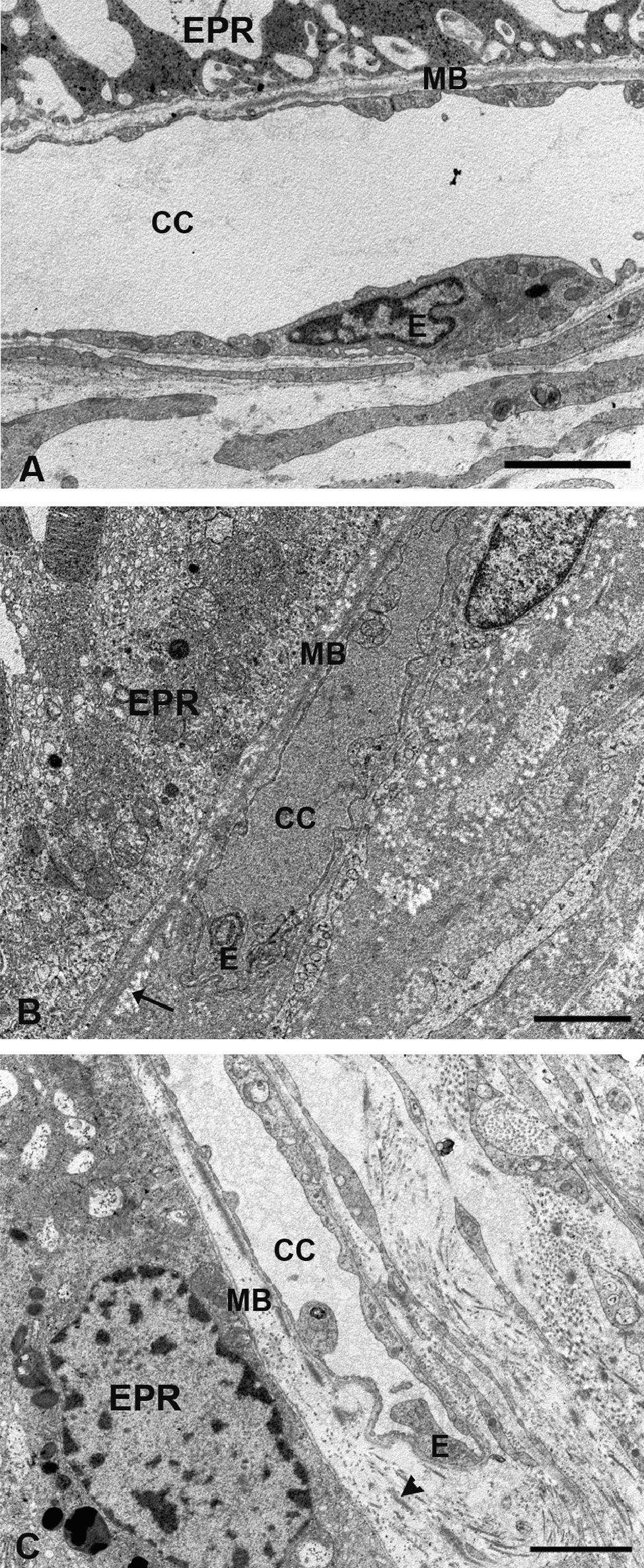
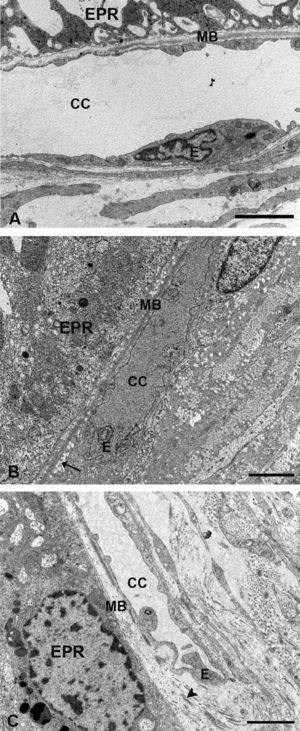
En el G1 en general la coriocapilar estaba completamente rechazada contra la membrana de Bruch, con las luces vasculares muy estrechadas y en ocasiones obliteradas (fig. 2B). Muchas células endoteliales estaban necróticas, mientras que otras presentan rarefacciones que contribuían a la reducción del lumen vascular (fig. 4B). En los animales tratados con estatinas (G2A y B) las luces de los capilares estaban abiertas y el endotelio de la coriocapilar no presenta signos de necrosis (fig. 4C).
Microscopía electrónica de la coriocapilar y de la membrana de Bruch. A) Grupo control. B) En los animales hipercolesterolémicos se observa la necrosis de las células endoteliales de la coriocapilar y lípidos en la membrana de Bruch (flecha). C) Animales tratados con estatinas el endotelio de la coriocapilar no presenta signos de necrosis. No se observan lípidos en la membrana de Bruch pero las fibras de colágeno son más gruesas (cabeza de flecha). (CC: coriocapilar; E: célula endotelial; EPR: epitelio pigmentario de la retina; MB: membrana de Bruch). (C: animal tratado con Pravastatina sódica). Barra: 2μm.
Se observaba un aumento generalizado de su espesor con respecto al grupo control debido, fundamentalmente, al acumulo de lípidos (fig. 4A,B). En los animales tratados con estatinas (G2A y B) el espesor de la membrana de Bruch era similar al control debido fundamentalmente a la gran disminución de los lípidos. Sin embargo, el tamaño de las fibras de colágeno era mayor (fig. 4A,C).
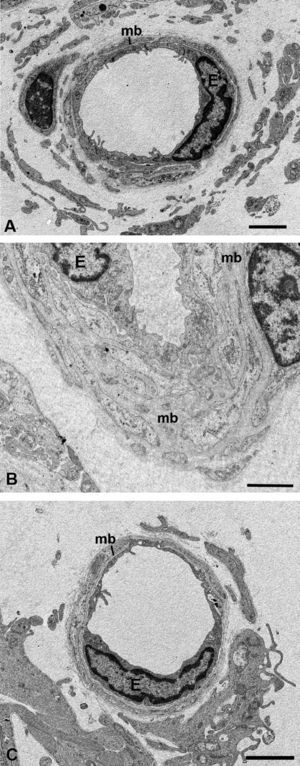
Ultraestructura de la retinaTanto los vasos localizados en la capa de fibras del nervio óptico (FNO) como los situados a nivel del vítreo no presentaban grandes alteraciones estructurales, sin embargo, se podía apreciar un aumento del espesor de su membrana basal en los conejos del G1 con respecto al control (fig. 5A,B). En el G1 los vasos retinianos presentaban una estructura semejante a la del grupo control (fig. 5A,C).
Microscopía electrónica de los capilares del humor vítreo. A) Animales control. B) Conejos hipercolesterolémicos. La membrana basal está engrosada con respecto al grupo control. C) En el grupo tratado con estatinas la membrana basal era semejante a la del grupo control. (E: célula endotelial; mb: membrana basal). (C: Pravastatina sódica). Barra: 2μm.
Aunque existen distintos modelos animales para estudiar los efectos de las hiperlipemias sobre los tejidos, quizá el más utilizado, sobre el que más se ha escrito y por lo tanto, se tiene más experiencia, sea el conejo. Esta circunstancia no es solo debida a que el animal sea más manejable, sino fundamentalmente a que el conejo presenta unas características del metabolismo lipídico muy parecidas a las del hombre. Sirva como ejemplo la forma en que el conejo elimina el exceso de colesterol de los tejidos periféricos. Tras su incorporación a las HDL, se forma una lipoproteína HDL-con Apo E que permite el paso desde la circulación sanguínea hasta el hepatocito receptor en el hígado. Esta forma de transporte del colesterol es similar a la del humano7.
La administración de una dieta enriquecida con 0,5% de colesterol durante 8 meses produjo una acusada hiperlipemia en nuestros conejos New Zealand8–10. A nivel ocular, una de las manifestaciones más notable de los conejos hipercolesterolémicos fue la gran cantidad de lípidos acumulados en los espacios supracoroideos. Este hallazgo, descrito ya por otros autores9,11,12 producía un efecto mecánico compresivo sobre los tejidos vecinos, con la consiguiente reducción de flujo sanguíneo tanto a nivel de los vasos coroideos como de la propia coriocapilar. Con el tiempo, el estrechamiento de la luz vascular produce cambios en el flujo sanguíneo que conducen a una disfunción endotelial13 y como consecuencia de esta, a una disminución en la producción de óxido nítrico (NO). Se genera así un entorno que favorece la formación de lesiones ateroscleróticas y la atracción e infiltración de monocitos7,14, que seguidamente migrarán al espacio subendotelial donde se transformarán en macrófagos y posteriormente en células espumosas15.
Los macrófagos o las células espumosas, una vez saturados por los lípidos y antes o después de su muerte, pueden liberar una serie de productos, como el colesterol (esterificado y oxidado), que pueden producir un mayor daño endotelial, favoreciendo la progresión de la lesión aterosclerótica y estimulando la proliferación y activación de células musculares lisas16,17 con la consiguiente remodelación del colágeno9,18. En nuestras preparaciones, estos efectos serían los responsables de las variaciones en las fibras colágenas y elásticas observadas en las paredes vasculares y en los espacios intervasculares.
Los depósitos subintimales de células espumosas en la capa de grandes vasos coroideos (cuyo diámetro puede llegar hasta las 90μm) y el incremento de colágeno a nivel de las arteriolas coroideas (20–40μm de diámetro) podrían dar lugar a la lipohialinosis arteriolar. Ambas manifestaciones vasculares, descritas por nuestro grupo en trabajos previos8–10, podrían coincidir con la denominada enfermedad de pequeño vaso de la aterosclerosis cerebral.
La membrana de Bruch de los conejos hipercolesterolémicos presentaba un aumento generalizado de su espesor debido fundamentalmente a un acumulo de lípidos8,10. Dicho acumulo podría interferir con el libre intercambio metabólico entre la coriocapilar y el epitelio pigmentario retiniano, pudiendo contribuir a la pérdida de la sensibilidad retiniana.
Una peculiaridad de la vascularización retiniana en el conejo, es que los vasos adoptan una posición epiretiniana y solo unos pocos capilares penetran en el parénquima19. En nuestros conejos hiperlipémicos, ni los vasos intrarretinianos ni los localizados a nivel del vítreo presentaban grandes alteraciones estructurales, pero sí se observaba un ligero aumento en el espesor de la membrana basal. Este engrosamiento de la basal podría dificultar el paso de oxígeno y nutrientes hacia el tejido nervioso retiniano así como la eliminación de productos de desecho, provocándose una situación de isquemia prolongada8,10,20. Dicha situación puede dar lugar a un aumento de la concentración extracelular de glutamato capaz de producir daño oxidativo a las neuronas por mecanismos citotóxicos8,10,21,22.
En un estudio previo realizado por nuestro grupo en el mismo modelo de conejo hipercolesterolémico utilizado en este trabajo, tras 8 meses de dieta enriquecida en colesterol los animales fueron alimentados con dieta estándar durante 6 meses más en un intento de frenar el proceso aterosclerótico. El análisis de los resultados reveló que la introducción de dieta estándar normalizaba los lípidos en sangre y eliminaba la mayoría de los acúmulos de lípidos en la porción posterior del globo ocular, sin embargo no se producía una reversión de los daños inducidos por el colesterol a nivel vascular, persistiendo cambios ultraestructurales compatibles con una isquemia crónica9. Entre estos cambios se encontraban un aumento de las fibras de colágeno. Se sabe que la reabsorción de colesterol libre y esterificado es seguida por una intensa actividad esclerogénica23 debida a la capacidad del colesterol y sus esteres de inducir inflamación.
Sabemos que la inflamación crónica es la respuesta de un tejido ante una lesión local de duración prolongada en la que se producen simultáneamente una inflamación activa, una destrucción del tejido y un intento de reconstrucción o fibrosis. Por tanto, la interacción entre los distintos factores sistémicos y locales, en este caso, el nivel de lípidos en el plasma y el daño tisular generado, serán los que determinen si los macrófagos serán células espumosas que conducirán a la progresión de la lesión o por el contrario, efectivas células eliminadoras que llevarán a la regresión de las mismas.
Sabemos que las lesiones ateroscleróticas pueden sufrir regresión en animales de experimentación como es el caso de los conejos, perros y primates no humanos24, y la falta de progresión o incluso la regresión, puede ocurrir en humanos, especialmente tras la llegada de las recientes opciones terapéuticas25.
Basado en nuestra experiencia previa sobre la ineficacia de la normalización de la dieta en la interrupción del proceso ateroesclerótico9, el G2 (A y B) del presente estudio se trató con fluvastatina sódica (G2A) o pravastatina sódica (G2B) a una dosis de 2mg/kg/d durante los 8 meses de alimentación con dieta enriquecida en colesterol en un intento de frenar el proceso ateroesclerótico. Las estatinas, además de reducir los niveles plasmáticos de colesterol, pueden inducir la regresión de la aterosclerosis26,27. La dosis utilizada en nuestro estudio es escasamente hipolipemiante, pero interesantemente contribuye a mejorar la relajación dependiente de endotelio tanto en la aorta como en las arterias femorales en conejos hipercolesterolémicos27,28. En el presente trabajo, esta dosis indujo cambios notables en la ultraestructura vascular de la retina y la coroides de los conejos tratados; cambios que no fueron debidos a la reducción de lípidos plasmáticos, sino probablemente, a los efectos pleitrópicos de las estatinas como son: su capacidad de restaurar la función endotelial, la estabilización de la placa de ateroma, o la disminución del stress oxidativo y la inflamación vascular6.
Uno de los hallazgos clave en los conejos tratados con estatinas fue la disminución de los acúmulos de lípidos de la supracoroides lo que supuso una disminución de la compresión de las luces vasculares de la coroides. Además, la mejoría observada en las células musculares y endoteliales de los vasos sugeriría una mejora en la relajación dependiente de endotelio. Ambas observaciones podrían contribuir a mejorar el flujo coroideo y por tanto la irrigación de la retina externa, reduciendo la situación de isquemia crónica. Otro hallazgo fundamental que contribuiría a mejorar la isquemia retiniana y por lo tanto, su funcionamiento, sería la reducción del grosor de la membrana de Bruch y de las membranas basales de los vasos retinianos y coroideos en los conejos tratados con estatinas, que con el tratamiento, adquirían un aspecto parecido al control. La desaparición de los lípidos en estas membranas probablemente estaría mejorando el transporte de oxígeno y nutrientes hacia la retina.
En los conejos hipercolesterolémicos, el tratamiento con fluvastatina sódica y pravastatina sódica a una dosis insuficiente para normalizar los niveles de lípidos plasmáticos (2mg/kg/d) previene la progresión de la aterosclerosis en los vasos coroideos y retinianos.
FinanciaciónEste trabajo se ha realizado gracias a proyectos de la Comunidad de Madrid 08.4/0017.1/99, de la UCM PR48/01-9905, del Instituto Salud Carlos III: Redes Temáticas CO3/01, C03/13 y RD06/0014/107 y a un beca de Novartis-SEA 2006 de investigación.
Contribución de los autoresTodos los autores cumplen los requisitos exigidos por la revista para ser coautores en el artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a Agustín Fernández y al Centro de Microscopia Electrónica «Luis Bru» (Universidad Complutense de Madrid) y a Desirée Contreras y Francisca Vargas por la asistencia técnica.