La patogenia de los síndromes coronarios agudos está relacionada con la rotura o erosión de una placa aterosclerótica vulnerable. La estabilización de dicha placa, por reducción del núcleo lipídico y/o aumento de la capa fibrosa, sería uno de los mecanismos potencialmente beneficiosos observados con agentes antiateroscleróticos. El concepto de estabilización de la placa de ateroma se desarrolló para explicar el efecto beneficioso del tratamiento hipolipemiante, sin cambios apreciables en el tamaño y la morfología de la lesión aterosclerótica («paradoja angiográfica»). En la actualidad, el desarrollo de nuevas técnicas de imagen no invasivas (ultrasonido vascular e histología virtual, resonancia magnética, tomografía de coherencia óptica, etc.) permite determinar el volumen, el tamaño y la composición de la placa, con lo que es posible caracterizar las placas más vulnerables y, por consiguiente, más susceptibles de rotura. Una estrategia hipolipemiante «agresiva» puede estabilizar e incluso reducir de forma significativa la carga aterosclerótica y la incidencia de episodios vasculares, al menos en parte, a través de un efecto estabilizador de la placa.
As it is well-known, a thrombus evolving into a disrupted/eroded atherosclerotic plaque causes most acute coronary syndromes. Plaque stabilization via reduction of the lipid core and/or thickening of the fibrous cap is one of the possible mechanisms accounted for the clinical benefits displayed by different anti-atherosclerotic strategies. The concept of plaque stabilization was developed to explain how lipid-lowering agents could decrease adverse coronary events without substantial modifications of the atherosclerotic lesion (‘angiographic paradox’). A number of imaging modalities (vascular ultrasound and virtual histology, MRI, optical coherence tomography, positron tomography, etc.) are used for non-invasive assessment of atherosclerosis; most of them can identify plaque volume and composition beyond lumen stenosis. An ‘aggressive’ lipid-lowering strategy is able to reduce the plaque burden and the incidence of cardiovascular events; this may be attributable, at least in part, to plaque-stabilizing effects.
La patogenia de los síndromes cardiovasculares agudos está relacionada con la rotura o erosión de una placa aterosclerótica vulnerable1. La estabilización de dicha placa, por reducción del núcleo lipídico y/o aumento de la capa fibrosa, sería uno de los mecanismos potencialmente beneficiosos observados con agentes antiateroscleróticos2. El concepto de estabilización de la placa de ateroma se desarrolló para explicar el efecto beneficioso del tratamiento hipolipemiante, sin cambios apreciables en el tamaño y la morfología de la lesión aterosclerótica mediante angiografía («paradoja angiográfica»).
En la actualidad, el desarrollo de nuevas técnicas de imagen no invasivas (ultrasonido intravascular [IVUS]+histología virtual, tomografía de coherencia óptica [OCT], resonancia magnética, tomografía con positrones [PET], etc.) permite la identificación temprana de ateromas en el árbol vascular, así como determinar el volumen, el tamaño y la composición de la placa, por lo que es posible caracterizar aquellas más vulnerables y, por consiguiente, más susceptibles de rotura y trombosis3. La estabilización de las placas vulnerables, por reducción del núcleo lipídico y/o aumento de la capa fibrosa, sería uno de los mecanismos potencialmente importantes del beneficio clínico observado con algunos agentes antiateroscleróticos, fundamentalmente estatinas.
Identificación de placas de alto riesgo/vulnerablesLa composición de la placa, más que el grado de estenosis, es el determinante crítico del riesgo de rotura y ulterior trombogenicidad. En concreto, el núcleo necrótico, la capa fibrosa y la inflamación son los principales factores que intervienen en la vulnerabilidad de la placa. De ellos, una cápsula fibrosa fina (<54μm), abundante núcleo necrótico y el grado de infiltrado inflamatorio se consideran los mejores discriminadores de vulnerabilidad4. Avances en el conocimiento de las bases celulares y moleculares de la progresión de la placa han permitido establecer el papel fisiopatológico de la inflamación en las placas vulnerables5. En la actualidad se sabe que mediadores inflamatorios asociados con una activación leucocitaria favorecen la progresión; un claro ejemplo es la interleucina 6 (IL-6), una citocina asociada con aumento de la producción de proteína C reactiva, que representa un marcador establecido de riesgo cardiovascular6,7.
El mejor conocimiento de la fisiopatología de la aterosclerosis y el desarrollo de nuevas técnicas de imagen ha permitido una mejor caracterización de las placas de alto riesgo8.
La angiografía coronaria ha sido tradicionalmente la prueba de imagen que mejor determina el grado de estenosis y sigue siendo la técnica empleada para guiar procedimientos de revascularización, tanto quirúrgicos como mediante cateterización intravascular. La angiografía proporciona información sobre el número y tamaño de las estenosis vasculares; sin embargo, se ha observado una escasa correlación entre los hallazgos angiográficos y la modificación de factores de riesgo, y además no permite conocer la composición de la placa.
La técnica de ultrasonidos intravascular (IVUS) más histología virtual permiten la identificación de ateromas en el árbol vascular, y puede cuantificar el tamaño, el volumen, la composición y la distribución en la placa. Asimismo, el IVUS puede detectar lesiones en vasos sin estenosis en el estudio angiográfico e identificar con precisión áreas con remodelado positivo y negativo, así como la «carga» aterosclerótica9.
La tomografía de coherencia óptica (OCT) permite detectar diversas variables relacionadas con la morfología y composición de la placa, así como depósitos de calcio, cuya presencia se correlaciona con la extensión de la aterosclerosis, si bien existe controversia sobre la relación entre calcificación y vulnerabilidad9.
La resonancia magnética posee ventajas sobre otras técnicas de imagen, al no requerir el empleo de contrastes iónicos intravasculares. Además, permite obtener imágenes en varios planos y proporciona información sobre la composición del tejido vascular. Investigaciones recientes han demostrado que es posible obtener imágenes no solo de la luz vascular, sino de la composición de la pared arterial10.
La ultrasonografía carotídea detecta la presencia de placas ateroscleróticas focales y cuantifica el grosor íntima-media (GIM) carotídeo. Se trata de un procedimiento no invasivo, estandarizado y validado en diversos estudios. El GIM, medido preferentemente en la arteria carótida primitiva, se ha correlacionado con el riesgo cardio y cerebrovascular en diferentes grupos de riesgo11.
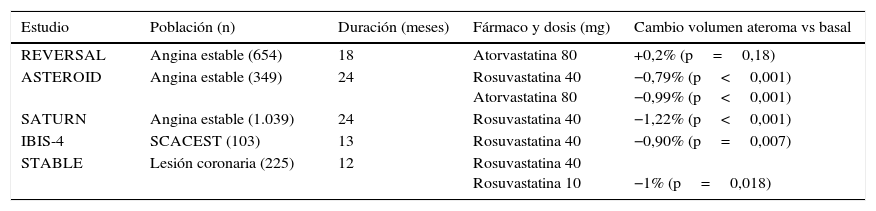
Medición de la respuesta de la placa a la terapia sistémicaLas estatinas han modificado la historia natural de la enfermedad aterosclerótica en general y de los síndromes coronarios y cerebrovasculares en particular, como se evidencia por la reducción de la morbimortalidad cardiovascular en estudios de prevención primaria y secundaria12,13. Lo que parece claro es que una estrategia hipolipemiante «agresiva» para mantener niveles de cLDL <70mg/dl es la que consigue mejores resultados (tabla 1). Sin embargo, se ha postulado que las estatinas ejercen acciones independientemente de la reducción de colesterol (efectos pleiotrópicos)14,15, sin que estos efectos potenciales hayan demostrado alguna repercusión clínica relevante.
Resumen de estudios con IVUS que determinan el impacto de una estrategia hipolipemiante «agresiva» sobre la regresión de la placa aterosclerótica
| Estudio | Población (n) | Duración (meses) | Fármaco y dosis (mg) | Cambio volumen ateroma vs basal |
|---|---|---|---|---|
| REVERSAL | Angina estable (654) | 18 | Atorvastatina 80 | +0,2% (p=0,18) |
| ASTEROID | Angina estable (349) | 24 | Rosuvastatina 40 Atorvastatina 80 | −0,79% (p<0,001) −0,99% (p<0,001) |
| SATURN | Angina estable (1.039) | 24 | Rosuvastatina 40 | −1,22% (p<0,001) |
| IBIS-4 | SCACEST (103) | 13 | Rosuvastatina 40 | −0,90% (p=0,007) |
| STABLE | Lesión coronaria (225) | 12 | Rosuvastatina 40 Rosuvastatina 10 | −1% (p=0,018) |
IVUS: ultrasonido intravascular; SCACEST: síndrome coronario agudo con elevación del ST.
Diversos estudios clínicos han encontrado una clara relación entre la reducción del colesterol y el beneficio clínico en varias categorías de pacientes, desde aquellos con enfermedad coronaria establecida a sujetos asintomáticos con riesgo cardiovascular y sujetos con patología carotídea, que no puede explicarse en términos cuantitativos (anatomía de la placa) sino cualitativos (biología de la placa)16-23.
En un estudio prospectivo incorporando IVUS y OCT se demostró una reducción significativa del volumen de la placa y un incremento de la capa fibrosa en el grupo tratado con 4mg de pitavastatina en comparación con controles18. El estudio YELLOW comparó IVUS y espectroscopia con infrarrojos en 87 pacientes sometidos a intervencionismo coronario, que fueron aleatorizados a rosuvastatina (40mg/día) o terapia estándar. Tras 7 semanas de tratamiento se observó que las dosis altas de estatinas se asociaron con una reducción significativa del núcleo necrótico y disminución de la progresión del ateroma19. Subanálisis del Study of Coronary Atheroma by Intravascular Ultrasound: Effect of Rosuvastatin Versus Atorvastatin (SATURN) evaluaron el efecto de una terapia hipolipemiante agresiva sobre las características de la placa identificadas mediante histología virtual en 1.039 pacientes. Se comparó rosuvastatina 40mg con atorvastatina 80mg durante un periodo de 24meses en pacientes con enfermedad aterosclerótica estable. Si bien no se observaron cambios en el porcentaje de la placa ocupado por tejido fibrótico, se constató un aumento del porcentaje de calcio intraplaca20,21. En el estudio IBIS-4 en sujetos sometidos a stent intracoronario por infarto de miocardio, un régimen de dosis altas de estatinas (rosuvastatina 20-40mg/día) se asoció con una considerable reducción en el volumen de lesión medido con histología virtual22. En el estudio ESTABLE, aleatorizado doble ciego en pacientes con indicación de angiografía o intervención percutánea, el tratamiento con rosuvastatina 40mg (y también 10mg) durante un año redujo de manera significativa el porcentaje de núcleo necrótico (del 21,3 al 18%), aumentó el de tejido fibrograso (del 11,7 al 14,8%) y disminuyó el porcentaje de volumen de la placa (del 51,4 al 50,4%)23 (tabla 1). Finalmente, un metaanálisis reciente de estudios prospectivos que investigaban el efecto de estatinas sobre el volumen y la composición de la placa mediante IVUS e histología virtual (9 estudios con 16 brazos de tratamiento con estatinas y 830 pacientes) concluyó que el tratamiento indujo cambios favorables en la placa, sobre todo a nivel de la membrana elástica y el tejido fibroso, sin efecto significativo sobre el volumen de la lesión ni sobre el contenido del núcleo necrótico24.
Existen asimismo evidencias de que un tratamiento intensivo con estatinas puede tener efectos beneficiosos sobre la morfología de la placa a nivel carotídeo, que pueden ser detectados mediante ultrasonidos, resonancia magnética o PET. Diferentes estudios también han demostrado que las estatinas reducen la progresión del GIM carotídeo y tienen un impacto favorable en pacientes sintomáticos sometidos a endarterectomía carotídea, si bien no se ha establecido cuál es la mejor técnica para cuantificar los cambios en la placa aterosclerótica. La angiorresonancia y la PET pueden proporcionar información adicional sobre el grado de inflamación de la placa e identificar las más vulnerables25,26.
Mecanismos por los que las estatinas pueden estabilizar la placa de ateromaAlgunos de estos resultados no pueden atribuirse exclusivamente a una reducción del cLDL sino a efectos pleiotrópicos relacionados con un mayor contenido de tejido fibroso, así como disminución de la trombogenicidad e inflamación a nivel de la placa27. En este sentido, en el estudio IBIS-4 la estabilización del núcleo necrótico en pacientes con infarto de miocardio que recibían dosis altas de estatinas se circunscribió a los que consiguieron una mayor reducción de los niveles de PCR durante el tratamiento28.
Una nueva frontera: inhibición de PCSK9La inhibición de la proproteína convertasa subtilisina/kexina 9 (PCSK9) representa uno de los mayores avances que se han producido en los 2 últimos años en relación con una reducción espectacular de c-LDL29. Un dato de interés, además de la disminución del c-LDL es la expresión de PCSK9 en placas ateroscleróticas humanas30, probablemente interviniendo en proceso de inflamación vascular y apoptosis. Además, el estudio ATHEROREMO-IVUS demostró que los niveles séricos de PCSK9 correlacionaron con el volumen de núcleo necrótico medido con IVUS e histología virtual31. Estudios en curso con inhibidores de PCSK9 (GLAGOV) permitirán establecer la importancia de la reducción de c-LDL y otras acciones de estos fármacos sobre la composición y comportamiento de la placa de alto riesgo32,33.
ConclusiónInvestigaciones llevadas a cabo en los últimos años han permitido establecer los mecanismos moleculares y celulares que subyacen en la biología de la placa de ateroma. A ello ha contribuido el desarrollo de las nuevas técnicas de imagen vascular. Las estatinas han cambiado la historia natural de la aterosclerosis, ya que existen evidencias clínicas de que un tratamiento hipolipemiante «agresivo» puede favorecer la estabilización e incluso la regresión de la placa aterosclerótica, lo que representa un importante hito en la medicina cardiovascular. El proceso de regresión del ateroma incluye cambios favorables en la morfología y composición de la placa, más que en el tamaño de la misma o en el grado de estenosis. Estudios en curso permitirán definir con precisión la respuesta de la placa a la terapia sistémica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.