Introducción
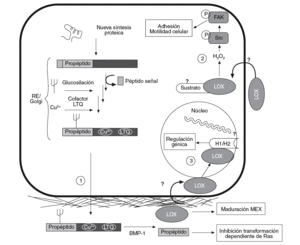
La lisil oxidasa (LOX) es una aminooxidasa dependiente del cobre que participa en la formación de enlaces covalentes intra e intercatenarios de las fibras de colágeno y elastina de la matriz extracelular (MEX). Esta enzima se sintetiza y secreta en forma de proenzima, que es procesada proteolíticamente en el espacio extracelular para dar lugar a la forma madura y enzimáticamente activa de 32 kDa (fig. 1)1. La actividad LOX determina las propiedades mecánicas de la MEX y asegura su integridad, su estabilidad y su correcto funcionamiento.
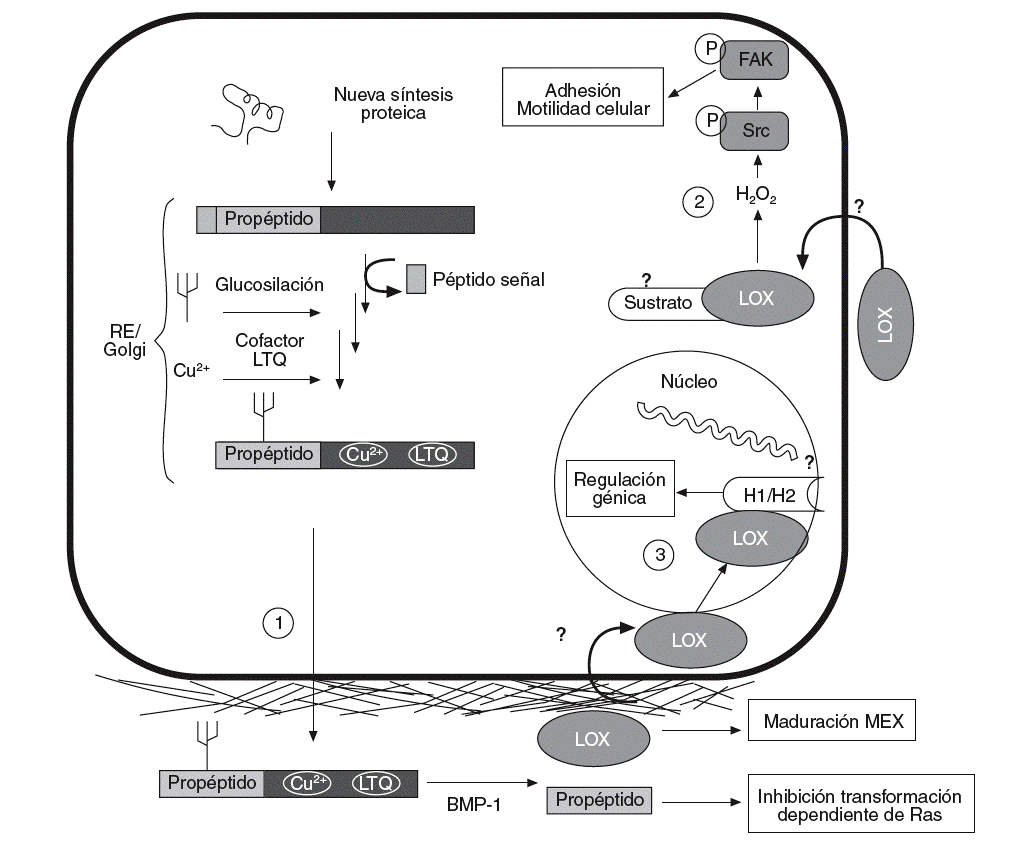
Figura 1. Esquema del proceso de síntesis de la lisil oxidasa (LOX), así como de sus funciones intra y extracelulares. La LOX se sintetiza en forma de preproteína y, tras la hidrólisis del péptido señal, su glucosilación y la incorporación de cobre y del cofactor LTQ (lisina tirosil quinona) es transportada al espacio extracelular (1). Allí es proteolizada por la BMP-1 (bone morphogenetic protein-1) para dar lugar a la forma madura y catalíticamente activa (32 kDa) y al propéptido. La forma madura actúa estabilizando los componentes de la matriz extracelular (MEX). Por su parte, el propéptido es el responsable de la inhibición de la transformación dependiente de Ras. Algunos autores han descrito que la LOX puede pasar del espacio extracelular al interior de la célula (2), donde controla la adhesión y la motilidad celular a través de la activación de Scr cinasa (Src) y FAK (focal adhesion kinase). También se han descrito formas intranucleares de LOX que podrían ser responsables de la capacidad de esta enzima de controlar la expresión génica (3). Se ha propuesto que las histonas H1 y H2 pueden ser sustratos intranucleares de la LOX. RE: retículo endoplasmático.
Hasta el momento se han identificado 5 isoformas pertenecientes a la familia de lisil oxidasas: LOX, LOX-like (LOXL)-1, LOXL-2, LOXL-3 y LOXL-4. Estas isoenzimas presentan una región C-terminal altamente conservada que incluye el dominio catalítico, lo que sugiere que todas ellas tienen actividad aminooxidasa2. Sin embargo, se desconoce cuál es el grado de contribución de cada isoenzima a la actividad LOX global, su función celular, así como la especificidad de sustrato.
Sorprendentemente, además del papel de la LOX en el mantenimiento de la estructura de la MEX, esta enzima se encuentra implicada en otros procesos celulares, entre los que se incluyen la diferenciación celular, la migración, la transformación y la regulación de la expresión génica (fig. 1)3. Por tanto, la modificación del patrón de expresión de esta enzima podría alterar la homeostasis celular y estar asociada al desarrollo de procesos patológicos. No en vano, recientemente, Erler et al4 han demostrado que la LOX es una enzima clave en el control de la metástasis tumoral. Asimismo, deficiencias en la expresión de la LOX se han relacionado con alteraciones vasculares como el aneurisma aórtico y la aterosclerosis5-8. En este sentido, nuestros trabajos previos han demostrado que la LOX es una enzima clave en la disfunción endotelial desencadenada por factores de riesgo aterosclerótico, como la hipercolesterolemia y la hiperhomocisteinemia8,9.
En este trabajo hemos determinado el patrón de expresión de estas enzimas en la pared vascular y hemos analizado los mecanismos moleculares implicados en la regulación de la LOX por lipoproteínas de baja densidad (LDL) en células vasculares.
Material y métodos
Recogida y preservación de las muestras de vaso
Las muestras de arterias coronarias humanas se recogieron a partir de corazones obtenidos durante las operaciones de transplante realizadas en el Hospital de la Santa Creu i Sant Pau de Barcelona. Inmediatamente después de la escisión quirúrgica, las arterias coronarias se diseccionaron y congelaron en N2 líquido para el análisis de expresión génica. Análogamente, se obtuvieron muestras de aorta abdominal porcina que se procesaron para inmunohistoquímica. En este caso, las muestras se sumergieron en solución de fijación (paraformaldehído al 4%/tampón fosfato salino 0,1 mol/l, pH 7,4) en la que permanecieron toda una noche. A continuación los vasos se seccionaron en bloques y se embebieron en parafina10. El protocolo de este estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital de la Santa Creu i Sant Pau de Barcelona.
Análisis por inmunohistoquímica
El patrón de expresión de la LOX en las muestras de aorta abdominal porcina se evaluó mediante inmunohistoquímica. Para ello se utilizaron secciones de 5 µm que se incubaron con un anticuerpo policlonal de LOX generado en conejo. Tras la incubación con el anticuerpo primario, se lavaron las secciones y se incubaron con el anticuerpo secundario biotinilado (VECTOR). Finalmente, las secciones se incubaron con el complejo avidina-biotina (VECTOR) y se usó 3,3' diaminobencidina (DAB) como sustrato de la peroxidasa. En experimentos control, en los que se utilizaba un suero no inmune, no se ob servó tinción inmunohistoquímica. De manera rutinaria, se rea lizaron tinciones por tricrómico de Masson para visualizar la estructura de la pared vascular.
Cultivo celular
Las células endoteliales de aorta porcina (PAEC) se obtuvieron a partir de animales adultos normolipémicos, como se describió previamente11. Las células se cultivaron en medio M199 (GIBCO), suplementado con 10% FCS (Biological Industries), antibióticos (0,1 mg/ml de estreptomicina y 100 U/ml de penicilina G), y 2 mmol/l de L-glutamina. Al cabo de 48 h en cultivo el medio se reemplazó por medio deficiente en suero (2% FCS) durante 24 h. A continuación se añadían las LDL (180 mg colesterol/dl) durante 24 h más. En los experimentos en los que se analiza la implicación de las proteínas G, las células PAEC se pretrataron durante 18 h con toxina pertúsica (TP, 100 ng/ml) y a continuación se incorporaron las LDL durante otras 24 h más. Se utilizaron células entre los pases 3 y 5.
Las CML se obtuvieron a partir de aorta de cerdo mediante una modificación de la técnica de explantes y se cultivaron tal y como se ha descrito previamente12. Las células se usaron entre los pases 2 y 5. Las CML se sembraron en placas de 6 pocillos y, una vez alcanzada la confluencia, se arrestaron con medio al 0,4% en suero fetal bovino (FCS, Biological Industries). Las células arrestadas se estimularon con LDL (100 µg/ml) durante 24 h.
Obtención de LDL
Las LDL se obtuvieron a partir de plasma humano fresco mediante ultracentrifugación secuencial (densidad de 1,019 a 1,063 g/ml). Las lipoproteínas se usaron antes de las 72 h de ser aisladas. La pureza de la preparación se determinó mediante electroforesis en gel de agarosa (Paragon System, Beckman). Las muestras de LDL no presentaban concentraciones detectables de endotoxina (Limulus Amebocyte Lysate test, BioWhittaker), y mostraban concentraciones de sustancias que reaccionan con el ácido tiobarbitúrico (TBARS) < 1,5 nmol malondialdehído/mg proteína13.
Extracción de ARN
El ARN total procedente de las células en cultivo o de coronarias humanas se aisló mediante el reactivo Ultraspec (Biotecx), según las instrucciones del fabricante.
RT-PCR
Los valores de ARNm de las enzimas de la familia de la LOX se analizaron mediante RT-PCR, tal como se ha descrito antes8. Los oligonucleótidos específicos seleccionados para cada gen fueron: LOX: 5'-tga aat agc tgc ttt ggt-3' y 5'-tct gta gat gcc agt ctg-3'; LOXL-1: 5'-aga agt gtc tgg cca gca ca-3' y 5'-tca cgt gca cct tga gga tg-3'; LOXL-2: 5'-tgg act gcc agc tcc tcc ta-3 y 5'-ctg ggg tgc gct tgc ggt ag-3'. Los valores de la gliceraldehído-3-fosfato deshidrogenasa (GAPDH) se usaron para normalizar los resultados14.
Análisis de Northern-blot
En los estudios para determinar la estabilidad del ARNm, el nivel de expresión de la LOX se analizó mediante Northern-blot. Las muestras de ARN total se fraccionaron en geles de agarosa al 1,2% con un 2% de formaldehído. El ARN se transfirió por capilaridad a membranas Nytran Supercharge (Schleicher & Schuell) que se fijaron mediante luz ultravioleta. A continuación los filtros se hibridaron con una sonda de LOX marcada con [32P]dATP13. La señal correspondiente al ARNm de LOX se visualizó mediante exposición de los filtros con películas de rayos X Agfa Curix RP2.
Análisis estadístico
Los resultados se expresan como media ± error estándar. Las diferencias entre grupos se determinaron mediante ANOVA. Las diferencias se consideraron significativas a partir de p < 0,05.
Resultados
Patrón de expresión de la LOX, la LOXL-1 y la LOXL-2 en la pared vascular
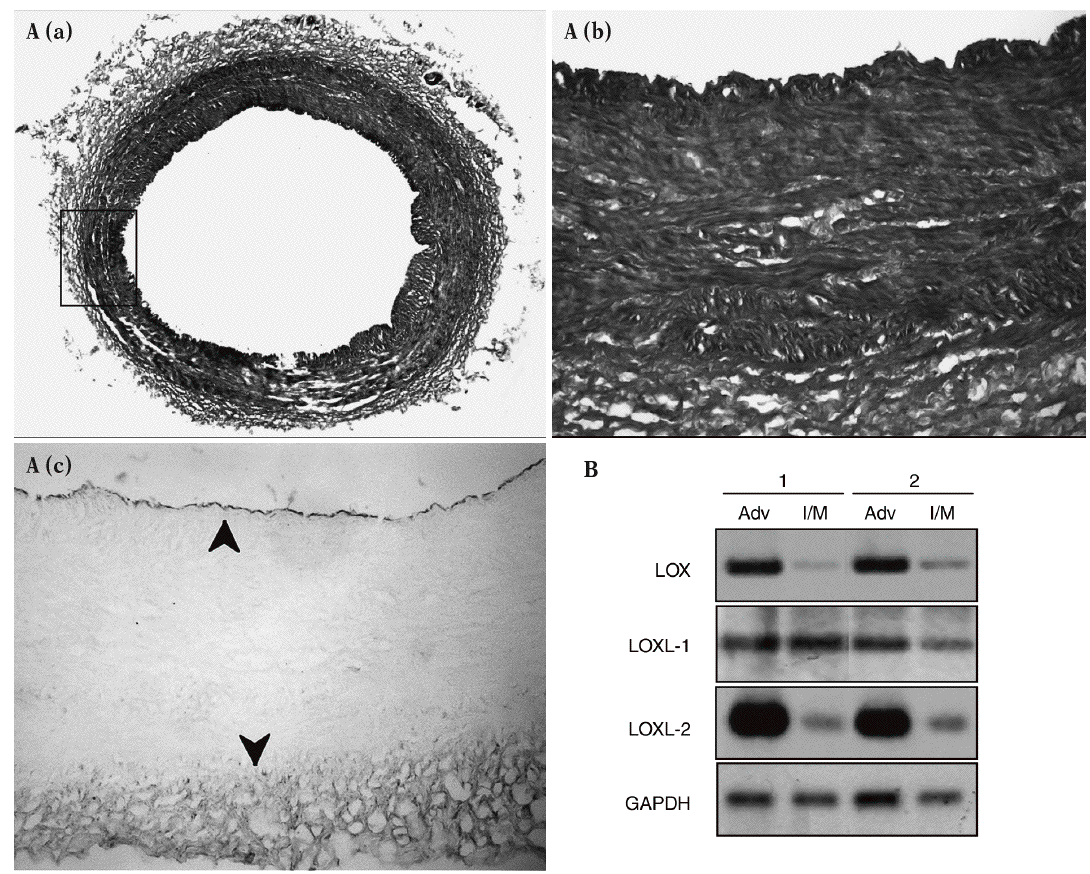
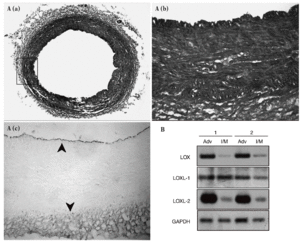
Los estudios de inmunohistoquímica realizados en muestras de aorta porcina con un anticuerpo específico para LOX mostraron que esta enzima se expresa sobre todo en el endotelio vascular y en la adventicia, mientras el marcaje en la capa media es débil (fig. 2A). Asimismo, se determinó el patrón de expresión del ARNm de la LOX, la LOXL-1 y la LOXL-2 en arterias coronarias humanas. En concordancia con los análisis inmunohistoquímicos, observamos que la LOX se expresa predominantemente en la adventicia frente a la capa íntima/media. La LOXL-2 mostró un patrón similar al de la LOX, mientras que la LOXL-1 se expresa de manera prácticamente homogénea en ambas capas arteriales (fig. 2B).
Figura 2. Patrón de expresión de la lisil oxidasa (LOX) y de otras isoenzimas de su familia en la pared vascular. A. Análisis inmunohistoquímico de la expresión de la LOX en la aorta abdominal de cerdo. a) Tinción por tricrómico de Masson de una sección de aorta abdominal porcina. b) y c) Magnificación de la región indicada en a, correspondiente a la tinción por tricrómico de Masson (b) y a la tinción de la LOX (c). Las flechas señalan la expresión de la LOX en el endotelio y la adventicia. B. Patrón de expresión de la LOX, la LOXL-1 y la LOXL-2 en muestras de arterias coronarias humanas procedentes de 2 individuos sanos (1 y 2). Se muestra el valor de ARNm analizado por RT-PCR en las capas adventicia e íntima/media. Como control se determinó el valor de ARNm de la gliceraldehído-3-fosfato deshidrogenasa (GAPDH).
Las LDL disminuyen la expresión de la LOX en células vasculares
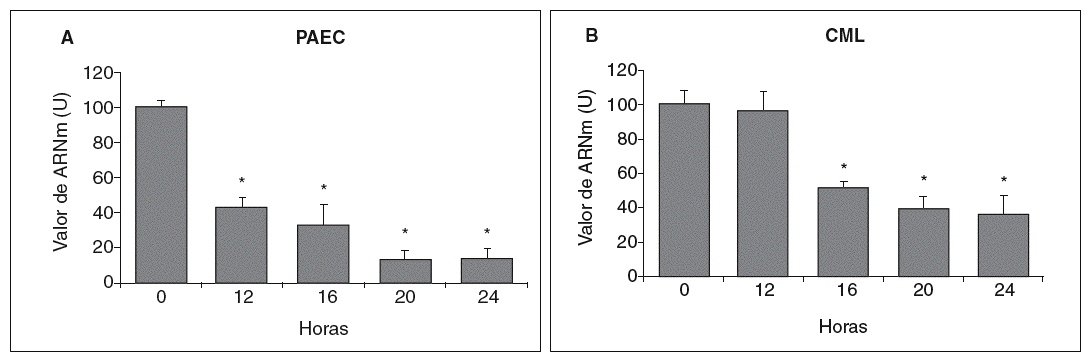
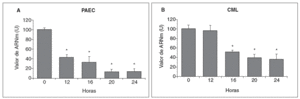
Se analizó el efecto de concentraciones aterogénicas de LDL (180 mg/dl) sobre el nivel de expresión de la LOX en células endoteliales. Como se observa en la figura 3A, el tratamiento de PAEC con LDL redujo el valor de ARNm de la LOX de forma dependiente del tiempo de incubación con esta lipoproteína (disminución del 80% al cabo de 24 h). Asimismo, en CML las LDL (100 µg/ml) disminuyeron la expresión de esta enzima con un patrón similar al observado en PAEC (fig. 3B).
Figura 3. Las lipoproteínas de baja densidad (LDL) disminuyen la expresión de la lisil oxidasa (LOX) en células endoteliales y células musculares lisas (CML). A. Determinación del valor de ARNm de la LOX en células endoteliales de aorta porcina (PAEC) estimuladas con LDL (180 mg/dl) durante los tiempos indicados. B. Análisis por RT-PCR del valor de ARNm de la LOX en CML estimuladas con LDL (100 µg/ml). Los resultados, normalizados por el gen control (GAPDH), se expresan como la media ± error estándar de 3 experimentos independientes realizados por duplicado. (*p < 0,01 respecto al tiempo 0).
Las LDL disminuyen la expresión de la LOX en células vasculares a través de un mecanismo transcripcional
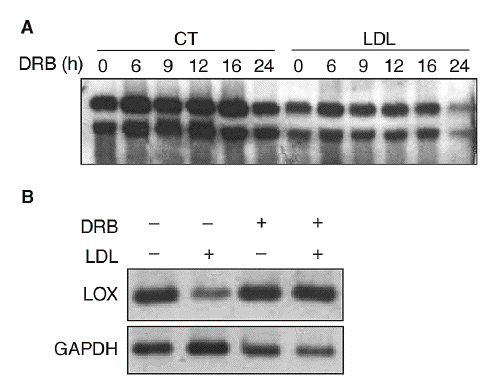
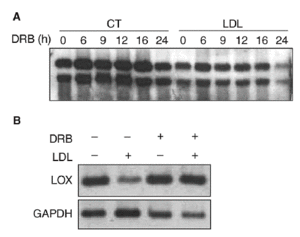
Con el objetivo de caracterizar los mecanismos implicados en la reducción de la expresión de la LOX en células vasculares, determinamos el efecto del 5,6-diclorobencimidazol (DRB), un inhibidor de la transcripción. Para ello, se incubaron células PAEC en presencia o ausencia de LDL (180 mg/dl) durante 24 h y a continuación se inhibió la transcripción con DRB (50 µmol/l; tiempo 0). Los valores de ARNm de la LOX se analizaron por Northern-blot a distintos tiempos (0, 6, 9, 12, 16 y 24 h). Como se observa en la figura 4A, la vida media del ARNm de la LOX es similar en células incubadas en presencia o en ausencia de LDL (entre 20 y 24 h), por lo que el efecto de las lipoproteínas no puede atribuirse a una disminución en la estabilidad del ARNm. Por otro lado, en células en las que se bloqueó la transcripción con DRB, la coincubación con LDL (180 mg/dl, 12 h) no fue capaz de reducir la expresión de la LOX, lo que sugiere la implicación de un mecanismo transcripcional (fig. 4B).
Figura 4. Las lipoproteínas de baja densidad (LDL) disminuyen la expresión de la lisil oxidasa (LOX) a través de un mecanismo transcripcional. A. Análisis de la estabilidad del mensajero de LOX en células endoteliales de aorta porcina (PAEC). Las células se incubaron en presencia o en ausencia de LDL (180 mg/dl, 24 h) y a continuación se añadió 5,6-diclorobencimidazol (DRB) (50 µmol/l). Al cabo de 0, 6, 9, 12, 16 y 24 h se analizó el valor de expresión de la LOX mediante Northern-blot. B. Efecto de la incubación de PAEC con DRB (50 µmol/l) en presencia de LDL (180 mg/dl) durante 12 h. El valor de ARNm de LOX se determinó por RT-PCR. Se muestra una autorradiografía representativa de 2 experimentos independientes. CT: control; GAPDH: gliceraldehído-3-fosfato deshidrogenasa.
Mecanismos implicados en la regulación de la expresión de la LOX por lipoproteínas
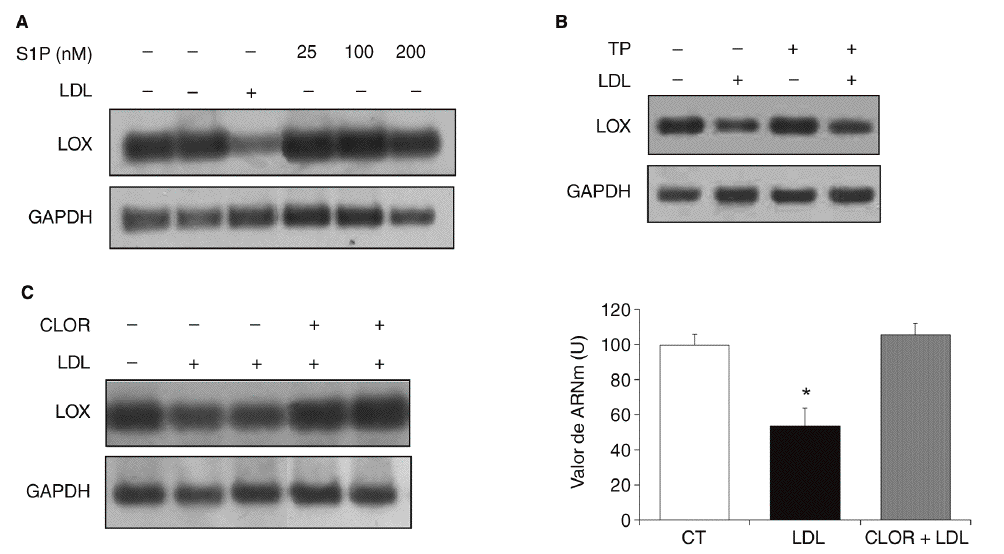
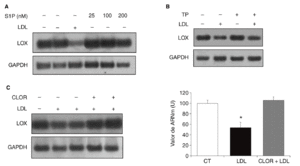
Quisimos determinar si la esfingosina-1-fosfato (S1P), un componente bioactivo de las lipoproteínas, podía estar implicada en la regulación de la expresión de la LOX en células vasculares. Para ello se incubaron células PAEC con S1P (25-200 nmol) durante 24 h. Como se muestra (fig. 5A), la S1P no alteró la expresión de la LOX. Puesto que este fosfolípido actúa a través de receptores de membrana asociados a proteínas G15,16, determinamos el efecto del bloqueo de proteínas G con TP. En la figura 5B se observa que la preincubación con TP (100 ng/ml) no revierte la reducción en los valores de ARNm de la LOX causada por las LDL. Finalmente, analizamos el efecto de la cloroquina (75 µM, 24 h), un inhibidor de la hidrólisis lisosomal. Como se observa en la figura 5C, la cloroquina bloqueó la inhibición de la LOX causada por las LDL, lo que indica que la regulación de esta enzima por LDL requiere el procesamiento lisosomal de la lipoproteína.
Figura 5. Mecanismos implicados en la regulación de la lisil oxidasa (LOX) por lipoproteínas de baja densidad (LDL). A. Autorradiografía representativa del análisis por RT-PCR del efecto de la esfingosina-1-fosfato (S1P) (25-200 nmol; 24 h) sobre el valor de ARNm de LOX en células endoteliales de aorta porcina (PAEC). B. Las PAEC se preincubaron durante 18 h con toxina pertúsica (TP; 100 ng/ml) y a continuación se incorporaron las LDL (180 mg/dl) durante 24 h más. El valor de ARNm de LOX se determinó por RT-PCR. Se muestra una autorradiografía representativa de 2 experimentos independientes. C. La cloroquina previene la disminución de la expresión de la LOX causada por las LDL. Análisis del valor de ARNm de LOX determinado por RT-PCR en células musculares lisas (CML) estimuladas con LDL (100 µg/ml) en presencia o ausencia de cloroquina (CLOR; 75 µM, 24 h). Los resultados se normalizaron por el gen control (GAPDH) y se expresan como media ± error estándar (*p < 0,05 respecto al colesterol total). Se muestra una autorradiografía representativa de 3 experimentos realizados por duplicado.
Discusión
La LOX es una enzima clave en la síntesis y estabilización de la MEX3. En los últimos años el hallazgo de la implicación de esta enzima en distintos procesos patológicos ha aumentado el interés por su estudio4,17-19. Asimismo, el descubrimiento de la actividad biológica del propéptido de LOX y de la existencia de formas intracelulares activas de esta enzima abre nuevas expectativas acerca de sus funciones celulares (fig. 1)3,20.
Concretamente, la generación de animales deficientes en LOX ha revelado su papel clave en el desarrollo y la funcionalidad del sistema cardiovascular, ya que estos animales presentan profundas alteraciones estructurales en la pared vascular7,21. En este contexto, nuestros estudios previos sugieren la implicación de la inhibición de LOX en la disfunción endotelial desencadenada por factores de riesgo aterosclerótico8,9. Los análisis inmunohistoquímicos muestran una elevada expresión de la LOX en el endotelio vascular, por lo que no es de extrañar que su inhibición altere la función endotelial. En realidad, la inhibición de la actividad LOX lleva consigo un aumento de la permeabilidad endotelial8, y, por tanto, éste podría ser uno de los mecanismos que contribuyan a la disfunción endotelial desencadenada por la hipercolesterolemia.
Hemos observado un patrón de expresión diferencial entre las distintas isoenzimas de esta familia en la pared vascular. Análogamente estas enzimas presentan diferencias en su patrón de expresión tisular2. Estos resultados sugieren que cada una de ellas tendría una función específica en la vasculatura. Esta hipótesis explicaría las graves consecuencias sobre la viabilidad de los animales que tiene la deficiencia de LOX, ya que este déficit no parece ser compensado por la actividad de las demás isoenzimas7. Por el contrario, los animales deficientes en LOXL-1 son viables, aunque también presentan alteraciones vasculares de menor relevancia22. En cuanto a LOXL-2, 3 y 4, se dispone de muy poca información acerca de cuáles son sus funciones y de su regulación.
Las CML desempeñan un papel fundamental en el desarrollo del proceso aterosclerótico. Estas células sintetizan activamente distintos componentes de la MEX, de forma que la actividad LOX contribuiría a su estabilización. La LOX es el isoenzima responsable del 80% de la actividad lisil oxidasa en CML de aorta23; por tanto, esta enzima sería clave en la deposición de la MEX en la pared vascular. Así, se ha sugerido que la desestructuración de la MEX asociada a la disminución de la actividad LOX en CML podría estar implicada en el desarrollo de aneurismas y disecciones aórticas y en la desestabilización de la placa de ateroma5-7,19. En este contexto, la disminución de la expresión de la LOX por LDL en CML podría contribuir a su vez al aumento de la fragilidad de las placas. No en vano, la LOX controla la actividad transcripcional del colágeno III24. Además, la inhibición de LOX llevaría consigo un incremento en las formas más solubles de colágeno, altamente susceptibles a la degradación por metaloproteinasas25. Por tanto, a través de distintos mecanismos, la inhibición de la LOX en CML causaría un debilitamiento de la MEX que podría facilitar la rotura de la placa de ateroma.
Los resultados de los ensayos con DRB descartan que las LDL estén alterando la estabilidad del mensajero de LOX y corroboran los datos obtenidos por otros autores en CML y fibroblastos en quiescencia, en los que la vida media de este ARNm es igualmente larga26,27. Asimismo, estos experimentos sugieren que la disminución de la expresión de la LOX causada por LDL se produce a través de un mecanismo transcripcional. Previamente habíamos descrito que las LDL son capaces de reducir la concentración de la sterol-regulatory binding protein-2 (SREBP-2) en células endoteliales8. No obstante, no hemos podido identificar ningún elemento de regulación por esteroles (SRE) en el promotor de la LOX, y la inhibición del catabolismo de los SREBP no es capaz de revertir el efecto de las LDL8, lo que descarta la implicación de este factor de transcripción. Junto a SREBP-2, las LDL son capaces de modular la activación de un gran número de factores de transcripción, CREB (cyclic-AMP response element binding protein) y AP-1 entre otros28,29. Sin embargo, no se ha llevado a cabo una caracterización de los elementos funcionales del promotor de LOX y, por tanto, se requieren estudios que analicen en profundidad los mecanismos transcripcionales de regulación de este gen.
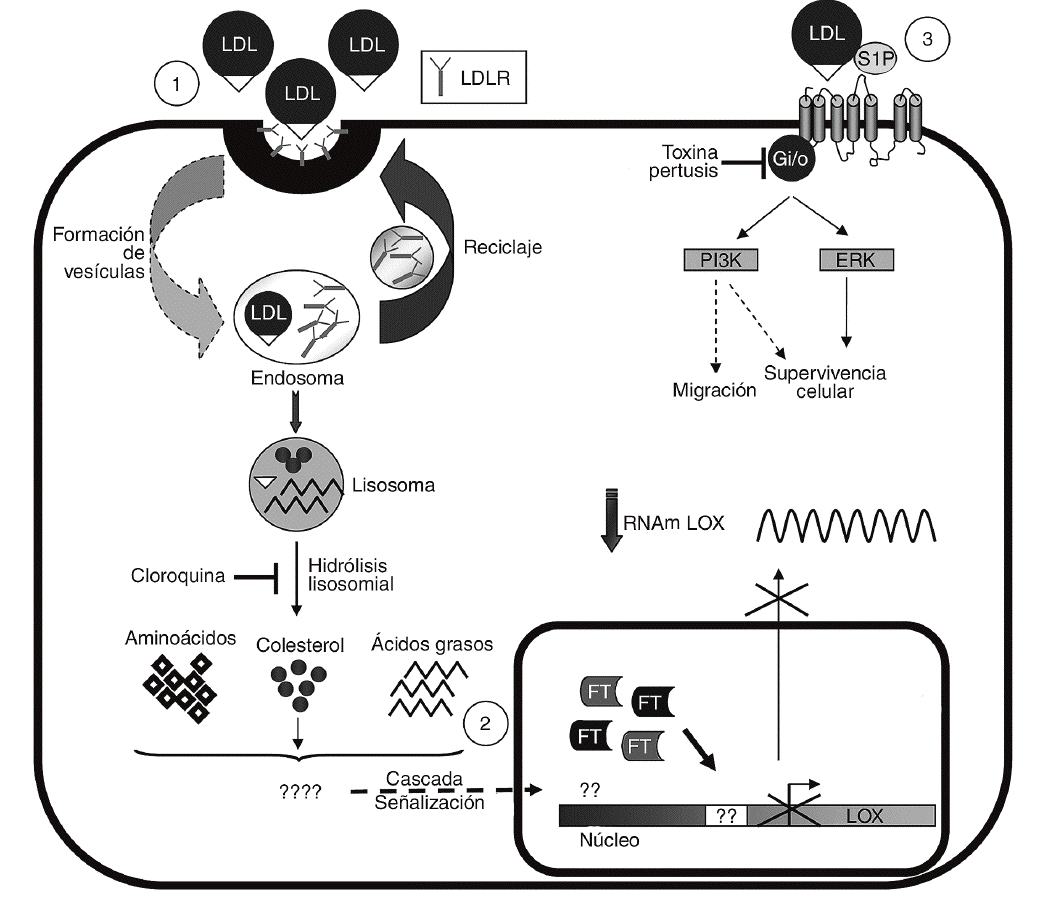
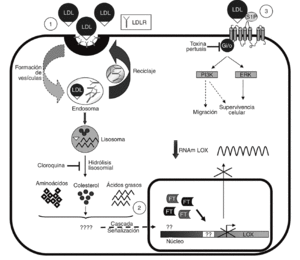
Las LDL actúan como transportadores de fosfolípidos biológicamente activos entre los que destaca la S1P30. Este fosfolípido es responsable de algunas de las acciones inducidas por las LDL en células vasculares31 y ejerce potentes efectos sobre proliferación, diferenciación, migración, apoptosis y adhesión celular a través de la activación de receptores específicos acoplados a proteínas G (fig. 6)15,16. Sin embargo, la S1P no altera la expresión de la LOX y la inhibición de proteínas G con TP es incapaz de revertir el efecto de las LDL, lo que nos lleva a descartar esta vía en la regulación de LOX. Por el contrario, la cloroquina, que bloquea el catabolismo de las LDL en el lisosoma, previene la reducción en los valores de expresión de la LOX causada por estas lipoproteínas. La endocitosis a través del receptor de las LDL (LDLR) y otras vías de captación, como la internalización vía lipoproteín lipasa, siguen la ruta lisosomal32-34. Sin embargo, la vía dependiente del LDLR es mucho más sensible a la cloroquina34, lo que sugiere que la regulación de LOX por LDL requeriría su captación por este receptor.
Figura 6. Esquema de los mecanismos implicados en la regulación de lisil oxidasa (LOX) por lipoproteínas de baja densidad (LDL). Se muestra la captación de las LDL a través del del receptor de las LDL (LDLR) y su procesamiento (1). Se desconoce qué componente y vía de transducción de señales lleva consigo la inhibición de la transcripción de LOX y el consiguiente descenso en su valor de ARNm (2). Se descarta la participación de la esfingosina-1-fosfato (S1P) y, por tanto, de la activación de sus receptores específicos acoplados a proteínas G en la modulación de la LOX (3). Se indican los procesos bloqueados por la cloroquina y la toxina pertúsica (TP). ERK: extracellular signal-regulated kinase; FT: factor de transcripción. PI3K: fofatidi linositol 3 cinasa.
En resumen, los resultados de este estudio nos han permitido demilia de LOX en la pared vascular y muestran que la regulación de la expresión de la LOX por LDL en células vasculares depende de su procesamiento lisosomal. Estos datos sugieren la importancia de la regulación vascular de la LOX en la aterosclerosis, aunque se requieren nuevos estudios que permitan definir con precisión cuál es el papel de esta enzima en la formación y progresión de la placa.
Agradecimientos
Damos las gracias a Silvia Aguiló por su apoyo técnico.