Introducción
Estudios clínicos y experimentales han demostrado que la degradación de la matriz extracelular (MEC) mediada por las metaloproteasas (MMP) es crítica en la rotura de la placa aterosclerótica responsable de los síndromes aterotrombóticos agudos (p. ej., infarto agudo de miocardio e ictus isquémico)1-5 y favorece el desarrollo de aneurismas abdominales, aórticos y coronarios6-8. Además, datos clínicos recientes sugieren que algunas MMP están implicadas en la rigidez arterial9 y participan en el remodelado vascular10,11.
Las MMP son una familia de al menos 24 endopeptidasas dependientes del zinc, similares en su estructura y clasificadas en base al sustrato que digieren preferentemente y a sus dominios estructurales12-13. Las estromelisinas 1 y 2 (p. ej., MMP-3 y MMP-10) son relevantes por su capacidad de degradar varios componentes de la MEC, como el colágeno tipo IV, la laminina y los proteoglucanos14,15, y por su capacidad de activar otras MMP que pueden, a su vez, degradar la MEC (MMP-1, 8 y 13)16,17. Diversos estudios indican que existe una alta expresión de MMP-10 activa en distintos tipos de cánceres, que está implicada en el remodelado de la MEC asociado con el crecimiento del tumor18. Sin embargo, son pocos los trabajos que han relacionado la expresión de MMP-10 con la inestabilidad de la placa aterosclerótica19, y no hay ningún estudio clínico que relacione la MMP-10 con el grado de aterosclerosis.
El espesor íntima-media carotídeo (EIM) se emplea como un marcador establecido de aterosclerosis subclínica, capaz de predecir futuros episodios cardiovasculares20. En algunos estudios se ha sugerido una relación entre la inflamación, medida por los valores circulantes de proteína C reactiva (PCR ultrasensible [hs-PCR]), y la aterosclerosis subclínica21,22. Recientemente, nuestro grupo ha demostrado que la PCR induce directamente la expresión de la MMP-10 en células endoteliales humanas23. Además, en una pequeña serie de sujetos sin historia de enfermedad cardiovascular encontramos que los que tenían valores altos de PCR presentaban aumento de MMP-10 circulante23.
Teniendo en cuenta que las MMP desempeñan un papel patogénico en la aterosclerosis, en este estudio analizamos la relación entre los valores séricos de MMP-1, 9 y 10, el EIM carotídeo y la presencia de placas en las arterias carótidas, como medida directa de aterosclerosis subclínica, en sujetos asintomáticos con factores de riesgo cardiovascular.
Pacientes y métodos
Se analizó a un total de 400 sujetos aparentemente sanos (77,7% varones; edad media, 54,3 años) que acudieron para la evaluación del riesgo vascular en el Departamento de Medicina Interna de la Clínica Universitaria de Navarra. Ninguno de ellos presentaba enfermedad aterosclerótica vascular, basándose en los siguientes criterios: 1) historia de enfermedad coronaria, de ictus o de enfermedad arterial periférica, y 2) electrocardiograma (ECG) y radiografía de tórax normal. La enfermedad coronaria fue definida por: 1) historia previa de infarto de miocardio, angina, o uso de nitroglicerina, y 2) antecedentes de angioplastia coronaria o cirugía de bypass aortocoronario. La enfermedad cerebrovascular fue definida como historia de ictus, ataque isquémico transitorio o endarterectomia carotídea. Se registraron los síntomas de claudicación intermitente y se realizó una adecuada exploración para valorar los pulsos periféricos. Los criterios de exclusión fueron: alteración grave de la función renal (filtrado glomerular < 60 ml/ min), enfermedades inflamatorias crónicas y administración de antiinflamatorios, antitrombóticos, o terapia hormonal en las 2 semanas previas. Los pacientes con infección aguda, según criterios clínicos, también fueron excluidos.
Evaluación de los factores de riesgo cardiovascular
Además del registro de los síntomas de enfermedad isquémica cardíaca, vascular periférica e ictus, se obtuvo información sobre los factores de riesgo cardiovascular: diabetes mellitus, hipertensión arterial, dislipemia, obesidad y tabaquismo. Los pacientes se consideraban hipertensos con presión arterial sistólica > 139 mmHg y/o presión diastólica > 89 mmHg y/o empleo de antihipertensivos. La dislipemia se diagnosticó por valores de colesterol total >= 200 mg/dl, colesterol unido a lipoproteínas de baja densidad (cLDL) >= 130 mg/dl, colesterol unido a lipoproteínas de alta densidad (cHDL) ¾ 50 mg/dl, triglicéridos >= 150 mg/dl y/o empleo de hipolipemiantes. La obesidad se estimó por el índice de masa corporal (IMC) >= 30 kg/m2. La diabetes mellitus se definió con los valores de glucosa > 126 mg/dl, o el empleo de antidiabéticos. El tabaquismo se evaluó basándose en el consumo de cigarrillos y se definió como fumador >= 10 cigarrillos por día durante un año.
Se obtuvo el consentimiento informado de todos los pacientes, y el estudio fue aprobado por el Comité de Ética de la institución. La investigación se realizó conforme a la Declaración de Helsinki.
El 33,5% de la población presentó 0 o 1 factor de riesgo, frente a más del 50% que tenían 2 o más factores. Se calculó el índice de riesgo vascular global PROCAM en todos los varones24. El EIM se midió en todos los pacientes mediante ultrasonografía-Doppler de las arterias carótidas comunes (ACC), como una medida directa de aterosclerosis subclínica como ha descrito previamente nuestro grupo25-27.
La ultrasonografía se realizó con un transductor lineal de 5-12 MHz (ATL 5000 HDI). El EIM carotídeo se midió en áreas sin placa a 1 cm del bulbo carotídeo en cada ACC y se determinó el promedio de cada arteria carótida común, por 2 ecocardiografistas desconocedores de la información clínica. La reproducibilidad de las medidas inter e intraoperadores se revisó en 20 individuos que volvieron 2 semanas más tarde para un segundo examen. Los coeficientes de variación inter e intraanálisis fueron del 5 y el 10%, respectivamente.
Las placas de ateroma se definieron como estructuras ecogénicas en el lumen del vaso con un área un 50% mayor que el grosor de la íntima más la media de zonas adyacentes28.
Análisis de laboratorio
Marcadores inflamatorios. Las muestras de plasma y suero se extrajeron en ayunas por venopunción, se centrifugaron (20 min, 1.200 xg) y se guardaron a 80 °C hasta su análisis. La actividad fibrinógeno del plasma se midió por el método de Clauss y la hs-PCR por inmunoensayo (Immulyte, Diagnostic Product Corporation). Los valores de factor von Willebrand (FvW, Asserachrom, Diagnostica Stago) e interleucina-6 (IL-6, Quantikine, R&D systems) se determinaron mediante ELISA siguiendo las instrucciones del fabricante.
Marcadores proteolíticos.Se empleó plasma citratado para determinar MMP-1 y MMP-9 (Biotrak, Amersham Biosciences) por ELISA específicos. Los valores de MMP-10 se midieron mediante ELISA en el suero de los pacientes siguiendo las instrucciones del fabricante (Quantikine, R&D Systems). Los ensayos MMP reconocen las formas cimógeno y activas. Los coeficientes de variación inter e intraensayo para los ELISA fueron < 6%.
Perfil lipídico. Se midió el colesterol total, el cHDL, los triglicéridos y la glucosa por técnicas estándar de laboratorio, en muestras de sangre extraídas en ayunas. El cLDL se estimó con la ecuación de Friedewald.
Análisis estadístico
Las asociaciones entre los valores de MMP-10 y los factores de riesgo aterosclerótico se realizaron mediante test de correlación de Pearson, para variables continuas, y la prueba de la t de Student para muestras no pareadas, para las variables categóricas. También se analizaron las asociaciones entre los valores de marcadores inflamatorios y el EIM carotídeo por el test de Pearson. Posteriormente se empleó el análisis de regresión lineal múltiple para examinar la asociación entre los valores de MMP-10 y el EIM carotídeo tras ajustar para edad, sexo, factores de riesgo aterosclerótico tradicionales (obesidad, hipertensión, diabetes, tabaquismo y dislipemia), marcadores inflamatorios y medicación administrada. El EIM carotídeo se comparó por los terciles de MMP-10 mediante ANOVA seguido por el test de Bonferroni. La odds ratio (OR) para la asociación de EIM y terciles de MMP-10 se estimó mediante regresión logística. Se muestran las OR e intervalos de confianza (IC) del 95% que se obtuvieron tras el ajuste para covariables relevantes. Un modelo lineal se aplicó también a los valores de MMP-10 y la presencia de placas, con la edad y el sexo como covariables. El análisis se realizó en SPSS 11.0 con la opción de diagnóstico colinealidad. Todas las asociaciones se consideraron significativas para p < 0,05.
Resultados
Se incluyó en el estudio a 400 sujetos sin enfermedad clínica cardiovascular (edad media, 54,3 años; 77,7% varones) tras aplicar los criterios de exclusión. Las características de los pacientes se muestran en la tabla 1, en la que se observa que la frecuencia de los factores de riesgo tradicionales fue variable: el 81% era dislipémico (el 34,2% recibían hipolipemiantes), el 50,7% era hipertenso (el 42,8% con terapia antihipertensiva), el 32% era obeso, el 29,5% fumador y el 16% diabético (el 62,5% con antidiabéticos).
MMP-10 y factores de riesgo cardiovascular
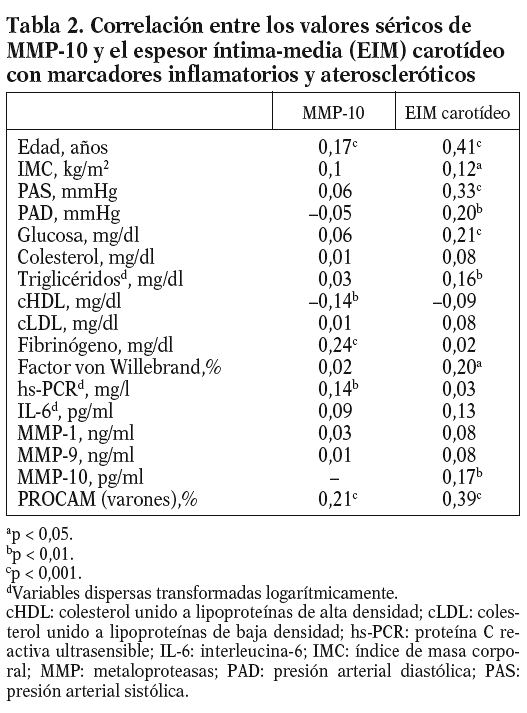
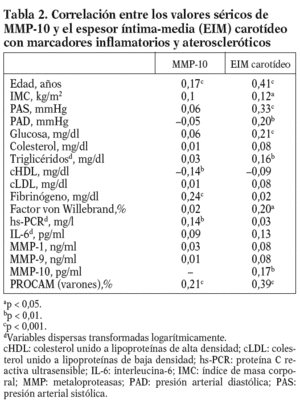
Los valores medios circulantes de MMP-10 en la población eran de 664,7 pg/ml, y mostraban un amplio rango de distribución (112,6-1.941,7 pg/ ml). Las correlaciones entre los valores de MMP-10 y los factores de riesgo aterosclerótico se muestran en la tabla 2. La MMP-10 se asoció con la edad (p < 0,001), y estaba más elevada en diabéticos (p < 0,05) y fumadores (p < 0,001) (tabla 3).
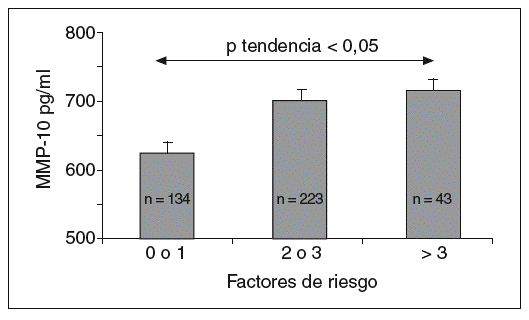
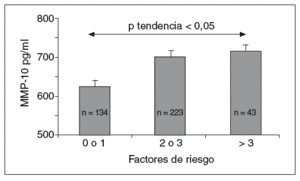
Los valores de MMP-10 aumentaron a medida que se incrementaba el número de factores de riesgo (fig. 1), y hubo una correlación positiva entre la MMP-10 y el índice PROCAM en varones (r = 0,21; p < 0,001; tabla 2). No se observó ninguna asociación con el sexo, el IMC, la hipertensión arterial, el colesterol total y el cLDL, pero existió una correlación negativa entre MMP-10 y HDL (p < 0,01). Además, la MMP-10 correlacionó positivamente con fibrinógeno (r = 0,24; p < 0,001) y hs-PCR (r = 0,14; p < 0,01), pero no con interleucina (IL)-6 y otras MMP, como MMP-1 y 9. Cabe resaltar, además, que los valores de MMP-10 en sujetos con estatinas, antihipertensivos y antidiabéticos fueron similares a los de los pacientes sin tratamiento (tabla 3).
Figura 1. Valores de MMP-10 en la población total (media ± error estándar a la media) según el número de factores de riesgo cardiovascular (tabaquismo, obesidad, hipertensión arterial, dislipemia y diabetes mellitus). MMP: metaloproteasas.
MMP-10 y EIM carotídeo
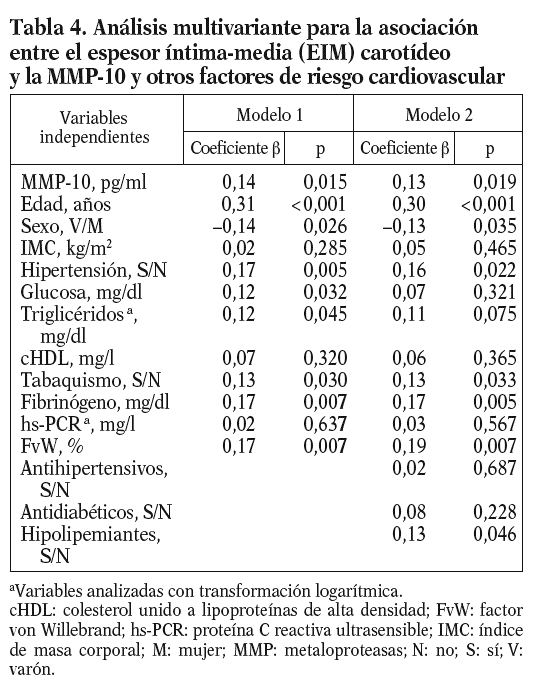
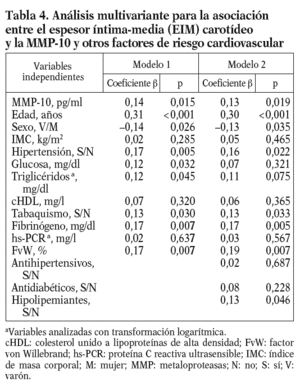
Para conocer la asociación entre la MMP-10 y los factores de riesgo aterosclerótico, se realizó un análisis univariante (tablas 2 y 3), que demostró una correlación positiva entre los valores de MMP-10 y el EIM carotídeo en la población total (r = 0,17; p < 0,01), no observada para MMP-1 y 9. Como esperábamos, el EIM carotídeo también correlacionó con algunos factores de riesgo aterosclerótico tradicionales y el FvW (r = 0,2; p < 0,05) (tabla 2). En el análisis de regresión múltiple (tabla 4), la asociación entre MMP-10 y el EIM permaneció significativa (p = 0,015) tras el ajuste para edad y sexo, otros factores de riesgo aterosclerótico y marcadores inflamatorios (modelo 1), y tras ajuste ulterior por tratamientos (p = 0,019, modelo 2).
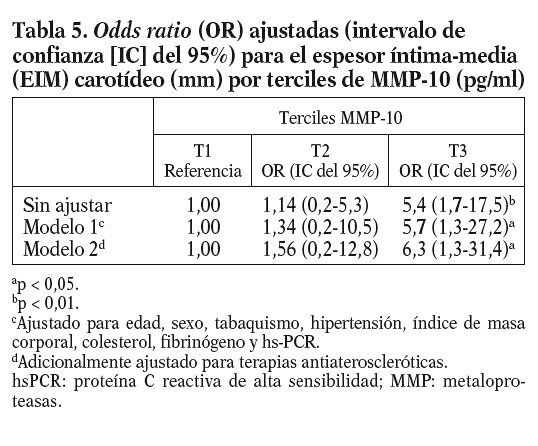
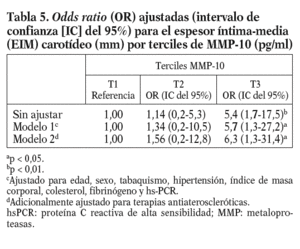
Dada la asociación entre MMP-10 y el EIM carotídeo, se analizó el EIM por los terciles de MMP-10. El EIM carotídeo era mayor en el tercil superior de MMP-10 en relación al medio (0,80 ± 0,25 frente a 0,73 ± 0,20 mm; p < 0,05) y al tercil menor (0,70 ± 0,16 mm; p < 0,01); además, la diferencia persistió tras ajustar por factores de riesgo aterosclerótico tradicionales y marcadores inflamatorios (OR ajustada 6,3; p = 0,024) (tabla 5). Finalmente, los valores de MMP-10 fueron superiores en pacientes con placas en las carótidas (n = 78) que en los pacientes sin placas (n = 322), tras ajustar para edad y sexo (792,93 ± 36,9 pg/ml frente a 642,02 ± 17,5 pg/ml; p < 0,01).
Discusión
Las MMP pueden favorecer el desarrollo de placas inestables1,29, pero también el remodelado vascular11,30,31 y la rigidez arterial9. En el presente estudio, en una serie de sujetos sin enfermedad cardiovascular hemos observado que valores elevados de MMP-10 se asocian tanto con un aumento de marcadores inflamatorios sistémicos, como con un incremento en el EIM carotídeo y con la presencia de placas carotídeas. Además esta asociación no depende de factores de riesgo aterosclerótico tradicionales, marcadores inflamatorios (fibrinógeno, hs-PCR y FvW) y tratamiento antiaterosclerótico. Por lo tanto, hemos demostrado una asociación independiente entre la MMP-10 sistémica (estromelisina-2) y la aterosclerosis subclínica en una amplia serie de sujetos asintomáticos. Los valores de MMP-10 fueron mayores en diabéticos y fumadores, y existió una correlación significativa con el riesgo vascular global PROCAM en el subgrupo de varones. Aunque estudios anteriores habían demostrado asociaciones entre los factores de riesgo aterosclerótico y los valores sistémicos de MMP-3 y 9 en pacientes con enfermedad cardiovascular3,4,32, ningún estudio había descrito previamente su relación con la MMP-10 circulante.
De acuerdo con un estudio reciente de nuestro grupo que muestra una correlación de MMP-10 con marcadores inflamatorios23, en este estudio también hemos encontrado una correlación significativa entre MMP-10 y fibrinógeno y MMP-10 y hs-PCR pero no con la IL-6, lo que indica que no todos los marcadores inflamatorios aumentan la MMP-10 y que existen mecanismos diferentes para PCR e IL-6 como marcadores de riesgo cardiovascular33.
Aún no se ha determinado si los valores elevados de MMP-10 pueden predecir el desarrollo de enfermedades cardiovasculares; en esta línea, nuestro trabajo demuestra que la MMP-10 se asocia con un incremento del EIM y con la presencia de placas de ateroma en arterias carótidas, que se mantiene significativa tras ajustar para factores de riesgo aterosclerótico tradicionales, marcadores inflamatorios y fármacos antiateroscleróticos, lo que sugiere una asociación independiente de MMP-10 con la aterosclerosis subclínica. Estos datos se corroboraron al observar que el EIM carotídeo estaba significativamente más elevado en los sujetos pertenecientes al tercil superior de MMP-10. En nuestro estudio no encontramos ninguna asociación entre la MMP-9 y el EIM carotídeo, en contraste con los datos de otro trabajo en pacientes con aterosclerosis3, probablemente por la diferente naturaleza de las poblaciones analizadas.
Nuestros datos apoyan una nueva hipótesis basada en que la MMP-10 puede desempeñar un papel en la aterogénesis, no sólo a través de la degradación de la MEC que conduciría a la inestabilidad de la lesión, sino también en las etapas iniciales del desarrollo y el crecimiento de la placa aterosclerótica. El engrosamiento de la íntima en respuesta a una lesión o durante la aterogénesis puede estar asociado con un aumento en la proliferación de las células vasculares de músculo liso (VSMC) y la cantidad de MEC producida por éstas. La mayoría de las VSMC que se localizan en la íntima provienen probablemente de la migración/proliferación de la capa media o de la diferenciación de precursores circulantes34, y las MMP desempeñan un papel regulador clave en estas interacciones matriz-célula y célula-célula. Filippov et al35 han demostrado recientemente el papel de la MMP-14 en la migración in vitro de las VSMC y el espesor de la arteria de carótida de ratón in vivo, pero es poco conocido el papel de las MMP en la proliferación VSMC36. En concreto, la MMP-10 es capaz de activar varias MMP, incluyendo MMP-1, 7, 9 y 1316,17, que podrían ser relevantes en la degradación de colágeno mediada por las CE, que favorecería la migración celular y el crecimiento de la íntima29,30,37.
La mayor parte de los estudios se han centrado en la degradación de la MEC mediada por MMP-10 como un factor principal en el crecimiento y extensión de los tumores38. Se ha demostrado la sobreexpresión de MMP-10 en varios carcinomas, incluyendo el de cabeza y cuello, el oral, el esofágico, el pulmonar y el de piel18,39. Algunos de estos estudios sugieren que la MMP-10 está implicada en el remodelado de la MEC asociado con el crecimiento y la extensión de las células metastáticas más que con la progresión a metástasis de la enfermedad18. Durante la reepitelización de las heridas, la MMP-10 se expresa por los queratinocitos que migran, y es crucial en la degradación controlada de la matriz que se produce en el lugar de la lesión40. Además, es interesante destacar que las citocinas inducen la expresión de MMP-10, y que las células que expresan MMP-10 en la lesión también sintetizan laminina-541, una proteína crucial de la MEC en la migración y la reparación celular que sigue a la lesión.
Es interesante resaltar que cáncer y aterosclerosis pueden compartir vías comunes en el endotelio vascular42. Sin embargo, se conoce poco el posible papel fisiopatológico de la MMP-10 en la progresión aterosclerótica humana. Henney et al19 demostraron un incremento en la expresión de MMP-10 en placas ateroscleróticas. Además, nuestro grupo ha demostrado recientemente un aumento de la expresión de MMP-10 en las placas ateroscleróticas de arterias carótidas humanas, colocalizando con macrófagos y células endoteliales23, lo que podría indicar un aumento en la síntesis de MMP-10 en las lesiones ateroscleróticas, que podría contribuir a incrementar los valores circulantes de MMP-10 de pacientes con mayor EIM carotídeo y, por tanto, estar asociada al proceso de crecimiento de la íntima. Finalmente, en pacientes con aneurismas aórticos abdominales se han descrito recientemente cambios en la secuencia de ADN del gen de la MMP-1043.
Por tanto, hemos demostrado una asociación independiente entre valores elevados de MMP-10 en suero y aterosclerosis carotídea, evaluada de manera no invasiva por el EIM carotídeo y por la presencia de placas ateroscleróticas en sujetos asintomáticos, lo que sugiere una relación entre MMP-10 y aterosclerosis precoz. Los valores circulantes de MMP-10 pueden representar un nuevo marcador de riesgo aterosclerótico en sujetos sin enfermedad clínica aterosclerótica, si bien se requieren más estudios para poder establecer su papel en el desarrollo de aterosclerosis.