La presencia de partículas de lipoproteínas de baja densidad (LDL) pequeñas y densas está normalmente asociada al aumento del número o del contenido en triglicéridos en las partículas de muy baja densidad (VLDL) del plasma. Por la acción de la proteína transferidora de ésteres de colesterol (PTEC), se produce una doble transferencia de lípidos: los triglicéridos de las partículas VLDL se intercambian por ésteres de colesterol de las partículas LDL y las de alta densidad (HDL). Los triglicéridos de LDL pueden ser entonces hidrolizados, preferentemente por la enzima hepático-lipasa (o la lipoproteína lipasa); esta hidrólisis, en combinación con la pérdida de ésteres de colesterol, reduce la concentración de lípidos del núcleo de las LDL, y da lugar a las LDL pequeñas y densas, con menos razón lípido/proteína que las partículas de LDL de mayor tamaño y menor densidad.
Esta heterogeneidad en cuanto a tamaño y densidad en las partículas de LDL ha originado la definición de dos fenotipos: el llamado fenotipo A, con una mayor proporción de partículas de LDL grandes y ligeras, y el fenotipo B, con predominio de partículas de LDL pequeñas y densas. Otras clasificaciones incluyen un fenotipo intermedio AB en el que no se objetiva un predominio claro de ninguno de los dos tipos de partícula. Desde un punto de vista clínico, la determinación del tamaño de las LDL es interesante puesto que las LDL pequeñas y densas pueden ser altamente aterogénicas debido a su mayor capacidad de penetración en la pared arterial, a su baja afinidad por el receptor de LDL lo que aumenta su vida media en el plasma y a su baja resistencia al estrés oxidativo. Así pues, desde la publicación de los primeros trabajos sobre la relación entre las LDL pequeñas y la enfermedad cardiovascular (ECV), el fenotipo B se ha asociado con un incremento de la susceptibilidad de desarrollar esta enfermedad.
En el Adult Treatment Panel III (ATPIII) del National Cholesterol Education Program (NCEP), la concentración circulante de colesterol LDL (cLDL) continúa siendo el objetivo terapéutico principal para la reducción de riesgo de ECV dependiente de lípidos. No obstante, junto a los factores de riesgo clásicos, el ATPIII introduce el concepto de factores de riesgo "emergentes" (lipídicos y no lipídicos).
Para que un nuevo marcador de riesgo de ECV sea aceptado como tal debe cumplir varias premisas: que se asocie con un incremento del riesgo de ECV, que se pueda variar mediante terapias que, a su vez, modifiquen el riesgo cardiovascular del paciente, que sea fácilmente cuantificable en cualquier laboratorio clínico y que se definan objetivos terapéuticos para el marcador en cuestión.
Como la capacidad de las partículas pequeñas de LDL no está firmemente establecida para predecir la ECV, independientemente de otros factores de riesgo, ni se dispone de métodos sencillos ni económicos para su medida (al menos hasta la publicación del ATPIII), la guía no recomienda su determinación en la práctica clínica habitual, aunque destaca su posible ayuda a los clínicos como indicador de dislipemia aterogénica y como uno de los factores de medida del síndrome metabólico. Su elevación también apoyaría cambios terapéuticos, como factor de decisión para el uso de tratamientos de terapia combinada en la disminución lipídica, frente al uso de una monoterapia con estatinas.
Subfracciones de LDL y riesgo de enfermedad cardiovascular
Crouse et al1 fueron los primeros en describir la existencia de una asociación significativa entre LDL pequeña (valorada mediante ultracentrifugación secuencial) con la presencia de enfermedad coronaria. Cuando se estudió a pacientes con estenosis coronaria superior al 50% en al menos una arteria coronaria mayor, se observó que éstos sujetos presentaban una disminución del peso molecular de LDL en comparación con los individuos control. El hecho de tener la LDL de menor tamaño se asociaba con una mayor probabilidad de tener diabetes, a la vez que existía hipertrigliceridemia y colesterol HDL (cHDL) disminuido en estos pacientes. No obstante, tras considerar la influencia de los triglicéridos plasmáticos, la relación entre el peso molecular de LDL y la ECV perdía significación estadística (p < 0,10).
En un estudio de casos de infarto de miocardio no mortal y controles, el fenotipo B se observó asociado con un riesgo tres veces más elevado de presentar ECV, aunque la asociación desaparecía tras considerar la influencia de los triglicéridos plasmáticos2. Griffin et al3 observaron que el riesgo de presentar ECV era siete veces mayor cuando las concentraciones de LDL pequeñas y densas superaban los 2,58 mmol/l.
Algunos estudios, como el Québec Cardiovascular Study4, han demostrado que individuos con predominio de LDL pequeñas y densas tienen un riesgo de ECV de 3,5 a 4 veces superior que los que tienen LDL grandes. Campos et al5 describieron una disminución del tamaño de la LDL en individuos con ECV grave (más del 75% de estenosis), pero considerando los triglicéridos plasmáticos y el cHDL, el tamaño de las LDL parecía no ser el predictor independiente más importante de ECV.
En el Stanford Five-City Project6, primer estudio que investigó de manera prospectiva la relación de la heterogeneidad de la LDL y la ECV, el tamaño
de la LDL fue significativamente más pequeño en los casos frente a los controles (p < 0,001) y, además, la relación tamaño LDL-ECV era independiente de los triglicéridos, el cHDL, el tabaquismo, la presión arterial y el índice de masa corporal (IMC). No obstante, esta relación no se observó en el grupo de mujeres que representaban el 27,42% de los individuos estudiados.
Jansen et al7 seleccionaron a un grupo de individuos con estenosis coronaria superior al 50% y valores de lípidos poco alterados; éstos tenían, en general, menos ECV grave y un perfil lipídico más favorable que los pacientes de los otros estudios citados. Esta circunstancia podría explicar el hallazgo de una incidencia relativamente baja (35%) de fenotipo B de LDL en el grupo, aunque el fenotipo fuera más frecuente en aquellos individuos con un perfil lipídico más desfavorable (concentraciones elevadas de triglicéridos y reducidas de cHDL).
En otro subestudio del Québec Cardiovascular Study, se observó que no había diferencia en el diámetro de LDL entre casos de enfermedad coronaria y controles, pero una vez categorizado el mismo en tertiles (pequeño: LDL ¾ 25,64 nm; intermedio: LDL entre 25,65 y 26,05 nm; grande: > 26,05 nm), resultó estar asociado de manera significativa con la enfermedad coronaria isquémica (p < 0,01), incluso tras corregir por diabetes mellitus, presión sanguínea sistólica, historia familiar de enfermedad cardíaca isquémica y uso de medicamentos. Tras corregir por triglicéridos, apolipoproteína B (apo B) y cHDL simultáneamente, la relación entre el riesgo de enfermedad coronaria isquémica y la existencia de LDL pequeña y densa se vio reducida a una ligera significación (p = 0,08). En contraposición con estos datos, en un estudio más reciente se ha descrito que las LDL más grandes serían las mejores predictoras de episodios coronarios en una población de sujetos con infarto de miocardio8.
En conclusión, los diferentes resultados observados de la asociación de la LDL pequeña y densa con la ECV pueden deberse a criterios de selección de los sujetos incluidos en los diferentes estudios. Factores como el perfil lipídico de los pacientes analizados (p. ej., contar sólo con individuos normolipémicos o bien con individuos con mínimas alteraciones tanto de colesterol como de triglicéridos) podrían justificar los resultados de aquellos estudios en los que no se encontró asociación entre la LDL pequeña y densa y un incremento de ECV.
Factores genéticos y ambientales causantes
de la heterogeneidad de las LDL
La correlación del fenotipo de LDL con diferentes variables lipídicas como el cHDL, el cLDL y los triglicéridos, demostrada en diversos estudios, sugiere la existencia de una vía metabólica que influiría en la distribución de las partículas LDL dentro del rango de tamaños posibles; esta vía, como otras del metabolismo lipídico, podría tener influencias genéticas9.
Algunos análisis genéticos cuantitativos indican que casi la mitad (44%) de la variación del tamaño de las partículas HDL y LDL se explica por efectos aditivos de los genes y que la correlación fenotípica entre ambas se debe, en parte, a acciones pleiotrópicas de un conjunto de genes, con influencia o no de las concentraciones de triglicéridos10.
Trabajos en sujetos con hiperlipemia familiar combinada (enfermedad oligogénica caracterizada por aumentos del colesterol y/o triglicéridos y de la apo B y por la presencia de elevada heterogeneidad en las LDL) sugieren la existencia de una herencia autosómica para el fenotipo B de las LDL, con un modo dominante o aditivo y un componente multifactorial pequeño, pero significativo. En familias con hiperlipemia familiar combinada, el predominio de LDL pequeñas y densas parece ser heredado frecuentemente como un carácter genético simple, estrictamente asociado a concentraciones elevadas de triglicéridos en el plasma. Por el contrario, el aumento de las concentraciones de apo B encontrados en estos pacientes no se explicaría por la localización propuesta11.
También los individuos heterozigotos para la deficiencia de lipoproteinlipasa (LPL) presentan múltiples anormalidades en las lipoproteínas, incluyendo el fenotipo B de LDL12. En ocasiones, en éstos se ha descrito un aumento de las lipoproteínas de muy baja densidad (VLDL) y de LDL pequeñas y densas (detectable en plasma como un aumento de las concentraciones de triglicéridos) y en otras, un aumento de las lipoproteínas de densidad intermedia (IDL) y LDL pequeñas y densas (detectable como un aumento del colesterol).
Métodos de identificación y valoración de subfracciones de LDL
Aunque la investigación sobre el tamaño de las LDL se viene realizando desde hace años, no se dispone de un método estandarizado para su determinación. La mayor parte de los métodos usados para su estudio se basan en la separación por electroforesis mediante geles de poliacrilamida con concentraciones fijas, tanto en gradiente linear como no linear. También existen más métodos, algunos clásicos, como la ultracentrifugación (UC) en gradiente de densidad, y otros, como la resonancia magnética o uno basado en una simple precipitación de lipoproteínas. Por otra parte, se ha sugerido que cálculos como el cociente cLDL/apo B, HDL/triglicéridos, colesterol total/triglicéridos u otros pueden ser estimadores sencillos de la existencia de partículas LDL pequeñas y densas.
Ultracentrifugación en gradiente de densidad (ultracentrifugación preparativa)
Existen distintos procedimientos de UC en gradiente de densidad para caracterizar las subfracciones de LDL; los diferentes procedimientos se diferencian en la formación del gradiente y en el perfil de fraccionamiento y no hay consenso acerca de sus condiciones. Un ejemplo de éstos reside en el aislamiento de 6 subfracciones usado en nuestro laboratorio13,14, consistente en la superposición de 7 soluciones de densidad con KBr sobre plasma previamente llevado a una concentración de 1.090 g/ml, seguida de una UC durante 20 horas a 20 °C y 160.000 g en rotor basculante, y posterior separación de seis subfracciones de LDL con distintos intervalos de densidad entre 1.020 y 1.056 g/ml.
La reciente descripción de una UC mediante gradiente con iodixanol15 permite diferenciar el predominio de LDL pequeñas y densas en un tiempo mucho más rápido (3 horas), lo que aumenta su práctica en el laboratorio. Otra ventaja añadida es que, en caso de querer analizar la composición lipídica de cada subfracción, no es necesario dializar la muestra gracias a las características intrínsecas al iodixanol: es una sustancia inerte, no es tóxico para las células y no es un inhibidor enzimático.
Los principales inconvenientes de este tipo de métodos son conocidos: utillaje costoso ultracentrífugas, rotores y mantenimiento, tiempo muy largo para una separación completa de las subfracciones (excepto en el caso concreto del iodixanol), existencia de cambios lipoproteicos durante la UC (lípidos y apolipoproteínas tienden a separarse); complicado proceso de preparación del gradiente, que requiere un entrenamiento muy específico del personal que lo realiza, y utilización de grandes cantidades de plasma para un análisis adecuado de la distribución de las lipoproteínas. Además, el fraccionamiento precisa uno de estos sistemas para la obtención final de las subfracciones: un fraccionador especial de gradiente, una perforación al final del tubo o una recogida de las subfracciones (con o sin pipeteo manual) desde la parte superior, sistemas que necesitan una gran cantidad de tiempo y una meticulosidad extrema debido a la facilidad de mezcla entre subfracciones en la separación.
A pesar de estas dificultades, la UC en gradiente de densidad proporciona una muy buena resolución entre las subfracciones lipoproteicas y posibilita el análisis de su composición química.
Electroforesis
La electroforesis en gel de poliacrilamida permite separar directamente distintas subfracciones de LDL y HDL, con una mejor resolución que las otras técnicas descritas. La separación de subfracciones se produce tanto por su carga como por su tamaño. El gel de poliacrilamida puede ser de concentración fija o en gradiente linear o no linear.
Las ventajas de separar las subfracciones de LDL utilizando métodos electroforéticos frente a la UC son claras: el equipo de trabajo es más económico y su uso más sencillo, las separaciones son relativamente rápidas, especialmente mediante el uso de muestras preteñidas, las lipoproteínas no se degradan durante la electroforesis y la técnica es relativamente sencilla, a la vez que requiere un pequeño volumen de muestra.
Electroforesis en gel con gradiente de acrilamida
La electroforesis en gel en gradiente es un método de laboratorio bien consolidado, con un uso muy extendido y empleado en multitud de estudios de investigación, para evaluación de posibles influencias de distintos factores en la distribución de subclases de LDL y HDL (dieta, ejercicio, medicaciones, etc.).
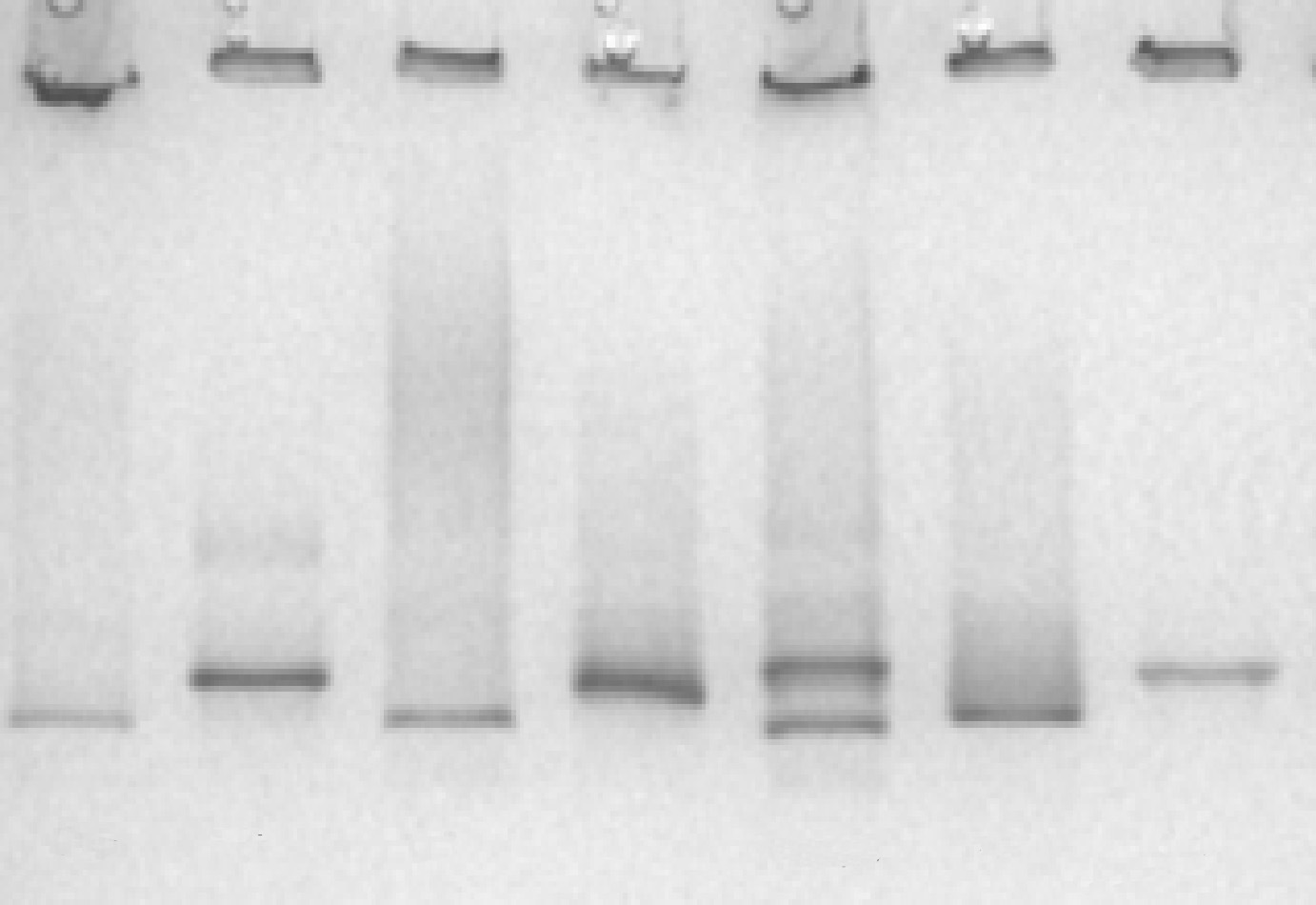
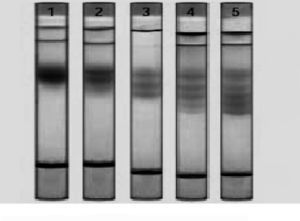
La base de este tipo de electroforesis es la migración de las lipoproteínas a través de un gradiente de concentración de poliacrilamida creciente sometido a un campo eléctrico. El tamaño del poro de la matriz va disminuyendo progresivamente a medida que la concentración de poliacrilamida va aumentando. Las partículas detienen su recorrido cuando llegan al límite de exclusión, que está en función de su tamaño y forma (fig. 1). Usualmente se utilizan geles con un gradiente de poliacrilamida del 2-16%16 que precisan la aplicación de una cantidad de muestra inferior a 25 µl. La separación puede ocupar hasta 24 h, dependiendo del voltaje utilizado. Una óptima separación de las subfracciones de LDL se consigue modificando los geles y optimizando su composición. La calibración normalmente se realiza mediante el uso de estándares formados por mezclas de proteínas de propiedades físicas conocidas y su validación puede realizarse mediante análisis directo del tamaño de las partículas con técnicas alternativas, como la microscopia electrónica.
Figura 1. Ejemplo de gel en gradiente de acrilamida 2-16% realizado en nuestro laboratorio. Fenotipo A: predominio de lipoproteínas de baja densidad (LDL) grandes y ligeras (> 25,5 nm). Fenotipo B: predominio de LDL pequeñas y densas (¾ 25,5 nm). ST: Estándar con bandas de tamaño conocido.
Geles de poliacrilamida en concentración fija
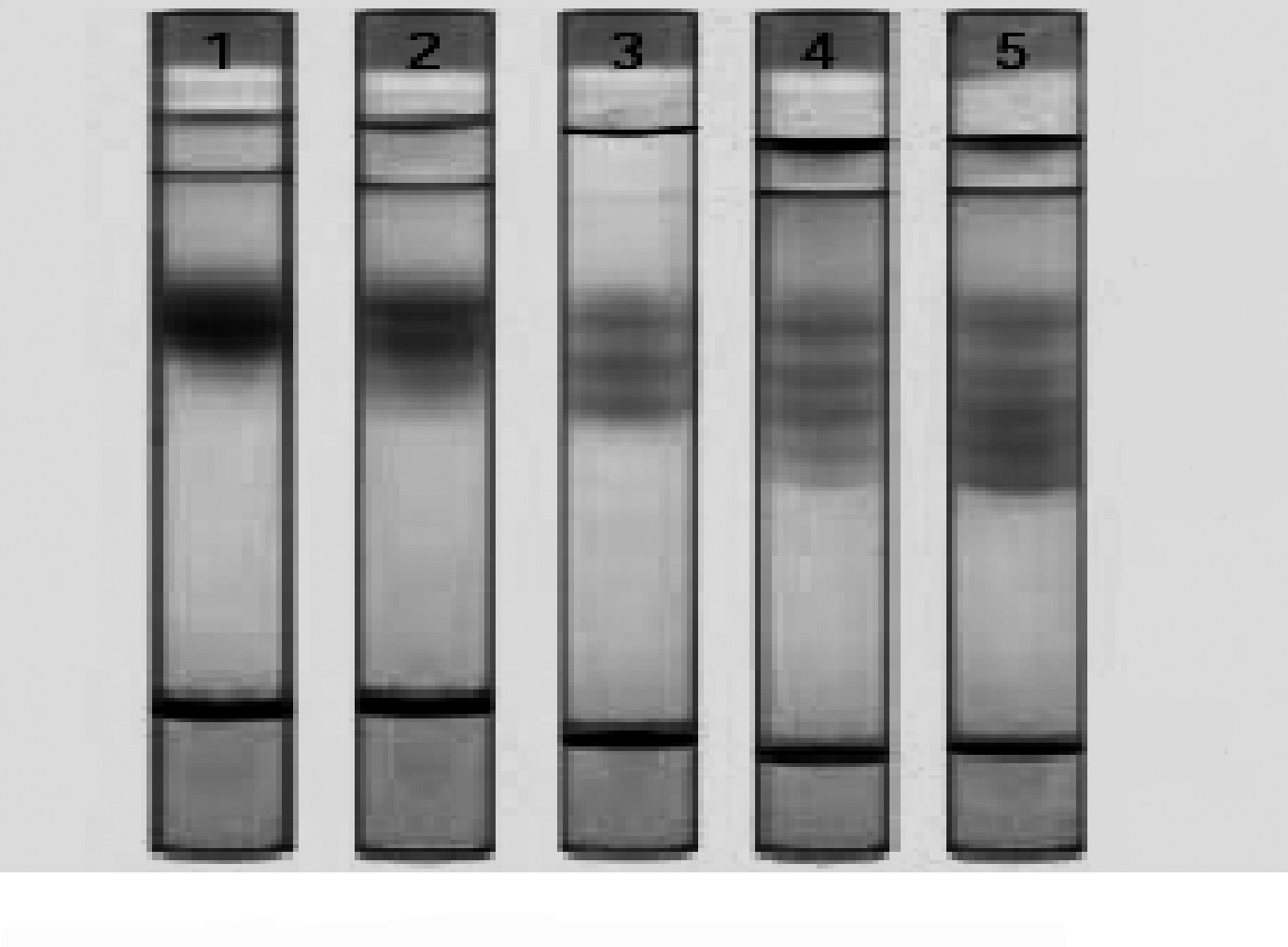
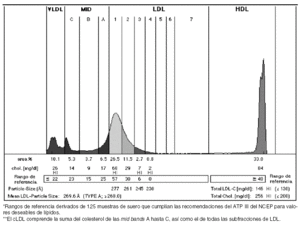
El sistema Lipoprint® (Quantimetrix Corporation) ha sido el primer sistema electroforético comercial, aprobado por la Food and Drug Administration de Estados Unidos (FDA), para su comercialización y uso en laboratorios clínicos que permite el análisis de subclases de lipoproteínas. Este método consiste en un gel de poliacrilamida con un gradiente fijo del 3%, dispuesto en un tubo de cristal y que sirve para la cuantificación de concentraciones relativas del cHDL, cIDL (llamadas mid-bands en el método), VLDL, LDL (ésta es la utilización aprobada por la FDA para finalidades clínicas) y de un máximo de 7 subfracciones distintas de esta última, llamadas desde LDL-1 (las partículas más grandes) hasta LDL-7 (las más pequeñas). También proporciona el tamaño medio de las partículas de LDL, aunque la FDA no ha aprobado este uso con fines clínicos, que ha quedado reservado para la investigación (fig. 2).
Figura 2. Geles de acrilamida con concentración fija del 3%. LDL-1 y LDL-2: lipoproteínas de baja densidad (LDL) grandes y ligeras. LDL-3 a LDL-7: LDL pequeñas y densas.
Brevemente, son necesarios 25 µl de suero que se añaden a la parte superior del tubo de gel junto a 200 µl de un gel de carga que contiene negro sudan B, un colorante específico para lípidos. Una vez polimerizada la mezcla durante unos 30 minutos mediante una lámpara fluorescente, los tubos se colocan en una cámara electroforética que se somete a una corriente eléctrica 3 mA por tubo de gel durante 1,05 horas. El tampón usado está compuesto por trisaminometano y ácido bórico, con pH de 8,2-8,6.
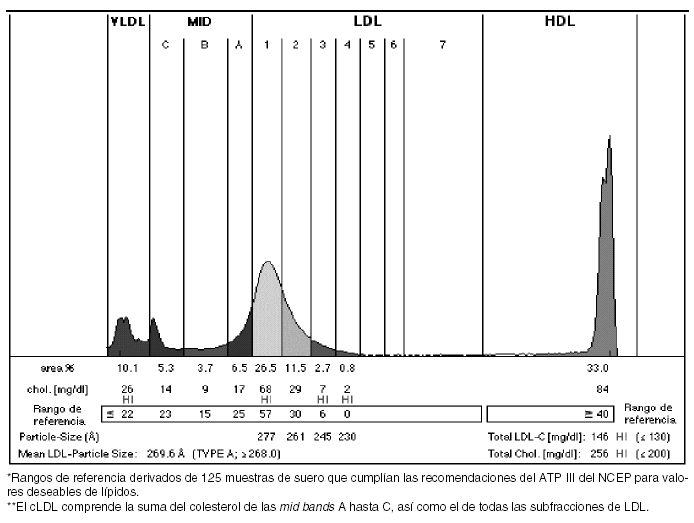
Una vez realizada la electroforesis y separadas las bandas, se lleva a cabo una densitometría de cada tubo, los datos son exportados y analizados en un ordenador mediante un software que introduce automáticamente unas líneas verticales con los valores apropiados de Rf, a la vez que calcula la correspondiente área bajo la curva de cada fracción (fig. 3). En menos de 3 horas se obtienen los resultados, por lo que su aplicabilidad en la práctica habitual en laboratorios clínicos especializados es buena17. El informe generado presenta el perfil de la distribución de lipoproteínas junto a los porcentajes de áreas y colesterol que contiene cada fracción.
Figura 3. Informe generado tras analizar las bandas obtenidas mediante un software que mide los valores de movilidad relativa (Rf) y calcula la correspondiente área bajo la curva de cada fracción. Se muestra el perfil de la distribución de lipoproteínas junto a los porcentajes de áreas y colesteroles de cada fracción.
El método ha sido comparado con el método de ß-cuantificación, que muestra una buena concordancia de resultados en las siguientes fracciones: VLDL (R2 = 0,909), LDL/midbands (R2 = 0,984) y HDL (R2 = 0,940).
El principal inconveniente del sistema es su elevado coste comparado con los métodos electroforéticos con preparación del gel por el propio laboratorio.
Resonancia magnética
La resonancia magnética estereoscópica es un método que permite cuantificar simultáneamente varias clases y subclases de lipoproteínas en unos pocos minutos.
La muestra (plasma) es sometida a la acción de un campo magnético. El sistema detecta las señales emitidas por el número total de grupos metilo terminales de los lípidos existentes en las partículas; los ésteres de colesterol y los triglicéridos contribuyen con 3 grupos y los fosfolípidos y el colesterol libre con dos. El número total de grupos metilo contenidos en cada subclase de partícula depende únicamente de su diámetro y no está afectado por diferencias en la composición lipídica de las partículas lipoproteicas presentes en el plasma de los pacientes. Además, las subclases de las partículas de LDL grandes y pequeñas pueden cuantificarse separadamente, como las de VLDL y las de HDL. A partir de las concentraciones de colesterol medidas se calcula la media ponderada del tamaño de VLDL, LDL y HDL.
La principal ventaja de este método frente a los otros es su rapidez (alrededor de 1 min para la cuantificación de distintas subclases de VLDL, LDL y HDL) y su eficiencia, que viene dada por la inexistencia de cualquier tipo de fraccionamiento físico ni manipulación de la muestra. Al igual que los métodos de electroforesis, el sistema emplea volúmenes mínimos de muestra (aproximadamente 0,5 ml) con la ventaja suplementaria de que ésta puede recuperarse tras el análisis.
Otvos18 caracterizó con este método hasta 15 subclases de lipoproteínas: 6 VLDL, 4 LDL (incluida la IDL) y 5 subclases de HDL. Los diámetros obtenidos son coherentes con los obtenidos mediante microscopia electrónica19, y unos 5 nm menores que los estimados por electroforesis en gel de gradiente20.
La rapidez del método contrasta con el precio prohibitivo de los aparatos necesarios para llevarlo a cabo. En la actualidad está patentado con el nombre de NMR Lipo Profile® y se realiza exclusivamente en el laboratorio de referencia LipoScience en Raleigh, Carolina del Norte (Estados Unidos), donde se pueden enviar muestras para su procesamiento.
Precipitación con heparina magnésica
Este método descrito recientemente21, dirigido a determinar el colesterol de las LDL pequeñas y densas, es sencillo de realizar y tiene un coste relativamente bajo. Consta de dos etapas: a) precipitación con heparina magnésica de las lipoproteínas con densidad < 1,044 g/ml, de manera que en el sobrenadante sólo quedan las LDL pequeñas y densas y las HDL, y b) medida del cLDL en el sobrenadante mediante un método homogéneo. La cuantificación del colesterol de las LDL pequeñas y densas mediante este método muestra una excelente correlación con el método de ultracentrifugación en gradiente de densidad (R = 0,90)22. Además, se observa una acentuada correlación inversa (R = 0,658; p < 0,0001) entre el tamaño de LDL determinado por electroforesis en gradiente de densidad, y el colesterol de las partículas de LDL pequeñas y densas determinado mediante este método.
Estimación del tamaño de LDL mediante cálculos
La razón HDL/triglicéridos ha sido uno de los primeros cocientes en aproximarse al predominio o no de LDL pequeñas y densas5. También la relación cLDL/apo B, usada por algunos autores para predecir el predominio de LDL pequeñas y densas23, es un cálculo basado en que el citado cociente tendrá valores menores en las partículas pequeñas y densas (cociente lípido/proteína menor) que en las partículas LDL de mayor tamaño (cociente lípido/proteína mayor). El método es sencillo y su principal coste reside en la determinación de apo B. No obstante, existen discrepancias en la bibliografía respecto a su eficacia. Se ha descrito que la estimación de tamaño mediante este cociente sería poco correcta en individuos con hipertrigliceridemia24. Por el contrario, otros autores han descrito una buena capacidad de predicción del tamaño de LDL mediante dicho cociente25, o incluso mediante el cociente colesterol total/triglicéridos, que en un estudio reciente se ha mostrado con una capacidad de predicción similar a la de cocientes anteriores y que se puede determinar con más facilidad26.
Consideraciones finales
Se dispone de varios métodos para identificar la heterogeneidad de las LDL; en consecuencia, sería necesario estandarizar los resultados para el uso de la medida de las LDL pequeñas y densas en la práctica clínica habitual.
A pesar del uso de distintas metodologías, la bibliografía científica demuestra que la correlación entre las LDL pequeñas y densas con la enfermedad coronaria es altamente consistente, tanto para el aumento de riesgo de presentar la enfermedad como para la predicción de futuros episodios clínicos. Mientras que algunos estudios han señalado la presencia de LDL pequeñas y densas como predictoras de cambios angiográficos, y que se producen cambios en el tamaño de la LDL en terapias asociadas con cambios en estenosis coronaria, otros no han podido demostrar ningún tipo de relación entre la heterogeneidad de las LDL y la respuesta a la terapia de disminución lipídica. No obstante, en la mayoría de los estudios se demuestra que la presencia de partículas pequeñas y densas se engloba en un patrón lipídico complejo que incluye valores elevados de triglicéridos, concentraciones reducidas de cHDL y altas de apo B.
En consecuencia, dada la falta de consistencia de los estudios clínicos y la disparidad y complejidad de los métodos necesarios para identificarlas, la medida de las LDL pequeñas y densas no debería recomendarse en la actualidad para su uso en la práctica clínica habitual.