La lipoproteína (a) (Lp[a]) es una lipoproteína esférica, rica en ésteres de colesterol y fosfolípidos con una apolipoproteína a que se asemeja estructuralmente a la molécula de lipoproteínas de baja densidad (LDL). Los valores elevados de Lp(a) se asocian a ataques cardíacos, apoplejías, estrechamiento de las arterias y reestenosis de vasos después de haber establecido quirúrgicamente un puente coronario. El hecho que la concentración de Lp(a) no pueda modificarse con los hipolipemiantes habituales influye en el cumplimiento terapéutico de los pacientes, ya que el porcentaje de colesterol transportado por la Lp(a) es inmodificable, y éste puede llegar a concentraciones de hasta 80-90 mg/dl.
ObjetivosEstudiar si los valores de Lp(a) influyen en la consecución de los objetivos terapéuticos y, en caso afirmativo, analizar las posibles alternativas.
Pacientes y métodosSe seleccionó a una población de 100 pacientes intervenidos de bypass aortocoronario. Todos los pacientes fueron pesados y tallados, se les tomó la presión arterial y el perímetro de cintura, se les determinó un hemograma, coagulación, perfil tiroideo, bioquímica general y un perfil de riesgo cardiovascular.
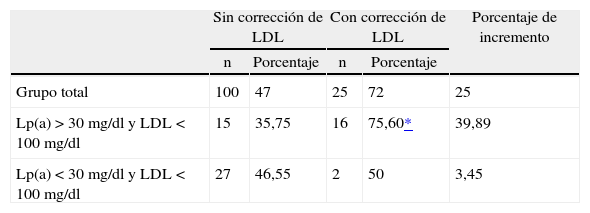
ResultadosDividimos a los pacientes en función de la concentración de Lp(a) al año de seguimiento. Según los valores de Lp(a) el cumplimiento es del 46,55% para Lp(a) < 30 mg/dl y del 35,75% para Lp (a) > 30 mg/dl. Si aplicamos el LDL corregido (colesterol unido a LDL – colesterol unido a Lp[a]) el cumplimiento en el grupo de mayor riesgo se incrementa en un 39,89%, pasando al 75,60%.
ConclusionesConfirmamos que la consecución de los objetivos terapéuticos de los pacientes puede mejorarse con un seguimiento de éstos de manera más intensiva y que esta consecución está influida por la elevación de las concentraciones de Lp(a), con lo que se confirma un cumplimiento más bajo en los pacientes con riesgo mayor en función de sus concentraciones de Lp(a).
Lipoprotein(a) (Lp[a]) is a spherical lipoprotein, rich in cholesterol esters and phospholipids, with an apolipoprotein structurally similar to the LDL molecule. Elevated LP(a) levels are associated with heart attacks, stroke, narrowing of the arteries and restenosis of vessels after coronary bypass surgery. Lp(a) concentrations cannot be modified by routine lipid-lowering therapy and consequently this lipoprotein will influence the achievement of therapeutic targets. The proportion of cholesterol carried by Lp(a) is unchangeable and can reach concentrations of up to 80-90 mg / dl.
ObjectivesTo study the influence of Lp(a) levels on the achievement of therapeutic LDL-cholesterol targets in high cardiovascular risk patients and to analyze the possible alternatives.
Patients and methodsWe selected a population of 100 patients undergoing aortocoronary bypass. In all patients, weight, height, blood pressure and waist perimeter were measured. Hemogram, coagulation parameters, thyroid profile, general biochemistry and cardiovascular risk profile were also determined.
ResultsPatients were divided according to Lp(a) concentrations at 1 year of follow-up. According to Lp(a) values, therapeutic LDL-cholesterol targets were achieved by 46.55% of patients with Lp(a) < 30 mg/dl and by 35.71% of those with Lp(a) > 30 mg/dl. When corrected LDL (LDL-c - Lp(a)-c) was applied, achievement of therapeutic targets increased by 39.89% in the group at highest risk, representing 75.60% of this group.
ConclusionsWe confirm that reaching therapeutic LDL-cholesterol targets can be improved by more intensive follow-up. Achievement of targets is influenced by rising concentrations of Lp(a), confirming that targets are harder to achieve in patients whose Lp(a) profile confers higher risk.
La lipoproteína (a) (Lp[a]) es una lipoproteína esférica, rica en ésteres de colesterol y fosfolípidos; contiene una glucoproteína específica, la apolipoproteína (a) (apo[a]), que es el componente esencial que le confiere propiedades especiales a la partícula y que se encuentra unida a la apo B-100 de manera covalente y no covalente a través de un enlace disulfuro1, lo que la asemeja a la estructura de las lipoproteínas de baja densidad (LDL).
Estudios retrospectivos2 han puesto de manifiesto una asociación entre valores elevados de Lp(a) y riesgo cardiovascular en individuos menores de 60 años, y otros estudios más recientes confirman que hay una relación directa entre valores de Lp(a), cardiopatía isquémica3–7 y su progresión angiográfica8. A los mismos resultados se ha llegado para la claudicación intermitente9, el infarto cerebral10, apoplejías, estrechamiento de las arterias y reestenosis de vasos después de haber establecido quirúrgicamente un puente coronario11.
El gen que codifica la apo(a) se considera uno de los genes más polimórficos de la especie humana, dando lugar a diferentes isoformas de apo(a) que tienen un efecto significativo en la concentración de la Lp(a). Actualmente se admite que el efecto aterotrombógeno de la Lp(a) está ligado con una concentración plasmática elevada. El principal factor que determina el nivel circulante de Lp(a) es el tamaño del gen de la apo(a)12; el tamaño de cada alelo varía en función del número de secuencias repetitivas correspondientes al kringle 4 de tipo 2; en diferentes estudios, se ha demostrado una relación inversa entre el tamaño de apo(a) y la concentración de Lp(a)13,14, de tal manera que si el tamaño de la región hipervariable es pequeño y la molécula es corta, en general la concentración plasmática de la Lp(a) estará elevada; por el contrario, si la molécula de apo(a) es larga, la concentración plasmática de ésta será baja. A pesar de que esta relación inversa entre tamaño de los alelos de apo(a) y concentración de Lp(a) no siempre se observa15, la cuestión es saber si el riesgo atribuido a la Lp(a) está ligado o no con las isoformas de apo(a) de baja masa molecular.
Al estudiar su estructura, se verificó una homología estructural de la Lp(a) con el plasminógeno16, ya que alrededor del 80% de los aminoácidos de la Lp(a) coinciden con los de esta molécula. Esta homología estructural entre ambas puede llevar a desencadenar la inhibición de la fibrinólisis17 y a desarrollar una diátesis trombogénica, ya que la presencia o ausencia de plasminógeno en un coágulo sanguíneo unido a una placa aterosclerótica puede marcar la diferencia entre una reparación benigna de un vaso alterado y un ataque cardíaco. Esta similitud entre una lipoproteína aterogénica y la enzima clave del sistema fibrinolítico proporciona una evidencia molecular del vínculo existente entre la aterosclerosis y la trombosis18. Asimismo, se ha comprobado que la Lp(a) compite con el plasminógeno y con su principal activador por los sitios de unión de la fibrina19–22. De esta manera, la Lp(a) inhibe la conversión del plasminógeno en plasmina.
La Lp(a) podría penetrar también en la pared de los vasos, alojada en el interior de los macrófagos, y éstos pueden sobrecargarse de una cantidad excesiva de lipoproteínas de baja densidad (LDL) oxidada, con el peligro de convertirse en células espumosas rebosantes de lípidos. Estas células pueden quedar atascadas en los vasos sanguíneos y pueden inducir la quimiotaxis de los monocitos, afectar al inhibidor 1 del activador del plasminógeno y a la expresión del factor tisular, por lo que podría promover la multiplicación celular, con el consiguiente espesamiento de la pared arterial.
El hallazgo inmunohistoquímico de la Lp(a) en lesiones ateromatosas indica que esta lipoproteína puede quedar retenida en la subíntima arterial, porque la Lp(a) se une fuertemente a la fibronectina, la cual está presente en las lesiones ateroscleróticas iniciales23. Además, puede formar complejos con los glucosaminoglucanos de la pared arterial. El establecimiento de estas uniones favorece la acumulación de lípidos en la íntima de las arterias y con ello promueve la formación de la placa de ateroma24,25.
La concentración normal de Lp(a) en sangre es menor de 30 mg/dl; no obstante, hay factores dietéticos y hormonales que influyen en la concentración de ésta; por ejemplo, el consumo de pescados la disminuye, y el hipotiroidismo y la acromegalia la incrementan26. El hecho de que no hay una enfermedad asociada con valores bajos de Lp(a) y la ausencia de factores selectivos en la evolución que limitarán el desarrollo de un gran polimorfismo de la apo(a), indica que la Lp(a) no es un factor biológico vital.
La predicción del riesgo cardiovascular asociado con la Lp(a) se realiza actualmente a partir de las concentraciones plasmáticas, está determinada por factores genéticos27 y se mantiene prácticamente constante en el curso de la vida; no se modifica con los cambios dietéticos; con los hipolipemiantes no se tienen resultados definitivos28–32, salvo con el ácido nicotínico y los ácidos grasos omega-3 no parecen tener efecto en ésta33–35.
El hecho de no modificarse con los hipolipemiantes habituales influye, sin duda alguna, en la consecución de los objetivos terapéuticos de los pacientes, ya que el porcentaje de colesterol transportado por la Lp(a) será inmodificable, y éste puede llegar a concentraciones de hasta 80-90 mg/dl.
La obtención o no de la consecución de los objetivos médicos en el marco de los servicios sanitarios es uno de los temas más relevantes desde puntos de vista muy variados. El problema del cumplimiento de objetivos en el tratamiento de las dislipemias está definido, principalmente, por el abandono o un cumplimiento parcial de éste. No hay estudios consistentes acerca de dicho abandono en la práctica médica habitual, siendo la mayor parte de los datos disponibles procedentes de grandes ensayos clínicos. El cumplimiento en estos ensayos36–42 oscila entre el 12 y el 45%, y es más bajo en los fármacos con menor eficacia o en los que tiene un impacto mayor en efectos secundarios asociados. Otros motivos de estas diferencias pueden residir en el propósito del tratamiento y, así, los pacientes en prevención secundaria cumplirían mejor, debido a que están motivados al haber experimentado un episodio cardiovascular; pero, por otro lado, el cumplimiento es peor debido a que los objetivos son mucho más exigentes.
El principal objetivo de este trabajo es comprobar si los valores de Lp(a) influyen en la consecución de objetivos terapéuticos y, en caso afirmativo, analizar las posibles alternativas.
Pacientes y métodosSe seleccionó a una población de 100 pacientes de riesgo cardiovascular alto que han sido intervenidos de bypass aortocoronario por el Servicio de Cirugía Cardiovascular en el Hospital Virgen Macarena de Sevilla. La recogida de datos de los pacientes se inició en enero de 2006 y continuó hasta enero de 2009. Para la inclusión de cada paciente en nuestro estudio, era condición indispensable la aceptación del consentimiento informado por parte del paciente y la cumplimentación de la ficha de datos y seguimiento de éstos. Se incluyó a pacientes de ambos sexos y se excluyó a los que presentaran algún tipo de enfermedad previa que afecte al metabolismo lipídico, o que carecieran de datos antropométricos completos.
En todos los pacientes se anotó peso y talla, se procedió a la medición del perímetro de cintura y se le midió la presión arterial. En el cuestionario cumplimentado por los pacientes, se interrogaba acerca de los factores de riesgo siguientes: tabaco, diabetes mellitus, hipertensión arterial, antecedentes familiares de enfermedad cardiovascular, antecedentes familiares y personales de enfermedad cardiovascular y diferentes tratamientos farmacológicos.
A todos los pacientes se les determinó un hemograma, coagulación, perfil tiroideo, bioquímica general y un perfil de riesgo cardiovascular que incluye parámetros habituales como el colesterol total, y triglicéridos (métodos enzimáticos); tras una ultracentrifugación para la separación de las lipoproteínas, se determinó el colesterol unido a cada una de ellas (colesterol unido a lipoproteínas de alta densidad [cHDL], colesterol unido a LDL [cLDL] y colesterol unido a lipoproteínas de muy baja densidad [cVLDL]); el perfil incluye también la cuantificación de las apolipoproteínas A-I y B-100 y diversos marcadores de riesgo e inflamación como la Lp(a), la proteína C reactiva (PCR) ultrasensible, el fibrinógeno y la homocisteína, que fueron determinados por inmunonefelometría. En el caso de producirse aumentos en los valores de homocisteína, se cuantificó el ácido fólico y la vitamina B12 por electroquimioluminiscencia para comprobar si este aumento puede ser motivado por un déficit vitamínico. Para el estudio estadístico, se calcularon concentraciones medias con un intervalo de confianza del 95%, y un análisis de varianza de medidas repetidas para comprobar la significación estadística.
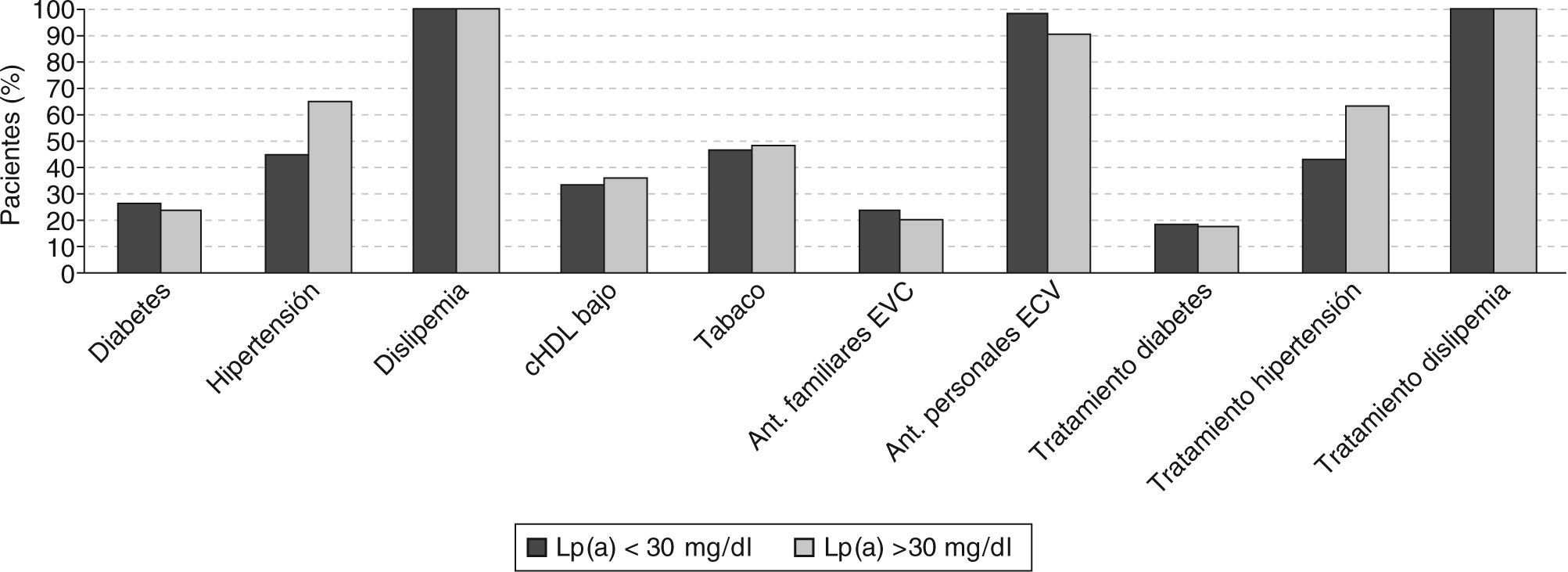
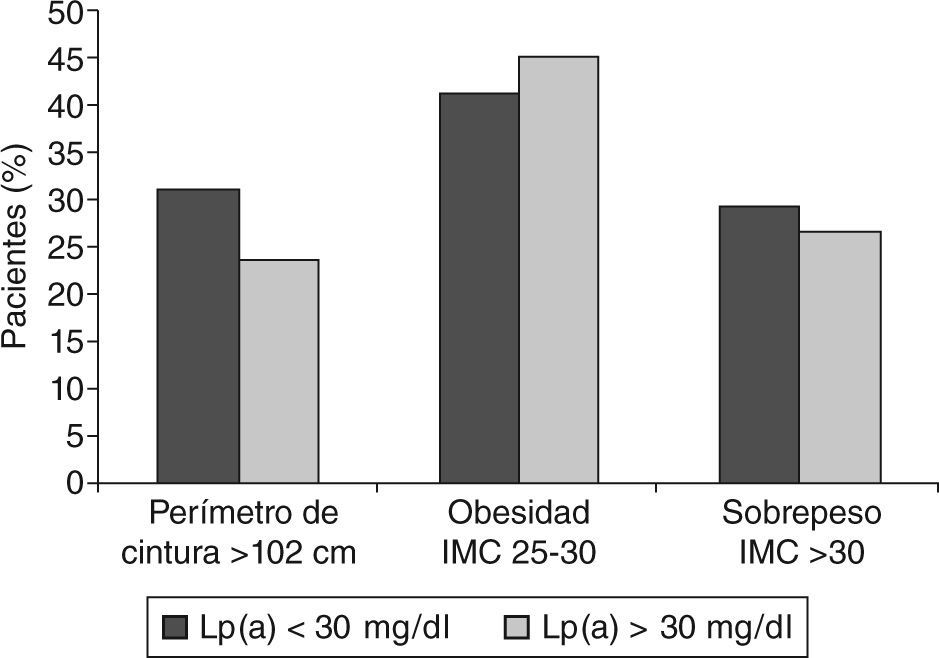
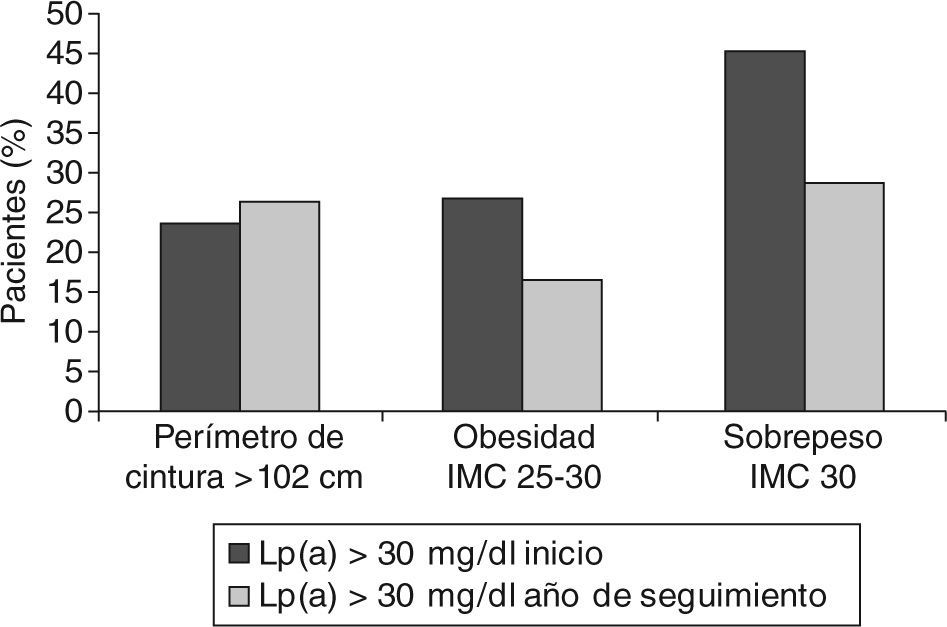
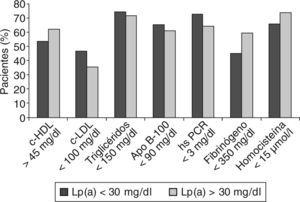
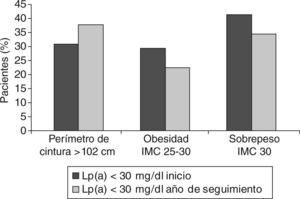
ResultadosCon el fin de observar la influencia que la Lp(a) pueda tener en las cifras de cLDL dividimos a los pacientes en función de la concentración de Lp(a) al año de seguimiento. El primer grupo está constituido 58 pacientes con concentración de Lp(a) < 30 mg/dl y el segundo grupo, por 41 pacientes con Lp(a) > 30 mg/dl. Cuando analizamos los distintos factores de riesgo en estos 2 grupos (fig. 1), observamos que los grupos son muy equiparables a excepción de la hipertensión que es más frecuente en el grupo Lp(a) > 30 mg/dl. Alrededor de un 20% de los pacientes de ambos grupos presenta antecedentes familiares de enfermedad cardiovascular, y más de un 90% presenta también antecedentes de algún episodio cardiovascular previo. El porcentaje de pacientes en tratamiento para la diabetes melltius y dislipemia es similar en ambos grupos. Respecto a la obesidad, el grupo Lp(a) < 30 mg/dl es el que presenta al inicio del estudio un porcentaje mayor de pacientes con sobrepeso y perímetro de cintura > 102 cm (fig. 2).
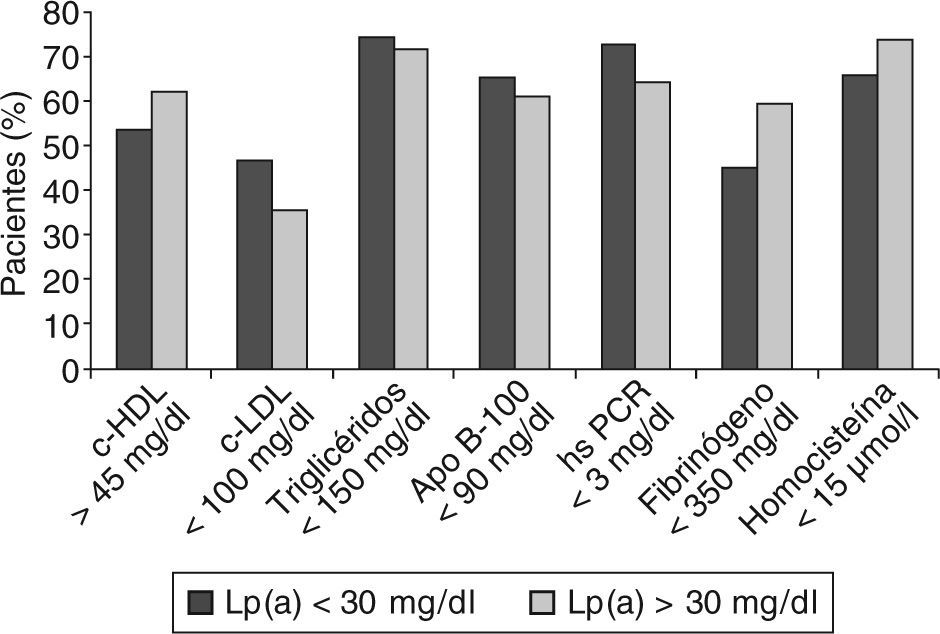
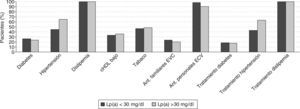
Respecto a los factores de riesgo lipidícos, emergentes y de inflamación, en la figura 3 puede observarse el porcentaje de pacientes que alcanza valores deseables de cHDL, cLDL, triglicéridos y apo B-100 y de los marcadores PCR, fibrinógeno y homocisteína.
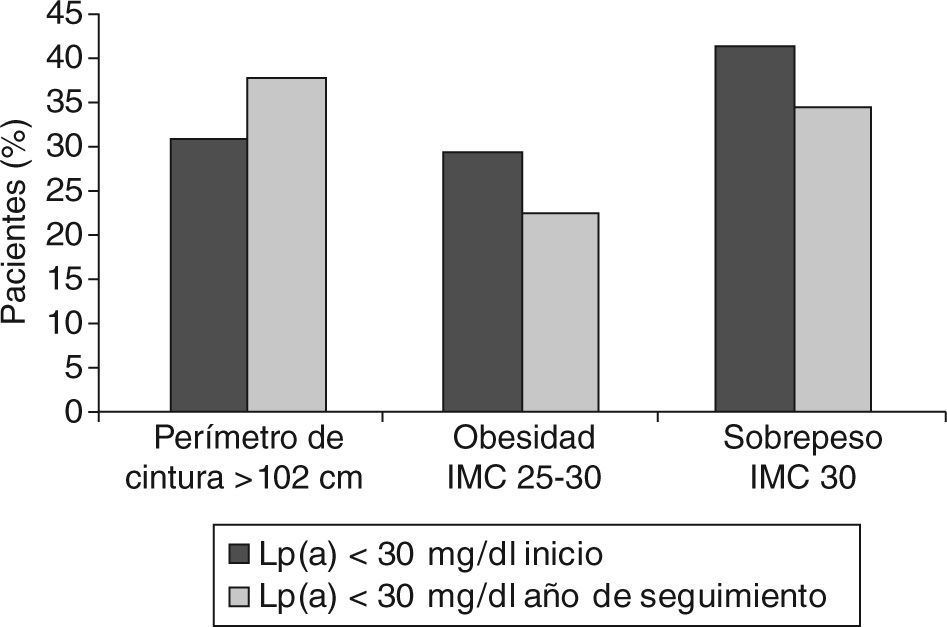
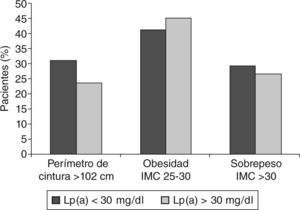
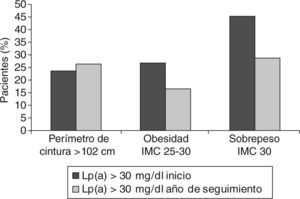
Al finalizar el estudio, las características de los pacientes referentes al IMC y al perímetro de cintura se encuentran reseñadas en las figuras 4 y 5 y se observa que en el grupo Lp(a) < 30 mg/dl el sobrepeso pasó del 29,30 al 22,41% y la obesidad del 41,37 al 34,48%; y en el grupo Lp(a) > 30 mg/dl el sobrepeso descendió del 26,61 al 16,60% y la obesidad del 45,23 al 28,57%. Sin embargo, estos descensos no se reflejaron en el perímetro de cintura que aumentó del 23,80 al 26,19% en el grupo Lp(a) > 30 mg/dl, y en el otro grupo pasó del 31,03 al 37,91%.
De acuerdo con la Guía Clínica del ATP III41, consideramos que los pacientes cumplen objetivos cuando sus cifras de cLDL son inferiores a 100 mg/dl. De esta forma, el cumplimiento en el grupo de 100 pacientes es del 47,00% y según los valores de Lp(a) el cumplimiento es del 46,55% para Lp(a) < 30 mg/dl y del 35,71% para Lp(a) > 30 mg/dl, con lo que se confirma un cumplimiento más bajo en los pacientes con un riesgo mayor en función de sus concentraciones de Lp(a).
DiscusiónEl interés en centrarnos en las concentraciones de esta molécula se debe a que los valores elevados de Lp(a) se asocian con ataques cardíacos, apoplejías, estrechamiento de las arterias y reestenosis de vasos en pacientes en los que se ha establecido quirúrgicamente un puente coronario11.
En nuestra población, cuando analizamos los distintos factores de riesgo en función de los valores de Lp(a), hemos comprobado que los grupos son muy equiparables, a excepción de la hipertensión y la obesidad, que son más frecuente en el grupo de riesgo mayor (Lp[a] > 30 mg/dl). Se observa un comportamiento inverso en el sobrepeso y en el perímetro de cintura.
Al año de seguimiento, comprobamos una mejoría importante en gran parte de los parámetros lipídicos y factores de riesgo analizados, pero se sigue manteniendo el hecho de que los pacientes del grupo Lp(a) > 30 mg/dl son los que siguen teniendo un riesgo mayor no sólo porque su cumplimiento de objetivos es más bajo, sino también porque es el grupo que tiene más pacientes con LDL > 100 mg/dl, fibrinógeno > 350 mg/dl y homocisteína >15 umol/l.
El estudio FORTIAM42 reveló que la Lp(a) en pacientes que han presentado un IAM se asocia a un peor pronóstico a los 6 meses de forma independiente a los factores de riesgo clásicos. El punto de corte para esta asociación de Lp(a) es de 60 mg/dl.
Suk Danik et al43, en un estudio prospectivo en el que se incluyó a 27.791 mujeres sanas que fueron seguidas durante 10 años, demostraron que valores elevados de Lp(a) (percentil 90, 65,5 mg/dl) se asocian con un incremento del riesgo cardiovascular, especialmente si además tienen elevaciones de cLDL. Este punto de corte es similar al dado por Gómez et al42 en el estudio antes comentado. Estos resultados, aunque con menos potencia estadística, se encuentran también en el percentil 75, que corresponde a concentraciones de Lp(a) de 32,8 mg/dl. Ambos trabajos corroboran nuestros resultados en el sentido de que pacientes con Lp(a) elevado tienen un riesgo cardiovascular mayor.
No hay una evidencia clínica que indique que descendiendo los valores de Lp(a) se disminuya el riesgo cardiovascular; sin embargo, tratamientos agresivos para descender cLDL han demostrado una disminución importante del riesgo cardiovascular en pacientes con valores elevados de Lp(a), lo cual indica que cuando los valores de Lp(a) se encuentren elevados, el objetivo primario debe ser el de intervenir agresivamente sobre el cLDL con estatinas o niacina44.
Al igual que ocurre con el tratamiento farmacológico, el grupo de mayor riesgo es el que consigue mayores beneficios, y así en los pacientes con Lp(a) > 30 mg/dl el sobrepeso y la obesidad descendió un 40%, mientras que en el otro grupo el descenso fue tan sólo de un 20%. Curiosamente, estos importantes descensos no se vieron reflejados en el perímetro de cintura, que aumentó en ambos grupos. No obstante, estas diferencias no alcanzaron significación estadística, debido probablemente al escaso número de pacientes que formaban cada grupo.
La Lp(a) debe cuantificarse en pacientes con aterosclerosis prematura, historia familiar de enfermedad coronaria prematura, pacientes que han tenido cirugía de bypass o puente arterial coronario con injerto, en los cuales el exceso de Lp(a) puede estar asociado a una estenosis del injerto o, en una población de alto riesgo, como puede ser la hipercolesterolemia familiar45.
El cumplimiento de objetivos terapéuticos obtenido puede verse modificado, como hemos visto por los valores de Lp(a). Dado que los fármacos hipolipemiantes habituales no modifican los valores de Lp(a), sería conveniente conocer el valor real de colesterol sobre el que podríamos intervenir y, por este motivo, aplicamos el llamado cLDL corregido, que se define como la diferencia entre el cLDL y el cLp(a), siendo este último el 45% de la concentración de Lp(a).
Entre los pacientes que no cumplen objetivos por tener un cLDL > 100 mg/dl, en el grupo de Lp(a) > 30 mg/dl hay 26 pacientes a los que sí les aplicamos la fórmula del cLDL corregido 16 de ellos si cumplirían objetivos al restarle el colesterol de la Lp(a) que no puede ser modificado. Al aplicar el mismo criterio para el grupo Lp(a) < 30 mg/dl, aparecen 2 pacientes más, por lo que el cumplimiento en ambos grupos se incrementa, especialmente en el grupo de riesgo mayor. De esta forma, podríamos decir que el cumplimiento obtenido fue del 75,60% en el grupo Lp(a) > 30 mg/dl y del 50% en el de Lp(a) < 30 mg/dl, con unos incrementos del 39,89 y del 3,45%, respectivamente, incrementos que una vez más confirman la influencia de la Lp(a) en el cumplimiento terapéutico (tabla 1).
Cumplimiento terapéutico de pacientes en función de los valores de lipoproteína (a) con y sin corrección del colesterol unido a LDL
| Sin corrección de LDL | Con corrección de LDL | Porcentaje de incremento | |||
| n | Porcentaje | n | Porcentaje | ||
| Grupo total | 100 | 47 | 25 | 72 | 25 |
| Lp(a) > 30 mg/dl y LDL < 100 mg/dl | 15 | 35,75 | 16 | 75,60* | 39,89 |
| Lp(a) < 30 mg/dl y LDL < 100 mg/dl | 27 | 46,55 | 2 | 50 | 3,45 |
LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a).
Consideramos muy satisfactorio el cumplimiento de objetivos conseguido si lo comparamos con lo publicado para pacientes en prevención secundaria. Se ha estimado que el porcentaje medio de pacientes que no cumple de forma adecuada las recomendaciones terapéuticas de sus médicos oscila entre un 30 y un 40%, lo que supone 2 de cada 5 pacientes. Sin duda, hay diferencias según distintos factores y, así, en las enfermedades agudas la tasa de incumplimiento llega al 20%, aproximadamente, mientras que en las crónicas es casi el doble y la tasa de incumplimiento es todavía más alta en el caso de regímenes terapéuticos que impliquen cambios en el estilo de vida, o en caso de complejidad en la modificación de un medicamento46–49.
Las cifras aportadas por Banegas et al50 en el trabajo "Control de factores de riesgo cardiovascular en España" y por Alvarez-Sala et al51 hablan de un 31% de cumplimiento; en el estudio Hispalipid50, los pacientes de riesgo alto tienen un cumplimiento del 15,1%; en el estudio Princeps, del 29,4%52, y en el estudio Reality53, donde se describe la proporción de pacientes de diversos países europeos que cumplen objetivos para LDL y colesterol total, la media de Europa está en un 40,5% y la de España, en un 26,3%, cifras todas ellas muy lejanas del 47% conseguidas por nosotros en el grupo general.
Por todo ello, confirmamos que la consecución de objetivos terapéuticos puede mejorarse con un seguimiento de los pacientes de manera más intensiva y que éste se ve influenciado por la elevación de las concentraciones de Lp(a), la cual debe cuantificarse para tomar las medidas oportunas, según se ha descrito.
Conflicto de interesesUna comunicación referente a esta línea de trabajo titulada Influencia de la Lp(a) en el cumplimiento terapéutico en pacientes de alto riesgo cardiovascular, se presentó en el XX Congreso Nacional de la SEA, Valencia 2007 y fue galardonado con una mención especial.