La combinación de marcadores bioquímicos y el diseño e implementación de algoritmos diagnósticos en el sistema informático de los laboratorios podrían convertirse en herramientas muy potentes en la estratificación del riesgo cardiovascular.
ObjetivosImplementar nuevos marcadores bioquímicos y algoritmos diagnósticos hasta ahora no disponibles para facilitar la estimación del riesgo cardiovascular y la orientación diagnóstica de las alteraciones lipídicas.
Material y métodosEstudio para la implementación de apolipoproteína B y de lipoproteína (a), así como la inclusión de diferentes algoritmos diagnósticos. Se ha realizado conjuntamente entre las diferentes unidades de lípidos de la Sociedad Española de Arteriosclerosis, Hospital Virgen Macarena de Sevilla, Hospital Juan Ramón Jiménez, Hospital Infanta Elena y Hospital de Río Tinto durante los años 2018 y 2019.
ResultadosSe han aplicado 4 algoritmos diagnósticos en el sistema de información del laboratorio, que mostraron 9.985 pacientes totales con c-LDL>200mg/dl. Según el algoritmo diagnóstico, que se amplió para que incluyera ApoB, 8.182 determinaciones presentaban una apolipoproteína B>100mg/dl. Se determinaron 747 casos de lipoproteína (a), de las cuales un 30,65% fueron superiores a 50mg/dl. El 71,80% presentaban resultados compatibles con partículas de LDL pequeñas y densas.
ConclusionesLa implementación de nuevos parámetros analíticos y el uso de algoritmos en los laboratorios en atención primaria permite identificar un número considerable de pacientes con diferentes alteraciones en el metabolismo lipídico que, junto con los factores de riesgo clásicos, podría contribuir a una correcta estratificación de riesgo y a evitar la progresión de la enfermedad cardiovascular.
The combination of biochemical markers, together with the design and implementation of diagnostic algorithms in laboratory computer systems could become very powerful tools in the stratification of cardiovascular risk.
ObjectivesTo implement new biochemical markers and diagnostic algorithms not yet available, in order to provide an estimation of cardiovascular risk and the diagnostic orientation of lipid alterations.
Material and methodsStudy of the implementation of apolipoprotein B and lipoprotein (a), as well as the inclusion of different diagnostic algorithms. This was carried out jointly by the different Lipid Units of the Spanish Society of Atherosclerosis, Hospital Virgen Macarena in Seville, Hospital Juan Ramón Jiménez, Hospital Infanta Elena, and Hospital de Río Tinto during 2018 and 2019.
ResultsThe 4diagnostic algorithms entered into the Laboratory Information System, showed a total of 9,985 patients with c-LDL>200mg/dl. The diagnostic algorithm was extended to include Apo B, with 8,182 determinations showing an apolipoprotein B>100mg/dl). A total of 747 lipoprotein (a) were determined, of which 30.65% were> 50mg/dl. More than 2/3 (71.80%) showed results compatible with small and dense LDL particles.
ConclusionsThe implementation of new analytical parameters and algorithms in Primary Care laboratory results can identify a considerable number of patients with different alterations in lipid metabolism. This, together with the classic risk factors, could contribute to a correct risk stratification in preventing the progression of cardiovascular disease.
Las enfermedades cardiovasculares (ECV) constituyen en la actualidad una de las principales causas de mortalidad en el mundo. Solo en Europa se contabilizan más de 4 millones de muertes1 por esta causa. Concretamente en España, según los datos más recientes aportados por el Instituto Nacional de Estadística correspondientes a diciembre de 2019, se produjeron 427.721 fallecimientos2.
Las alteraciones en el metabolismo de los lípidos, así como los factores de riesgo cardiovasculares (RCV), son un factor clave y predisponente en el desarrollo de la enfermedad ateroesclerótica cardiovascular3. Para prevenir su instauración y la progresión de futuros eventos cardiovasculares, se dispone de tablas de estimación para el cálculo del RCV. Las más utilizadas en Europa y recomendadas por la Sociedad Europea de Cardiología y la Sociedad Europea de Arteriosclerosis son las del proyecto SCORE4. La implementación de estrategias para mejorar el cálculo de riesgo tiene un valor clínico alto, pero presenta cierta dificulta si se basan únicamente en factores de riesgo clásicos. Se genera, por lo tanto, la necesidad de buscar nuevas herramientas o de introducir nuevos biomarcadores que mejoren la predicción del riesgo de ECV con capacidad de identificar a las personas en riesgo, dar estabilidad a los resultados cuando se repitan y ofrecer un impacto terapéutico con intervención temprana5. Recientes estudios han demostrado que algunos marcadores, incluyendo la elevación de lipoproteína (a) (Lp[a]), la homocisteína y, particularmente, la proteína C reactiva, están asociados con riesgo incrementado de coronariopatía6,7. Además, es conocido que la exposición continua a las lipoproteínas que contienen apolipoproteína B (ApoB) contribuye al crecimiento y progresión de las placas ateroscleróticas, por lo que es probable que el tamaño de la placa se determine tanto por la concentración de c-LDL circulante como por otras lipoproteínas que contienen ApoB, y por la duración total de exposición a estas lipoproteínas8. Al igual ocurre con otro biomarcador, como es la Lp(a), estudios de aleatorización mendeliana han demostrado de modo consistente que la exposición de por vida a niveles más altos de Lp(a) está fuerte y causalmente asociada con un mayor riesgo de ECV9,10. Es lógico, por tanto, trabajar en el desarrollo de modelos de predicción y prevención de la enfermedad ateroesclerótica cardiovascular con el objetivo de conocer sobre qué factores de riesgo intervenir para disminuir la probabilidad de que un paciente desarrolle un evento cardiovascular11. En la actualidad, diversas guías van incorporando nuevas recomendaciones sobre la utilidad de marcadores bioquímicos en la valoración del RCV. El documento de consenso recientemente publicado por la Sociedad Europea de Arteriosclerosis y la Federación Europea de Química Clínica y Medicina de Laboratorio12 cita la incorporación del colesterol no HDL al perfil lipídico básico en la toma de decisiones terapéuticas y valora si marcadores como la ApoB, la Lp(a) o el tipo de partículas LDL son útiles para guiar las decisiones terapéuticas. En esta línea, la reciente guía de la sociedad australiana para mejorar la atención de la hipercolesterolemia familiar incluye, además de los mencionados, el cálculo de partículas remanentes y la tríada lipídica aterogénica13. La combinación de marcadores bioquímicos y el diseño e implementación de algoritmos diagnósticos automatizados en el sistema informático de los laboratorios clínicos (SIL) podrían convertirse en herramientas muy potentes en salud pública para ayudar en la estratificación del RCV de pacientes desde la prevención primaria y, así, detectar de forma precoz alteraciones en el metabolismo lipídico.
El objetivo de este estudio es la implementación de nuevos marcadores bioquímicos y algoritmos diagnósticos en prevención primaria hasta ahora no disponibles en el laboratorio clínico para facilitar al médico peticionario la estimación del RCV y la orientación diagnóstica de las alteraciones lipídicas resultantes en las analíticas.
Este estudio para la implementación en la cartera de servicios de atención primaria de nuevas técnicas analíticas se ha realizado en 4 laboratorios pertenecientes a unidades de lípidos de la Sociedad Española de Arterioesclerosis: el del Hospital Virgen Macarena de Sevilla, el del Hospital Juan Ramón Jiménez, Hospital Infanta Elena y el del Hospital de Río Tinto, los 3 en Huelva. El proyecto se inició en el segundo semestre de 2018 y finalizó el 31 de diciembre de 2019.
Con la financiación obtenida de la beca de la Sociedad Española de Arterioesclerosis se obtuvieron diferentes kits para las determinaciones de ApoB y Lp(a), las cuales se automatizaron en los analizadores Roche 6000 y 8000 según disponibilidad en cada laboratorio clínico, y para ApoE en nefelómetro BN II Prospect. La implementación de las citadas técnicas analíticas se ha logrado por aplicación de algoritmos diagnósticos diseñados en los SIL Smarliss y Omega. Se ha confeccionado un algoritmo diagnóstico para hipertrigliceridemias con incorporación de ApoE, hipercolesterolemias con incorporación de ApoB y Lp(a) y dislipidemias diabéticas con incorporación de ApoB.
Además, se incorporaron en el perfil lipídico básico otros parámetros calculados como colesterol VLDL calculado (c-VLDL=triglicéridos/5), partículas de c-LDL pequeñas y densas (sd-LDL) estimadas por el cociente sd-LDL=LDL/ApoB<1,3 y colesterol no-HDL. A continuación, se exponen los siguientes algoritmos implementados en el SIL:
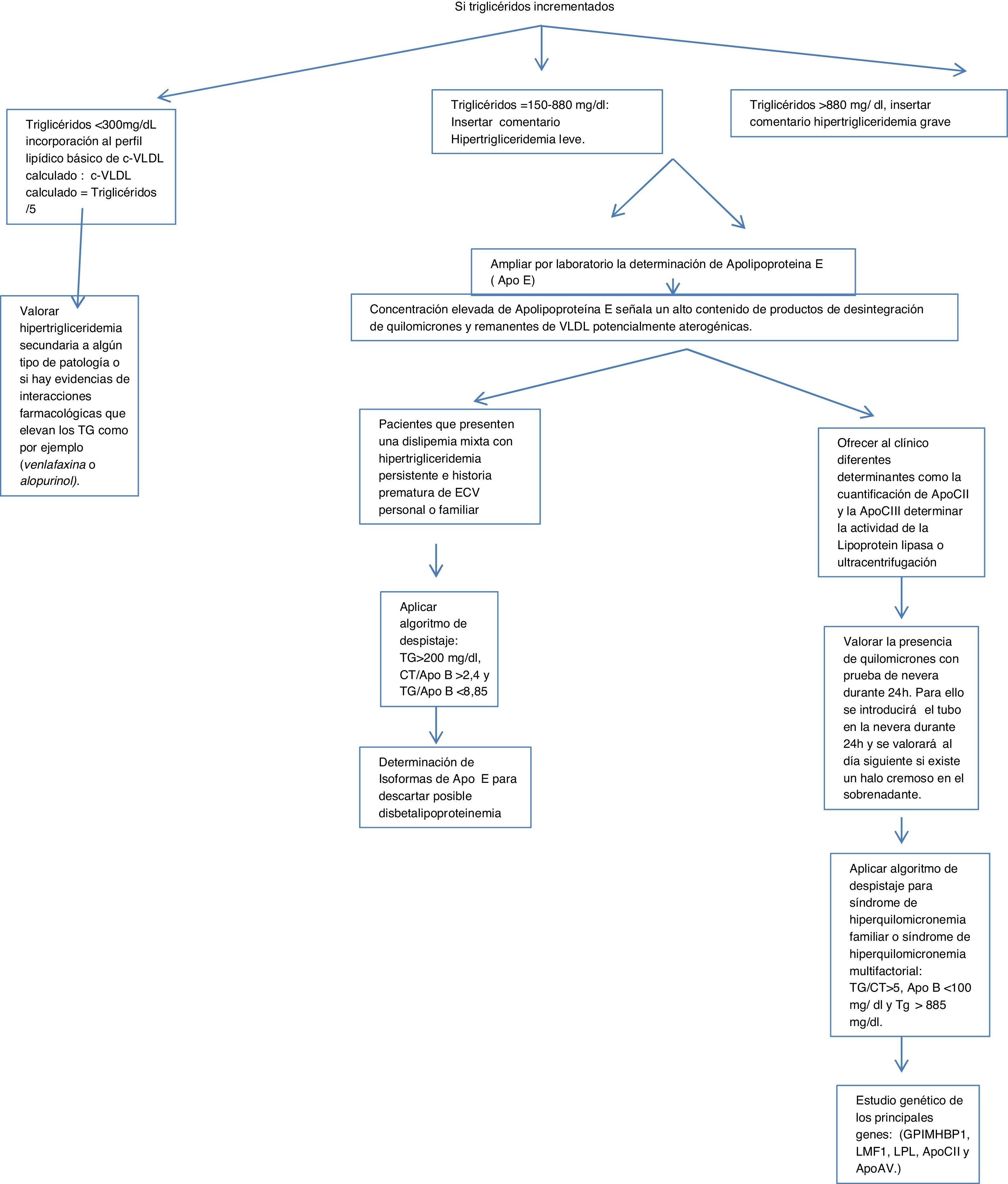
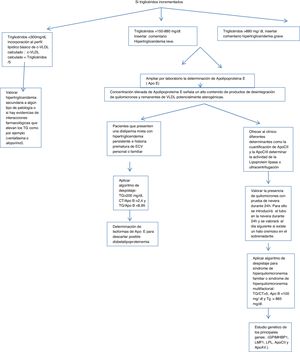
Algoritmo número 1: Despistaje de hipertrigliceridemias con incorporación de parámetro analítico ApoE en pacientes con concentración de triglicéridos> 150mg/dl.
En el caso de los triglicéridos incrementados en función de la concentración resultante en la analítica de rutina de atención primaria, se procede a la inserción de cálculos, alertas y ampliación de ApoE.
- 1)
Si:
- a)
Triglicéridos <300mg/dl, incorporación al perfil lipídico básico de c-VLDL calculado: c-VLDL calculado=triglicéridos/5.
- b)
Triglicéridos=150-880mg/dl: se insertó comentario: hipertrigliceridemia leve; valorar posibles causas secundarias.
- c)
Triglicéridos>880mg/ dl, se insertó comentario: hipertrigliceridemia grave.
Si los triglicéridos son superiores a 150, se procede a ampliar por laboratorio la determinación de ApoE insertando en el SIL la siguiente leyenda: Estudio de lípidos ampliado por laboratorio. La concentración elevada de ApoE señala un alto contenido de productos de desintegración de quilomicrones y remanentes de VLDL potencialmente aterogénicas.
- 1)
Valorar la presencia de quilomicrones con prueba de nevera durante 24h. Para ello se introducirá el tubo en la nevera durante 24h y se valorará al día siguiente si existe un halo cremoso en el sobrenadante.
- 2)
Aplicar algoritmo de despistaje para síndromes de hiperquilomicronemia familiar o multifactorial: triglicéridos/colesterol total>5, ApoB <100mg/dl y triglicéridos> 885mg/dl14.
- 3)
Con el fin de determinar el origen de esta hipertrigliceridemia se le pueden ofrecer al clínico diferentes determinantes, como la cuantificación de ApoCII y la ApoCIII (cofactores de la enzima lipoproteína lipasa, que hidroliza los triglicéridos) por técnicas inmunológicas, que no suelen estar disponibles en los laboratorios clínicos de práctica clínica, pero sí en laboratorios externos, se determina la actividad de la lipoproteína lipasa o se emplea la ultracentrifugación del suero. En caso de déficit de la actividad de la lipoproteína lipasa, se puede solicitar un estudio genético de los principales genes: (GPIMHBP1, LMF1, LPL, ApoCII y ApoAV.)
- 4)
Valorar hipertrigliceridemia secundaria a algún tipo de patología o si hay evidencias de interacciones farmacológicas que elevan los triglicéridos, como, por ejemplo, venlafaxina o alopurinol.
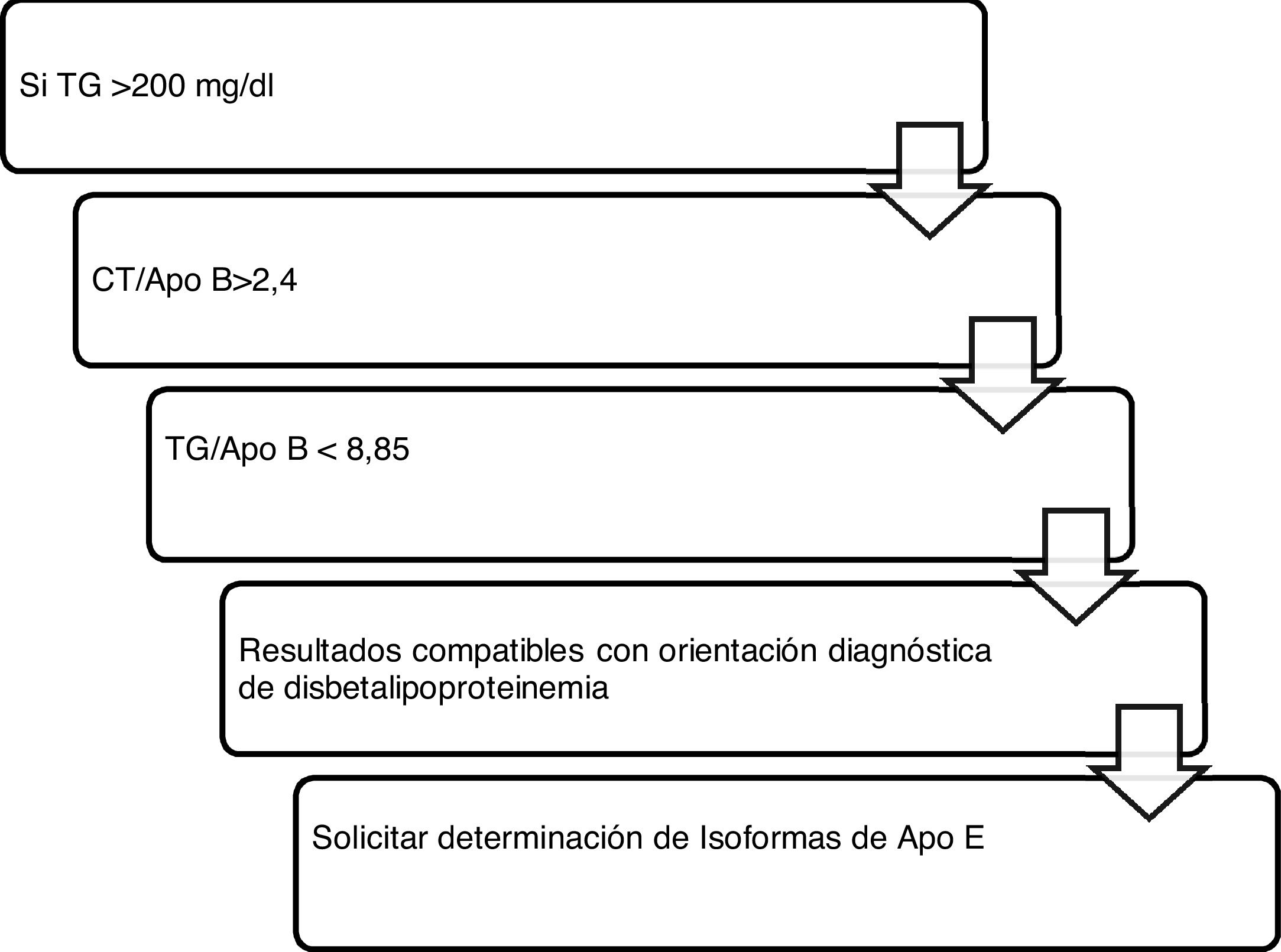
Para aquellos pacientes que presenten una dislipidemia mixta con hipertrigliceridemia persistente e historia prematura de ECV personal o familiar, sería interesante la determinación de isoformas de ApoE para descartar posible disbetalipoproteinemia (fig. 1).
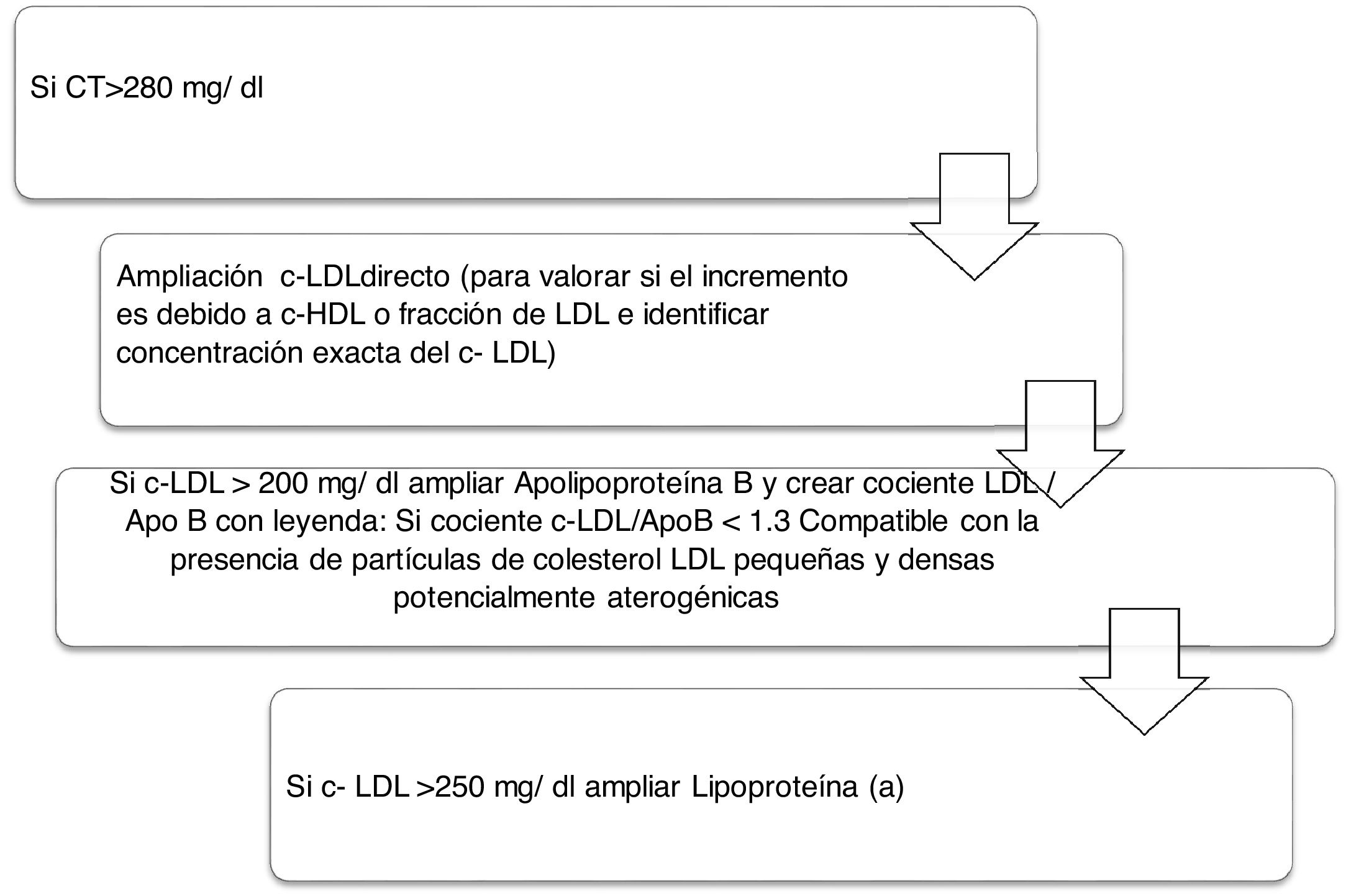
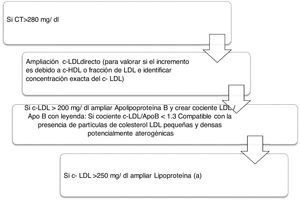
Algoritmo número 2: Incorporación del parámetro Lp(a) para la detección de pacientes de alto RCV: identificar en pacientes con colesterol total incrementado el tipo de c-LDL y si existe además incremento de la Lp(a) que potencie el RCV del paciente (fig. 2).
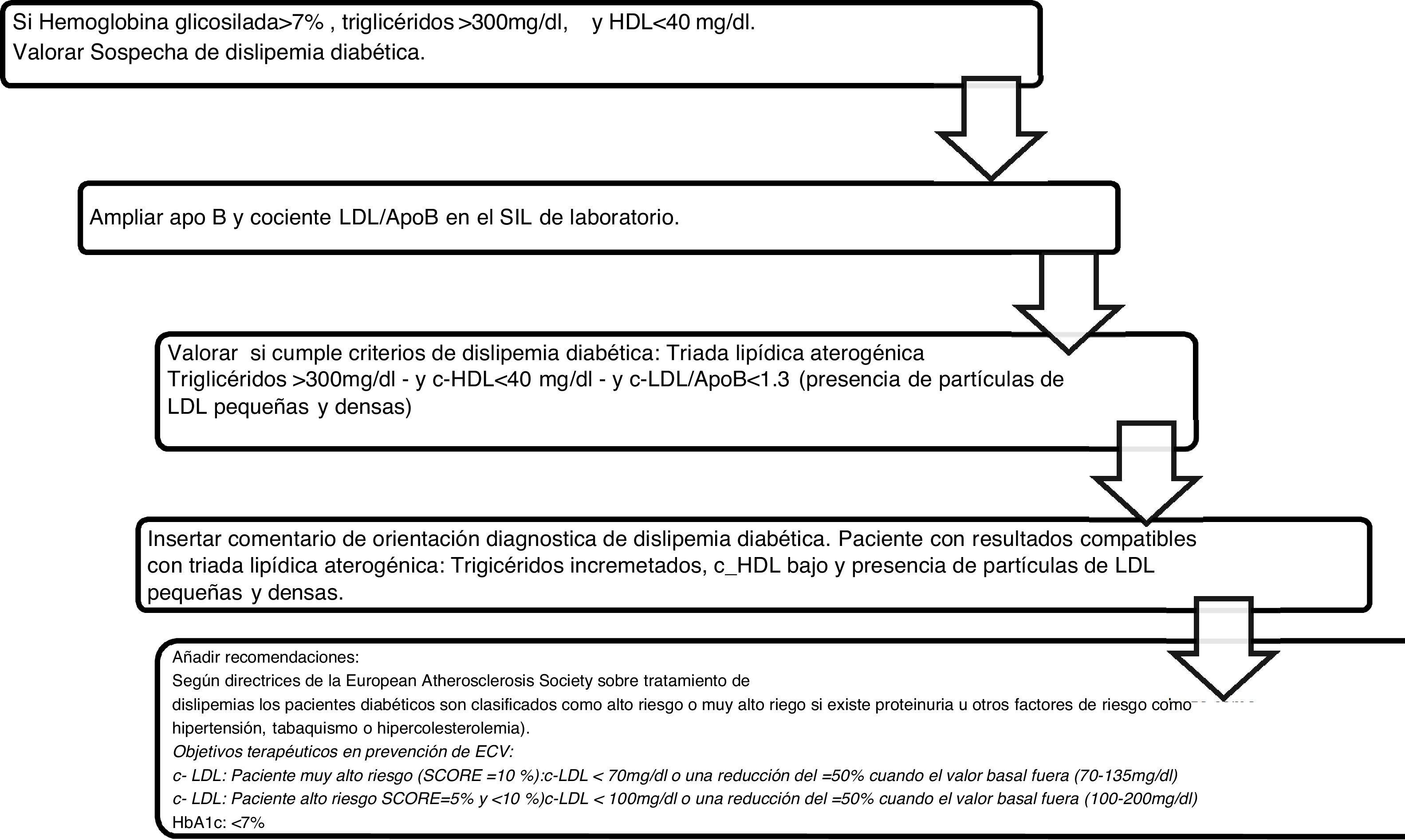
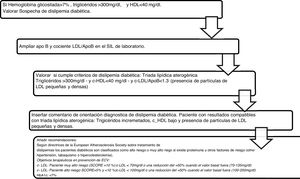
Algoritmo número 3: Incorporación del parámetro ApoB para el algoritmo diagnóstico de dislipidemia diabética (fig. 3).
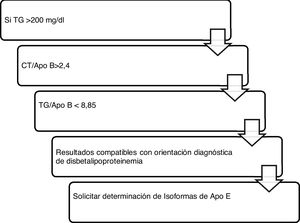
Algoritmo número 4: Incorporación del parámetro ApoB para el algoritmo diagnóstico de disbetalipoproteinemia15 (fig. 4).
Algoritmo número 4: Incorporación del parámetro ApoB para el algoritmo diagnóstico de disbetalipoproteinemia15.
En la tabla 1 se muestran los resultados del número de marcadores bioquímicos implementadas de novo en el SIL de laboratorio, el porcentaje de pacientes con lipoproteína superior al valor de normalidad, el número de pacientes así como el porcentaje de ApoB según diferentes puntos de corte, y el número de pacientes en función de la concentración de triglicéridos obtenidos. En la figura 5 se muestra el número de marcadores bioquímicos según aplicación de algoritmo número 2 con implementación de LDL/ApoB, Lp(a) y ApoB.
Número de determinaciones implementadas de novo en el sistema informático del laboratorio
| Determinación implementada en informes analíticos: | Número |
|---|---|
| Triglicéridos=150-880 mg/dl | 118.187 |
| Triglicéridos>880 mg/dl | 515 |
| Apolipoproteína E si triglicéridos 150-880 mg/dl | 1.174 |
| Apolipoproteína E si triglicéridos>880 mg/dl | 260 |
| Colesterol no HDL | 17.432 |
| Partículas de LDL pequeñas y densas | 1.103 |
| Tríada lipídica aterogénica | 563 |
| Colesterol VLDL calculado | 246.275 |
| Colesterol no HDL | 17.432 |
| Total lipoproteína (a)% pacientes con lipoproteína a>50 mg/dl | 79432,86% |
| Total apolipoproteína B 2018-2019Apolipoproteína B>160 mg/dl | 3.51558,75% |
| Total de apolipoproteína B 2018-2019Apolipoproteína B <80 mg/dl | 40517,22% |
Las recomendaciones actuales de la Sociedad Española de Arterioesclerosis16 sobre la prevención de enfermedad ateroesclerótica cardiovascular en la práctica clínica van dirigidas a la evaluación del RCV global de cada paciente. En la misma línea, el panel de consenso conjunto de la Sociedad Europea de Arteriosclerosis y la EFLM12 abordó recientemente los desafíos presentes y futuros en el diagnóstico de laboratorio de las lipoproteínas aterogénicas. Ambas destacan que el conjunto de determinaciones, tales como colesterol total, triglicéridos, el colesterol de lipoproteínas de alta densidad (HDLC), el colesterol LDL y el no-HDL constituyen el panel de lípidos primario para estimar el riesgo de enfermedad cardiovascular aterosclerótica e incluye varias recomendaciones, entre las que se destaca la creación de un «perfil de lípidos estándar» y un «perfil lipídico expandido» que incluya Lp(a) o ApoB en casos seleccionados. Con el objetivo de adaptarnos a las recomendaciones de las mencionadas guías clínicas, se ha implementado en las analíticas de rutina con este proyecto la determinación directa de 2parámetros analíticos, la ApoB y la Lp(a), así como otros marcadores estimados.
La importancia de la determinación conjunta de c-LDL y ApoB radica en valorar la posible presencia de sd-LDL potencialmente aterogénicas debido a que estas partículas presentan una menor afinidad por el receptor de LDL, mayor susceptibilidad de oxidación y mayor afinidad por los proteoglicanos de la pared arterial. En el proyecto actual se han informado un total de 1.103 pacientes con resultado compatible con la presencia de sd-LDL remitidas al médico peticionario en la analítica de rutina para el correcto manejo clínico y terapéutico de cada paciente. Así, este marcador, combinado con otros marcadores lipídicos clásicos en las analíticas de rutina, nos sirve para la aplicación de otro algoritmo para caracterizar la dislipidemia aterogénica. Un estudio desarrollado en el sur de Europa, The Hortega-Liposcale Follow-up Study17, publicó que sd-LDL mostró la asociación más fuerte con eventos cardiovasculares cuando se investigó la composición de las partículas en lugar de la concentración total, de tal manera que un cambio en la composición inicial de las partículas de LDL de grandes a medianas y pequeñas se asoció con un mayor RCV.
La combinación de c-HDL disminuido, el predominio de sd-LDL y los triglicéridos incrementados constituye la denominada «tríada lipídica aterogénica»18, que incrementa el riesgo de ECV a partir de sus 3componentes. Se han implementado 563 alertas de resultados compatibles con la tríada lipídica aterogénica con su correspondiente interpretación en el informe analítico. La dislipidemia aterogénica está infradiagnosticada, infratratada y, en consecuencia, infracontrolada tanto en Europa como en España19,20. En el registro europeo de prevención secundaria EUROASPIRE III21, con población representativa de 22 países, se concluyó que más de un tercio presentaban dislipidemia aterogénica y el Dyslipidemia International Study (DYSIS)14 en población española, un 13,1%. El estudio EDICONDIS-ULISEA15 sobre el control de la dislipidemia en las unidades de lípidos y riesgo vascular de la Sociedad Española de Arteriosclerosis reveló que solo uno de cada 6 pacientes con dislipidemia aterogénica alcanzó los objetivos terapéuticos en el c-HDL y los triglicéridos.
La guía de la Canadian Cardiovascular Society, aunque sitúa al c-LDL como objetivo principal, también introduce la ApoB y el colesterol no-HDL como objetivos alternativos y señala que este último puede ser, incluso, un mejor objetivo que la ApoB por la facilidad de implementación de su cálculo22. Se incluyeron en el perfil lipídico básico de atención primaria 17.432 determinaciones de colesterol no-HDL, lo que aportó información añadida de todas las partículas que causan enfermedades cardiovasculares, es decir, LDL, VLDL, IDL y Lp(a) en el estado sin ayuno, incluyendo además el colesterol en quilomicrones y sus partículas remanentes12. Una de las indicaciones más novedosas es la recomendación de usar la ApoB para la evaluación de riesgos, que puede ser preferible al colesterol no-HDL en personas con hipertrigliceridemia de leve a moderada (de 2 a 10 mmol/L), diabetes, obesidad o síndrome metabólico, o c-LDL muy bajo <1,8 mmol/L23. Los datos más recientes de cuantificación de ApoB en Andalucía corresponden al estudio Dieta y Riesgo de Enfermedades Cardiovasculares en Andalucía (DRECA), en el que la clasifican en función de la presión arterial y el IMC en concentraciones medias, pero no existen registros de ApoB en pacientes con hipercolesterolemias severas24. De acuerdo con los resultados de este estudio y lo señalado por las guías, vemos beneficiosa su inclusión en la cartera de servicios de los laboratorios clínicos, ya que su determinación es superior a las mediciones y cálculos de c-LDL y no-HDL para la evaluación de la exposición al número de partículas de lipoproteínas aterogénicas en la circulación. Además, al igual que el colesterol no-HDL, se puede medir sin precisar ayuno y no se ve afectado por la variabilidad biológica de triglicéridos.
Como parámetro complementario, la introducción del cálculo de c-VLDL en las analíticas de rutina, en nuestro caso, 246.275, ofrecen una información adicional de la estimación del RCV del pacientes, ya que también se ha demostrado su presencia en placas ateroscleróticas humanas y de conejo25. Los estudios de aleatorización mendeliana indican que las concentraciones séricas elevadas de lipoproteínas ricas en triglicéridos o sus restos se asocian causalmente con un mayor riesgo de ECV y mortalidad por todas las causas26. En el caso de pacientes con hipertrigliceridemia, debido a la gran variabilidad biológica de este parámetro tan dependiente de la ingesta dietética reciente o de enfermedades secundarias asociadas, la aplicación del algoritmo así como la ampliación de la ApoE correspondiente se realiza con el propósito de alertar al médico peticionario de los valores que supondrían un riesgo para el paciente si no se revertieran a la normalidad. La reciente publicación del estudio CAMARGUE (adherencia de los laboratorios a las directrices recomendadas para el tratamiento de la dislipidemia en Europa) ha mostrado que tan solo el 23% de los laboratorios agregan una alarma cuando el riesgo de pancreatitis por hipertrigliceridemia es alto27. En nuestro caso, se han implementado 118.187 alarmas de hipertrigliceridemias leves o moderadas con sus 1.174 ApoE correspondientes, de las cuales el 90% era superiores al valor de normalidad y 515 eran alertas de hipertrigliceridemia grave con 260 ApoE, todas ellas en rango patológico. La caracterización del tipo de hipetrigliceridemia, así como la ampliación de la ApoE aportan, además del posible riesgo de pancreatitis, información acerca del número de partículas remanentes potencialmente aterogénicas y mejoran el manejo de esta enfermedad de difícil diagnóstico. La no disponibilidad de la determinación de las isoformas de ApoE en muchos laboratorios es un gran inconveniente para la confirmación de la sospecha28,29.
Con respecto a los resultados obtenidos en la cuantificación de Lp(a), se realizaron un total de 747 determinaciones. El dato más relevante y poco alentador es que, tras la aplicación del algoritmo número 4, el 30,65% de los pacientes con c-LDL>220mg/dl presentaba concentración de Lp(a)> 50mg/dl. El riesgo que supone un c-LDL superior al doble de lo indicado por las guías clínicas como riesgo bajo se potencia en un 30,65% de los pacientes con hiper-Lp(a). Además, 13 pacientes mostraron Lp(a) superior a 180mg/dl. Como señalan las últimas guías europeas de la Sociedad Europea de Arteriosclerosis, los pacientes con niveles extremadamente altos de Lp(a)> 180mg/dl (>430 nmol/L) pueden tener un mayor riesgo de por vida de enfermedad ateroesclerótica cardiovascular, similar al de las personas con hipercolesterolemia familiar heterocigota. Hasta ahora, el estudio más grande que analiza los niveles de Lp(a) y ECV en el contexto de la hipercolesterolemia familiar fue la cohorte holandesa, que mostró una asociación significativa entre niveles de Lp(a)> 30mg/dl y ECV30. El registro español con mayor número de Lp(a) cuantificada se corresponde con el SAFEHEART (estudio de cohorte de hipercolesterolemia familiar española), que cuenta con la inclusión de 2.917 sujetos (1.960 pacientes con hipercolesterolemia familiar y 957 familiares sin ella): el número de sujetos con niveles de Lp(a)> 50mg/dl fue significativamente mayor en el grupo de hipercolesterolemia familiar (p <0,001)31. Debido a que alrededor del 90% del nivel de Lp(a) de una persona se hereda, la Lp(a) extremadamente elevada puede representar un nuevo trastorno lipídico hereditario que se asocia con un riesgo muy alto de ECV de por vida y es 2veces más frecuente que la hipercolesterolemia familiar heterocigota. Este grupo de trabajo señala que puede ser valioso el cribado de Lp(a) elevada en pacientes sin hiperclesteolemia familiar o con ella, ya que estos pacientes tienen un mayor riesgo de enfermedad ateroesclerótica cardiovascular, particularmente con hipercolesterolemia familiar coexistente32. Los estándares de la Sociedad Española de Arterioesclerosis33 para el control global del RCV coinciden en su papel relevante en el incremento del riesgo vascular que presentan algunos pacientes con hipercolesterolemia familiar, y en sujetos con enfermedad isquémica prematura o recurrente, a pesar de un buen control de sus factores de RCV. En estas circunstancias estaría indicada su determinación.
La inclusión de este nuevo marcador en los laboratorios automatizados fue pionera en la provincia de Huelva gracias a la financiación de este proyecto. Casi un tercio de los pacientes analizados presentaban cifras patológicas, por lo que su RCV bioquímico y genético se encuentra incrementado y se conoce precozmente gracias a la aplicación de los algoritmos bioquímicos.
ConclusionesLa implementación de nuevos parámetros analíticos como la ApoB y la Lp(a) en los laboratorios y la aplicación de algoritmos diagnósticos en atención primaria permiten identificar un número considerable de pacientes con diferentes alteraciones en el metabolismo lipídico que, junto con los factores de riesgo clásicos, podrían contribuir a una correcta estatificación del riesgo y a evitar la progresión de la ECV.
FinanciaciónEstudio financiado con una beca de la Sociedad Española de Arterioesclerosis en 2018 para investigación en atención primaria en arteriosclerosis: Implantación de un programa de cribado bioquímico y genético de hipercolesterolemia familiar y otras dislipidemias en la Unidad de Lípidos del Hospital Virgen Macarena de Sevilla y en la Unidad de Lípidos del Hospital Infanta Elena de Huelva. Implicación del laboratorio en la consecución de objetivos terapéuticos. Estudio ARIAN.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Begoña Gallardo Alguacil, Eva Nadiejda Gutiérrez Cortizo, Francisco Javier Caballero Granado, Elena Sánchez Ruiz Granados, Guadalupe Bueno Rodríguez, Marta Rico Rodríguez, Francisco Gonzalvo López, Pilar Carrasco Salas, Miguel Ángel Castaño López, Antonio León Justel.