Ante la necesidad de comprender el fundamento de los beneficios metabólicos del ejercicio surgió el descubrimiento de la irisina, hace menos de 2años. Esta citoquina, secretada por el músculo esquelético debido al ejercicio, tendría efectos positivos a nivel del metabolismo energético. Concretamente, actuaría como mensajero sobre el tejido adiposo blanco modificando su fenotipo hacia adipocito beige e incrementando su capacidad termogénica. A partir de su descripción, han sido numerosos los estudios orientados a delinear su función con el fin de determinar si la irisina configuraría una posible diana terapéutica en el contexto de enfermedades relacionadas con el exceso calórico, como la obesidad y la diabetes. En esta revisión se resume el descubrimiento de la irisina y sus efectos in vitro e in vivo descritos hasta la actualidad.
Due to the need to understand the basis of the metabolic benefits of exercise, irisin was discovered a few years ago. This cytokine, secreted by skeletal muscle due to exercise, should have positive effects on energetic metabolism. In particular, it could act as a messenger on white adipose tissue, modifying its phenotype into the beige adipocyte, and increasing its thermogenic capacity. Since it was described, there have been numerous studies led to depict its function, with the aim of determining if irisin could become a therapeutic target in the context of diseases associated with a caloric excess, such as obesity and diabetes. In this review, the irisin discovery is summarized, along with its in vitro and in vivo effects described up until now.
La Asociación Médica Americana (AMA) acaba de otorgar a la obesidad la categoría de enfermedad, con lo que se evidencia la necesidad de conocer en detalle los mecanismos subyacentes implicados. La obesidad se debe a un exceso de grasa corporal como resultado de un desequilibrio entre la ingesta calórica y el gasto energético1, y se asocia con un aumento en la morbimortalidad2. Son numerosas las hormonas implicadas en la regulación del balance energético, encontrándose la mayoría a nivel gastrointestinal3. Además, factores proteicos producidos y liberados por el tejido adiposo y músculo —adipoquinas y mioquinas— suscitan una atención especial, puesto que actúan como efectores paracrinos o endocrinos, interviniendo en la regulación metabólica4,5. Por ello, es importante conocer cómo estas citoquinas afectan a la regulación del metabolismo energético y, en último término, a la obesidad.
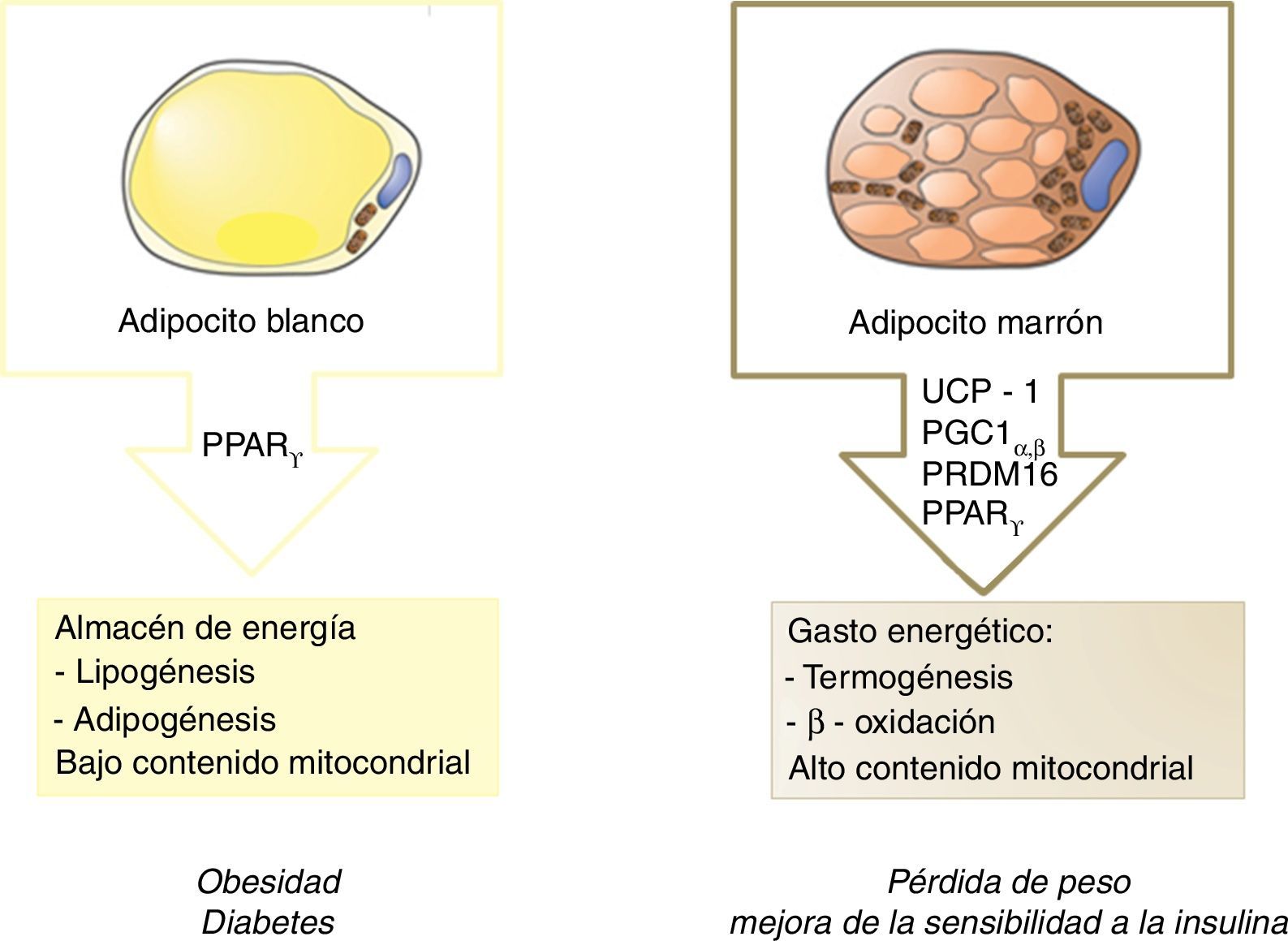
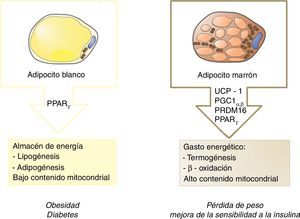
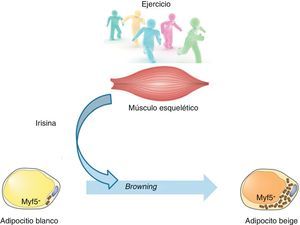
De forma clásica, el tejido adiposo blanco ha sido considerado como almacén de energía, mientras que el tejido adiposo marrón (grasa parda), por su parte, cumple un cometido opuesto, desempeñando una función termogénica (fig. 1). Esta capacidad se debe a su elevado contenido mitocondrial y a la proteína especializada denominada uncoupling protein 1 (UCP1). Básicamente, esta proteína desacopladora promueve la fuga de protones a través de la membrana interna mitocondrial, disipando energía en forma de calor. Es por ello que estas células protegen contra la hipotermia en la mayoría de los mamíferos y desempeñan un papel natural contra la obesidad y la diabetes.
Tradicionalmente se consideró que el tejido adiposo marrón estaba limitado a la etapa infantil en mamíferos y en humanos. Sin embargo, en un estudio basado en tomografía de emisión de positrones (PET) se describe la persistencia de tejido adiposo marrón funcional en humanos adultos expuestos al frío, concretamente en la región supraclavicular y en el cuello6. Tres años más tarde este «nuevo» tejido adiposo marrón se identificó como adipocito beige, que presentaría características similares a las del adipocito marrón pero diseminado en el tejido adiposo blanco7.
Para conocer en detalle la funcionalidad del tejido beige, se estudió su origen. Así, mientras que los precursores de la grasa parda expresan el factor miogénico Myf5, los adipocitos beige derivan de precursores que no expresan dicho factor8. Esta nueva información sugiere la existencia de un progenitor adipocitario bipotencial con capacidad para actuar como un interruptor funcional. De este modo, dependiendo de los estímulos recibidos, podría diferenciarse hacia adipocito blanco o beige. Por ello, un punto clave sería comprender la contribución de dicha plasticidad del tejido sobre el balance energético global en humanos.
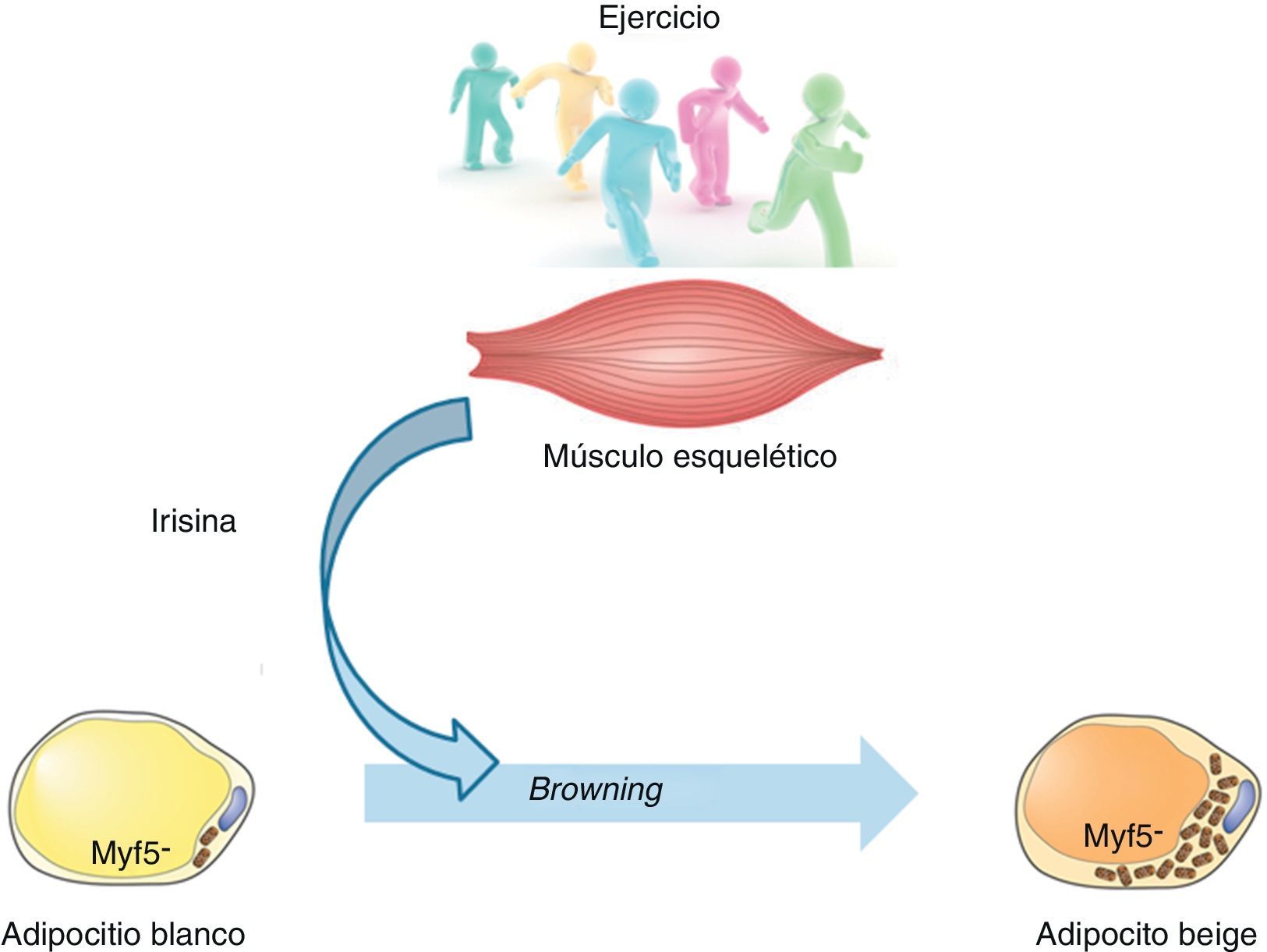
Ante cualquier tratamiento para combatir la obesidad nos encontramos con una regulación de los hábitos alimentarios y un aumento de la actividad física. Sin embargo, aún no se conoce con claridad el mecanismo molecular mediante el que el ejercicio ejerce sus resultados positivos. No obstante, uno de los efectos descritos de la práctica de actividad física es la conversión o transdiferenciación del tejido adiposo blanco hacia marrón (también denominado browning, empleando el término anglosajón). En este sentido, estudios desarrollados en los 2 últimos años sugieren la presencia de una molécula, la irisina, responsable de esta comunicación entre el tejido muscular esquelético y el adiposo.
A continuación se revisa el descubrimiento de la irisina y sus efectos in vitro e in vivo descritos hasta la actualidad.
Estudios en modelos murinosIrisina y ejercicioTras plantearse la cuestión acerca de la posible capacidad de conversión del tejido adiposo blanco hacia marrón, una de las moléculas identificadas fue peroxisome proliferator-activated receptor gamma coactivator-1-alpha (PGC-1α). Se trata de un cofactor transcripcional que actúa como principal regulador de la biogénesis mitocondrial en mamíferos. Su expresión en el tejido adiposo marrón es superior a la del blanco y, tras su incorporación en el tejido adiposo blanco, este expresa mayor número de mitocondrias y algún elemento característico del tejido marrón. El laboratorio de John Holloszy demostró un aumento en la expresión de PGC-1α debido al ejercicio tanto en roedores como en humanos9. Además, se ha descrito que los ratones con expresión transgénica de PGC-1α específica de músculo presentan una mayor conversión del tejido adiposo blanco hacia marrón. De forma paralela, tras 3semanas de ejercicio en los ratones se inducía un perfil genético similar, indicando que tanto la sobreexpresión específica de músculo de PGC-1α como la práctica de ejercicio desencadenaban una transdiferenciación del tejido adiposo blanco hace beige10. Con estos hallazgos, los autores se plantearon la posible existencia de una molécula que, proveniente del músculo, pudiese comunicar el tejido muscular con el adiposo. Para ello se identificaron 5 proteínas susceptibles de ser dianas potenciales de PGC-1α a nivel muscular y, además, con una elevada probabilidad de ser secretadas. Experimentos posteriores confirmaron a fibronectin type iii domain-containing protein 5 (FNDC5) como el candidato más probable en mediar el efecto transdiferenciador. De hecho, la administración in vitro de FNDC5 a adipocitos blancos les confería positividad frente a UCP1, a la vez que elevaba la tasa de consumo de oxígeno y el gasto energético.
FNDC5 es una proteína transmembranal, constituida por un péptido señal y una zona hidrofóbica semejante a un dominio transmembrana, cuya expresión se centra principalmente en el músculo esquelético, el corazón y el sistema nervioso central. Al transfectar el gen que codifica para esta proteína se comprobó que se secreta con una ligera modificación en su patrón de glucosilación. Este fragmento secretado constituido por los aminoácidos 30-143 de FNDC5 es la denominada irisina. Recibe esta denominación debido a Iris, el dios griego transmisor de mensajes desde el monte Olimpo hacia los humanos en la Tierra. Con ello se pretende enfatizar su papel como mensajero desde el músculo a otras partes del cuerpo. Posteriormente inyectaron a ratones vectores adenovirales que expresaban el fragmento completo de FNDC5 y que, tras procesamiento proteolítico, secretan irisina. Observaron que los animales a los que se les administró el virus presentaban un ligero aumento en las concentraciones de irisina circulantes. Al mismo tiempo, tanto las concentraciones de ARNm y de proteína de UCP1 del tejido adiposo blanco presentaban un aumento. Ante la realización de estos experimentos en un contexto de una dieta obesogénica, se observó una reducción en las concentraciones circulantes de insulina y una mejora en su efecto, lo que indica que incluso una moderada elevación de las concentraciones de irisina induce la conversión del tejido blanco y una mejora de la homeostasis de la glucosa.
Teniendo en cuenta la información presentada, Boström et al.10 proponen un modelo específico: los niveles de PGC-1α aumentarían debido al ejercicio, lo que conduciría a un incremento en los niveles de la proteína de superficie del músculo FNDC5 que sería escindida proteolíticamente para formar la nueva mioquina, la irisina. La secreción de esta hormona polipeptídica actuaría sobre las células del tejido adiposo subcutáneo para desencadenar una reacción de transdiferenciación del tejido blanco al marrón de carácter protector sobre la patología metabólica (fig. 2).
Sumado a la importante función metabólica de la irisina sobre el tejido adiposo, se ha demostrado una importante interacción con la miostatina, una mioquina con expresión predominante en el músculo esquelético11. Aparte de su papel como regulador de la masa muscular esquelética, la miostatina también puede actuar sobre el metabolismo y la sensibilidad a la insulina12. Así, Shan et al.11 han publicado que ratones knock-out para dicha mioquina (Mstn-/-) presentan un aumento de la masa muscular y una disminución de la masa grasa acompañado de un incremento en la expresión de PGC-1α y FNDC5 musculares, de las concentraciones circulantes de irisina y de una transdiferenciación del tejido adiposo blanco hacia marrón.
Irisina como adipoquinaAdemás de probarse su síntesis a nivel muscular, en el trabajo de Roca-Rivada et al.13 se ha evaluado la secreción de irisina debida al ejercicio por el tejido adiposo. Sus resultados indican que el tejido adiposo blanco aumenta la secreción de FNDC5/irisina tras la práctica de ejercicio a corto plazo (una semana), mientras que tras 3semanas de ejercicio se produce una disminución en su secreción. Este hecho, unido a la observación de las semejanzas entre el patrón de liberación de FNDC5/irisina con respecto a otras adipoquinas, sugiere un posible feedback en el que el tejido adiposo podría ser susceptible a las concentraciones circulantes de FNDC5/irisina.
Por otra parte, se ha estudiado la relación entre la expresión de FNDC5 y leptina. En este sentido, se ha probado una asociación positiva de la expresión de FNDC5 con la masa grasa y con la leptina plasmática. Sin embargo, el tratamiento de miotubos in vitro con leptina no presentaba efecto alguno sobre las concentraciones de PGC-1α o FNDC5. Previamente, en un modelo murino de obesidad (ratones ob/ob) había sido demostrado que el tratamiento con leptina aumenta la expresión de PGC-1α en el músculo esquelético a través de la señalización mediada por AMPK14. No obstante, aunque parezca contrario a los resultados presentados por Roberts et al., la efectividad del tratamiento con leptina depende de las concentraciones endógenas15. De todos modos, serían necesarios estudios sobre los efectos de la leptina, tanto en estados de resistencia como sensibles a la adipoquina, para conocer las posibles interacciones entre la irisina y la leptina en la regulación de la homeostasis energética.
Irisina y homeostasis de la glucosaLas aproximaciones experimentales apuestan por la influencia de la homeostasis de la glucosa sobre las concentraciones de irisina. Así, Roberts et al.16 demostraron que en ratas OLEFT —modelo murino con manifestaciones clinicopatológicas semejantes a las presentadas por individuos con diabetes tipo2— las concentraciones de expresión de FNDC5 muscular duplicaban a los observados en ratas LETO —modelo animal de ratas sanas y delgadas—. Sin embargo, paradójicamente, las concentraciones circulantes de irisina tendían a ser menores en las ratas OLEFT. Actualmente no existe una explicación sólida a esta paradoja observada, y los autores proponen que el procesamiento proteolítico de FNDC5 para la liberación de la irisina podría estar disminuido en ratas OLETF, aunque no se ha corroborado. Una posible explicación sería un mecanismo de feedback entre las concentraciones de irisina circulantes y la expresión de PGC-1α o FNDC5, hipótesis aún pendiente de confirmación. Finalmente, este resultado sorprendente podría ser justificado asimismo por diferencias metodológicas, puesto que las concentraciones de irisina y la expresión de FNDC5 fueron determinadas en cohortes de ratas diferentes.
Irisina en otros tejidosCon el fin de explorar los mecanismos mediante los que la irisina ejercería su efecto termogénico en el tejido adiposo, Dun et al.17 han proporcionado la primera evidencia de la expresión de irisina inmunorreactiva en células musculares cardiacas y esqueléticas y en cerebro de roedores, específicamente en células de Purkinje GAD-positivas del cerebelo. Ofrecen, por tanto, una nueva vía neural que, originándose en las células de Purkinje del cerebelo y mediante diversos intermediarios sinápticos en la médula espinal, regularía el metabolismo adipocitario. Por ello, el efecto termogénico de la irisina mediado por vía neural procedería tanto por una mayor capacidad de respuesta del tejido adiposo al estímulo simpático como por una mayor estimulación simpática.
Es importante resaltar los recientes datos que subrayan la ausencia de una asociación directa entre el resultado defendido por Boström en ratones y los hallazgos observados en humanos. Basándose en alineamientos de secuencia multiespecies, los autores aseguran que FNDC5 podría ser un pseudogén en humanos debido al empleo de un codón de inicio alternativo18, a pesar del elevado grado de conservación entre especies descrito hasta entonces, con el 100% de homología de la irisina entre la mayoría de las especies de mamíferos10. Por otra parte, Raschke et al.19, mediante experimentos in vitro, no han conseguido reproducir los resultados derivados de los estudios iniciales. En vista de ello, sugieren que la irisina sería una proteína más corta y traducida con una baja eficiencia, por lo que proponen que la función inicial descrita para ratones no sería trasladable a humanos. Ante estos nuevos datos podría desvanecerse el prometedor boom inicial que supuso la descripción de irisina como puente entre la actividad física y la homeostasis del metabolismo energético.
No obstante, las publicaciones referentes a la irisina, especialmente en humanos, han surgido a un ritmo muy elevado. Como se expondrá en esta revisión, existe una falta de consistencia entre los resultados debido a la gran variedad de condiciones analizadas.
Estudios en humanosIrisina y ejercicioDesde el trabajo inicial de Boström et al.10 en el que demostraban que el ejercicio físico, tanto en ratones como en humanos, elevaba las concentraciones de irisina circulantes, se ha cuestionado la vinculación de FNDC5 e irisina con el ejercicio físico y el posible papel que podrían desempeñar. Sin embargo, de forma contraria al estudio preliminar, en el trabajo realizado por Timmons et al.20 empleando arrays de expresión génica se detectó un aumento de la expresión de FNDC5 inducido por el ejercicio en individuos de avanzada edad pero no en jóvenes. En un tercer estudio publicado en un intento de aportar claridad a la relación entre irisina y ejercicio físico se sugiere la importancia del tipo de ejercicio practicado (aeróbico vs. anaeróbico). Así, tras analizar las concentraciones circulantes de irisina en individuos jóvenes observan que aumentan tras 30’ de ejercicio controlado pero no tras 8semanas, aludiendo a la repercusión que la presencia/ausencia de oxígeno podría tener a la hora de liberar esta mioquina21. Sin embargo, las numerosas variables que intervienen durante el ejercicio podrían dificultar la identificación de componentes clave.
En este sentido, se ha descrito que un estilo de vida activo aumenta las concentraciones circulantes de irisina en una cohorte de 427 sujetos (hombres y mujeres). Además, hemos comprobado que, en individuos sedentarios, las concentraciones de irisina se asocian positivamente con diversos parámetros relacionados con un aumentado riesgo cardiometabólico. A la vista de los resultados obtenidos, proponemos que factores adicionales como la edad o el área de residencia serían elementos determinantes en las concentraciones de irisina (datos no publicados).
Tras un programa de entrenamiento de resistencia se ha observado que, tanto en pacientes sometidos a diálisis como en individuos sanos, las concentraciones de irisina plasmáticas no variaban, a pesar del aumento de masa muscular observado22. De modo semejante, en 4 tipos de programas de ejercicio diferentes con diversas frecuencias no se han encontrado cambios significativos ni en la expresión de PGC-1α, ni en FNDC5 a nivel muscular ni en las concentraciones circulantes de irisina23.
Las presentes discrepancias con respecto al estudio original podrían ser explicadas por el hecho de que FNDC5 en humanos podría ser un pseudogén18, por lo que su interpretación en modelos murinos no podría trasladarse a humanos. Además, es importante subrayar que, en la mayoría de estudios las variaciones en la expresión de PGC-1α no se acompañan de cambios correlativos en FNDC5, sugiriendo la existencia de otros factores sobre su regulación. Además, se debe tener en cuenta que PGC-1α es uno de los principales reguladores del metabolismo energético24, por lo que varios mecanismos, incluyendo los estimulados por el propio ejercicio, podrían afectar la expresión de PGC-1α y FNDC5.
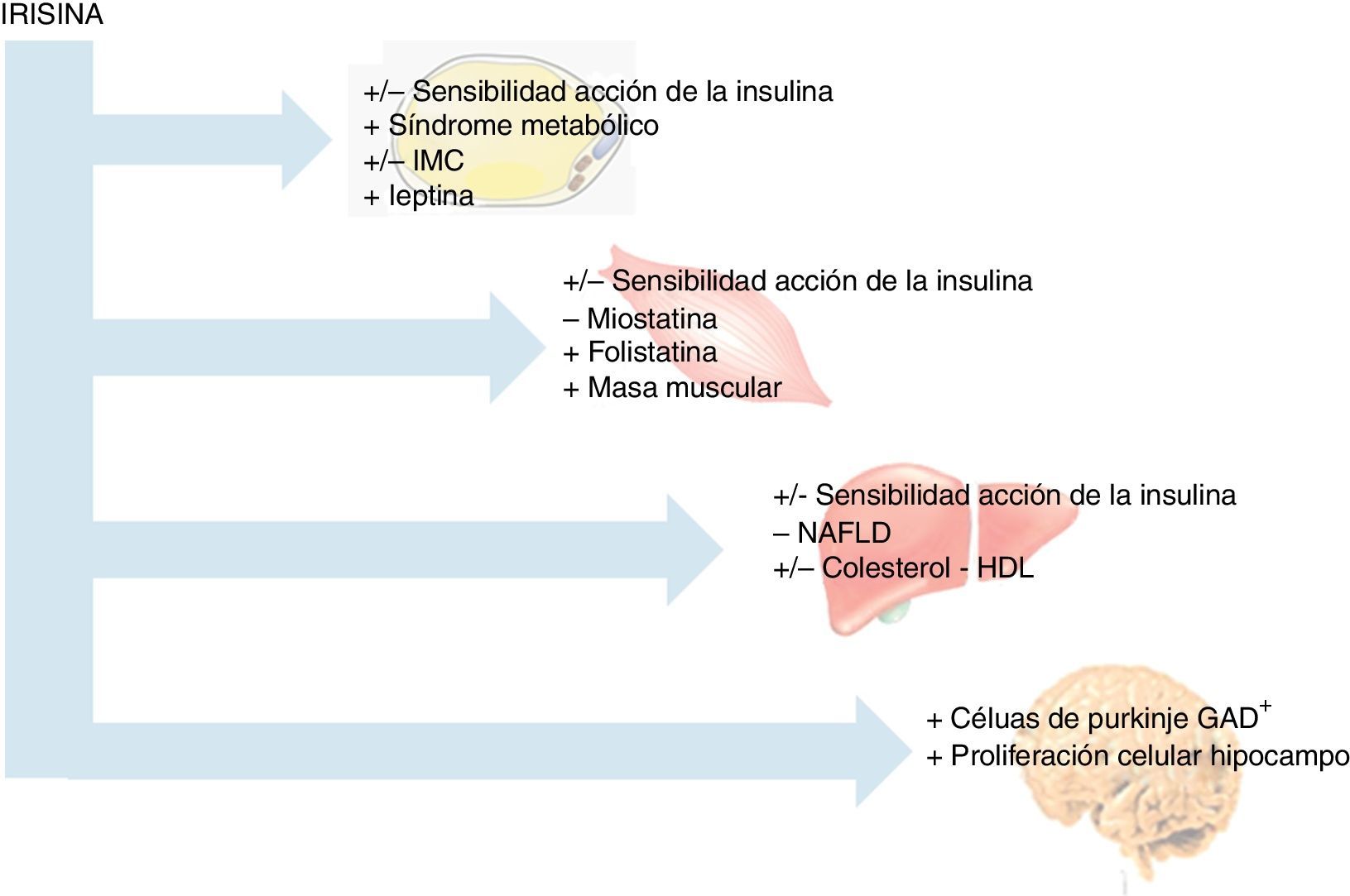
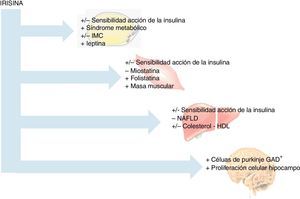
Con respecto a la posible asociación de la irisina con otras miostatinas, en el estudio publicado por Vamvini et al.25 se demuestra una asociación positiva de irisina con folistatina, a diferencia de otros factores similares producidos por el músculo, como miostatina o activina a (fig. 3). Ante los resultados de su trabajo, proponen que irisina y folistatina podrían ser reguladas por el mismo mecanismo o, en su defecto, que una de las mioquinas determinase la expresión de la otra, indicando que la irisina podría actuar también a nivel muscular.
A fin de ampliar el conocimiento acerca de los factores reguladores de la secreción de irisina se ha estudiado in vitro el efecto de señales relacionadas con la contracción muscular en mioblastos. Sin embargo, no se ha encontrado ningún efecto sobre la expresión de FNDC5 y/o la secreción de irisina con el tratamiento de ácidos grasos libres o adrenalina o AICAR26.
Con el objeto de conocer su funcionalidad en detalle se ha estudiado el papel de dicha mioquina durante el ejercicio en el contexto de diversas patologías. Así, en el estudio transversal realizado por Lecker et al.27 en pacientes con insuficiencia cardiaca caracterizados por su intolerancia al ejercicio se demuestra la relación entre la expresión muscular de FNDC5 y su capacidad funcional. Tras evaluar el rendimiento aeróbico comprueban que una menor expresión de FNDC5 podría ser la base del deterioro de la capacidad aeróbica en dichos pacientes.
Por otra parte, referente a patologías neurodegenerativas se ha descrito que el ejercicio proporciona algunas mejoras, siendo virtualmente el único factor descrito que causa neurogénesis en adultos humanos28. Sin embargo, en la mayoría de los casos estas condiciones son tan severas que para estos pacientes resulta complicada la adherencia a una actividad física determinada. Así, en experimentos in vitro, como el realizado por Moon et al.29, se ha puesto de manifiesto que el tratamiento con irisina a células de ratón H19-7 (neuronas de hipocampo), a dosis farmacológicas, aumenta la proliferación celular (fig. 3). Es importante reseñar que el hipocampo es la región del cerebro principalmente afectada en la enfermedad de Alzheimer en humanos30, y que un nivel diario alto de actividad física se asocia con un menor riesgo de enfermedad de Alzheimer29. Por ello, la irisina podría representar un enlace entre el ejercicio y la enfermedad de Alzheimer y podría convertirse en una potencial diana terapéutica en el tratamiento de esta patología. Basándose en estos datos, y siendo conscientes de la necesidad de ampliar los estudios, parece que FNDC5 y/o irisina son importantes para el desarrollo y la diferenciación del sistema nervioso central, donde podrían actuar como neurotransmisores.
Irisina como adipoquinaEs destacable la presencia de FNDC5 en el secretoma del tejido adiposo humano, lo que reorienta el concepto de irisina hacia adipoquina, no solo como mioquina, insinuando una función autocrina de irisina en el tejido adiposo13,31. El patrón de secreción de FNDC5 observado en el tejido adiposo parece depender de la localización anatómica del mismo. Así, el tejido adiposo subcutáneo secreta mayores niveles de FNDC5 que otros depósitos13,31, hecho que sería esperable debido al papel beneficioso de este tipo de tejido comparado con la grasa visceral, ya que se ha demostrado su implicación en numerosas complicaciones metabólicas asociadas con la ganancia de peso y la obesidad32.
Irisina y homeostasis de la glucosaPor otra parte, se han realizado estudios observacionales en humanos con respecto a la relación entre la homeostasis de la glucosa y la irisina. En concreto, se basan en la disminución de las concentraciones de irisina en diversas cohortes de pacientes diabéticos tipo2 con respecto a individuos control31,33,34. Además, en una serie de hombres no diabéticos, las concentraciones circulantes de irisina parecen presentar una correlación positiva con la sensibilidad a la acción de la insulina (fig. 3)31 aludiendo a un papel beneficioso de irisina en la homeostasis de la glucosa, posiblemente como una consecuencia del aumento en la actividad física.
No obstante, el análisis de la expresión de FNDC5 en músculo en una cohorte de 118 sujetos no muestra asociación con la homeostasis de la glucosa19. Estos datos, lejos de parecer contradictorios, no resultan casuales, ya que parecen confirmar los anteriormente descritos por Roberts et al.16 en ratas OLETF, en los que, a diferencia de la expresión de FNDC5, las concentraciones de irisina sí se relacionan con la homeostasis de la glucosa. Nuevamente se subraya la importancia que el procesamiento postranscripcional de FNDC5 podría tener en las acciones de la irisina.
Por el momento, solamente se ha publicado un estudio en humanos que proporciona evidencias acerca de la variación genética de FNDC5 y su relación con la sensibilidad a la insulina. Ha sido llevado a cabo en una población alemana con un elevado riesgo de desarrollar diabetes tipo2. En concreto, han identificado 2 SNP dentro del mismo locus, con efectos en la sensibilidad a la insulina pero no sobre la adiposidad corporal o la secreción de insulina. Sus datos revelan un efecto desensibilizador de la insulina por parte de la irisina35. Los mecanismos moleculares por los que estas variantes afectan a la sensibilidad a la insulina no se conocen, y por ello sería interesante estudiar el impacto de este gen sobre el riesgo de padecer diabetes tipo2.
En relación con el síndrome metabólico, el estudio realizado por Park et al.36 alude a un mayor riesgo de manifestarlo en aquellos pacientes con concentraciones más elevadas de irisina. Además, se probó una asociación negativa entre las concentraciones de irisina y adiponectina, y positiva con el índice de masa corporal (IMC), la presión sanguínea, la glucemia, el HOMAIR y los triglicéridos. Por ello, y en línea con diversos estudios previos, la irisina parece estar relacionada con un estado metabólico desfavorable.
Irisina y composición corporalDebido a la importancia del descubrimiento de la irisina, así como de sus controvertidas y potenciales funciones, es necesario obtener información adicional referente a la naturaleza de la hormona y a su papel específico en la composición corporal. A pesar de su síntesis y liberación predominante a nivel muscular, son varios los estudios transversales que establecen relación entre las concentraciones de irisina y el IMC. Así, en 2 poblaciones no diabéticas se ha descrito una asociación positiva entre las concentraciones de irisina circulantes y el IMC21,37. En ambos estudios, los individuos con obesidad mórbida presentaban concentraciones de irisina superiores a los individuos con normopeso y a pacientes con anorexia, respectivamente37. Además, la pérdida de peso aguda, como la inducida por cirugía bariátrica, supone una disminución tanto de la expresión muscular de FNDC5 como de las concentraciones circulantes de irisina21. Además, en ambos estudios se demuestra una estrecha asociación positiva entre las concentraciones de irisina y marcadores de masa muscular, como el perímetro muscular del brazo y la masa magra (fig. 3). De hecho, Huh et al.21 encuentran que el principal predictor del nivel de irisina circulante es la masa muscular, y que la disminución de las concentraciones de la mioquina tras la pérdida de peso se explica por la pérdida de masa muscular.
De forma contraria a los trabajos mencionados anteriormente, un estudio realizado en hombres defiende que las concentraciones de irisina están asociadas negativamente con el IMC, con el índice cintura/cadera y con la masa grasa. De hecho, se observa que las concentraciones de irisina son menores en individuos con sobrepeso y en hombres obesos diabéticos, incluso después de corregir por la edad, el índice cintura/cadera y la sensibilidad a la insulina31.
No obstante, por paradójico que parezca, se observa una asociación positiva de la expresión muscular de FNDC5 con el IMC, así como con la expresión de PGC-1α31, hallazgos semejantes a los descritos por Huh et al.21. Estas discrepancias podrían reflejar diferencias en el género de las cohortes empleadas, pero también sugieren una desvinculación entre la expresión de FNDC5 y las concentraciones circulantes de irisina bajo determinadas condiciones. Por ello, sería conveniente realizar nuevos estudios que evalúen el mecanismo de procesamiento de FNDC5 y secreción de irisina para una correcta interpretación de los datos.
Considerando estos precedentes, la tasa de secreción músculo/adiposo de irisina podría variar atendiendo a la situación fisiológica en la que nos encontrásemos. Por ello, con el ejercicio, el músculo podría determinar las concentraciones de irisina, mientras que en casos atípicos de IMC, como en la obesidad, podría ser el tejido adiposo el que determinase sus concentraciones plasmáticas.
Irisina y metabolismo lipídicoEn relación con el metabolismo lipídico, apenas 3 estudios encuentran relaciones contradictorias entre las concentraciones de irisina y de colesterol-HDL. Por una parte, se ha demostrado una asociación inversa entre las concentraciones de irisina y de colesterol-HDL tanto en una cohorte de mujeres sanas como en pacientes con síndrome de hígado graso no-alcohólico (NAFLD)21,36. Además, observan que los pacientes con NAFLD presentan concentraciones de irisina menores, por lo que muestran a la irisina como un posible factor protector en la esteatosis hepática38. Sin embargo, en pacientes con enfermedad renal crónica se ha visto una asociación positiva entre concentraciones de irisina con concentraciones de colesterol-HDL39. Hasta la actualidad no se ha descrito un mecanismo directo que justifique el efecto de la irisina sobre el metabolismo del colesterol. No obstante, la presencia de esta asociación podría ser explotada debido a su potencial terapéutico.
En esta misma línea se ha evaluado el efecto de fármacos hipolipemiantes sobre las concentraciones de irisina, observándose que el tratamiento con simvastatina aumenta sus concentraciones in vivo e in vitro sobre cultivo primario humano de músculo esquelético. Sin embargo, no puede descartarse que se deba al posible daño muscular causado por la estatina, lo que podría descubrir a la irisina como un biomarcador de daño muscular más sensible que los disponibles en la actualidad40.
Irisina en otros tejidosDe forma semejante a lo realizado en modelos murinos, en los estudios realizados en humanos se ha probado que la expresión de FNDC5 no es exclusiva del tejido muscular, tal y como se ha mencionado. A pesar de que la principal expresión de FNDC5 tiene lugar principalmente en el músculo esquelético, a medida que el número de estudios va en aumento se amplían también los tejidos humanos en los que se prueba la expresión de dicha proteína. Así, se ha demostrado su síntesis en el pericardio y el recto, así como en el corazón, las arterias intracraneales, la lengua y el nervio óptico, aunque en menor medida21. Recientemente se ha sugerido la importancia de la irisina en el desarrollo de los recién nacidos debido a la presencia de este péptido en muestras de leche materna, tanto en el calostro como en la leche de transición y madura. A pesar de no llegar a confirmar su origen, los autores hipotetizan que la glándula mamaria sería la principal responsable de su origen debido a las superiores concentraciones de irisina encontradas en la leche con respecto al plasma41.
En resumen, parecen existir hallazgos contradictorios referentes a la función de la irisina y a su gen precursor. Ante los datos publicados hasta la actualidad se podría afirmar que los efectos del ejercicio sobre FNDC5 y/o irisina en humanos no son generalizables y su papel en el metabolismo energético es cuestionable. Sin embargo, aún resulta necesario esclarecer los mecanismos de procesamiento postranscripcional de FNDC5 (glucosilación, procesamiento proteolítico, liberación de irisina), que podrían justificar las diferencias observadas entre estudios, así como identificar los receptores a través de los que la irisina estaría ejerciendo su acción. No obstante, la irisina podría ser beneficiosa no solo en alteraciones relativas a la homeostasis de la glucosa, sino también en patologías neurodegenerativas, pudiendo llegar a ser una atractiva diana terapéutica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.