Introducción
Se ha demostrado que las estatinas, inhibidores de la enzima 3-hidroxi-3-metilglutaril coenzima A (HMG-CoA) reductasa, reducen la morbilidad y mortalidad cardiovascular, no sólo por su efecto reductor del colesterol plasmático, sino también mediante mecanismos pleiotrópicos. En este sentido, se ha descrito que las estatinas pueden mejorar la disfunción endotelial1 y modular la angiogénesis2.
Las estatinas inhiben la biosíntesis del mevalonato. El mevalonato es un precursor del colesterol, así como de isoprenoides intermediarios, tales como el farnesil pirofosfato (FPP) y el geranilgeranil pirofosfato (GGPP), que intervienen en la modificación postransduccional de una gran variedad de proteínas implicadas en procesos de señalización celular3. Las estatinas, al inhibir la HMG-CoA reductasa, originan un agotamiento de las reservas intracelulares de isoprenoides. Por tanto, las estatinas también regulan la actividad de las proteínas intracelulares que deben ser preniladas, para participar en procesos de transducción de señal celular. En este sentido, se ha descrito que las estatinas pueden modular la formación de nuevos vasos sanguíneos2; sin embargo, los resultados publicados referentes a su contribución a la angiogéneis son contradictorios. Las estatinas, dependiendo de su concentración, ejercen un efecto bifásico en la actividad angiogénica de las células endoteliales umbilicales humanas, a bajas concentraciones aceleran la proliferación celular, la migración y la diferenciación, manifestando un efecto proangiogénico, mientras que a altas concentraciones inhiben estas funciones4,5.
La angiogénesis está regulada por un delicado balance entre factores pro y antiangiogénicos. Entre los factores inhibidores de la angiogénesis se encuentran la trombospondina (TSP)6. La TSP es una proteína multifuncional que tiene efectos complejos y específicos según el tipo celular6. La TSP es una glucoproteína sintetizada por una gran variedad de tipos celulares, incluidas las células endoteliales7. El papel de la TSP en la angiogénesis depende de su concentración tisular, de la concentración de ciertos agonistas angiogénicos, de la localización de la TSP en el tejido y de su estado proteolítico7. Las observaciones referentes a que la trombospondina puede inhibir la angiogénesis por diferentes vías (migración, proliferación, formación del tubo, apoptosis de la célula endotelial) en células en cultivo8 plantean diversas cuestiones sobre el mecanismo por el cual la TSP regula la angiogénesis y sobre cuál es la vía de señalización intracelular, activada por los inhibidores de la angiogénesis. Dado que el efecto de las estatinas en el metabolismo del colesterol se realiza inhibiendo reacciones de prenilación de proteínas que intervienen en las vías de señalización celular, consideramos que sería de interés estudiar la influencia de la atorvastatina en el binomio angiogénesis-trombospondina.
El objetivo del presente trabajo es determinar el efecto de la atorvastatina en la síntesis y liberación de trombospondina por las células endoteliales umbilicales humanas en cultivo y su posible regulación por los metabolitos de la vía del mevalonato.
Material y método
Células endoteliales umbilicales humanas
Las células endoteliales se obtuvieron de cordones umbilicales humanos procedentes del Centro Maternal de nuestro hospital. La obtención y el cultivo de las células endoteliales de vena de cordón umbilical lo realizamos siguiendo básicamente el método descrito por nosotros9. Como medio de cultivo se utilizó medio 199 con 15 mM HEPES suplementado con 20% de suero bovino fetal (SBF), 1% de factor de crecimiento celular endotelial, 2 mM de L-glutamina, 1 mM de piruvato sódico, 50 µU/ml de penicilina, 50 mg/ml estreptomicina. Los subcultivos se obtuvieron a partir de monocapas confluentes del cultivo primario, tratadas con 0,25% de tripsina, 0,1% de EDTA en 10 mM tampón fosfatos, 150 mM de NaCl, pH 7,4 (PBS). Todas las experiencias se realizaron en el primer o segundo subcultivo.
Tratamiento de las células con atorvastatina
Monocapas confluentes de células endoteliales (placas de 96 pocillos) se incubaron en medio de cultivo con 2% de SBF durante 24 h. A continuación las células endoteliales se trataron con atorvastatina (Calbiochem) a concentraciones comprendidas entre 0,001 y 10 µM, durante los tiempos indicados en cada experimento. Para analizar la influencia de los metabolitos intermedios de la biosíntesis del colesterol, las células se incubaron con 1 µM de atorvastatina y 300 µM de mevalonato (Sigma), 20 µM de FPP (Sigma) o 20 µM de GGPP (Sigma) durante 24 h. Mevalonato, FPP y GGPP se añadieron al cultivo al mismo tiempo que la atorvastatina. En todas las experiencias se realizaron controles en paralelo. Al final de las incubaciones los sobrenadantes se recogieron y se congelaron a 80 °C. Las células se lavaron 3 veces con PBS y, después de un ciclo de congelación y descongelación, se lisaron con 50 µl/pocillo de 1% tritón X-100, 5 mM EDTA en PBS, pH 7,5, conteniendo 1 mM PMSF, durante 2 h, con agitación, a 4 °C.
Determinación de la concentración de trombospondina
Los niveles de TSP en el sobrenadante del cultivo y en el lisado celular, se cuantificaron mediante la técnica de ELISA indirecto. Brevemente, la placa de ELISA (MaxiSorp surface, Nunc) se incubó durante toda la noche con 100 µl/pocillo de TSP (20-40 µg/ml, obtenida en nuestro laboratorio a partir de plaquetas). Las muestras y los estándares de TSP se diluyeron con 5% de albúmina bovina en PBS y se incubaron durante toda la noche con el anticuerpo policlonal específico para TSP, dilución 1:1.000 (NeoMarkers Lab Vision Corporation). Al final de la incubación, 100 µl/pocillo de cada muestra se añadieron a la placa y se incubaron durante 2 h. La detección se realizó añadiendo a cada pocillo 100 µl del conjugado IgG-peroxidasa, dilución 1:2.000 (peroxidase HRP-conjugated goat antirabbit IgG, Amersham), como segundo anticuerpo, e incubando durante 2 h, a temperatura ambiente. Como sustrato se utilizó una solución de orto-fenildiamino-dihidrocloruro (OPD) a la concentración de 0,4 mg/ml en tampón acetato 0,12 M, pH 4 con 0,04% H2O2 de 30% p/v (preparada inmediatamente antes de su uso). A cada pocillo se añadieron 200 µl de la solución de OPD, incubándose a continuación durante 10 min. La reacción se paró con 4 M H2SO4. La densidad óptica (DO) se leyó a las longitudes de onda de 492 y 620 nm, en un lector de placas para ELISA (AThermo Labsystems). La conversión de lecturas de DO a concentración de TSP (ng/ml) se realizó mediante la obtención de una curva estándar, con un rango de concentración de 12 a 400 ng/ml de TSP (Sigma). El contenido proteico de los lisados celulares se determinó por el método de Lowry. La tasa de TSP de los lisados celulares se expresó en ng/µg proteínas.
Análisis estadístico
Los resultados se expresan como media ± desviación estándar de 5 experimentos independientes realizados por duplicado. Para la valoración estadística de los datos se ha empleado el paquete estadístico SPSS versión 11.0.
La significación de la diferencia entre medias se evaluó empleando la prueba de la t de Student para datos independientes (datos correspondientes a la valoración del efecto de la concentración de atorvastatina) y para datos apareados (datos correspondientes al estudio de la regulación del efecto de la atorvastatina).
Resultados y discusión
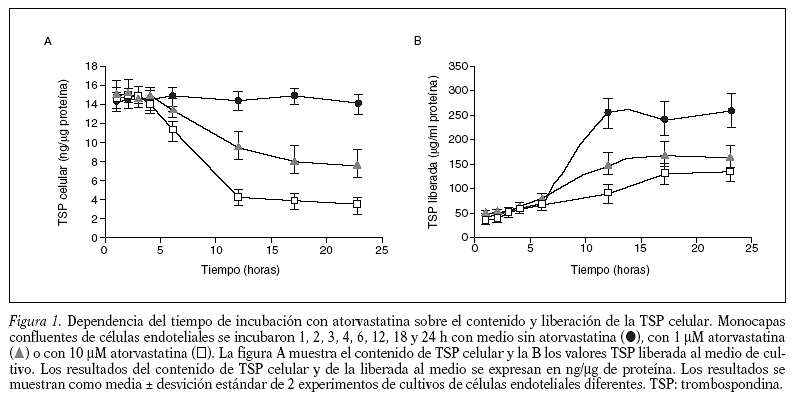
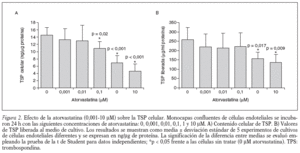
La atorvastatina disminuye el contenido y la liberación de TSP en células endoteliales umbilicales humanas en cultivo. Este efecto inhibitorio de la atorvastina sobre la TSP celular es dependiente del tiempo y la concentración. La figura 1 muestra el ensayo de dependencia del tiempo de incubación (1 a 24 h) de las células endoteliales con atorvastatina (1 y 10 µM) sobre los valores de TSP. Se observa que el contenido celular de TSP (fig. 1A) y los valores de TSP liberada al medio (fig. 1B) disminuyen con el tiempo de incubación con atorvastatina, al comparar estos valores con los obtenidos en células no tratadas. A las 24 h de incubación el efecto inhibitorio es máximo, a las dos concentraciones (1 y 10 µM) de atorvastatina estudiadas.
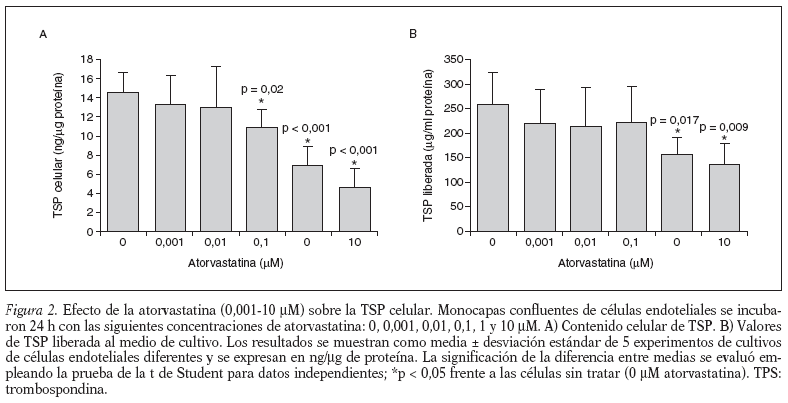
Para examinar el efecto de la concentración de atorvastatina sobre la TSP celular, las células endoteliales umbilicales humanas se incubaron con diferentes concentraciones de atorvastatina (0,001-10 µM), durante 24 h y se cuantificaron el contenido celular de TSP y los valores de TSP liberada al medio de cultivo. Nuestros resultados muestran (fig. 2) que la atorvastatina causa una inhibición dependiente de la dosis del contenido y liberación de TSP en las células endoteliales. Las células tratadas con atorvastatina a las concentraciones de 0,1, 1 y 10 µM (fig. 2 A) muestran una inhibición del contenido celular de TSP de un 25% (10,7 ± 2,0 frente a 14,5 ± 2,1 ng/µg proteína; p = 0,02), un 51% (7,1 ± 1,7 frente a 14,5 ± 2,1 ng/µg proteína; p < 0,001) y un 68% (4,7 ± 1,7 frente a 14,5 ± 2,1 ng/µg proteína; p < 0,001), respectivamente. Las células tratadas con 1 y 10 µM de atorvastatina (fig. 2B) muestran una inhibición de los valores de TSP liberada de un 38% (161 ± 35 frente a 260 ± 41 ng/µg proteína; p < 0,02) y un 46% (141 ± 41 frente a 260 ± 41 ng/µg proteína; p < 0,01), respectivamente. Estos resultados muestran que la atorvastatina, a concentraciones >= 0,1 µM, disminuye la síntesis (contenido celular) y a concentraciones >= 1 µM, disminuye la liberación de TSP en las células endoteliales umbilicales humanas en cultivo.
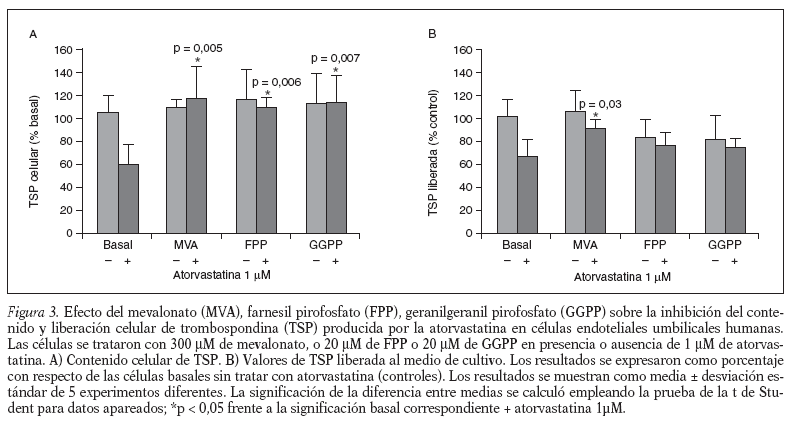
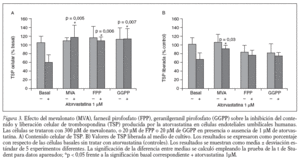
Para confirmar que el efecto de la atorvastatina, sobre el contenido y la liberación de TSP celular, está mediado por la inhibición de la HMG-CoA reductasa, incubamos las células endoteliales con atorvastatina (1 µM), con mevalonato (300 µM) y, con atorvastatina (1 µM) más mevalonato (300 µM). Nuestros resultados muestran que la incubación con mevalonato solo no afecta ni al contenido ni a la liberación de TSP por la célula endotelial (fig. 3A y B) y que, en la incubación de atorvastatina más mevalonato, el mevalonato revierte el efecto inhibitorio producido por la atorvastatina, tanto sobre el contenido como sobre la liberación de la TSP celular (fig. 3A y B).
Para conocer la implicación de los isoprenoides FPP y GGPP, en el efecto inhibitorio de la atorvastatina, sobre el contenido y la liberación de TSP celular, las células endoteliales se incubaron con atorvastatina (1 µM), con FPP (20 µM), con GGPP (20 µM), con FPP (20 µM) más atorvastatina (1 µM) y con GGPP (20 µM) más atorvastatina (1 µM). Nuestros resultados muestran (fig. 3A) que la presencia de FPP y el GGPP no afecta al contenido celular de TSP y que ambos revierten totalmente el efecto inhibitorio producido por la atorvastatina en el contenido celular de TSP. Sin embargo, la presencia, tanto de FPP como de GGPP, en ausencia de atorvastatina añadida (fig. 3B) produce una disminución en la liberación de TSP próxima al 20% en ambos casos, sin alcanzar significación estadística. En las células tratadas con atorvastatina, en presencia de FPP y de GGPP, aunque revierte en parte la inhibición causada por la atorvastatina, el aumento observado no es estadísticamente significativo (fig. 3B).
Nuestros resultados muestran, por primera vez, que la atorvastatina produce una inhibición de la expresión proteica y de la liberación de TSP en células endoteliales umbilicales humanas y que esta inhibición ocurre de forma dosis dependiente. La disminución de los valores de TSP intracelular se observa a concentraciones de atorvastatina iguales o mayores de 0,1 µM, mientras que la disminución de la TSP liberada al medio se observa a concentraciones de atorvastatina iguales o mayores de 1 µM. Estos resultados están de acuerdo con los obtenidos previamente por otros autores al valorar el efecto de diferentes estatinas sobre células musculares lisas. Riessen et al10 describieron que inhibidores de HMG-CoA reductasa, tales como la lovastatina y la simvastatina, disminuyen la expresión de TSP en células musculares lisas; sin embargo, la pravastatina no la disminuye. En un estudio reciente11, realizado en cultivos de células musculares lisas, se ha descrito que la cerivastatina inhibe de manera dependiente de la dosis el nivel de ARN mensajero de TSP, disminuye la TSP intracelular a dosis comprendidas entre 0,05 y 0,1 µM y también la liberación de TSP a dosis mayores de 0,5 µM.
Nuestros resultados muestran que el efecto inhibitorio de la atorvastatina en la TSP intracelular puede atribuirse a la reducción del mevalonato o de sus metabolitos, ya que la inhibición del contenido proteico de TSP celular causada por la atorvastatina revirtió completamente al añadir tanto mevalonato, como FPP o GGPP. Estos hallazgos coinciden con los obtenidos por otros autores que demuestran que el efecto inhibitorio de la lovastatina sobre la expresión de TSP en células musculares lisas fue completamente bloqueado por el mevalonato10. La coincubación de mevalonato con atorvastatina también restauró la tasa de TSP liberada al medio de cultivo por las células endoteliales, revirtiendo el efecto de la atorvastatina. Sin embargo, la coincubación de FPP y GGPP con atorvastatina no revirtió el efecto de esta última sobre la liberación de TSP. El hecho de que FPP y GGPP bloqueen el efecto de la atorvastatina sobre el contenido celular de TSP y no bloqueen el efecto sobre la liberación, al contrario que el mevalonato, podría explicarse considerando la importancia del FPP y GGPP en los mecanismos de transducción de señal de la membrana celular. En este sentido, es conocido que FPP y el GGPP son sustratos para las reacciones de isoprenilación de proteínas, asegurando una adecuada localización y función de las proteínas implicadas en los mecanismos de transducción de señal12 y que ciertas proteínas preniladas están implicadas tanto en la regulación del tráfico de membrana, como en la inhibición de la prenilación que previene la secreción proteica13. Además, estas reacciones de isoprenilación, farnesilación y geranilgeranilación están catalizadas por las enzimas farnesil proteína transferasa (FPTasa) y geranilgeranil proteína transferasa (GGPTasa) I y II, que aseguran la adecuada localización de las proteínas implicadas en los mecanismos de la transducción de señal14. Un exceso de sustrato (FPP o GGPP) podría disminuir la concentración de la enzima libre y alterar la prenilación de las proteínas implicadas en la secreción de TSP. Este mecanismo podría explicar el hecho de que la adición de FPP y GGPP revierta el efecto de la atorvastatina sobre la TSP intracelular y no revierta el efecto de la atorvastatina sobre la liberación de TSP. En suma, la presencia de mevalonato no modifica el contenido de TSP celular, ni la tasa liberada al medio; sin embargo, la presencia de FPP y GGPP no modifican el contenido celular de TSP pero sí que disminuyen la tasa de TSP liberada al medio. Estos hechos implican dos mecanismos de acción; por un lado el mevalonato que sigue la vía de degradación a FPP y a GGPP sin alterar la liberación de TSP y, por otro lado, el exceso de FPP y GGPP que agota la acción enzimática de las transferasas implicada en la isoprenilación y que explicaría la disminución de TSP liberada.
En conclusión, la atorvastatina regula negativamente a la TSP, en la célula endotelial, a través de la inhibición del mevalonato. Este hallazgo proporciona un nuevo acercamiento al conocimiento de los mecanismos de acción de las estatinas sobre la pared vascular.
Agradecimientos
Agradecemos a Guadalupe Manzano, Úrsula Salinas y Aurelia Royo por su excelente ayuda técnica.