Las lipoproteínas de baja densidad (LDL) son un agente causal de la enfermedad cardiovascular. En la práctica, se asume una identificación entre las LDL y el colesterol unido a las LDL (cLDL). De esta forma el cLDL se ha transformado en un objetivo prioritario para la prevención cardiovascular. Sin embargo, cada vez existen más evidencias de que las lipoproteínas ricas en triglicéridos, especialmente las de muy baja densidad (VLDL) son capaces de promover y desarrollar arteriosclerosis, transformando así el colesterol unido a VLDL (cVLDL) y sus remanentes en otro potencial objetivo terapéutico. Esto es particularmente importante, por su magnitud, en los individuos con hipertrigliceridemia. Podemos señalar, por tanto, que la suma del cLDL más cVLDL y sus remanentes y el colesterol de la lipoproteína(a) –o lo que resulta similar, el colesterol-no-HDL (c-no-HDL)–. Además, la concentración de c-no-HDL no muestra variaciones significativas en el estado de ayunas o posprandial.
En consecuencia, el c-no-HDL se ha transformado en un excelente indicador de colesterol aterogénico, y un objetivo terapéutico primordial en individuos con dislipidemia aterogénica. De acuerdo con los distintos ensayos clínicos, y los estudios epidemiológicos de base poblacional y genética, en los pacientes de muy alto riesgo, el nivel óptimo de cLDL es inferior a 70mg/dl, y de c-no-HDL inferior a 100mg/dl, mientras que en los de alto riesgo será 100 y 130mg/dl, respectivamente.
Lowe density lipoproteins (LDL) are the causal agent of cardiovascular diseases. In practice, we identify LDL with cholesterol transported in LDL (cLDL). So, cLDL has become the major target for cardiovascular prevention. Howewer, we have progressive evidences about the role of triglycerides rich lipoproteins, particularly those very low density lipoprotein (VLDL) in promotion and progression of atherosclerosis, that leads cholesterol in VLDL and its remanents as a potential therapeutic target. This feature is particularly important and of a great magnitude, in patients with hypertiglyceridemia. We can to considere, that the non-HDL cholesterol –cLDL+cVLDL+c-remmants+Lp(a)– is the real measurement of atherogenic cholesterol. In addition, non-HDL-cholesterol do not show any variations between postprandial states.
In fact, non-HDL-cholesterol should be an excellent marker of atherogenic cholesterol, and an major therapeutic target in patients with atherogenic dyslipidaemia. According with different clinical trials and with the epidemiological and mendelian studies, in patients with high cardiovascular risk, optimal level of cLDL will be under 70mg/dl, and under 100 ng/dl for non-HDL-cholesterol; and in high risk patients, 100mg/dl and 130mg/dl, respectively.
Aunque en el momento actual el descenso del colesterol unido a las lipoproteínas de baja densidad (cLDL) es una prioridad para reducir el riesgo cardiovascular, también es suficientemente conocido el papel del aumento de las lipoproteínas ricas en triglicéridos o el descenso del colesterol unido a las lipoproteínas de alta densidad (cHDL) como factores de riesgo y objetivos terapéuticos secundarios en los pacientes de alto/muy alto riesgo cardiovascular. Ambas circunstancias unidas tienen un efecto sinérgico sobre el riesgo cardiovascular, y generalmente van unidas a un fenotipo de partículas de LDL pequeñas y densas, constituyendo la dislipidemia aterogénica
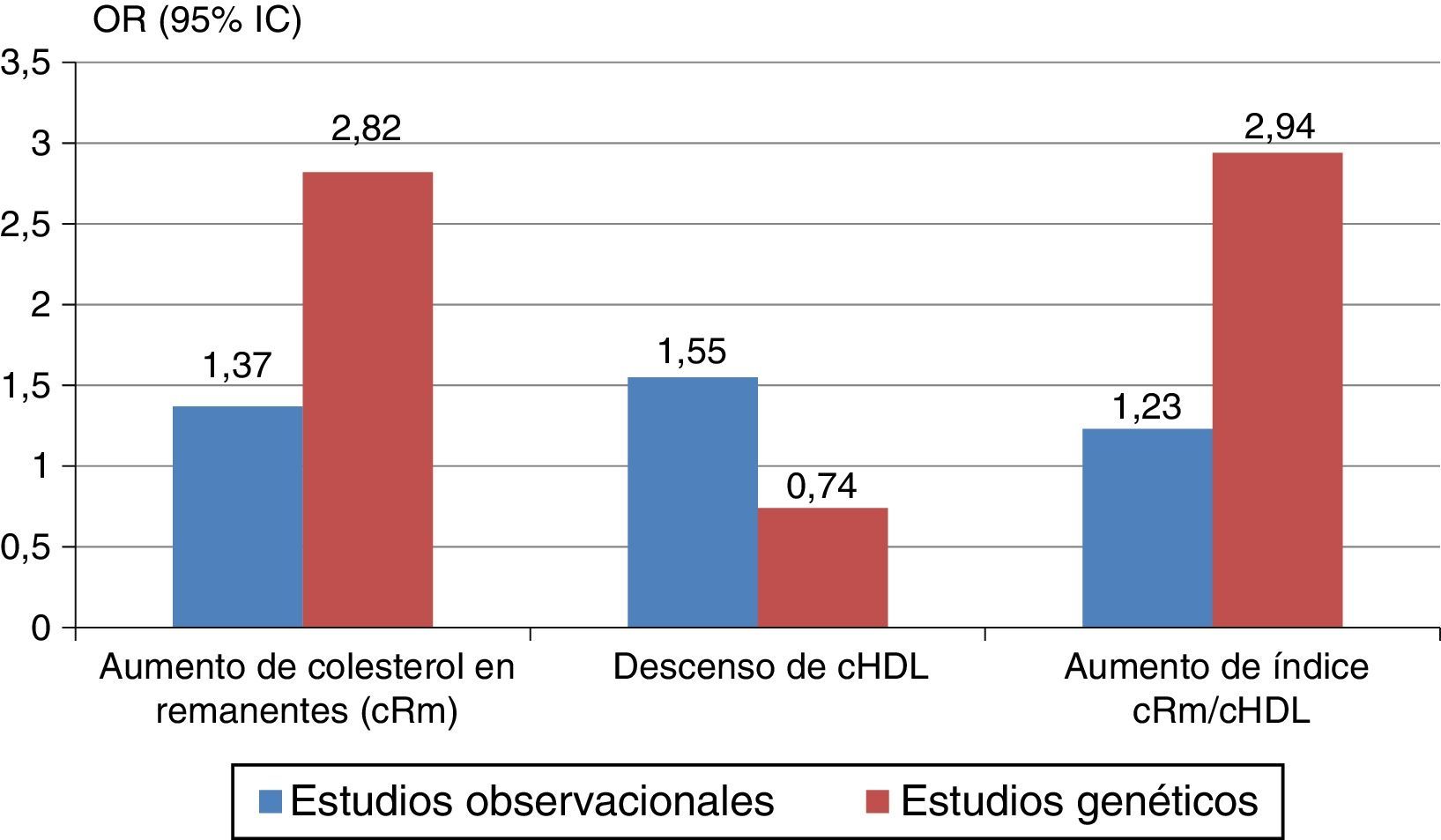
Las evidencias son muy consistentes, y algunos de los estudios epidemiológicos y/o de intervención así lo han demostrado1, incluidos algunos con una gran base poblacional (tabla 1). Con respecto a la elevación de triglicéridos, el estudio Emerging Risk Factors Collaboration, en población general sin enfermedad cardiovascular previa, puso de manifiesto una asociación de las cifra de triglicéridos con distintos episodios cardiovasculares, aunque dicha asociación desaparecía cuando se ajustaba por cHDL y c-no-HDL2. En el estudio PROVE-IT TIMI 22, realizado en pacientes con síndrome coronario agudo en tratamiento con estatinas y cLDL en objetivo (<70mg/dl), una cifra de triglicéridos>150mg/dl se asociaba de forma independiente con una menor tasa de recurrencias3. El análisis agrupado de los estudios IDEAL y TNT demostró, asimismo, que en pacientes en prevención secundaria tratados con estatinas, el descenso de triglicéridos se acompañaba de reducción en la incidencia de accidentes cardiovasculares, aunque esta asociación se atenuaba al ajustar por cHDL4. En relación con ello, es preciso advertir que el mismo estudio Emerging Risk Factors Collaboration ya señalado2, indicaba al cHDL como un factor de riesgo predictor independiente de episodios coronarios y cerebrovasculares, incluso cuando se ajustaba por el resto de factores lipídicos y no lipídicos de riesgo. El estudio SPARCL, en pacientes con enfermedad cerebrovascular previa, mostró un mayor descenso en el riesgo de recurrencia de ictus cuando los niveles de cHDL eran más altos, independientemente de las cifras de cLDL5. Los metaanálisis de Cholesterol Treatment Trialists’ Collaborators, tanto en prevención primaria como en secundaria, y en pacientes tratados con estatinas, señalan de forma inequívoca que, al margen e independientemente de las cifras de cLDL, el riesgo cardiovascular es inferior con cifras más elevadas de cHDL, aun en los casos de cLDL más bajo6,7. Otro estudio en pacientes con cardiopatía isquémica y con alta intensidad de estatina (TNT) también señaló el poder predictor de las concentraciones bajas de cHDL, aun con cLDL bien controlado (<70mg/dl)8. Finalmente, incluso otro estudio –MIRACL– en pacientes con síndrome coronario agudo y tratados con estatinas, ha constatado que el cHDL, y no así el cLDL, era un marcador predictor independiente del pronóstico a corto plazo9.
Por tanto, la asociación del cHDL con el riesgo cardiovascular es muy determinante, y algún estudio ha sido suficientemente expresivo para establecer que el c-no-HDL es un elemento destacadísimo para valorar el riesgo cardiovascular, tanto si se ajusta como si no, por otros factores de riesgo asociados2.
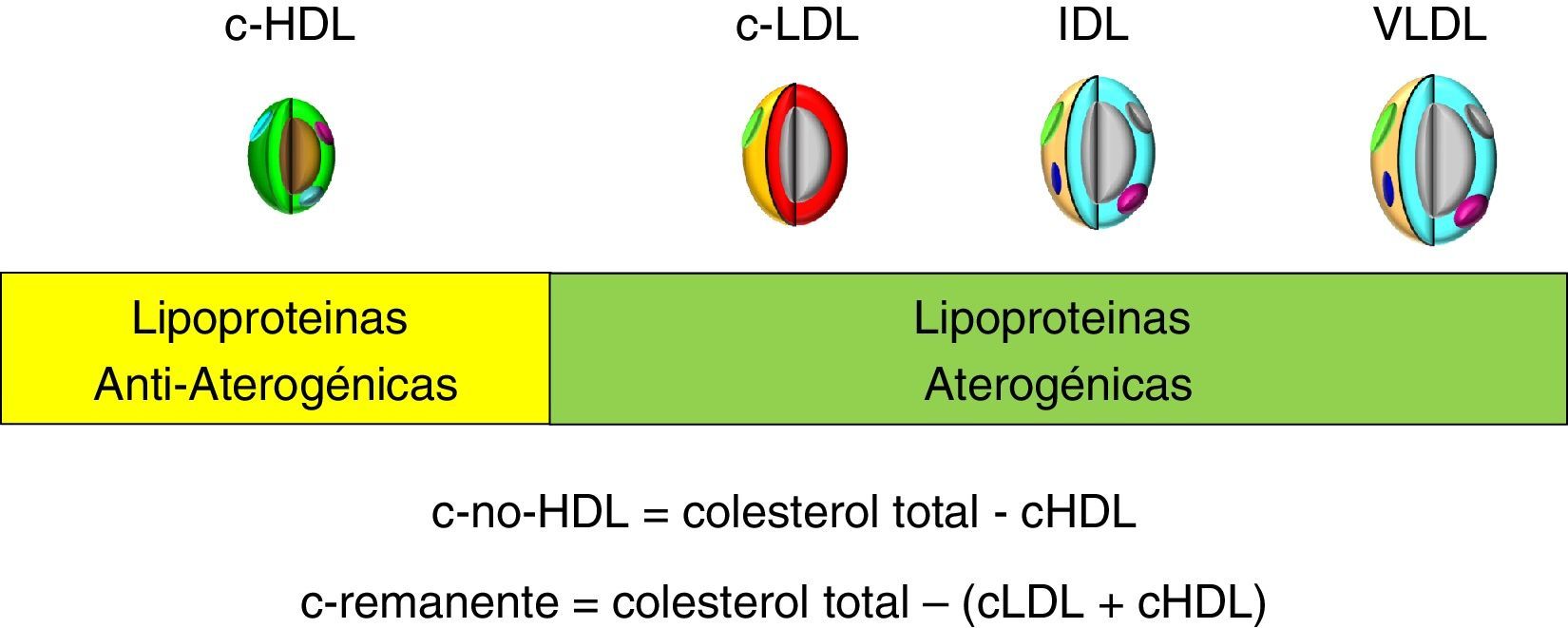
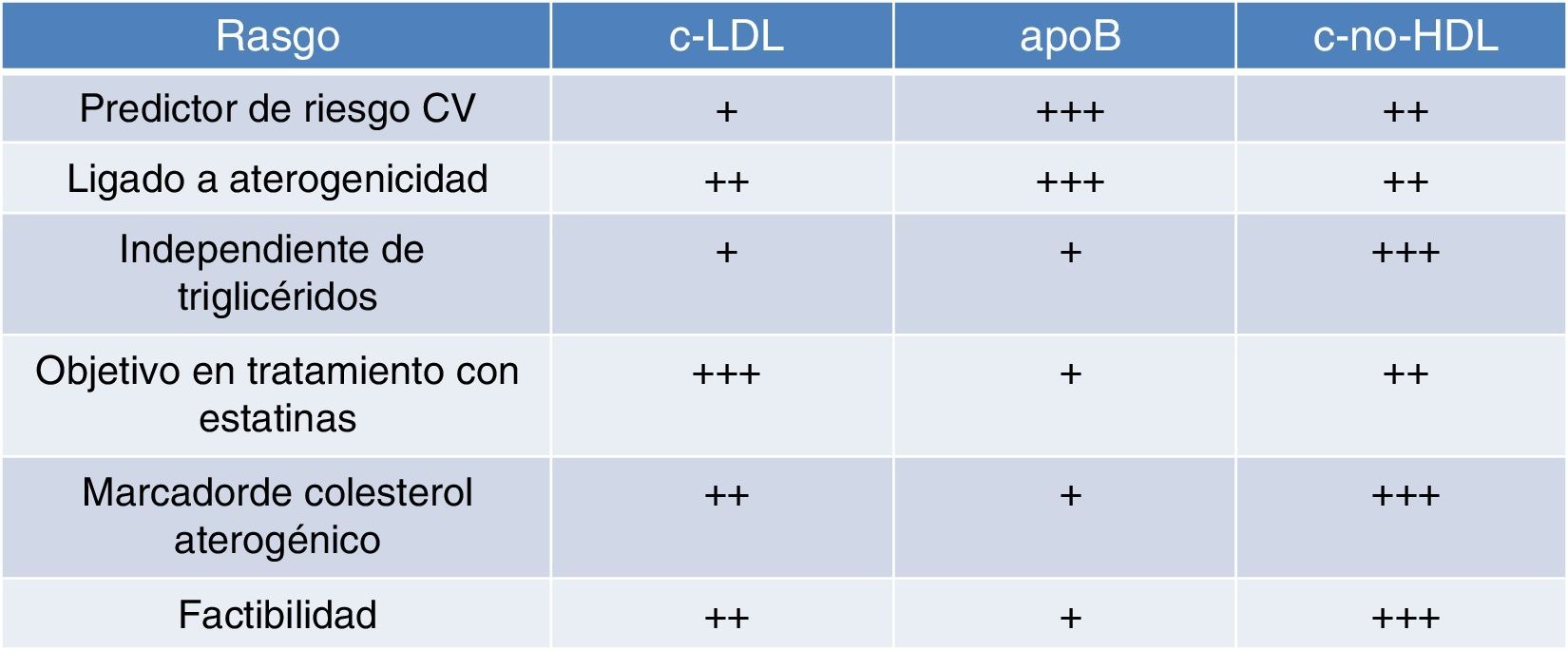
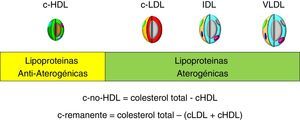
Además, el c-no-HDL puede ofrecer una magnitud del balance entre lipoproteínas aterogénicas y antiaterogénicas, por cuanto representa la suma de las lipoproteínas aterogénicas (fig. 1) y esto es especialmente útil en situaciones clínicas tan frecuentes como la diabetes mellitus, el síndrome metabólico o la obesidad visceral, en las que la dislipidemia aterogénica (aumento de triglicéridos, descenso de cHDL y partículas LDL pequeñas y densas) es un trastorno característico, pasando a constituirse en un marcador de riesgo residual de origen lipídico.
Colesterol-no-HDL y riesgo residualLa organización Residual Risk Reduction initiative (R3i), en su estrategia de mejorar el diagnóstico y el tratamiento de la dislipidemia aterogénica como un elemento clave determinante del riesgo residual, señala que el c-no-HDL es un elemento sencillo y práctico para ayudar a las decisiones diagnósticas (muestra del disbalance antes señalado) y terapéuticas (objetivo prioritario de control del riesgo residual de origen lipídico)10.
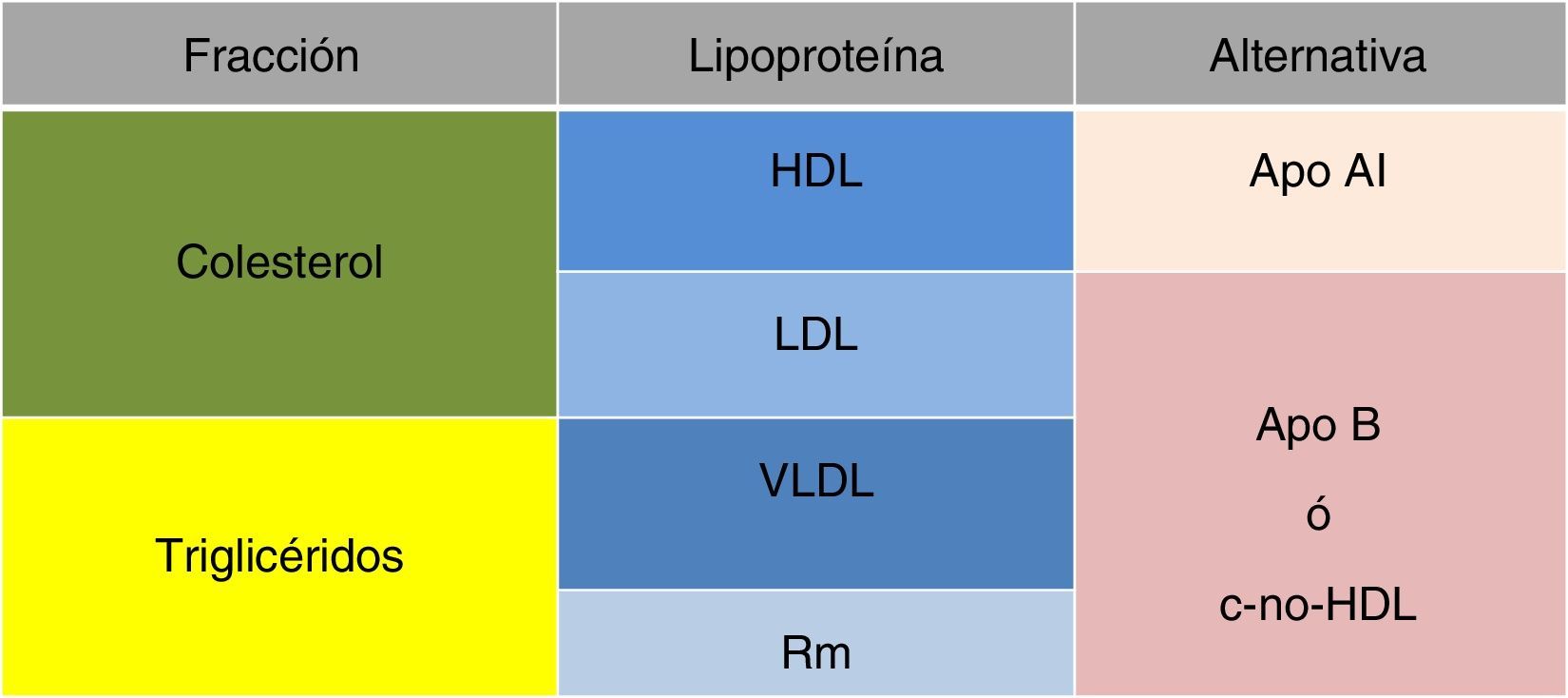
Por definición, el c-no-HDL representa esencialmente la suma del cLDL, del colesterol de la lipoproteína(a), del cVLDL y del colesterol de las partículas remanentes.
Estas últimas son un determinante del riesgo residual «no-LDL-dependiente», motivo por el que R3i recomienda poner énfasis en el empleo del c-no-HDL para la toma de decisiones, de cara a disminuir las complicaciones macrovasculares. Además, este marcador pasa a ser una expresión directa de cómo unas cifras concretas (concentración de colesterol total, cLDL, cHDL y triglicéridos) se pueden transformar en una variable continua única con visión global y unitaria del balance entre aterogenicidad y antiaterogenicidad de las lipoproteínas. Un marcador que puede ser empleado de forma más sencilla y pragmática, y sin interferencias con el resto de determinaciones lipídicas (tablas 2 y 3).
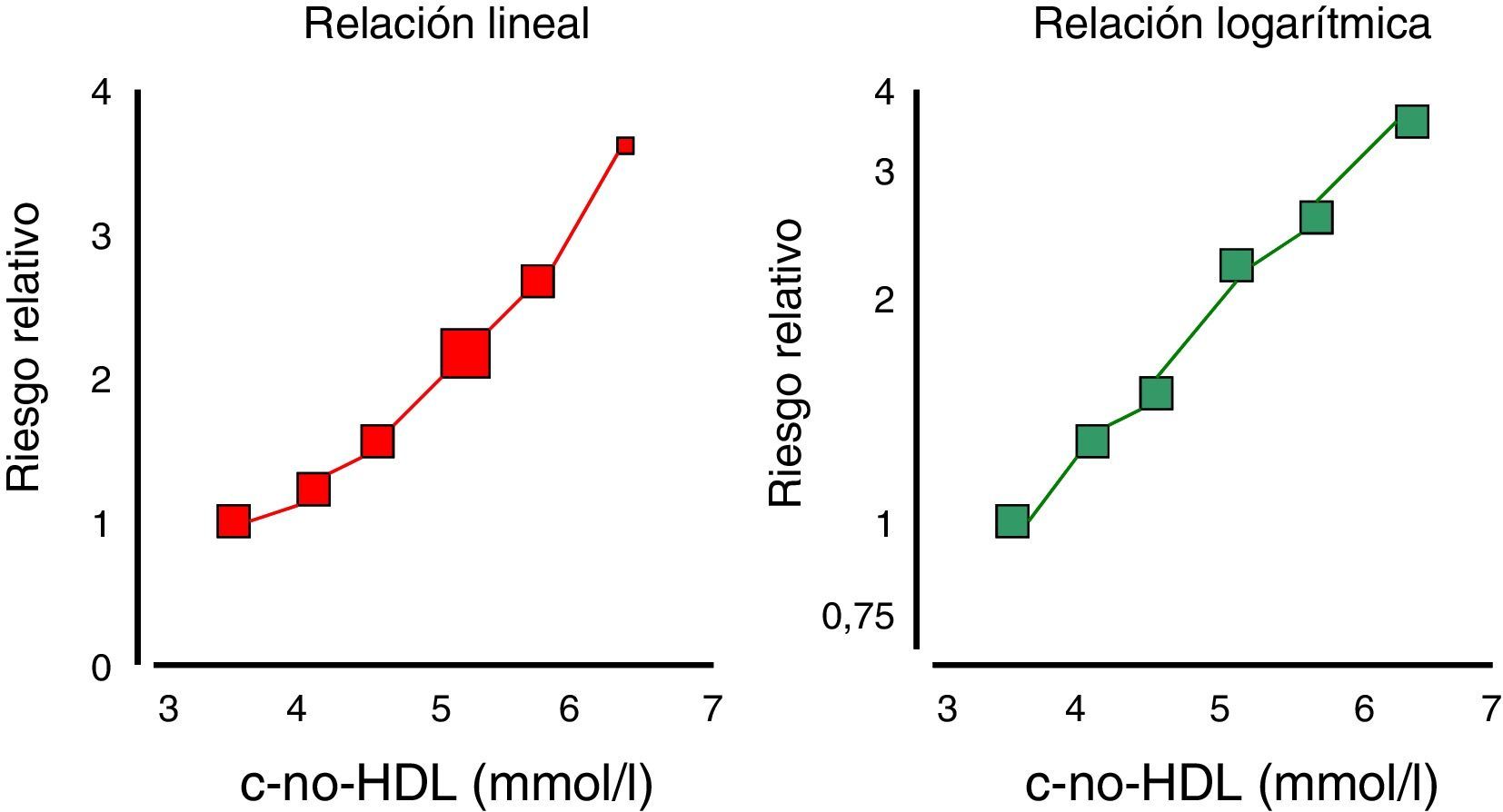
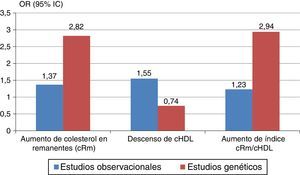
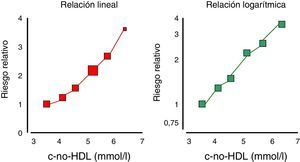
Aún más, el colesterol unido a las lipoproteínas remanentes o lipoproteínas de densidad intermedia (IDL) se ha transformado en un elemento, que por sí solo aporta evidencias de ser un agente causal de cardiopatía isquémica, independientemente del cHDL11 (fig. 2), y relacionado con la mortalidad total en los pacientes con enfermedad cardiovascular12.
Riesgo de enfermedad isquémica de corazón estimado según cifras de colesterol-remanente: total-(LDL+HDL). Modificada de Fruchart et al.10.
En suma, dadas las interrelaciones metabólicas entre cHDL y el resto de las lipoproteínas, y los efectos sinérgicos sobre el riesgo cardiovascular entre todas las lipoproteínas aterogénicas, que contienen colesterol y son ricas en apolipoproteína B (apoB), el c-no-HDL, como representante de la totalidad del colesterol aterogénico, se convierte en un marcador idóneo para valorar el mismo, así como para establecer el objetivo terapéutico que proceda.
Más recientemente, se han publicado evidencias sobre el riesgo residual para complicaciones microvasculares en aquellos pacientes con dislipidemia aterogénica13. En este estudio, en pacientes diabéticos, la elevación de triglicéridos y el descenso de cHDL eran factores asociados de forma significativa e independiente a las complicaciones microvasculares, específicamente a la nefropatía, y con menos fuerza, a la retinopatía14. Estos hallazgos están en consonancia con la importancia que se ha atribuido en los pacientes diabéticos para considerar el c-no-HDL como un indicador de riesgo y un objetivo terapéutico15.
Colesterol-no-HDL y riesgo vascular de origen metabólicoEn pacientes con síndrome metabólico se ha recomendado que el objetivo terapéutico más preciso sea el c-no-HDL, o bien la apoB, puesto que ambos parámetros se correlacionan mejor con el riesgo cardiovascular que el cLDL16. Estos pacientes tienen un riesgo cardiovascular doble o triple que el de la población general, firmemente sustentado en la dislipidemia aterogénica17–19. Esta situación es paradigmática para comprender cómo aunque el cLDL pueda permanecer más o menos estable, a medida que aumentan el resto de lipoproteínas aterogénicas –ricas en apoB– y disminuye el cHDL, el riesgo se incrementa, señalando así al colesterol total aterogénico, y no solo al cLDL, como el mejor marcador y objetivo en estas circunstancia (fig. 3). Si en esta situación se empleara el cLDL estaríamos infraestimando el riesgo porque no reflejaría el auténtico aumento de lipoproteínas aterogénicas20, y en consecuencia, el c-no-HDL nos informa de manera más precisa sobre el riesgo cardiovascular.
Así, el c-no-HDL es un magnífico indicador de las lipoproteínas ricas en apoB, cuya determinación es mucho más fácil, no precisa el ayuno para cuantificarlo, no está influido por la cifra de triglicéridos, y es un excelente marcador de colesterol aterogénico (tabla 3), con una mejor correlación con el riesgo cardiovascular que el cLDL20.
Por tanto, en estos pacientes, la alternativa de considerar el c-no-HDL como un objetivo primario está plenamente justificada, porque representa más y mejor que el cLDL el riesgo de origen lipídico, y porque es más factible que la determinación de apoB. Una vez establecidos los niveles óptimos y el objetivo terapéutico en función de cada individuo (tabla 4), se procederá a ajustar el tratamiento para mejorar el control con los fármacos iniciales, que suelen ser las estatinas. Si bien, el control eficaz de este riesgo dependerá frecuentemente de la asociación con otro fármaco, bien sea ezetimiba para optimizar el control de cLDL, o fenofibrato para optimizar el control de la hipertrigliceridemia y/o HDL bajo. Esta última estrategia ha mostrado efectos favorables cuando la dislipidemia aterogénica se encuentra presente21,22.
Colesterol-no-HDL como objetivo terapéuticoEl cLDL es considerado como un objetivo primario según la práctica tradicional en la intervención para reducir el riesgo cardiovascular. Sin duda, las partículas de LDL son las principales lipoproteínas aterogénicas. Pero no son las únicas por cuanto las partículas de VLDL también son lipoproteínas con potencial efecto aterogénico adicional, y esto puede ser muy relevante en aquellos pacientes con gran cantidad de VLDL. En consecuencia la suma de LDL y VLDL representará más fielmente la totalidad del colesterol aterogénico, lo que puede derivar a considerarlo como un objetivo terapéutico muy apropiado de cara a la intervención.
Además, la capacidad de aportar un poder predictor incluso superior al del cLDL y semejante al de la apoB, y el hecho de que no requiera la determinación en ayunas para su cuantificación, hacen que la suma de las lipoproteínas aterogénicas (LDL+VLDL+IDL –o lo que es lo mismo en términos prácticos colesterol total-HDL–) sea la medida más precisa del colesterol aterogénico y que, aunque la mayoría de las guías de práctica clínica mantienen al cLDL como el objetivo tradicional, el c-no-HDL se va transformando en un parámetro de utilización preferente.
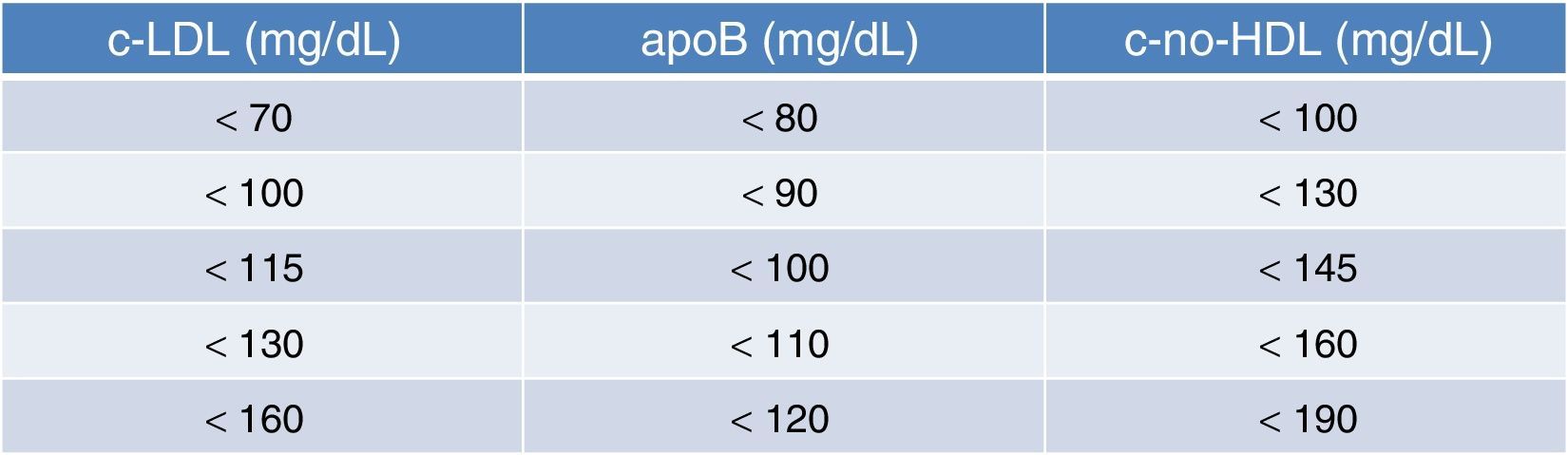
Por sí solas, las LDL y las lipoproteínas ricas en triglicéridos (VLDL pequeñas e IDL) pueden iniciar y promover los fenómenos aterogénicos, si bien es cierto que estos fenómenos pueden verse acelerados por otros factores de riesgo: tabaco, hipertensión arterial, diabetes, descenso de HDL, o factores genéticos (historia familiar). Por tanto, la prevención primaria de la enfermedad cardiovascular pasa por el control del cLDL y también del c-no-HDL. En prevención primaria, los niveles óptimos de c-no-HDL se mantienen en un máximo de 130mg/dl23, lo que equivale a un cLDL inferior a 100mg/dl. Son los niveles considerados como óptimos, y no tanto como objetivos que dependerán, en todo caso, del juicio clínico y de las particularidades del individuo. De cualquier manera, una tabla de equivalencias entre cLDL, apoB y c-no-HDL siempre ha de tenerse en consideración (tabla 5)16.
Equivalencia entre objetivos de cLDL, apoB y c-no-HDL en individuos con triglicéridos>200mg/dl. Tomada de Ascaso y Carmena16
Los niveles óptimos representan aquellos que, cuando se alcanzan con cualquiera de los tratamientos disponibles, se acompañan de una reducción máxima. Los objetivos terapéuticos se deben establecer sobre la base de una proyección de la eficacia de un tratamiento, de su seguridad y de su coste-efectividad. Esto significa, en la práctica, que en condiciones habituales y de cara a un tratamiento estándar, los niveles óptimos representan habitualmente un objetivo razonablemente bien establecido.
En prevención secundaria, los niveles óptimos de c-no-HDL son inferiores a 100mg/dl, equivalente a cLDL<70mg/dl. Con frecuencia, cuando resulta difícil alcanzar el objetivo de c-no-HDL una vez que se han alcanzado dosis máximas toleradas de estatinas, se precisa un tratamiento combinado con ezetimiba (en hipercolesterolemia pura) o con fenofibrato (en presencia de dislipidemia aterogénica). Todo ello al margen de la optimización de las normas correctoras del estilo de vida.
Colesterol-no-HDL: implicaciones terapéuticasLos pacientes con elevación de cLDL se encuentran expuestos a un elevado riesgo cardiovascular, por lo que han de ser tratados generalmente con fármacos. Además, la elevación de triglicéridos supone un factor de riesgo adicional que además se exacerba si concurren niveles bajos de cHDL. Este es el motivo por el que se considera que el c-no-HDL forma parte de los objetivos de tratamiento, al menos como un objetivo secundario y de especial trascendencia cuando exista hipertrigliceridemia24,25.
Los grandes estudios de intervención han demostrado la eficacia y seguridad del empleo de estatinas en monoterapia o en combinación con otros fármacos hipolipidemiantes. En particular en los pacientes con hipertrigliceridemia en los que, como queda señalado, la utilización de c-no-HDL como marcador de riesgo con valor pronóstico, y también como objetivo terapéutico, ha de ser considerado como de gran utilidad, la adición de fenofibrato a la estatina. Esta asociación ha mostrado de forma inequívoca un beneficio clínico, hasta el punto de que la European Medicine Agency tiene aprobada la combinación para el tratamiento de la dislipidemia mixta cuando, pese al uso de una estatina, los triglicéridos y el cHDL permanecen fuera de objetivos26.
De hecho un panel europeo de expertos ha publicado recientemente unas recomendaciones al respecto27. Así, para la dislipidemia LDL dependiente y en los pacientes con riesgo cardiovascular de intermedio a muy alto, el tratamiento con estatinas debe comenzar al mismo tiempo que se optimizan las medidas relacionadas con el estilo de vida. El tipo de estatina y su dosis dependerá de la magnitud de la reducción de cLDL que se requiera para alcanzar el objetivo establecido en las guías de práctica clínica; si fuera preciso, se podría incrementar la dosis de estatina hasta alcanzar la máxima dosis tolerada. La adición de ezetimiba podría añadir potencia hipocolesterolemiante al tratamiento con estatina, llegado el caso.
En la dislipidemia no-LDL-dependiente, el c-no-HDL ha de ser empleado como un objetivo terapéutico secundario (y ser calculado como 30mg/dl adicionales al objetivo de cLDL). En los pacientes con dislipidemia aterogénica, el fenofibrato habrá de emplearse en los casos con aumento de triglicéridos (superior a 200mg/dl) o descenso de cHDL. En estos casos, el empleo de una terapia combinada de estatina y fenofibrato, a dosis fija y en un solo comprimido, podría mejorar el cumplimiento y la adherencia terapéutica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.