El colesterol es de vital importancia para la estructura y función de la membrana celular de los vertebrados. Es obvio que es esencial una adecuada regulación de la homeostasis del colesterol. La hipercolesterolemia promueve la aterosclerosis, y por lo tanto representa un importante factor de riesgo cardiovascular. El hígado ha sido considerado el principal órgano para el control de la homeostasis del colesterol. Facilita el aclaramiento de las lipoproteínas de (muy) baja densidad y de los remanentes de quilomicrones, sintetiza colesterol, sintetiza y secreta lipoproteínas de alta densidad (nacientes), secreta colesterol y sales biliares a la bilis, y está implicado en el transporte reverso de colesterol. En los últimos años se ha constatado la importancia creciente del intestino en muchos aspectos de la fisiología del colesterol. Es evidente que la secreción directa de colesterol desde la sangre al intestino, o la excreción transintestinal de colesterol, juegan un papel importante en la eliminación del colesterol a través de las heces. En esta revisión se discuten los conocimientos actuales sobre la fisiología de la homeostasis del colesterol, con énfasis en su absorción, síntesis y excreción fecal, así como las opciones terapéuticas para la hipercolesterolemia.
Cholesterol is of vital importance for vertebrate cell membrane structure and function. It is obvious that adequate regulation of cholesterol homeostasis is essential. Hypercholesterolemia promotes atherosclerosis and thereby represents a major risk factor for cardiovascular disease. The liver has been considered the major site of control in maintenance of cholesterol homeostasis. The liver facilitates clearance of (very) low density lipoprotein particles and cholesterol-containing chylomicron remnants, synthesizes cholesterol, synthesizes and secretes (nascent) high density lipoprotein particles, secretes cholesterol and bile salts to bile, and is involved in reverse cholesterol transport. In recent years, however, the importance of the intestine in many aspects of cholesterol physiology is increasingly recognized. It has become apparent that direct secretion of cholesterol from the blood compartment into the intestine, or transintestinal cholesterol excretion, plays a major role in disposal of cholesterol via the feces. This review will discuss current knowledge on the physiology of cholesterol homeostasis, with emphasis on cholesterol absorption, cholesterol synthesis and fecal excretion, and therapeutic options for hypercholesterolemia.
El colesterol es un componente de vital importancia para la estructura y la función de la membrana celular de los vertebrados1. Es esencial para el crecimiento tisular y la síntesis de hormonas esteroideas. Los metabolitos del colesterol, tales como las sales biliares, las hormonas esteroideas y los oxisteroles realizan funciones biológicas importantes2. Es evidente que la regulación adecuada de la homeostasis del colesterol es esencial. La relación entre las concentraciones séricas de colesterol y enfermedad coronaria es conocida desde hace muchos años. El primer gran estudio clínico de prevención cardiovascular realizado con un fármaco hipocolesterolemiante hace 20años (Lipid Research Clinics Coronary Primary Prevention Trial) confirmó la reducción de incidencia de enfermedad cardiaca coronaria al disminuir las cifras de colesterol3. Desde entonces, numerosos estudios epidemiológicos y clínicos han confirmado la asociación positiva entre colesterol total y colesterol transportado en lipoproteínas de baja densidad (cLDL) y el riesgo de desarrollar arteriosclerosis y enfermedad cardiaca coronaria4, así como la asociación negativa con el colesterol transportado en lipoproteínas de alta densidad (cHDL)5.
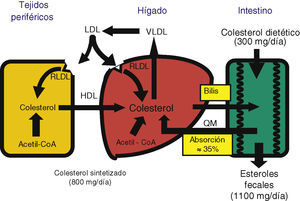
En los mamíferos el colesterol puede obtenerse a través de la absorción de colesterol de la dieta (vía exógena) o de la síntesis de novo en las células del organismo (vía endógena). El hígado es el órgano responsable de la regulación de la homeostasis del colesterol6. Entre sus funciones figuran: facilitar la eliminación de las lipoproteínas de muy y de baja densidad (VLDL y LDL) y los remanentes de quilomicrones que contienen colesterol; sintetizar colesterol; sintetizar y secretar lipoproteínas (nacientes) de alta densidad (HDL); segregar colesterol y sales biliares a la bilis, y estar implicado en el transporte reverso de colesterol7. Recientemente, sin embargo, cada vez es más reconocida la importancia del intestino en muchos aspectos de la fisiología del colesterol por su gran impacto sobre la homeostasis del colesterol a nivel de su reabsorción, de su excreción fecal y de su síntesis de novo8.
A continuación se exponen los conocimientos recientes sobre la fisiología de la homeostasis del colesterol. En el siguiente apartado se resumen las diferentes formas de transporte del colesterol en el plasma. Más adelante se muestran distintos aspectos sobre la síntesis y absorción de colesterol. Y por último se discuten las vías del transporte reverso de colesterol.
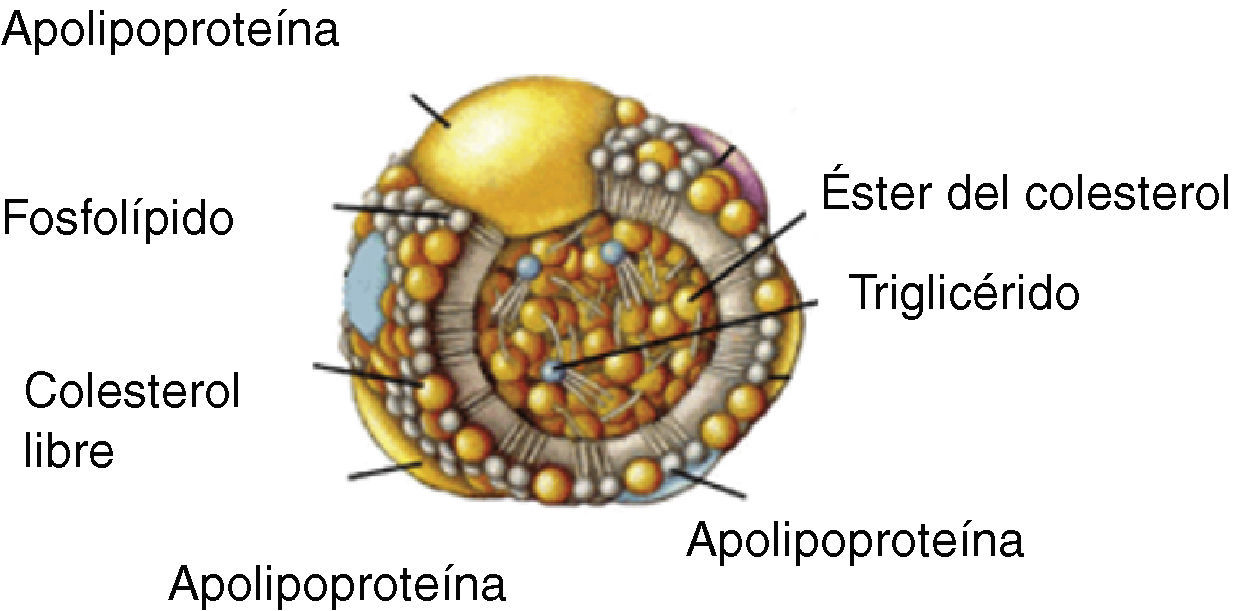
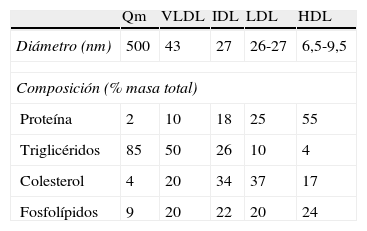
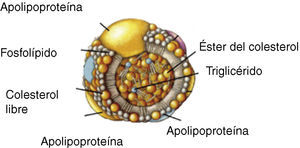
Transporte del colesterol en plasmaDebido a su insolubilidad en medio acuoso, para poder ser transportado por los fluidos biológicos el colesterol se une a fosfolípidos y proteínas formando las lipoproteínas, que son agregados polimoleculares esféricos con una capa externa hidrosoluble que contiene fosfolípidos, colesterol libre y proteínas de transporte lipídico (apolipoproteínas), y una parte interna insoluble con triglicéridos y ésteres de colesterol (fig. 1). Podemos distinguir 5 grandes grupos de lipoproteínas en función de su densidad: quilomicrones, lipoproteínas de muy baja densidad (VLDL), lipoproteínas de densidad intermedia (IDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL), que tienen un tamaño y una composición química diferente (tabla 1)9.
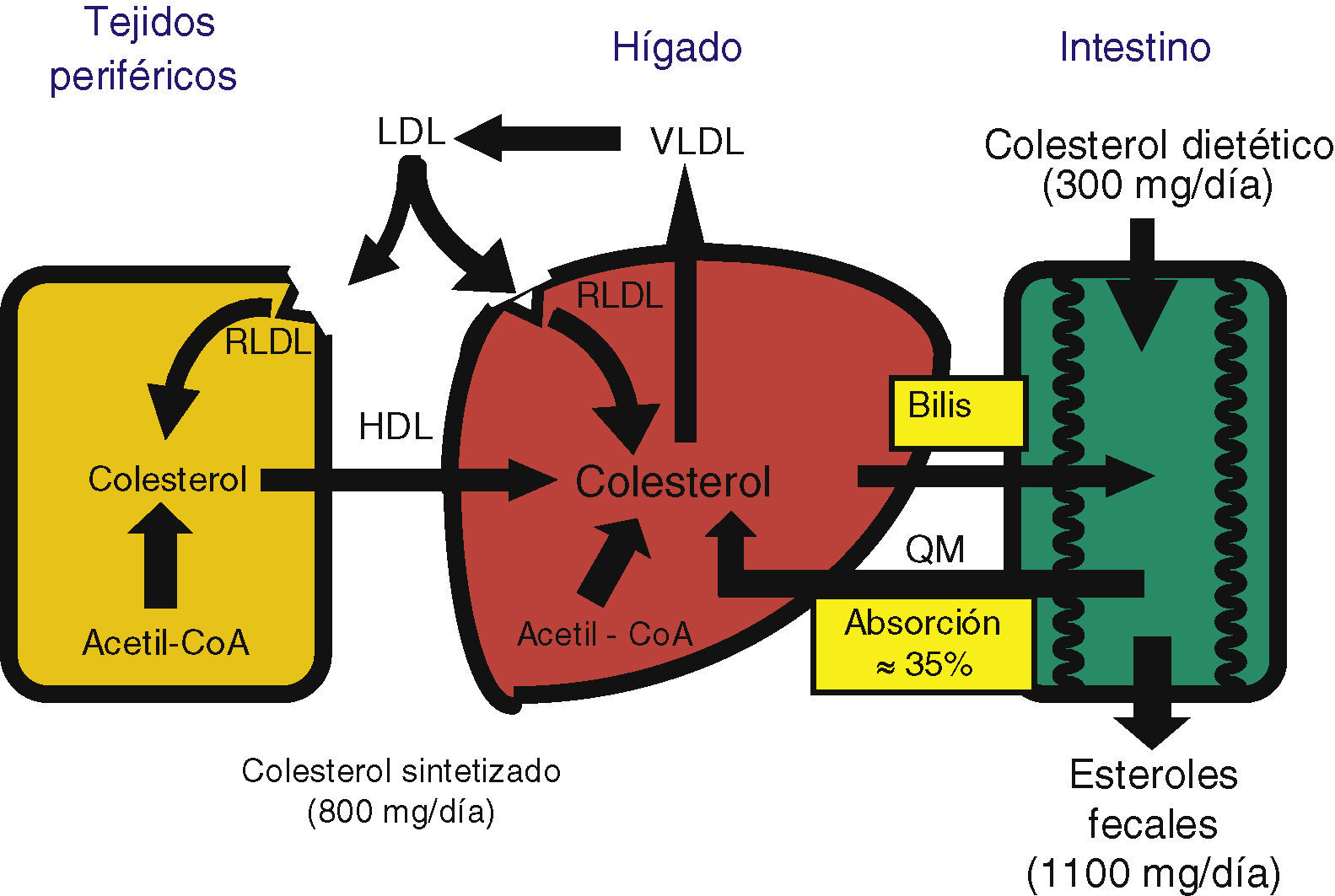
La homeostasis del colesterol se logra equilibrando la síntesis endógena, la absorción intestinal y la secreción de ácidos biliares y colesterol6. Dado que los ácidos biliares son reabsorbidos eficientemente y una parte del colesterol biliar es reabsorbido en el intestino, el balance global del colesterol depende de que las entradas (síntesis y dieta) se equilibren con las pérdidas (excreción fecal) (fig. 2). El colesterol excretado con las heces depende de la eficiencia de la absorción intestinal del colesterol biliar y dietético. Por eso la regulación de la absorción intestinal del colesterol es de gran interés como diana terapéutica para reducir las cifras de colesterol7.
Existen marcadas diferencias en el metabolismo de las lipoproteínas entre humanos y roedores. Por ejemplo, los ratones no poseen la proteína CETP (Cholesteryl Ester Transfer Protein) y tienen hasta 40 veces más aclaramiento de LDL en el hígado respecto a los humanos6,10. Asimismo, los ratones transportan la mayor parte de su colesterol plasmático en partículas HDL, y por ello no son un buen modelo de fenotipos hiperlipidémicos humanos, y este tipo de estudios hay que realizarlos en ratones modificados genéticamente para determinadas moléculas implicadas en el metabolismo del colesterol plasmático, tales como el receptor de las LDL (rLDL)11 o la apolipoproteína E12.
También existen modelos murinos en los que se expresa la CETP humana13.
Síntesis de colesterolLa molécula de colesterolTodas las células del organismo tienen la capacidad de sintetizar colesterol, pero el hígado es el órgano central. Existen 3 vías para obtener colesterol (fig. 2)6:
1. Entrada de colesterol de la dieta a través de los remanentes de quilomicrones.
2. Captación de las LDL que contienen colesterol circulante y de tejidos extrahepáticos mediante los rLDL, pero también captación del colesterol en forma de HDL y de remanentes de VLDL por receptores específicos.
3. Síntesis del esteroide a partir de la acetil-CoA bajo el control de la enzima limitante 3-hidroximetil-glutaril coenzimaA (HMG-CoA) reductasa a través de una vía metabólica compleja (vía inhibida por las estatinas)14,15.
La enzima HMG-CoA reductasa es la enzima limitante en la síntesis de colesterol16.
La síntesis del colesterol está estrechamente regulada por las proteínas Sterol Regulatory Element-Binding Proteins (SREBP), principalmente la tipo2. Cuando el colesterol celular es alto, SREBP2 se encuentra en el retículo endoplasmático formando complejo con SREBP2 Cleavage-Activating Protein (SCAP). Cuando las células agotan los esteroles, SCAP acompaña a SREBP2 desde el retículo endoplasmático al aparato de Golgi, donde se escinde con el fin de liberar parte de la proteína desde la membrana. SREBP2 puede entrar en el núcleo y unirse al Sterol Response Element (SRE) en la región promotora de muchos genes implicados en la síntesis de colesterol, activando su transcripción17.
La importancia de la síntesis de colesterol para la vida se pone de manifiesto en el hecho de que defectos en la vía de síntesis del colesterol son generalmente letales en ratones.
En humanos es rara la pérdida completa de la función de las enzimas colesterogénicas, la cual provoca malformaciones severas y enfermedades18.
Medición de la síntesis del colesterol in vivoLos diferentes métodos disponibles para determinar la síntesis de colesterol in vivo implican las siguientes técnicas: balance de esteroles (ingesta+síntesis de colesterol=excreción fecal de sales biliares+esteroles neutros); medición de precursores plasmáticos del colesterol, y técnicas de incorporación de trazadores tales como incorporación de deuterio y análisis de la distribución de masas isotopómeras.
Los pools corporales de colesterolEl sistema nervioso central contiene una parte importante del colesterol total del cuerpo (15 y 23% en ratones y en humanos, respectivamente). Sin embargo, no se detecta absorción de colesterol plasmático, a través de la barrera hematoencefálica, al cerebro19, y la síntesis cerebral de colesterol es insignificante para el cálculo de la síntesis de colesterol total corporal.
Síntesis de colesterol corporalPrácticamente todas las células de mamíferos sintetizan colesterol. En la mayoría de animales gran parte se sintetiza en los órganos extrahepáticos6, y para su medición hay que tener en cuenta su ritmo circadiano.
En humanos el hígado contribuye en un 10% a la síntesis total de colesterol (10mg/kg/día)6.
Influencia de la dieta y del ritmo circadiano en la síntesis del colesterolLas tasas específicas de síntesis de colesterol, tanto el total corporal como en los órganos, varía en función de la presencia de colesterol y otros lípidos de la dieta. En ratas la adición a su dieta de un 2% de colesterol inhibe la síntesis hepática de colesterol, mientras que permanece similar en el intestino y otros tejidos extrahepáticos20. Sin embargo, la grasa de la dieta por sí sola no afecta la síntesis hepática y corporal del colesterol, pero puede inducir la síntesis de colesterol intestinal. La restricción calórica per se parece tener el mayor efecto en la reducción de la síntesis de colesterol7. Tanto los animales como los humanos presentan un ritmo circadiano de síntesis de colesterol, con un pico tras varias horas después de la ingesta de comida, el cual viene regulado por diferentes mecanismos moleculares que modulan la expresión de genes implicados en la síntesis del colesterol21.
Síntesis de colesterol como diana en la hipercolesterolemiaInhibidores de la HMG-CoA reductasa (estatinas) se han utilizado con éxito desde finales de 1980 para inhibir la síntesis de colesterol y reducir la mortalidad cardiovascular22.
La reducción del colesterol hepático se compensa mediante la síntesis del rLDL, el cual elimina colesterol plasmático logrando disminuir sus niveles23.
Algunas estatinas (pravastatina) parecen inhibir preferentemente la síntesis en el hígado y el intestino (90%) en comparación con la síntesis en los órganos extrahepáticos, tales como riñones (73%), testículos (55%), pulmones (53%), bazo (53%) y glándulas suprarrenales (49%)24. Otras estatinas (lovastatina) muestran una inhibición generalizada de la síntesis de colesterol25.
Aunque altamente efectivas, las estatinas poseen efectos secundarios y producen mialgias y miopatías (rabdomiólisis) en un grupo importante de pacientes, especialmente polimedicados26.
Estatinas más recientes, como la pitavastatina, con un perfil metabólico distinto, muestran una reducción en la incidencia de estos efectos adversos27. Además, se están diseñando nuevos fármacos que inhiben la síntesis de colesterol en diferentes niveles de la vía, como, por ejemplo, los inhibidores de la escualeno sintasa. No obstante, estos inhibidores no tienen como diana pasos limitantes de la síntesis de colesterol; por lo tanto, no pueden reducir de forma efectiva la síntesis de colesterol como monoterapia a dosis tolerables.
Las variaciones en la eficacia de las estatinas pueden ser debidas a muchos factores, entre ellos la raza (genética), el peso corporal y la dieta. De este modo, las personas con bajas tasas de síntesis de colesterol responden de forma menos adecuada al tratamiento con estatinas. El descenso del cLDL como respuesta a las estatinas es más bajo en la raza negra en comparación con la raza blanca.
Las estatinas pueden inducir la expresión de la Proprotein Convertase Subtilisin-Like Kexin type 9 (PCSK9) y SREBP2. PCSK9 es una proteína circulante que afecta el aclaramiento del cLDL mediante la degradación de rLDL. La PCSK9 puede disminuir la eficacia de las estatinas. Los inhibidores de la PCSK9 se encuentran actualmente en fase de ensayos clínicos28. En general, la inhibición de la síntesis de colesterol conduce a un aumento recíproco en la absorción de colesterol29 que ha comportado la investigación para desarrollar inhibidores de la absorción de colesterol.
Con el aumento de los conocimientos sobre los factores determinantes en la respuesta a la terapia para la reducción del colesterol, en el futuro podría resultar viable la elaboración de un tratamiento farmacológico individualizado para cada paciente.
Absorción de colesterolDeterminantes de la absorción de colesterolLa absorción de colesterol es un proceso complejo, debido a la insolubilidad y a la hidrofobicidad de esta molécula, que requiere varios pasos: emulsificación, hidrólisis del enlace éster (cuando está esterificado) por una hidrolasa pancreática específica, solubilización micelar, absorción en el yeyuno proximal, reesterificación en el citoplasma de los enterocitos y transporte a la linfa en quilomicrones7,30. Aparte del colesterol de los alimentos (unos 300-500mg diarios en una dieta occidental), el colesterol intestinal también procede de 2 fuentes endógenas: la bilis, que contribuye a unos 800-1.000mg por día, y la descamación del epitelio intestinal, que aporta una parte muy pequeña31 (fig. 2).
El proceso de absorción de colesterol es singular debido a su relativa ineficiencia, ya que en promedio se absorbe sólo el 40%, pudiendo variar entre el 30 y el 80%32. El colesterol absorbido tiene como destino final el hígado, que es el principal órgano responsable de la producción y aclaramiento de las LDL6,30, por lo que cualquier variación en la eficiencia de la absorción intestinal de este esteroide influye en las concentraciones séricas del cLDL. En humanos existe una correlación positiva entre las concentraciones plasmáticas de cLDL y la eficiencia de la absorción intestinal de colesterol. Sin embargo, las variaciones del colesterol de la dieta a menudo no están asociadas con cambios de las concentraciones circulantes de LDL y, por tanto, se han estudiado otros factores que influyen en la absorción de colesterol. Estos incluyen factores dietéticos, biliares, luminales, celulares, genéticos o farmacológicos11,33,34.
La dieta occidental típica, además de colesterol, contiene cantidades similares de compuestos estructuralmente similares denominados fitoesteroles (95%) y estanoles (5%), los cuales se han relacionado con una disminución de la absorción intestinal de colesterol en estudios experimentales y clínicos35,36.
La absorción de colesterol, de los esteroles vegetales y estanoles viene mediada por el transportador Niemann-Pick C1 Like 1 (NPC1L1)37, localizado en el borde en cepillo de la membrana de los enterocitos del yeyuno, pero no del íleon.
En el intestino delgado proximal (y en la membrana apical de los hepatocitos) la NPC1L1 co-localiza con los 2 transportadores en tándem ATP Binding Cassette ABCG5 y ABCG8, los cuales facilitan la secreción del colesterol y de los esteroles vegetales y estanoles esterificados desde el enterocito a la luz intestinal, así como la secreción del colesterol biliar38,39.
Medición de la absorción de colesterol in vivoLos métodos disponibles para medir la absorción de colesterol tanto en humanos como en ratones consisten en: isótopos; perfusión intestinal, y medición de los niveles en sangre de marcadores subrogados como los esteroles vegetales y los compuestos intermedios de la síntesis de colesterol.
El método de perfusión intestinal es el único método que puede cuantificar directamente la absorción de colesterol intestinal en humanos40, pero no se puede usar de forma masiva por la necesidad de intubación y la exposición a radiactividad. La única técnica, a gran escala, para medir cambios en la absorción de colesterol es mediante la medición de marcadores plasmáticos subrogados, que incluye el ratio de esteroles vegetales (campesterol y sitosterol) o colestanol con el colesterol41,42. Estos marcadores son útiles para evaluar cambios en la absorción de colesterol durante tratamientos farmacológicos. Sin embargo, componentes de la dieta (grasas, colesterol, esteroles y estanoles vegetales)43, fármacos (estatinas)44 y enfermedades metabólicas (diabetes mellitus)45,46 pueden alterar la interpretación correcta de los niveles de estos marcadores.
Absorción de colesterol como diana en la hipercolesterolemiaEl tratamiento con estatinas no es suficiente para prevenir el riesgo de enfermedad cardiovascular en una proporción sustancial de individuos47. Para aumentar la eficacia del tratamiento han despertado considerable interés las intervenciones dietéticas y farmacológicas que inhiben la absorción de colesterol, como los esteroles/estanoles de la dieta y la ezetimiba, respectivamente.
EzetimibaLa inhibición específica de la absorción de colesterol, ya sea de origen biliar o dietético, se realiza por la unión de ezetimiba a la NPC1L1, bloqueando la internalización del complejo NPC1L1/colesterol48.
En humanos, NPC1L1 se expresa en los canalículos biliares pero no ejerce un papel muy activo en la reabsorción de colesterol biliar.
En los seres humanos, la ezetimiba disminuye la absorción de colesterol en un 54% y disminuye la concentración del cLDL plasmático en un 19%, pero aumenta su síntesis en un 89%49. Por lo tanto, en la hipercolesterolemia el tratamiento con ezetimiba combinado con estatinas es muy efectivo por sus efectos aditivos50. Sin embargo, según los resultados de diversos ensayos clínicos, el efecto de utilizar la terapia combinada es controvertido. La ezetimiba se prescribe en pacientes en los que el tratamiento con estatinas es inadecuado o no tolerado. En monoterapia, ezetimiba mejora la hiperlipidemia posprandial y la disfunción endotelial51.
Suplementos de esteroles/estanoles vegetalesLos fitoesteroles son los esteroles de las plantas, con una estructura similar y una función análoga a la del colesterol en los vertebrados52.
Dentro del grupo de los esteroles vegetales encontramos 2 categorías: los esteroles, que tienen un doble enlace en posición 5, y los estanoles, que no tienen este doble enlace53. Se han descrito más de 200 especies de esteroles en las plantas, siendo el sitosterol y el campesterol las más abundantes52.
A diferencia del colesterol, los fitoesteroles no se pueden sintetizar en el organismo humano, por lo tanto, su adquisición debe ser a través de la dieta. Son componentes importantes de los cereales integrales, frutos secos, semillas y aceites derivados y, por tanto, de una dieta rica en productos vegetales52. La fuente más concentrada son los aceites vegetales, como los de trigo, girasol, soja y colza (contienen entre un 0,1 y un 1%)54. En la dieta occidental la ingesta diaria de fitoesteroles se estima en 150-400mg y es similar a la ingesta de colesterol, si bien puede ser superior en dietas vegetarianas55.
Aunque la estructura química del colesterol y los esteroles vegetales es similar, su metabolismo difiere. Las concentraciones séricas de los fitoesteroles son del orden de 1.000 veces inferiores a las de colesterol, y las de estanoles son aún más bajas56. Esto se debe a varias razones. Como se ha comentado, los fitoesteroles no se pueden sintetizar en el organismo y los debemos adquirir con la dieta. Además, la mucosa intestinal absorbe fitoesteroles con menor eficiencia que el colesterol. A diferencia del colesterol, los fitoesteroles no son transformados en ácidos biliares y, finalmente, su excreción por la bilis es más rápida que la del colesterol. Con el fin de poder ser absorbidos en el intestino, los esteroles, que son moléculas muy hidrofóbicas, deben ser solubilizados, lo que se consigue integrándolos en estructuras lipídicas llamadas micelas, formadas por ácidos biliares, fosfolípidos, monoglicéridos y ácidos grasos, las cuales transportan lípidos insolubles (colesterol, fitoesteroles, vitaminas liposolubles) en la luz intestinal de manera similar a como lo hacen las lipoproteínas en la sangre. La tasa de absorción de fitoesteroles (0,4-3,5%) difiere de la del colesterol (35-60%).
La absorción de los fitoesteroles en el intestino se hace a través de la proteína transportadora NPC1L157, pero dentro del enterocito, uno de los factores que más influye en la absorción de fitoesteroles es la actividad de los transportadores ATP-Binding Cassette G5 y G8 (ABCG5 y G8), que actúan en tándem y permiten el eflujo de esteroles de las células intestinales. Estos transportadores eliminan colesterol y, sobre todo, fitoesteroles para evitar su acumulación, devolviendo gran parte de los fitoesteroles a la luz intestinal para su eliminación58. De hecho, la variabilidad genética de estos transportadores contribuye a las cifras séricas de fitoesteroles54, y es conocido que las mutaciones homocigóticas y heterocigóticas de estos genes causan la β-sitosterolemia59.
Esta rara enfermedad autosómica recesiva se caracteriza por una hiperabsorción intestinal de esteroles, un aumento de las concentraciones de fitoesteroles plasmáticos, xantomas y arteriosclerosis acelerada60.
Otro posible factor que puede explicar la baja absorción de los fitoesteroles es la Cholesterol O-Acyl Transferase (ACAT), ya que pequeñas cantidades de fitoesteroles no localizados en la luz intestinal pueden incorporarse a los quilomicrones y ser transportados al hígado.
Excreción de colesterolTransporte reverso de colesterolEl colesterol puede ser excretado en las heces bajo 2 formas: como esteroles neutros (colesterol y sus metabolitos intestinales resultado de la degradación bacteriana) y en forma de sales biliares. El transporte reverso de colesterol consiste en el flujo de colesterol desde los tejidos periféricos al hígado mediado principalmente por lipopartículas HDL y su posterior secreción a la bilis, que es transportada a la luz intestinal, dando lugar a la excreción fecal de colesterol. Durante décadas se ha considerado el transporte reverso de colesterol como la principal vía de eliminación del colesterol. Sin embargo, la vía de excreción transintestinal de colesterol (TICE) contribuye de forma significativa a la eliminación fecal de esteroles neutros.
Excreción transintestinal de colesterolEl concepto de TICERecientes estudios han demostrado que la parte proximal del intestino delgado es capaz de secretar colesterol activamente, constituyendo una vía de eflujo de colesterol denominada transintestinal (TICE), la cual en humanos representa un tercio de la excreción fecal de esteroles neutros61,62.
Se desconocen las proteínas involucradas en el transporte del colesterol desde el torrente sanguíneo al enterocito y su posterior excreción intestinal.
Diversos estudios demuestran que el TICE no funciona como un mecanismo compensatorio en casos en que la secreción biliar de colesterol es defectuosa.
Se ha sugerido para los esteroles vegetales/estanoles que un posible mecanismo de acción en la disminución del colesterol sea mediante el TICE.
Asimismo, la estimulación del TICE podría representar una nueva diana terapéutica para reducir la hipercolesterolemia.