Introducción
Es cada vez más evidente que alteraciones de la estructura y la composición de la matriz extracelular (MEC) desempeñan un papel clave en el proceso aterogénico. Lejos de ser una estructura estática, la MEC es un medio dinámico sometido a un continuo proceso de remodelado que afecta de un modo importante a su actividad funcional. En este sistema desempeñan un papel clave las metaloproteasas (MMP), enzimas especializadas en diversos procesos fisiológicos y patológicos, como cicatrización de las heridas, angiogenia y cáncer, pero también en el desarrollo y las complicaciones de enfermedades cardiovasculares de naturaleza aterotrom-bótica1-5.
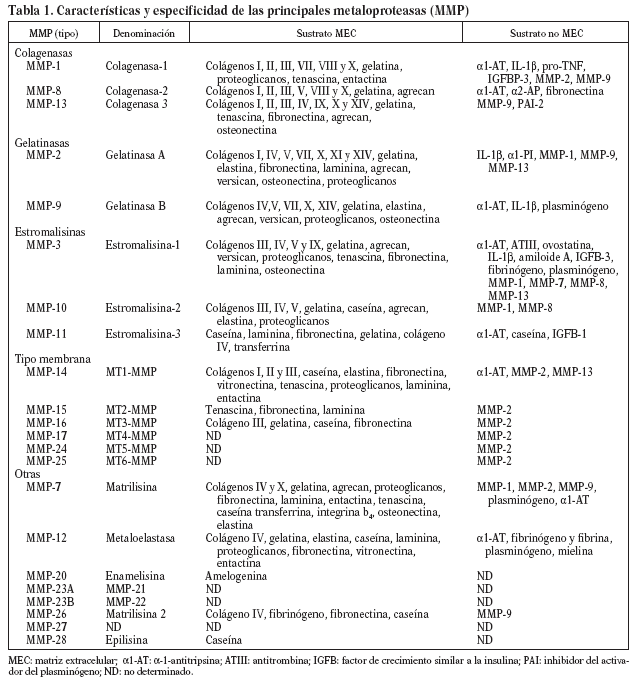
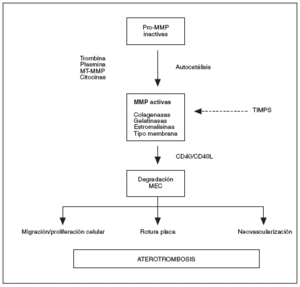
Las MMP forman una familia de endopeptidasas dependientes del cinc, producidas por diversos tipos celulares, endoteliales, musculares lisas y monocitos, que degradan numerosos componentes de la MEC, así como otras proteínas no relacionadas6,7. Las MMP son sintetizadas y secretadas como proenzimas inactivas, y poseen un dominio propeptídico rico en cisteínas, capaz de ligar Zn++ al dominio catalítico, lo que conlleva inactivación de la enzima8,9. Se clasifican en subgrupos basados en su estructura, especificidad por el sustrato y unión a membranas (tabla 1): colagenasas (MMP-1, 8 y 13), estromalisinas (MMP-3, 10 y 11), gelatinasas (MMP-2 y 9), tipo membrana (MT-MMP) y otras MMP (matrilisina, metaloelastasa, etc.)7-9,10,11. La actividad de las MMP está regulada intra y extracelularmente en 3 ámbitos: transcripcional, postranslacional y a través de interacción con inhibidores específicos. Diversos factores de crecimiento, citocinas y hormonas aumentan su expresión transcripcional, mientras que la heparina, el factor de transformación ß (TGF-ß) y los corticoides la inhiben. La activación extracelular de zimógenos latentes (Pro-MMP) representaría el segundo nivel de control: el principal activador fisiológico de las MMP es la plasmina, que convierte las formas latentes en activas mediante proteólisis del enlace cisteína-Zn++ y exposición del dominio catalítico9. Otras enzimas, como trombina, el factor Xa y las propias MMP también poseen la capacidad de activar MMP12-14. Finalmente, existiría un control de la actividad de MMP mediado por inhibidores específicos (TIMPS), de los que se han descrito 4 miembros (TIMP-1, 2, 3 y 4). Los TIMP inhiben las MMP mediante unión irreversible a la forma activa de la enzima. En resumen, el balance proteolítico dependerá de la concentración relativa de activadores e inhibidores7-9 (fig. 1).
Figura 1. Proteólisis mediada por metaloproteasas en la aterotrombosis.
Funciones biológicas de las MMP
Diversos estudios experimentales y clínicos han permitido establecer un papel de las MMP en varios procesos fisiológicos.
Actividad del endometrio
La menstruación se caracteriza por la destrucción tisular como resultado de la degradación del endometrio funcional en el inicio del ciclo reproductivo femenino. Se ha observado un aumento de colagenasas y estromalisinas durante la fase menstrual en el endometrio humano15.
Cicatrización de heridas
La degradación proteolítica de la MEC es un requisito indispensable en numerosas fases del proceso de cicatrización, como la angiogenia y la migración de queratinocitos. La expresión de MMP-1 se incrementa tras la lesión cutánea, continúa durante la cicatrización y persiste durante la reepitelización. Se ha demostrado que la actividad MMP-1 es esencial para la migración de queratinocitos a través del colágeno, proceso mediado por la integrina *vß316.
Actividad fibrinolítica celular
Las interacciones entre el sistema de MMP y el sistema plasminógeno/plasmina afectan la fibrinolisis celular. La MMP-3 (estromalisina-1) hidroliza específicamente activadores del plasminogéno como la urocinasa (u-PA) en un fragmento de 17 kDa, que contiene el receptor para la enzima (u-PAR). Además, hidroliza la *2-antiplasmina, principal inhibidor fisiológico de la plasmina, así como el inhibidor del activador del plasminógeno 1 (PAI-1), principal inhibidor de los activadores del plasminógeno. Como se ha señalado anteriormente, la plasmina es uno de los principales activadores de pro-MMP en enzimas activas17. Estas interacciones moleculares entre MMP y el sistema de activación del plasminógeno desempeñarán un papel fundamental en la regulación de la fibrinólisis celular3,18.
Remodelado epitelial
Una de las funciones principales de la mucosa epitelial es actuar de barrera defensiva antimicrobiana y como componente de la inmunidad innata. La expresión de matrilixina en el epitelio mucoso, la más pequeña de las MMP descritas hasta la actualidad (28 kDa), sugiere que esta enzima sería responsable de la activación de prodefensinas, precursoras de sustancias que destruyen bacterias a través de una disrupción de su membrana19.
Envejecimiento
La edad es un factor de riesgo para las enfermedades vasculares, como la hipertensión y la aterosclerosis. Se ha observado desorganización en la lámina elástica interna en ausencia de lesión vascular en relación con la edad, por aumento de la expresión de diversas MMP con actividad elastasa, como MMP-2 y 9. Estímulos inflamatorios presentes en aortas de sujetos de edad avanzada, como TNF-3a y TGF-ß, están involucrados en una mayor activación de MMP a escala vascular. Estos cambios moleculares observados durante el proceso de envejecimiento pueden representar nuevas dianas para la prevención y tratamiento de enfermedades vasculares relacionadas con la edad20.
Papel de las MMP en aterosclerosis: desarrollo de la lesión, rotura de la placa y formación de aneurismas
Alteraciones en la homeostasis de la MEC, como consecuencia de cambios en la síntesis y/o la degradación, se han asociado con enfermedades vasculares. Hay evidencia de que las MMP están involucradas en todas las fases del proceso aterosclerótico, desde la lesión inicial a la rotura y la trombosis. El espectro de MMP en la aterosclerosis estará condicionado por el tipo celular predominante, los factores solubles y la interacción células-MEC5,7,21,22.
Las moléculas implicadas en la comunicación de los tipos celulares implicados en la proteólisis vascular no se conocen con precisión. Diversas citocinas proinflamatorias, como el TNF-* y las interleucinas, así como las lipoproteínas de baja densidad (LDL) oxidadas, aumentan la expresión de MMP por monocitos y células endoteliales in vitro23-26. Estudios recientes han implicado al sistema CD40/CD40L, ya que la unión de CD40 por células presentes en el ateroma causa activación de MMP27,28. La hipoxiareoxigenación y las especies reactivas del oxígeno pueden inducir la expresión de diversas MMP29,30. La hiperglucemia puede aumentar la expresión de MMP-9 en células endoteliales31. Finalmente, la trombina es capaz de activar pro-MMP-2 in vitro, lo que sugiere una probable activación de MMP en los lugares de lesión vascular12. En placas ateroscleróticas complicadas, la trombina podría promover su inestabilidad al incrementar la degradación de la MEC5. La activación combinada de trombina y MMP podría suponer un importante mecanismo de retroalimentación en los síndromes clínicos aterotrombóticos (fig. 1). Es importante señalar que no todas las MMP reaccionan de forma similar ante los mismos estímulos y que el impacto de varios fac-
tores puede ser específico del tipo celular implica-do. Así, el TGF-ß inhibe la expresión de MMP-12, pero aumenta la de MMP-2 y 9 en monocitos humanos9,22.
Variaciones en la secuencia de la región promotora de genes que codifican MMP pueden ser otro de los mecanismos implicados en la regulación de la actividad proteolítica. Se ha descrito un polimorfismo C/T en la región promotora de la gelatinasa-B (MMP-9) que influye en la expresión de la proteína; la variante T es la que se asociaría con mayor actividad proteolítica32. Asimismo, un polimorfismo 5A/6A en la región promotora de la MMP-3 origina cambios en la actividad del enzima, con un aumento 2 veces superior en los portadores del alelo 5A33. Finalmente, un estudio reciente ha demostrado que el polimorfismo 5A-1171/6A en la estromalisina-1 se ha asociado con aumento significativo en la incidencia de infarto de miocardio en mujeres34.
La formación de la placa ocurre como resultado de la migración y proliferación celular, acompañada de acumulación de MEC. La degradación de la MEC por acción de MMP promueve la migración y el desarrollo de la placa. Durante las fases iniciales, el remodelado de la MEC representa un mecanismo compensador que evita la estenosis arterial. En fases ulteriores del proceso aterosclerótico, la degradación de la capa fibrosa o la erosión endotelial mediada por MMP favorece la rotura y la desestabilización, y promueve la trombosis. La participación de MMP se considera, por consiguiente, clave en estos procesos35,36. Finalmente, la formación de aneurismas representaría una fase avanzada del proceso de remodelado arterial por degradación de la MEC mediada fundamentalmente por MMP-2 y 937,38.
Se ha observado, a escala experimental y clínica, mediante estudios inmunocitoquímicos y zimográficos, un aumento de la expresión de MMP en diferentes tipos de lesiones ateroscleróticas39-41. Galis et al, en un modelo de lesión carotídea en ratones knockout para MMP-9, observaron descenso de la hiperplasia de la íntima y acumulación de colágeno intersticial en el sistema vascular42. En otro estudio, en ratones knockout para TIMP-1 (en los que la actividad MMP-1 estaba aumentada), se observó una reducción del tamaño de la placa aterosclerótica43. La conclusión de estos estudios es que la inhibición de MMP podría contribuir a la estabilidad de la placa al promover un incremento del contenido de colágeno.
Nuestro grupo ha demostrado recientemente, en un modelo experimental de aterosclerosis en cerdos inducido por dieta más angioplastia en artería ilíaca, un marcado aumento de la expresión vascular de colagenasa (MMP-1) tras angioplastia (fig. 2), que se correlacionaba con una reducción del contenido de colágeno de la placa (fig. 3). También observamos un aumento de la actividad proteolítica sistémica en el grupo hipercolesterolémico, identificada como MMP-1 por western-blot44. Estos resultados sugieren que la lesión vascular supone un potente estímulo para la expresión vascular y sistémica de MMP-1 en este modelo experimental de hipercolesterolemia porcina.
Figura 2. Modelo experimental de hipercolesterolemia más lesión ilíaca en cerdos. Marcado aumento de expresión de MMP-1 tras lesión vascular (izquierda) y efecto del tratamiento con vitaminas antioxidantes (derecha).
Figura 3. Modelo experimental de hipercolesterolemia más lesión ilíaca en cerdos. Reducción del contenido de colágeno en la placa de ateroma tras lesión vascular (izquierda) y aumento del colagéno tras tratamiento con vitaminas antioxidantes (derecha).
También hemos analizado el perfil proteolítico vascular en pacientes con lesiones ateroscleróticas avanzadas45. Se obtuvieron segmentos vasculares de pacientes sometidos a cirugía de revascularización periférica y se determinó, mediante inmunohistoquímica, la expresión de MMP y TIMP. Se midió la expresión de MMP-1,3 y 9, y de TIMP-1, así como el contenido de colágeno en secciones vasculares de pacientes sometidos a endarterectomía carotídea (n = 11) y revascularización periférica (femoral; n = 23), así como en secciones de arteria mamaria de pacientes sometidos a bypass aortocoronario (n = 20; grupo control). Se analizaron los resultados con relación al lecho vascular y tipo de lesión (oclusiva o aneurismática).
Nuestros resultados demostraron un incremento significativo de MMP en lesiones avanzadas, sobre todo en áreas con alto contenido en macrófagos y, por tanto con mayor inflamación45. Además, se observó una alteración del balance proteolítico en relación con el lecho vascular (carótida o femoral) y el tipo de lesión aterosclerótica (trombótica o aneurismática). En concreto, observamos una mayor expresión de MMP-1, 3 y 9, que se correlacionó con una reducción del contenido de colágeno en las lesiones ateroscleróticas avanzadas, mayor expresión de MMP-1 y 3 en las lesiones aneurismáticas, aumento de TIMP-1 en las que mostraban calcificación y una mayor expresión de MMP-9 en lesiones carotídeas comparadas con femorales45 (fig. 4). Estos resultados indican un papel preponderante de las MMP en lesiones ateroscleróticas avanzadas y que las diferencias observadas en el balance proteolítico en los distintos lechos vasculares pueden estar implicadas en la evolución final de la lesión aterosclerótica humana y en la formación de aneurismas37,38,46.
Figura 4. Diferente expresión de MMP-9 en la arteria carótida (izquierda) en relación con femorales (derecha).
Nuestros resultados estarían de acuerdo con otros estudios que han demostrado un aumento de MMP-9 en placas coronarias y carotídeas inestables47. Además, se observó un incremento de los valores circulantes de MMP-9 en pacientes sometidos a endarterectomía con evidencia de embolización espontánea47.
Asociación de MMP con síndromes coronarios agudos
Si bien, a escala vascular, existen evidencias de una estrecha asociación entre MMP y la vulnerabilidad de la placa, hay más controversia con los resultados observados en la clínica2. Kai et al midieron las concentraciones de MMP-2 y 9 en 50 pacientes con síndromes coronarios. Los valores de MMP-9 estaban significativamente más elevados en aquellos con infarto agudo de miocardio (IAM) y angina inestable que en los que presentaban angina estable48. Otro estudio analizó los valores de MMP-9 y TIMP-1 en pacientes con lesiones coronarias diagnosticadas angiográficamente. Se observó un aumento significativo de ambos parámetros en sujetos con IAM y angina inestable en relación con aquellos con síndrome coronario estable49. En un tercer trabajo se midieron los valores de MMP-1 y 2 en pacientes hospitalizados con IAM. Los valores de MMP-2 experimentaron un aumento significativo los días 14 y 2150. Recientemente, Blankeberg et al demostraron una potente asociación entre los valores de MMP-9 y el riesgo de episodios coronarios fatales tras 4 años de seguimiento en 1.127 pacientes con enfermedad coronaria establecida51. En nuestro grupo también hemos observado una alteración del balance fibrinolítico/proteolítico en una serie de pacientes con angina estable y lesiones coronarias demostradas angiográficamente52. Sin embargo, existen importantes limitaciones en estos estudios derivadas del hecho de que no siempre la actividad proteolítica plasmática refleja la actividad de la placa y de la demostración de que la trombina, enzima causante de la formación del coágulo de fibrina, también puede activar MMP, por lo que el aumento observado en pacientes con síndromes coronarios sería la consecuencia, más que la causa de la trombosis intravascular7,22.
MMP como dianas terapéuticas en la aterosclerosis
Teniendo en cuenta el papel de las MMP en la aterosclerosis no es sorprendente que su inhibición pueda representar una estrategia terapéutica potencial encaminada a la estabilización de las placas de ateroma, reduciendo la degradación de la MEC y restaurando el equilibrio MMP/TIMP. Teóricamente, los métodos de inhibición de MMP inclui-rían agentes inhibidores de la actividad y producción de MMP y aumento de TIMP-153,54, si bien existen resultados contradictorios sobre el efecto beneficioso de la inhibición selectiva de MMP55.
Diversos fármacos empleados en el tratamiento de la aterosclerosis pueden tener un efecto modulador de la actividad proteolítica celular y/o sistémica. Inhibidores de la enzima HMGCoA-reductasa (estatinas) afectan la expresión de diversas MMP: la fluvastatina y la simvastatina reducen la secreción celular de MMP-1 y 9 in vitro56. Experimentalmente, múltiples estatinas disminuyen la expresión de MMP-1, 3 y 957. Estudios recientes indican, asimismo, que compuestos del tipo de las tiazolidindionas (TZD, rosiglitazona) disminuyen la expresión de MMP-9, probablemente a través de la unión a PPAR-*58.
En modelos animales en los que se indujo aumento de la expresión de TIMP-1 mediante terapia génica se observó una disminución en la formación de aneurismas, mientras que la transfección viral del gen TIMP-2 previno el desarrollo de la íntima en ratones deficientes en apolipoproteína E59.
Nuestro grupo ha demostrado recientemente que un régimen antioxidante incluyendo la combinación de vitaminas C y E reducía significativamente la expresión vascular de MMP-1 en el modelo de hipercolesterolemia porcina más angioplastia (fig. 2) y mejoraba el contenido de colágeno de la placa (fig. 3). Se observó, asimismo, una disminución de la actividad caseinolítica sistémica dependiente de MMP-144. Estos resultados sugieren un efecto beneficioso de las vitaminas C y E en el modelo porcino de aterosclerosis experimental. Teniendo en cuenta el papel del estrés oxidativo en la patogenia de la aterosclerosis, la reducción de la peroxidación lipídica podría ser uno de los mecanismos para explicar el efecto beneficioso de los antioxidantes60,61.
Conclusiones
Existen evidencias clínicas y experimentales que sugieren que una alteración del balance entre MMP y sus inhibidores rompería el equilibrio entre síntesis/degradación de la MEC y conduciría a la rotura de la placa de ateroma que precede a los síndromes clínicos vasculares oclusivos, IAM y otros síndromes coronarios agudos e ictus isquémico, principales causas de mortalidad en los países occidentales. Existen diferencias en el balance proteolítico vascular, tanto en relación con el tipo de lesión como con el lecho vascular implicado, lo que podría ser de interés para explicar diferencias en las características de las placas de ateroma en relación con la región anatómica afectada. Finalmente, las MMP podrían ser dianas terapéuticas atractivas para prevenir la desestabilización de la placa y el desarrollo de complicaciones aterotrombóticas.