La hipertensión arterial en individuos con diabetes mellitus tipo2 incrementa el riesgo de eventos cardiovasculares. Las guías internacionales de manejo recomiendan iniciar tratamiento farmacológico con valores de presión arterial >140/90mmHg Sin embargo, no existe un punto de corte óptimo a partir del cual se logre reducir los eventos cardiovasculares sin originar eventos adversos; un rango de presión arterial >130/80 y <140/90mmHg parece ser el adecuado. Estos valores pueden alcanzarse mediante intervenciones no farmacológicas (dieta, ejercicio) y farmacológicas (por fármacos que hayan demostrado reducir eventos cardiovasculares). La elección de uno o varios fármacos debe ser individualizada, de acuerdo con factores como etnia, edad, comorbilidades asociadas, entre otros.
High blood pressure in individuals with type2 diabetes mellitus increases the risk of cardiovascular events. The international management guidelines recommend starting pharmacological treatment with blood pressure values >140/90mmHg. However, there is no optimal cut-off point from which cardiovascular events can be reduced without causing adverse events. A blood pressure range of >130/80 to <140/90mmHg seems to be adequate. These values can be achieved through non-pharmacological (diet, exercise) and pharmacological interventions (using drugs that have been shown to reduce cardiovascular events). The choice of one or several drugs must be individualised, according to factors including, ethnicity, age, and associated comorbidities, among others.
La enfermedad cardiovascular (ECV) continúa siendo la causa más común de morbimortalidad en adultos, y dentro de los factores mayores de riesgo cardiovascular (RCV), la hipertensión arterial (HTA) es el más prevalente; por su parte, la diabetes mellitus (DM) es considerada un factor de riesgo independiente para el desarrollo de ECV. La coexistencia de HTA y DM establece a priori un mayor RCV (que la presencia aislada de una u otra condición), teniendo en cuenta que las dos entidades comparten en común ciertos aspectos metabólicos (dislipidemia, obesidad, disfunción endotelial, resistencia a la insulina, arteriosclerosis, entre otros). Se ha establecido que la población con HTA al momento del diagnóstico de DM tipo2 (DM2) presenta un alto riesgo de mortalidad por toda causa, al compararse con pacientes normotensos sin DM21. El control de las cifras de presión arterial (PA) juega un papel clave en pacientes con DM2. Diferentes estudios han evaluado múltiples metas de PA y su relación con desenlaces cardiovasculares (CV), pero aún persisten algunas preguntas sin responder. La reducción de la PA por medio de intervenciones farmacológicas (antihipertensivos [anti-HTA]) y no farmacológicas es la estrategia más efectiva para reducir la morbimortalidad CV en individuos con DM2. La evidencia surge a partir de ensayos clínicos aleatorizados, estudios observacionales y metaanálisis, en diferentes ámbitos clínicos; por ejemplo, pacientes de edad avanzada con hipertensión sistólica aislada, individuos con hipertensión esencial o con alto RCV, o con enfermedad arterial coronaria (EAC), o con antecedentes de ataque vascular cerebral (AVC), entre otros. Las guías internacionales recomiendan iniciar o intensificar el tratamiento con anti-HTA con valores de PA>140/90mmHg, aunque no está claro aún el punto de corte ideal que debe manejar esta población con DM22. Las metas de PA que debe lograr la población con DM2 han oscilado entre los siguientes valores: <140/90, <140/85, <140/80, <130/85, <130/80mmHg; no obstante, estas metas habían sido soportadas por una evidencia no tan sólida.
Criterios de búsquedaSe realizó una búsqueda con rigor epidemiológico de la literatura en idioma inglés y en español, en las siguientes bases de datos: PubMed, Cochrane Library, Embase, DARE, Lilacs y SciELO, utilizando los términos (en inglés y en español): [«diabetes», «arterial hypertension», «cardiovascular outcomes», «diet», «exercise», and «anti-hypertensives»], solos o en combinación. El foco primario de la revisión se realizó sobre ensayos clínicos aleatorizados, metaanálisis, revisiones sistemáticas y estudios longitudinales con desenlaces cardiovasculares, desde enero de 1960 hasta abril de 2018.
Carga global de la diabetes mellitus y de la hipertensión arterialLa DM se define como un estado de hiperglucemia crónica, de etiología heterogénea, causada por una alteración en el metabolismo de hidratos de carbono, lípidos y proteínas. Las complicaciones específicas relacionadas con la DM incluyen las microvasculares (retinopatía, nefropatía y neuropatía) y las macrovasculares (ECV, enfermedad cerebrovascular y enfermedad arterial periférica). La hiperglucemia crónica también hace alusión a los llamados estados intermedios entre los niveles normales de glucemia y la presencia de DM (prediabetes), que incluyen la glucosa alterada en ayunas (GAA), definida como un valor de glucemia en ayunas ≥100mg/dl y <126mg/dl, y la intolerancia a la glucosa (ITG), definida como un valor de glucemia —a las 2h poscarga de 75g de glucosa— ≥140mg/dl y <200mg/dl. Tanto la GAA como la ITG representan y definen un alto riesgo para el desarrollo posterior de DM2 y de ECV1-3. La relación entre DM2 y ECV es compleja y multifactorial, ya que la DM2 puede coexistir con otros factores de RCV como HTA, dislipidemia, tabaquismo y obesidad, junto a otros estados metabólicos asociados (incremento del estrés oxidativo, inflamación de bajo grado, resistencia a la insulina, disfunción endotelial, neuropatía autonómica e hipercoagulabilidad), los cuales, en conjunto, contribuyen directamente al desarrollo de ECV4. Los individuos con DM2 tienen un incremento en el riesgo de ECV de 2 a 4 veces mayor que aquellos sin DM2, y cerca del 70% de los pacientes con DM2 ≥65años mueren por ECV. Además, los individuos con DM2 sin historia de ECV tienen un RCV «equivalente» al de individuos no diabéticos con historia previa de infarto del miocardio (IM). Aunque las tasas de mortalidad atribuibles a ECV han disminuido en la población con y sin DM2, la carga global de ECV en aquellos con DM2 permanece inaceptablemente alta. Adicionalmente, al momento del diagnóstico de DM2, la mayor parte de los pacientes tienen al menos un factor de RCV (asociado o no) a la presencia de enfermedad arteriosclerótica manifiesta, lo que hace plantear que ambas condiciones comparten factores genéticos, epigenéticos y medioambientales5,6. Para el año 2017, se estimó que en el mundo habían 451 millones de personas con DM2 (con un incremento esperado de 693 millones para el año 2045); además, se estimó que al 49,7% de las personas que viven con DM2 no se les ha realizado el diagnóstico de la enfermedad; por otra parte, se estableció que 374 millones de personas tenían ITG, y se calculó que cerca de 5 millones de muertes a nivel mundial fueron atribuidas a DM2 en el rango de edad de 20-99años. Finalmente, el costo global estimado en salud para esta condición para el año 2017 fue de 850.000 millones de dólares americanos7-10.
Mientras tanto, la HTA es un factor mayor de RCV y se considera una de las cinco principales causas de muerte en el mundo. La HTA tiene un patrón de presentación clínica silente, lo cual hace que un grupo importante de individuos se encuentren sin diagnóstico y sin tratamiento, originando un aumento marcado en el riesgo de muerte súbita y/o prematura, y de otras complicaciones micro y macrovasculares. En el año 2010 se estableció de manera global que el 31,1% de la población adulta ≥20años tenían HTA, definida como un valor de PA sistólica (PAS) ≥140mmHg y/o de PA diastólica (PAD) ≥90mmHg; globalmente, se estimó que entre 9 a 10 millones de muertes fueron causadas por HTA11-13. Lo anterior es de suma importancia, en especial si se tiene en cuenta que del total de individuos con HTA, solo el 57% tiene conocimiento de su condición, el 40,6% recibe algún tipo de anti-HTA y solo el 13,2% alcanza un control adecuado de las cifras tensionales14,15.
La HTA es común en individuos con DM2, y la alta coexistencia de estas dos condiciones en un mismo paciente es considerada un fuerte determinante de disfunción endotelial, enfermedad arteriosclerótica y daño vascular. Se ha establecido que la prevalencia de HTA en pacientes con DM2 es 1,5-2,0 veces más alta que en la población sin DM2, y su frecuencia depende de algunos factores asociados, como, por ejemplo, severidad de la obesidad y de la arterioesclerosis, resistencia a la insulina, edad avanzada y tasa de filtración glomerular16,17. Actualmente, y basado en estudios observacionales, se reporta una prevalencia de HTA (definida como un valor ≥140/90mmHg, o en manejo con anti-HTA) en individuos con DM2 mayor del 50%. Esta frecuencia puede estar influenciada por el hecho de que ambas condiciones, cuando han estado presentes por largo tiempo (de manera aislada) en un mismo individuo, incrementan la probabilidad de coexistencia18,19. Pocos estudios han evaluado la asociación entre la coexistencia de HTA y DM y la presencia de ECV, encontrando que el riesgo de ECV en este tipo de pacientes es por lo menos 5 veces más alto (respecto a individuos sin HTA y sin DM2), y es por lo menos 3 veces más alto en hombres y 5-7 veces más alto en mujeres. Además, la presencia de HTA es responsable del incremento en el riesgo de muerte de 7,2 veces en individuos con DM220,21. Las diferencias globales en la distribución de las frecuencias observadas de HTA y DM2 parecen asociarse con aspectos como el desarrollo económico global, y por lo tanto, con cambios en el estilo de vida, factores medioambientales, consumo de alcohol, tabaquismo, obesidad, pobre actividad física, transición nutricional, demográfica y epidemiológica, entre otros22.
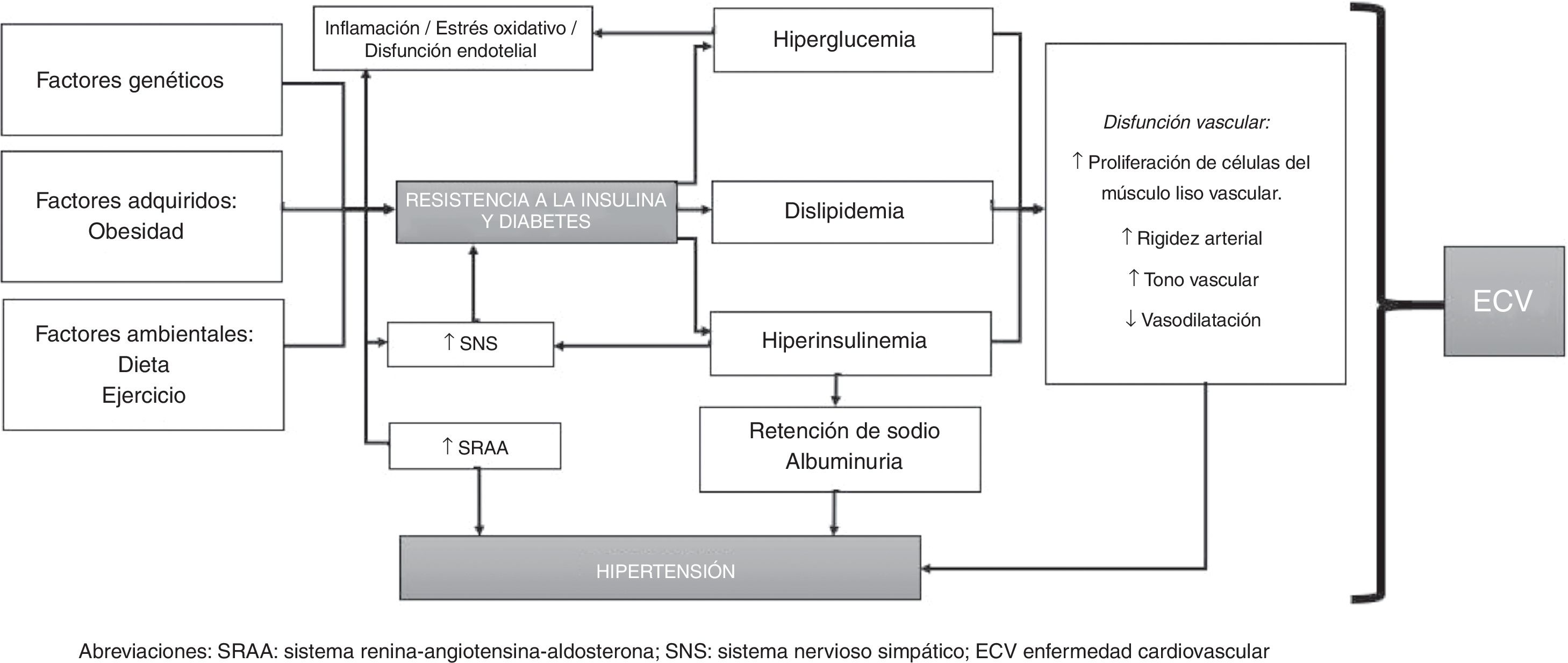
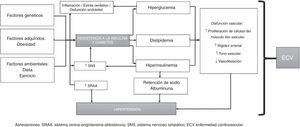
FisiopatologíaLa fisiopatología de la HTA y de la DM2 está altamente interrelacionada y es pobremente entendida. En general, se ha considerado que la HTA en individuos con DM es dependiente de volumen, ya que la hiperglucemia incrementa la osmolalidad del líquido extracelular y, por lo tanto, a medida que el agua pasa del espacio intracelular al extracelular —con el propósito de mantener el equilibrio osmótico— el espacio extracelular se expande a expensas de la deshidratación intracelular, originando un estado de sobrecarga de volumen (a menos que la hiperglucemia sea lo suficientemente severa para producir un estado de diuresis osmótica, en donde la sobrecarga de volumen es menos probable). Adicionalmente, las células endoteliales desempeñan un papel central en el mantenimiento de la homeostasis vascular, y su disfunción está asociada con ECV y otros trastornos metabólicos; es por eso que se considera que la disfunción endotelial es el factor más importante en el desarrollo de HTA en pacientes con DM2; esta se caracteriza por un desequilibrio entre vasodilatación y vasoconstricción, junto con un aumento del estrés oxidativo, inflamación vascular, alteración de las vías fibrinolíticas y protrombóticas, proliferación anormal de células de músculo liso y alteración de los mecanismos de reparación23-25.
Junto al compromiso endotelial, el sistema renina-angiotensina-aldosterona (SRAA) surge como un modulador clave de la función vascular, y su hiperactividad está involucrada en la disfunción endotelial. El SRAA está compuesto por varios componentes: la renina, la angiotensinaII (ATII), la enzima convertidora de angiotensina (ECA), el receptor de angiotensinaI (ATI) y la aldosterona. La interacción de estos componentes promueve la vasoconstricción, la proliferación y el estrés oxidativo, la remodelación y la lesión vascular, el crecimiento celular, la vasoconstricción, el estrés oxidativo, la inflamación y la activación de algunos factores de transcripción proinflamatorios (como el factor nuclear κB). En conjunto, dichas moléculas incrementan y promueven la hiperplasia/hipertrofia de las células del músculo liso vascular, la reabsorción de sodio y el incremento en la resistencia vascular periférica, con un aumento subsecuente en los niveles de PA.
En general, los individuos diabéticos con HTA tienen niveles circulantes de renina bajos o normales, y estos niveles son todavía más bajos en aquellos con nefropatía diabética; sin embargo, los niveles catalogados como «normales» en realidad están inapropiadamente elevados para la expansión de volumen observada en DM2, aunque es claro que el exceso absoluto en la producción de renina es una causa poco probable de HTA en DM226-28.
La rigidez del árbol arterial puede presentarse tanto en la DM2 per se como en asociación con HTA, ya que en ambas entidades existe disfunción endotelial e inflamación, las cuales pueden promover el aumento de los niveles de moléculas de adhesión y citoquinas inflamatorias (principalmente ICAM-1 y TNF-α); esta rigidez arterial ha sido reproducida en varios estudios, los cuales han demostrado que la HTA contribuye a la rigidez arterial y a la disfunción endotelial en pacientes con DM229.
Por otra parte, en individuos con DM2 la resistencia a la insulina y la hiperglucemia producen inflamación y estrés oxidativo, y la dislipidemia que acompaña con frecuencia al paciente diabético con HTA también se asocia con rigidez arterial y disfunción vascular; además, la hiperinsulinemia genera retención de sodio y aumento de la actividad del sistema nervioso simpático (SNS), con un incremento posterior en el nivel de catecolaminas circulantes, originando un aumento en los niveles de PA, lo cual a su vez genera activación del SRAA (promoviendo también inflamación) y convierte este proceso en un círculo vicioso30,31.
Por otro lado, los avances en los estudios genómicos han permitido tener una visión más amplia de la patogénesis de la HTA y de la DM2. Tanto la HTA y la DM2 se caracterizan por ser de naturaleza compleja y por tener una alta variabilidad genética, con interacciones entre gene-gene, gene-medioambiente y factores epigenéticos. Diferentes genes han sido implicados en el desarrollo de HTA, entre los cuales están CACANA1H, IPO7, PMS1, SLC24A4, YWHAZ, GPR98, ARRDC3, C21orf91, SLC25A42, genes HLA-B, entre otros; y entre los asociados a DM2 destacan SLC44A3, F3, RBM43, RND3, GALNTL4, CPA6, LOC729013 y factores de transcripción como el TCF7L2, el cual está fuertemente asociado en el desarrollo de DM2 en diversos grupos étnicos32-34.
En conclusión, la fisiopatología de la HTA en individuos con DM2 se puede resumir de la siguiente forma: la resistencia a la insulina (y la hiperinsulinemia resultante) induce la activación del SNS y del SRAA, lo cual promueve la retención de sodio y de agua. Por su parte, la DM2 conlleva el incremento en la reactividad vascular y la proliferación de células del músculo liso vascular, las cuales juegan un papel significativo en el desarrollo de HTA. La hiperglucemia y el incremento en el recambio del sodio corporal total pueden originar un exceso de líquido extracelular y expansión del volumen plasmático. Adicionalmente, los individuos con DM2 tienen un aumento en la sensibilidad vascular a las hormonas vasoactivas (en especial si la ingesta de sodio proveniente de la dieta es elevada), lo cual, junto a la hiperinsulinemia presente, contribuye a mantener cifras elevadas de PA (debido a que la insulina promueve la retención de sodio y realza la actividad del SNS). Lo anterior está mediado por factores genéticos, epigenéticos y por la interacción entre ellos (fig. 1).
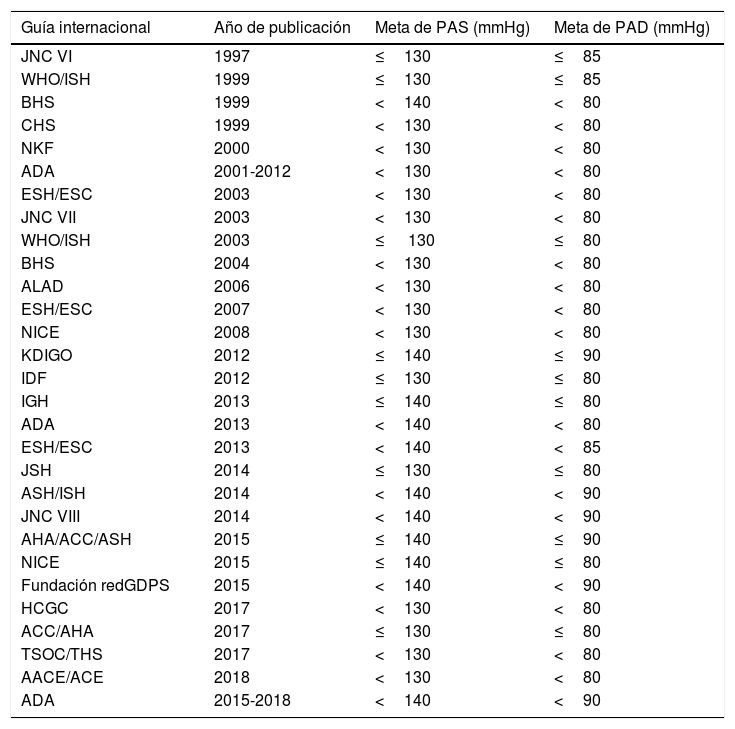
Metas de control de la presión arterial en diabetes mellitus tipo 2, antecedentes históricosLas diferentes guías de manejo internacionales se han centrado en establecer umbrales en las cifras de PA en individuos con DM2, y en ellas se han discutido una o varias opciones de manejo según la evidencia disponible; de esta forma, a lo largo del tiempo se han descrito metas de PA<130/85, <130/80, <140/90, <140/80 y <140/85mmHg (tabla 1). Las guías y recomendaciones iniciales establecían una meta ideal de PA<130/80mmHg; sin embargo, los estudios que sustentaban dicha recomendación demostraban que las cifras de PA alcanzadas eran >135/85mmHg, lo cual indicaba que la recomendación de llevar la PA a un valor <130/80mmHg quizás no era la más correcta. Por otra parte, algunos estudios habían demostrado que el control estricto de la PA parecía no lograr la reducción de los desenlaces CV esperados35-37. Lo anterior originaba dudas y algunas preguntas al respecto; por ejemplo, había la incertidumbre de si el inicio de la terapia farmacológica para un umbral establecido de PAS y de PAD cambiaba los resultados o desenlaces clínicos; o si la terapia farmacológica, con el objetivo de lograr una meta específica de PAS y PAD, modificaba los desenlaces CV o sobre mortalidad; o si existían diferencias entre los diferentes fármacos anti-HTA (sobre resultados CV y sobre mortalidad). A pesar de ello, había evidencia que valores de PA>115/75mmHg se asociaban con un incremento en la frecuencia de eventos micro/macrovasculares y en la mortalidad, indicando que el control de las cifras de PA en individuos diabéticos era importante en la prevención de desenlaces clínicos fatales y no fatales. Por otra parte, también se consideraba que la relación existente entre PA y desenlaces CV era consistente, continua e independiente de otros factores de RCV, debido a que los estudios observacionales en adultos sin antecedentes de enfermedad vascular demostraban que el riesgo de mortalidad por eventos vasculares (CV y cerebrovasculares) se incrementaba de manera lineal y progresiva según los niveles de PA. Además, se encontró que la reducción agresiva en los niveles de PA no necesariamente se traducía en una mejoría sustancial del daño vascular; es más, se documentó que al intentar alcanzar metas más exigentes de PA obligaba al incremento en las dosis de los anti-HTA, o a la combinación de varios de ellos, incrementando el riesgo de efectos adversos, entre esos, mayores eventos CV (a este efecto se le denominó «fenómeno de curva J»). También se estableció que la relación entre PA y desenlaces CV presentaba asimismo una distribución en «curva U», indicando que la tasa de eventos vasculares era elevada con valores o muy bajos o muy altos de PA, y que valores de PA<110-120/60-70mmHg podían predecir un incremento en el riesgo de eventos vasculares38-40.
Metas de presión arterial en diabetes mellitus tipo 2, a partir de diferentes guías de manejo
| Guía internacional | Año de publicación | Meta de PAS (mmHg) | Meta de PAD (mmHg) |
|---|---|---|---|
| JNC VI | 1997 | ≤130 | ≤85 |
| WHO/ISH | 1999 | ≤130 | ≤85 |
| BHS | 1999 | <140 | <80 |
| CHS | 1999 | <130 | <80 |
| NKF | 2000 | <130 | <80 |
| ADA | 2001-2012 | <130 | <80 |
| ESH/ESC | 2003 | <130 | <80 |
| JNC VII | 2003 | <130 | <80 |
| WHO/ISH | 2003 | ≤ 130 | ≤80 |
| BHS | 2004 | <130 | <80 |
| ALAD | 2006 | <130 | <80 |
| ESH/ESC | 2007 | <130 | <80 |
| NICE | 2008 | <130 | <80 |
| KDIGO | 2012 | ≤140 | ≤90 |
| IDF | 2012 | ≤130 | ≤80 |
| IGH | 2013 | ≤140 | ≤80 |
| ADA | 2013 | <140 | <80 |
| ESH/ESC | 2013 | <140 | <85 |
| JSH | 2014 | ≤130 | ≤80 |
| ASH/ISH | 2014 | <140 | <90 |
| JNC VIII | 2014 | <140 | <90 |
| AHA/ACC/ASH | 2015 | ≤140 | ≤90 |
| NICE | 2015 | ≤140 | ≤80 |
| Fundación redGDPS | 2015 | <140 | <90 |
| HCGC | 2017 | <130 | <80 |
| ACC/AHA | 2017 | ≤130 | ≤80 |
| TSOC/THS | 2017 | <130 | <80 |
| AACE/ACE | 2018 | <130 | <80 |
| ADA | 2015-2018 | <140 | <90 |
AACE: American Association of Clinical Endocrinologists; ACC: American College of Cardiology; ACE: American College of Endocrinology; ADA: American Diabetes Association; AHA: American Heart Association; ALAD: Asociación Latinoamericana de diabetes; ASH: American Society of Hypertension; BHS: British Hypertension Society; CHS: Canadian Hypertension Society; ESC: European Society of Cardiology; ESH: European Society of Hypertension; Fundación redGDPS: Fundación de red de Grupos de Estudio de la Diabetes en Atención Primaria de la Salud; HCGC: The Hypertension Canada Guidelines Committee; IDF: International Diabetes Federation; IGH: Indian Guidelines on Hypertension; ISH: International Society of Hypertension; JNC: Joint National Committee; JSH: Japanese Society of Hypertension; KDIGO: Kidney Disease Improving Global Outcomes; NICE: National Institute for Health and Care Excellence; NKF: National Kidney Foundation; PAD: presión arterial diastólica; PAS: presión arterial sistólica; THS: Taiwan Hypertension Society; TSOC: Taiwan Society of Cardiology.
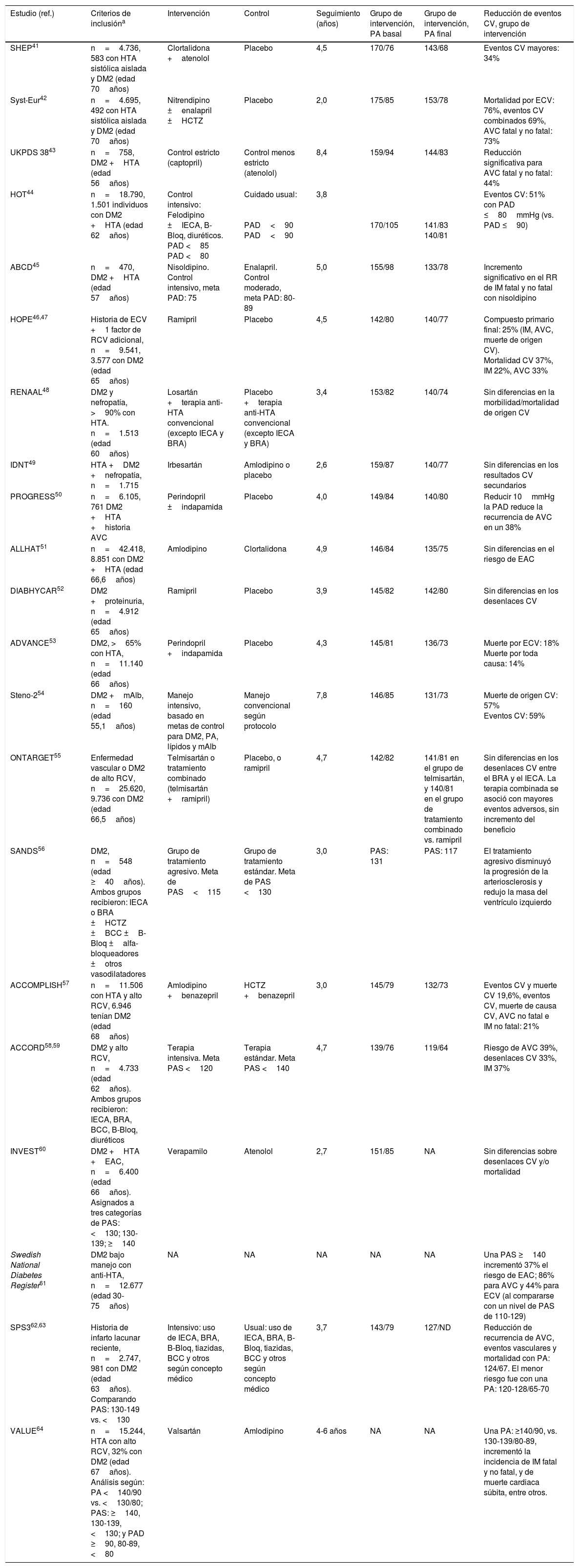
Los estudios que han evaluado el impacto del control de las cifras de PA en individuos con DM2 fueron diseñados principalmente para evaluar el efecto del control glucémico en individuos con DM2, o para evaluar la presencia de desenlaces CV en subgrupos de sujetos con DM2 (que hacían parte de estudios sobre tratamiento de HTA). Dichos estudios se han caracterizado por su alta heterogeneidad y falta de uniformidad (en la definición de las metas de PA, por ejemplo). Cada uno de estos estudios evaluó varios grupos de fármacos anti-HTA, que fueron: inhibidores de la ECA (IECA), bloqueadores del receptor de angiotensina (BRA), bloqueadores de canales de calcio (BCC) dihidropiridínicos y diuréticos tiazídicos (todos considerados como anti-HTA de primera línea), y en menor medida se han evaluado otros anti-HTA que pueden tener utilidad según las características o condiciones basales del paciente (vasodilatadores, alfa-bloqueadores, beta-bloqueadores y diuréticos de asa). Los estudios en mención se enfocaron en evaluar los siguientes aspectos (tablas 2 y 3):
- 1.
Efecto del tratamiento anti-HTA, en población ≥60años y desenlaces CV.
- 2.
Efecto del tratamiento anti-HTA, evaluando el control estricto vs. el control menos estricto (o moderado) de las cifras de PA, y desenlaces CV.
- 3.
Efecto del tratamiento anti-HTA, desenlaces CV y mortalidad.
- 4.
Efecto del tratamiento anti-HTA, comparando el control intensivo vs. el control menos intensivo o convencional de las cifras de PA.
- 5.
Efecto del tratamiento anti-HTA, respecto a diferentes metas o estratos de PAD y desenlaces CV.
- 6.
Efecto del tratamiento anti-HTA y desenlaces CV en individuos con alto RCV.
- 7.
Efecto del tratamiento anti-HTA y desenlaces CV en individuos con nefropatía diabética.
- 8.
Efecto del tratamiento anti-HTA y desenlaces CV, más allá del efecto atribuible de la disminución de la PA.
- 9.
Efecto del tratamiento anti-HTA y recurrencia de AVC.
- 10.
Efecto del tratamiento intensivo (basado en metas, a través de una combinación de medicamentos y modificación del estilo de vida) vs. tratamiento convencional multifactorial, y desenlaces CV.
- 11.
Efecto del tratamiento anti-HTA y desenlaces CV en individuos con enfermedad coronaria establecida.
- 12.
Efecto del tratamiento anti-HTA y progresión de la enfermedad arteriosclerótica41-70.
Estudios observacionales y ensayos clínicos que han evaluado el efecto del tratamiento de la presión arterial en diabetes tipo 2
| Estudio (ref.) | Criterios de inclusióna | Intervención | Control | Seguimiento (años) | Grupo de intervención, PA basal | Grupo de intervención, PA final | Reducción de eventos CV, grupo de intervención |
|---|---|---|---|---|---|---|---|
| SHEP41 | n=4.736, 583 con HTA sistólica aislada y DM2 (edad 70años) | Clortalidona +atenolol | Placebo | 4,5 | 170/76 | 143/68 | Eventos CV mayores: 34% |
| Syst-Eur42 | n=4.695, 492 con HTA sistólica aislada y DM2 (edad 70años) | Nitrendipino ±enalapril ±HCTZ | Placebo | 2,0 | 175/85 | 153/78 | Mortalidad por ECV: 76%, eventos CV combinados 69%, AVC fatal y no fatal: 73% |
| UKPDS 3843 | n=758, DM2 +HTA (edad 56años) | Control estricto (captopril) | Control menos estricto (atenolol) | 8,4 | 159/94 | 144/83 | Reducción significativa para AVC fatal y no fatal: 44% |
| HOT44 | n=18.790, 1.501 individuos con DM2 +HTA (edad 62años) | Control intensivo: Felodipino ±IECA, B-Bloq, diuréticos. PAD <85 PAD <80 | Cuidado usual: PAD<90 PAD<90 | 3,8 | 170/105 | 141/83 140/81 | Eventos CV: 51% con PAD ≤80mmHg (vs. PAD ≤90) |
| ABCD45 | n=470, DM2 +HTA (edad 57años) | Nisoldipino. Control intensivo, meta PAD: 75 | Enalapril. Control moderado, meta PAD: 80-89 | 5,0 | 155/98 | 133/78 | Incremento significativo en el RR de IM fatal y no fatal con nisoldipino |
| HOPE46,47 | Historia de ECV +1 factor de RCV adicional, n=9.541, 3.577 con DM2 (edad 65años) | Ramipril | Placebo | 4,5 | 142/80 | 140/77 | Compuesto primario final: 25% (IM, AVC, muerte de origen CV). Mortalidad CV 37%, IM 22%, AVC 33% |
| RENAAL48 | DM2 y nefropatía, >90% con HTA. n=1.513 (edad 60años) | Losartán +terapia anti-HTA convencional (excepto IECA y BRA) | Placebo +terapia anti-HTA convencional (excepto IECA y BRA) | 3,4 | 153/82 | 140/74 | Sin diferencias en la morbilidad/mortalidad de origen CV |
| IDNT49 | HTA +DM2 +nefropatía, n=1.715 | Irbesartán | Amlodipino o placebo | 2,6 | 159/87 | 140/77 | Sin diferencias en los resultados CV secundarios |
| PROGRESS50 | n=6.105, 761 DM2 +HTA +historia AVC | Perindopril ±indapamida | Placebo | 4,0 | 149/84 | 140/80 | Reducir 10mmHg la PAD reduce la recurrencia de AVC en un 38% |
| ALLHAT51 | n=42.418, 8.851 con DM2 +HTA (edad 66,6años) | Amlodipino | Clortalidona | 4,9 | 146/84 | 135/75 | Sin diferencias en el riesgo de EAC |
| DIABHYCAR52 | DM2 +proteinuria, n=4.912 (edad 65años) | Ramipril | Placebo | 3,9 | 145/82 | 142/80 | Sin diferencias en los desenlaces CV |
| ADVANCE53 | DM2, >65% con HTA, n=11.140 (edad 66años) | Perindopril +indapamida | Placebo | 4,3 | 145/81 | 136/73 | Muerte por ECV: 18% Muerte por toda causa: 14% |
| Steno-254 | DM2 +mAlb, n=160 (edad 55,1años) | Manejo intensivo, basado en metas de control para DM2, PA, lípidos y mAlb | Manejo convencional según protocolo | 7,8 | 146/85 | 131/73 | Muerte de origen CV: 57% Eventos CV: 59% |
| ONTARGET55 | Enfermedad vascular o DM2 de alto RCV, n=25.620, 9.736 con DM2 (edad 66,5años) | Telmisartán o tratamiento combinado (telmisartán +ramipril) | Placebo, o ramipril | 4,7 | 142/82 | 141/81 en el grupo de telmisartán, y 140/81 en el grupo de tratamiento combinado vs. ramipril | Sin diferencias en los desenlaces CV entre el BRA y el IECA. La terapia combinada se asoció con mayores eventos adversos, sin incremento del beneficio |
| SANDS56 | DM2, n=548 (edad ≥40años). Ambos grupos recibieron: IECA o BRA ±HCTZ ±BCC ±B-Bloq ±alfa-bloqueadores ±otros vasodilatadores | Grupo de tratamiento agresivo. Meta de PAS<115 | Grupo de tratamiento estándar. Meta de PAS <130 | 3,0 | PAS: 131 | PAS: 117 | El tratamiento agresivo disminuyó la progresión de la arteriosclerosis y redujo la masa del ventrículo izquierdo |
| ACCOMPLISH57 | n=11.506 con HTA y alto RCV, 6.946 tenían DM2 (edad 68años) | Amlodipino +benazepril | HCTZ +benazepril | 3,0 | 145/79 | 132/73 | Eventos CV y muerte CV 19,6%, eventos CV, muerte de causa CV, AVC no fatal e IM no fatal: 21% |
| ACCORD58,59 | DM2 y alto RCV, n=4.733 (edad 62años). Ambos grupos recibieron: IECA, BRA, BCC, B-Bloq, diuréticos | Terapia intensiva. Meta PAS <120 | Terapia estándar. Meta PAS <140 | 4,7 | 139/76 | 119/64 | Riesgo de AVC 39%, desenlaces CV 33%, IM 37% |
| INVEST60 | DM2 +HTA +EAC, n=6.400 (edad 66años). Asignados a tres categorías de PAS: <130; 130-139; ≥140 | Verapamilo | Atenolol | 2,7 | 151/85 | NA | Sin diferencias sobre desenlaces CV y/o mortalidad |
| Swedish National Diabetes Register61 | DM2 bajo manejo con anti-HTA, n=12.677 (edad 30-75años) | NA | NA | NA | NA | NA | Una PAS ≥140 incrementó 37% el riesgo de EAC; 86% para AVC y 44% para ECV (al compararse con un nivel de PAS de 110-129) |
| SPS362,63 | Historia de infarto lacunar reciente, n=2.747, 981 con DM2 (edad 63años). Comparando PAS: 130-149 vs. <130 | Intensivo: uso de IECA, BRA, B-Bloq, tiazidas, BCC y otros según concepto médico | Usual: uso de IECA, BRA, B-Bloq, tiazidas, BCC y otros según concepto médico | 3,7 | 143/79 | 127/ND | Reducción de recurrencia de AVC, eventos vasculares y mortalidad con PA: 124/67. El menor riesgo fue con una PA: 120-128/65-70 |
| VALUE64 | n=15.244, HTA con alto RCV, 32% con DM2 (edad 67años). Análisis según: PA <140/90 vs. <130/80; PAS: ≥140, 130-139, <130; y PAD ≥90, 80-89, <80 | Valsartán | Amlodipino | 4-6 años | NA | NA | Una PA: ≥140/90, vs. 130-139/80-89, incrementó la incidencia de IM fatal y no fatal, y de muerte cardiaca súbita, entre otros. |
Anti-HTA: anti-hipertensivos; AVC: ataque vascular cerebral; B-Bloq: beta-bloqueadores; BCC: bloqueadores de canales de calcio; BRA: bloqueadores del receptor de angiotensina; CV: cardiovascular; DM2: diabetes mellitus tipo 2; EAC: enfermedad arterial coronaria; ECV: enfermedad cardiovascular; HTA: hipertensión arterial; HCTZ: hidroclorotiazida; IECA: inhibidores de la enzima convertidora de angiotensina; IM: infarto del miocardio; mAlb: microalbuminuria; NA: no aplica; PA: presión arterial; PAD: PA diastólica; PAS: PA sistólica; RCV: riesgo cardiovascular.
Metaanálisis que han evaluado el efecto del tratamiento de la presión arterial en diabetes tipo 2
| Autor | Criterios de inclusión | Tratamiento activo | Control | Número de estudios | Desenlaces CV |
|---|---|---|---|---|---|
| Reboldi et al.65 | ECC que compararon diversos anti-HTA en DM2, n=73.913 | IECA, BRA, BCC, diuréticos, B-Bloq, en monoterapia o en terapia combinada | Placebo u otro tratamiento activo | 31 | El riesgo de AVC se redujo significativamente en 13% por cada reducción en 5mmHg de la PAS, y en 11,5% por cada reducción en 2mmHg de la PAD. El riesgo de IM se redujo de manera significativa en 11% en el grupo de tratamiento activo |
| McBrien et al.66 | ECC y cuasi-aleatorizados, comparando diversos anti-HTA en DM2, n=7.312 (edad 53-62años). Todos los estudios utilizaron anti-HTA de forma escalonada para alcanzar metas preespecificadas de PA | Control intensivo, metas de PA ≤130/80mmHg | Control estándar de PAS: 140-160mmHg y PAD: 85-100mmHg | 5 | No hubo diferencias en el riesgo de muerte o IM; el riesgo de AVC se redujo de manera significativa en el grupo de control intensivo en 35% |
| Bangalore et al.67 | ECC comparando diversos anti-HTA en DM2, GAA o con ITG, n=37.736 | Control intensivo, meta de PAS ≤135mmHg, con monoterapia o terapia combinada así: benazepril/amlodipino, candesartán, doxazosina, enalapril, fosinopril/amlodipino, perindopril, perindopril/indapamida, ramipril, valsartán | Control estándar, meta de PAS ≤140mmHg, con monoterapia, terapia combinada o placebo así: Benazepril/HCTZ, clortalidona, nifedipino, amlodipino, placebo | 13 | El grupo de control intensivo redujo significativamente la mortalidad por toda causa y la de AVC en 17%; no hubo diferencias en otros desenlaces CV |
| Emdin et al.68 | ECC comparando diversos anti-HTA en DM2, n=100.354. Los estudios se estratificaron en categorías de PAS: ≥140, <140, ≥130 y <130 mmHg | IECA, BRA, B-Bloq, diuréticos, BCC | Placebo u otros anti-HTA | 40 | Por cada 10mmHg de reducción en la PAS, el riesgo de mortalidad se redujo significativamente (13%), los eventos CV en 11%, la EAC en 12% y el AVC en 27% |
| Brunström et al.69 | ECC comparando diversos anti-HTA en DM2, n=73.738 | Cualquier tipo de fármaco anti-HTA, o dos fármacos anti-HTA | Placebo, o monoterapia con otros anti-HTA | 49 | Para un nivel basal de PAS <150mmHg, el grupo de tratamiento activo redujo significativamente el riesgo de mortalidad CV (25%), IM (26%), y AVC (23%). Si el nivel basal de PAS era de 140-150mmHg, el tratamiento adicional redujo de manera significativa el riesgo de IM (16%) y fallo cardiaco (20%) |
| Thomopoulos et al.70 | ECC, comparando diversos anti-HTA, n=260.210 (61.772 con DM2). Se evaluó el efecto de la reducción de la PAS: ≥140, o de 130 a <140, o <130mmHg; y de la PAD: ≥80 o <80mmHg | IECA, BRA, B-Bloq, diuréticos, BCC en monoterapia o tratamiento combinado | Placebo, no tratamiento u otros anti-HTA | 41 | Un valor de PAS de al menos 140mmHg redujo significativamente el riesgo de desenlaces CV en personas con DM2 vs. sin DM2. Para DM2, se redujo el riesgo de AVC en 27%, EAC en 29% y falla cardiaca en 25% |
Anti-HTA: anti-hipertensivos; AVC: ataque vascular cerebral; B-Bloq: beta-bloqueadores; BCC: bloqueadores de canales de calcio; BRA: bloqueadores del receptor de angiotensina; CV: cardiovascular; DM2: diabetes mellitus tipo2; EAC: enfermedad arterial coronaria; ECC: ensayos clínicos controlados; ECV: enfermedad cardiovascular; GAA: glucemia alterada en ayunas; HTA: hipertensión arterial; HCTZ: hidroclorotiazida; IECA: inhibidores de la enzima convertidora de angiotensina; IM: infarto del miocardio; ITG: intolerancia a la glucosa; mAlb: microalbuminuria; NA: no aplica; PA: presión arterial; PAD: PA diastólica; PAS: PA sistólica; RCV: riesgo cardiovascular.
El manejo adecuado de las cifras de PA en individuos con DM2 ha demostrado ser una medida coste-efectiva, ya que los beneficios de dicha intervención sobre los resultados CV sobrepasan los alcanzados por el control glucémico per se; sin embargo, la recomendación inicial en la cifra de PAS <130mmHg, parecía solo reducir el riesgo de AVC isquémico o hemorrágico (al compararse con niveles de PAS >130 y <140mmHg). Aunque en un análisis posterior de los resultados del estudio ACCORD se encontró que la población con DM2, a la cual se le asignó tratamiento intensivo y que alcanzó cifras de PAS de 119mmHg (vs. el grupo estándar, el cual alcanzó cifras de 136mmHg), después de la asignación inicial a una reducción intensiva vs. estándar de los niveles de A1c se encontró que los individuos que lograron una reducción intensiva de los niveles de PAS (y una disminución estándar de los niveles de A1c) presentaron una reducción marcada del riesgo de AVC del 39%, de desenlaces CV combinados del 33% y de IM del 37%. En este mismo estudio se encontró que los individuos que pudieron alcanzar metas de PAS <120mmHg presentaron un incremento significativo en el riesgo de eventos CV respecto a aquellos que permanecieron en el rango entre 120-139mmHg71,72. Los resultados del estudio ACCORD debilitaron la creencia establecida de «cuanto más bajo mejor».
Por su parte, las metas establecidas de PAD en las diferentes guías de manejo se han establecido en <80, <85 y <90mmHg. Así, en el estudio HOT se documentó una reducción del 51% en la incidencia de eventos CV entre los que alcanzaron cifras de PAD ≤80mmHg vs. los que alcanzaron cifras ≤85 y ≤90mmHg. En el estudio UKPDS38, los pacientes con DM2 y con HTA que lograron bajo tratamiento niveles de PAD de 83mmHg tuvieron un 21% menos riesgo de IM y un 44% menos riesgo de AVC, en comparación con los que lograron cifras de PAD de 87mmHg. Ambos estudios (HOT y UKPDS38) fueron los que determinaron la recomendación establecida por muchas guías de alcanzar un valor de PAD ≤80 o ≤85mmHg.
Con los resultados de los estudios anteriores no era posible establecer si un valor de PAS <130mmHg en individuos diabéticos con HTA era mejor que un valor de PAS <140mmHg; lo que sí se podía concluir era que valores de PAS <120mmHg no parecían beneficiar a esta población (respecto a desenlaces CV). Con relación a las cifras de PAD, se encontró que un valor <80mmHg reducía el riesgo de eventos vasculares en esta población, aunque la magnitud global de reducción del RCV se lograba con cifras de PAD entre 80-89mmHg. Lo anterior permitía considerar también el hecho de que al lograr cifras de PAS en el rango de 130-139mmHg casi siempre se acompaña de cifras de PAD <90 o <85mmHg, e incluso <80mmHg73,74. De igual manera, y a pesar de que el logro de estas metas de PAD (rango entre 70-79mmHg) no se asociaban con efectos indeseables en los individuos que lograban el control de sus cifras de PAS, surgía la duda acerca del «fenómeno de curva J», el cual puede presentarse al manejar valores de PAD <80mmHg75.
Por lo tanto, y si se tiene en cuenta que la perfusión constante de órganos vitales (corazón, cerebro, riñones) se compromete cuando los niveles de PA disminuyen de manera progresiva, el tratamiento con anti-HTA (y el logro de cifras muy estrictas de PA) puede originar un punto de inflexión, en donde un valor de PA muy bajo es capaz de afectar la perfusión y la función de múltiples órganos. Esto se ha demostrado en múltiples estudios, en los cuales niveles de PAS y de PAD por debajo de ciertas cifras se han asociado con una mayor incidencia de eventos CV («fenómeno de curva J»)76-78; esto es, si se tiene en cuenta que el flujo coronario es una función de la presión de perfusión y de las resistencias de las arterias coronarias, la presión de perfusión es la diferencia entre la presión diastólica aórtica y la presión telediastólica ventricular izquierda; asimismo, un nivel bajo de PA (en especial de la PAD) puede comprometer la perfusión coronaria; y como la perfusión coronaria ocurre en la diástole, la hipotensión diastólica puede llevar a hipoperfusión coronaria, principalmente en personas con un flujo coronario comprometido. Esto puede explicar por qué en los estudios experimentales donde se obtienen niveles de PAD <90mmHg (por medio del uso de nitroprusiato de sodio) se origina una reducción marcada del flujo sanguíneo coronario en individuos hipertensos con hipertrofia ventricular izquierda (HVI), mientras que en aquellos sin HVI no se encontraron alteraciones en la perfusión coronaria al alcanzar cifras de PAD cercanas a 70mmHg; por lo tanto, individuos hipertensos con comorbilidad cardiovascular (HVI, EAC) son más propensos a presentar un «fenómeno de curva J»79-81. De igual forma, otros estudios han encontrado una asociación entre un nadir de PAD de <70, <80, o de 85-89mmHg y la aparición de eventos vasculares en DM2. En el estudio HOT no se encontraron diferencias en los desenlaces CV entre los grupos de tratamiento cuando fueron asignados a una meta de PAD de ≤90, ≤85 o ≤80mmHg, e incluso entre los individuos con enfermedad cardiaca isquémica previa, los que alcanzaron cifras de PAD de 80mmHg tuvieron una alta tasa de IM respecto a los que alcanzaron cifras de 85mmHg. El incremento en el riesgo de IM con reducción de la PAD no se encontró en pacientes sin enfermedad cardiaca isquémica. Por su parte, en el estudio INVEST los individuos con EAC establecida y con HTA tuvieron menos eventos CV cuando el nivel de PAD fue <90mmHg, mientras que el riesgo se incrementó cuando el valor fue <70mmHg. Por otro lado, en el estudio ONTARGET la incidencia de eventos CV se redujo cuando los niveles de PA disminuyeron de 145/82mmHg a 133/76mmHg, pero se incrementaron nuevamente entre los individuos que alcanzaron metas más bajas de PA (125/72 y 116/68mmHg).
Lo anterior indica que el «fenómeno de curva J» debe tenerse en cuenta al establecer metas de PA en la población con DM2; es más, el nadir puede ser incluso más alto que el establecido para individuos no diabéticos; esto es, si la DM2 es considerada un «equivalente» de RCV, hipotéticamente esta población debe tener al menos el mismo nadir de BP para originar hipoperfusión coronaria que la población sin DM2 (pero con HVI, o con EAC establecida). Finalmente, es probable que no exista un único nadir en individuos con DM2, pudiéndose encontrar varios de ellos dependiendo de las características basales de los pacientes (clase funcional, fracción de eyección, disfunción diastólica, insuficiencia aórtica, exceso de peso, tabaquismo, comorbilidades asociadas y presencia de otros factores de RCV, uso de múltiples fármacos anti-HTA, entre otras)82,83.
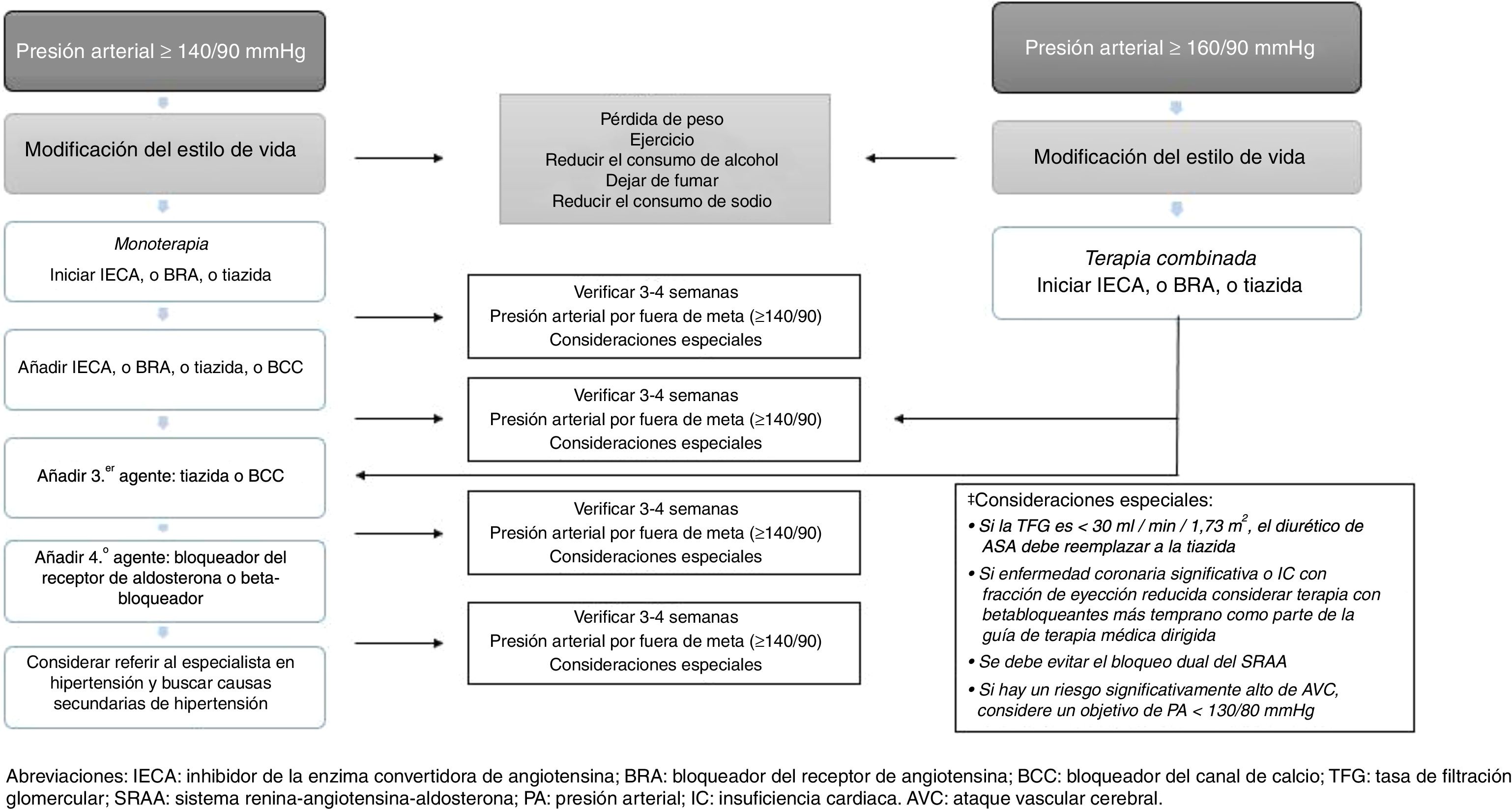
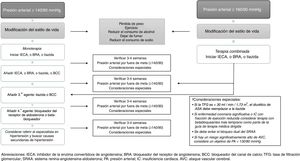
Recomendaciones para el tratamiento farmacológico de la hipertensión arterial en individuos con diabetes mellitus tipo 2Las diferentes guías de manejo que establecen recomendaciones para el manejo farmacológico de la HTA en pacientes con DM2 coinciden en varios aspectos84-89, que se resumen a continuación:
- 1.
El tratamiento de inicio debe involucrar fármacos anti-HTA que hayan demostrado reducción de desenlaces CV. El umbral de PA considerado para inicio de tratamiento (en monoterapia) es ≥140/90mmHg; en general, el uso de anti-HTA tipo IECA, BRA o tiazidas es recomendado en monoterapia, siempre y cuando las cifras de PA se encuentren ≥140/90 y <160/90, ya que valores ≥160/90 es indicación para terapia combinada con anti-HTA (fig. 2).
- 2.
Todas las clases «mayores» de anti-HTA (por ejemplo, IECA, BRA, BCC dihidropiridínicos y diuréticos tiazídicos) deben recomendarse como agentes de primera línea.
- 3.
En individuos con presencia de albuminuria (≥30mg/g creatinina) los anti-HTA de primera línea son los IECA y los BRA.
- 4.
Los IECA y los BRA pueden enlentecer la progresión de nefropatía y retinopatía; por lo tanto, deben considerarse los anti-HTA de primera línea en estos pacientes.
- 5.
En pacientes sin albuminuria, el tratamiento inicial en monoterapia puede hacerse indistintamente con IECA, BRA, tiazidas o BCC dihidropiridínicos, ya que, en ausencia de albuminuria, el riesgo de progresión de la enfermedad renal es bajo, y los IECA y los BRA no han demostrado una mayor cardioprotección al compararse con otros anti-HTA.
- 6.
En pacientes con ECV ya establecida o con insuficiencia cardiaca puede recomendarse el uso de beta-bloqueadores, teniendo en cuenta que este tipo de fármacos no han demostrado reducir la mortalidad en ausencia de dicha condición. Por su parte, los diuréticos de asa pueden ser útiles en individuos con enfermedad renal o con insuficiencia cardiaca, los cuales tienen mayor propensión a la retención de líquidos.
- 7.
El control de la PA es más difícil de alcanzar en pacientes con DM2 que en aquellos sin DM2; por lo tanto, puede ser necesaria la terapia combinada con anti-HTA en un número importante de individuos.
- 8.
Existe evidencia muy escasa sobre la eficacia, seguridad y desenlaces CV con fármacos como alfa-bloqueadores (aunque pueden ser útiles en pacientes con prostatismo asociado) y con fármacos que actúan sobre el metabolismo de la aldosterona (espironolactona o eplerenona); sin embargo, pueden considerarse en individuos con HTA resistente al tratamiento (monitoreando la función renal y el nivel sérico de potasio, en especial al combinarse con IECA, BRA u otros diuréticos).
- 9.
El tratamiento combinado debe considerarse a partir de cifras de PA ≥150/100mmHg, siendo más sólida la recomendación con niveles ≥160/100mmHg.
- 10.
La elección de cualquiera de todos los anti-HTA «mayores» es la base del tratamiento farmacológico de la HTA en DM2, pero esta decisión debe tomarse de manera individualizada, teniendo en cuenta factores como: etnia, riesgo de efectos adversos, control glucémico, costes, interacción entre los fármacos, ECV, insuficiencia cardiaca y función renal (los cuales pueden tener influencia sobre aspectos como adherencia, eficacia, desenlaces y seguridad).
Desde los efectos neutros sobre la PA que tienen grupos de medicamentos como las sulfonilureas, metformina, meglitinidas e insulina, pasando por aquellos que tienen un efecto neutro (o que pueden tener un efecto reductor leve de las cifras de PA) como los inhibidores de la α-glucosidasa y los inhibidores de la DPP-IV, hasta aquellos que originan una reducción moderada de los niveles de PA (tiazolidinedionas, que tienen un efecto reductor de las cifras de PAS, con un efecto neutro o reductor leve de la PAD), hasta fármacos que además de reducir los niveles de PA también reducen los desenlaces micro y macrovasculares en DM2 (los inhibidores SGLT2 [SGLT2-inh] y los agonistas del receptor de GLP-1 [GLP1-RA])90,91.
Por definición, los fármacos antihiperglucemiantes (parenterales y no parenterales) no son anti-HTA; sin embargo, los SGLT2-inh (empagliflozín y canagliflozín) y los GLP1-RA (liraglutida y semaglutida) han demostrado reducir desenlaces CV. La reducción de la PA demostrada con los SGLT2-inh probablemente sea debida a sus efectos diuréticos osmóticos y a la natriuresis acompañante, ya que la inhibición de los SGLT2 induce una mayor excreción de agua y glucosa (causada por la presencia de glucosa no-reabsorbida en el túbulo renal proximal); el incremento en el gasto urinario (entre 110 a 470ml/día) junto a la natriuresis presente contribuye a la reducción del volumen plasmático y a reducir los niveles de PA. Adicionalmente, la pérdida de peso originada por los SGLT2-inh (2-3kg) también contribuye a la reducción de los niveles de PA (bien sea por contracción de volumen o por pérdida de tejido adiposo y/o magro). Finalmente, estos fármacos pueden también originar reducción de la PA a través de la inhibición local del SRAA (secundaria al mayor suministro de sodio en el aparato yuxtaglomerular, ya que reducen la reabsorción de sodio en el túbulo proximal, secundario al incremento de sodio en la mácula densa). Se han descrito otros mecanismos, como algunos efectos indirectos mediados por el óxido nítrico (al reducirse el estrés oxidativo, al mejorar los niveles de glucemia) o por la posible regulación del sistema nervioso autónomo (probablemente induciendo activación del sistema parasimpático). En general, los niveles de PAS se reducen entre 2,9 y 5,73mmHg, y los de PAD entre 1,09-2,62mmHg (reducción significativa respecto a placebo o a otros fármacos antihiperglucemiantes)92-97.
Por su parte, los GLP-1RA han demostrado tener un efecto reductor leve sobre los niveles de PA. Los mecanismos por medio de los cuales este tipo de medicamentos reduce la PA no están bien dilucidados, y la vía metabólica más probable es por el incremento en el péptido natriurético auricular (PNA), mediado por el GLP-1R (el cual se expresa a nivel de las aurículas). Por ende, los GLP-1RA, al estimular el GLP-1R, pueden inducir la natriuresis mediada por PNA. Adicionalmente, el GLP-1R regula la sensación de saciedad y la ingesta de agua, y este mecanismo parece explicar (al menos en parte) la pérdida de peso encontrada en los diferentes estudios y, en cierta forma, influir sobre los niveles de PA. Finalmente, se ha descrito un efecto vasodilatador (independiente de óxido nítrico) mediado por los GLP-1RA. Desde el punto de vista clínico, GLP-1Ras como lixisenatida reduce la PAS en 0,8mmHg; liraglutida reduce la PAS en 1,2mmHg (pero la PAD se incrementó en 0,6mmHg); semaglutida reduce la PAS entre 1,3-2,6mmHg (dependiente de la dosis utilizada), sin cambios en los niveles de PAD, y exenatida (aplicación semanal) reduce la PAS en 1,6mmHg. La pérdida de peso promedio inducida por este tipo de fármacos es de 3-5kg, siendo mayor con liraglutida en dosis altas (3,0mg)97-100.
Tratamiento no farmacológicoEn general, las recomendaciones no farmacológicas para el manejo de pacientes con HTA y DM2 son extrapolaciones de estudios diseñados en población con HTA y sin DM. Dentro de estas recomendaciones, las que han demostrado un efecto importante en dichos individuos son la pérdida de peso, la restricción de sodio de la dieta y el ejercicio físico.
En individuos con sobrepeso u obesidad la meta es llevar un índice de masa corporal al rango normal (18,5-24,9kg/m2) y una circunferencia abdominal <102 y <88cm para hombres y mujeres, respectivamente. Con relación a la dieta, el estudio Dietary Approaches to Stop Hypertension (DASH) concluyó que esta dieta reduce las cifras de PA en pacientes sin DM2, pero posteriormente se demostró que, además de reducir las cifras de PA en personas con sobrepeso, podía mejorar la sensibilidad a la insulina en un programa integral de modificación de estilo de vida (lo cual incluía pérdida de peso, cambios de conducta y un seguimiento frecuente, de al menos cada 4-6meses). La dieta DASH se basa principalmente en un alto consumo de frutas y verduras sin almidón, con ingestas moderadas de lácteos sin grasas (o bajos en grasas), granos integrales, carnes magras, aves, habichuelas, alimentos con soya y huevo, pescado, nueces, aceite de oliva (o canola) y limitar el consumo de granos refinados como el pan blanco, pastelillos y los dulces. Un aspecto fundamental es la disminución del consumo de sodio (<2g/día, o <87mmol/día, o <5 gm/día de sal), y el incremento del consumo de potasio (a partir de verduras y frutas). Por otra parte, el consumo de cafeína no ha demostrado evidencia contundente sobre los riesgos o beneficios de su consumo crónico, pero sí se ha demostrado que el consumo de alcohol aumenta la frecuencia de HTA en diferentes poblaciones; por lo tanto, se debe evitar o aceptar como máximo un consumo de 30g/día en el hombre y 15g/día en la mujer101-103.
Con relación al ejercicio, es claro que el estilo de vida sedentario y la falta de actividad física son fuertes predictores de mortalidad CV (independiente de la presencia de HTA y de otros factores de RCV). Se recomiendan los ejercicios dinámicos, de moderada intensidad (caminar, trotar, natación, entre otros), con una frecuencia de 4-7 veces por semana (cada sesión de 30-60min), junto a las actividades rutinarias diarias; los ejercicios de alta intensidad son todavía más efectivos, y junto a las modificaciones de la dieta se ha asociado con una reducción más significativa de las cifras de PA. El llevar a cabo estas recomendaciones puede originar una reducción en los niveles de PAS de 5-10mmHg y de PAD de 1-6mmHg; sin embargo, no es claro el efecto a largo plazo sobre desenlaces CV en población con HTA y DM2. La intensidad del ejercicio debe ser individualizada y acorde con la condición clínica del paciente104,105.
Consideraciones finalesLos resultados derivados de los estudios descritos han permitido consolidar algunas recomendaciones respecto al valor de PA que debe alcanzarse en individuos con DM2; no obstante, es difícil poder establecer un valor óptimo para esta población específica. La evidencia actual indica que una meta de PAS entre 130-139mmHg protege contra complicaciones CV y renales, y se ha demostrado que llevar un valor de PAS lo más cercano a 130mmHg logra un beneficio adicional y significativo (respecto a un valor más alto). Por su parte, una meta <130mmHg puede beneficiar a individuos con alto riesgo de eventos cerebrovasculares (como pacientes con historia previa de AVC) y a aquellos con nefropatía y proteinuria marcada. Finalmente, valores de PAS <120mmHg no deben considerarse en esta población, ya que no se ha demostrado que reduzcan significativamente la frecuencia de desenlaces CV o sobre mortalidad, y por el contrario, pueden asociarse con un «fenómeno de curva J». Por otro lado, un nivel de PAD entre 80-89mmHg puede ser establecido como meta inicial en estos pacientes; sin embargo, puede lograrse un beneficio adicional al reducir dicho valor a un rango entre 70-79mmHg (siempre y cuando no se incremente la tasa de efectos adversos). Debe tenerse en cuenta también que las metas de PA pueden variar entre la población con DM2 (por ejemplo, por factores como edad, daño en órgano blanco, diagnóstico reciente de DM2, etnia, presencia de efectos adversos, comorbilidades, etc.), y por tanto debe individualizarse la meta de PA, haciendo la salvedad de que una meta muy exigente prácticamente obliga al uso combinado de anti-HTA (incrementando así el riesgo de eventos adversos, y probablemente baja adherencia). Pocos estudios se han realizado con el objetivo de establecer metas de BP en individuos con DM2 >80años; una meta <150/90mmHg puede ser razonable, aunque de igual forma debe sopesarse el riesgo/beneficio de establecer metas más exigentes en dichos individuos.
ConclusionesEn individuos con DM2 y HTA, una meta de PAS entre 130-139mmHg y de PAD entre 80-89mmHg ha demostrado ser segura y reduce el riesgo de desenlaces CV. Valores de PAS <130mmHg se deben reservar para pacientes con alto riesgo de eventos cerebrovasculares; las cifras de PAD entre 70-79mmHg son ideales, siempre y cuando no se incremente el riesgo de eventos adversos o de «fenómeno de curva J» (en especial en individuos con EAC establecida, o con HVI). Estas metas deben individualizarse de acuerdo con las características basales de los pacientes y sus comorbilidades. Finalmente, valores de PAS <120mmHg o de PAD <70mmHg no han demostrado disminuir la presencia de desenlaces CV, e incluso, pueden incrementar la tasa de aparición de estos. Los fármacos de primera línea son los IECA y los BRA; los otros anti-HTA que pueden utilizarse son los BCC, tiazidas y beta-bloqueadores, y en menor medida los alfa-bloqueadores y los fármacos que actúan sobre el metabolismo de la aldosterona. Con los resultados actuales sobre seguridad cardiovascular, reducción de desenlaces CV y efectos moderados en la reducción de la PA, el uso de SGLT2-inh y de GLP-1RA muy seguramente aparecerá en las diferentes guías de manejo para el tratamiento de la HTA en personas con DM2.
Conflicto de interesesH. V.-U. ha sido speaker y ha hecho parte de Advisory boards de los siguientes laboratorios: Sanofi, Novo, Novartis, MSD, Boehringer Ingelheim y AstraZeneca. Él no tiene conflicto de intereses que declarar en la realización del actual manuscrito.
M.F. C.-A. no tiene conflictos de intereses que declarar.