Con frecuencia, los pacientes con cardiopatía tienen disfunción renal manifestada por el descenso del filtrado glomerular (FG) y/o aumento de la albuminuria.
ObjetivosEl objetivo fue estudiar el papel del aumento de la rigidez aórtica en la presencia y extensión de la enfermedad coronaria (EC) y en la disfunción renal en sujetos con EC.
Pacientes y métodosEstudio observacional transversal de 48 pacientes con sospecha de EC sometidos a coronariografía. Mediante tonometría de aplanamiento sobre la arterial radial y aplicando una función de transferencia, se calcularon los valores de presión arterial central. El estudio de la rigidez aórtica se hizo mediante la determinación de la velocidad de pulso carótida-femoral (Vpc-f).
ResultadosDe los 48 pacientes, 11 no tenían lesiones coronarias significativas, 24 evidenciaron lesiones significativas en una o dos arterias coronarias y 13 en ≥ tres arterias.
El grupo con mayor grado de EC tenía valores de presión de pulso central (PPc) más altos que el grupo sin EC. La Vpc-f aumentaba de forma progresiva y significativa con el grado de EC. La regresión logística mostraba que la VPc-f predecía de forma independiente la presencia de EC. El FG se correlacionaba de forma negativa y significativa con la edad. La Vpc-f se asociaba a la albuminuria.
ConclusionesEn pacientes con EC estable, la Vpc-f se relaciona de forma independiente con la existencia y extensión de la EC, así como con la disminución del FG y el aumento de la albuminuria.
Patients with heart disease frequently have renal dysfunction manifested by a decrease in glomerular filtration rate (GFR) and / or increase of albuminuria.
ObjectivesThe objective was to study the possible role of increased aortic stiffness in the presence and extent of coronary artery disease (CAD) and kidney dysfunction in a group of patients with suspected CAD.
Patients and methodsWe studied forty-eight patients undergoing coronariography for suspected coronary disease (CAD). Using applanation tonometry on the radial artery and applying a transfer function, central blood pressure values were calculated. The study of aortic stiffness was done by determining the carotid-femoral pulse velocity (Pvc-f).
ResultsOf the 48 patients, 11 had no significant coronary lesions, 24 showed significant lesions in 1 or 2 coronary arteries and 13 in ≥ 3 arteries.
The group with a higher degree of CD had significantly higher cPP values than the group without CD. The Pvc-f increased progressively and significantly with the degree of CD. The logistic regression showed that Pvc-f independently predicted the presence of CD. The relative risk of CD increased 2.5 times for each meter of increase in Pvc-f. The GFR was negatively and significantly correlated with age and Pvc-f was associated with albuminuria.
ConclusionsIn patients with stable CD, Pvc-f, expression of aortic stiffness, is independently associated with the existence of CD and its degree of extension. The increase in arterial stiffness also participates in the decrease in GFR and in the increase in albuminuria.
Tanto la enfermedad coronaria (EC) como la enfermedad renal crónica (ERC) tienen una elevada prevalencia1,2. Es frecuente la asociación de alteraciones cardiacas y renales. Los pacientes con enfermedad cardiovascular (ECV) presentan, con gran frecuencia, disfunción renal3, y los que tienen cualquier manifestación de ERC ya sea disminución del filtrado glomerular (FG) y/o aumento de excreción urinaria de albúmina tienen más riesgo de ECV4. Es tal la consistencia de esta asociación, que se ha consolidado el término «síndrome cardio-renal» para definir las alteraciones cardiacas secundarias a la disfunción renal y las anomalías renales derivadas de problemas cardiacos, o a la disfunción de ambos órganos por una causa común5.
La interrelación cardiopatía-nefropatía puede deberse a varios hechos. Ambas pueden ser el resultado del efecto de factores de riesgo vascular tradicionales comunes (envejecimiento, hipertensión arterial [HTA], diabetes mellitus [DM], dislipemia, entre otros). Por otra parte, en la ERC moderada-severa con descenso del FG, se generan factores de riesgo no tradicionales (estrés oxidativo, mediadores proinflamatorios, alteraciones del metabolismo fosfocálcico, entre otros) que pueden inducir alteraciones cardiovasculares (CV)4. En presencia de cardiopatía, también puede haber mediadores proinflamatorios y estímulos neurohormonales que promueven la disfunción renal5.
Uno de los mecanismos patogénicos que puede subyacer en el daño conjunto cardiaco y renal es el deterioro estructural y funcional de las grandes arterias. Tanto los factores de riesgo vascular tradicionales, como los fenómenos generados por la disfunción cardiaca y renal pueden contribuir a la arterio y aterosclerosis vascular con aumento de la rigidez arterial y alteraciones hemodinámicas secundarias con incremento de la carga pulsátil, lo que puede coadyuvar al daño cardiaco y renal4–7.
El objetivo de este trabajo fue estudiar el posible papel de las alteraciones de la función y rigidez de la aorta en la presencia y extensión de lesiones coronarias, y en la función renal en un grupo de enfermos con sospecha de EC en los que se realizó coronariografía.
Material y métodosSe estudiaron 48 sujetos que ingresaron de forma programada para la realización de coronariografía, prescrita por un cardiólogo, por probable EC con base en la edad, el sexo, los síntomas y otros test cardiacos. Se excluyeron del estudio los pacientes ingresados por síndrome coronario agudo. Podían ser incluidas personas con infarto de miocardio y/o revascularización que hubieran sucedido al menos un año antes del estudio. Todos los pacientes dieron su consentimiento informado para efectuar la coronariografía y otras medidas hemodinámicas arteriales no invasivas, así como para las determinaciones de laboratorio. El estudio cumplió todos los criterios éticos de la institución donde se ha llevado a cabo.
Antes de la realización de la coronariografía y en ayunas, se obtuvo sangre para la determinación de los parámetros de laboratorio (hemoglobina, creatinina, perfil lipídico, marcadores de inflamación, ácido úrico, glucemia, índice homeostasis model assessment insulin resistence (HOMA-IR). La función renal de los pacientes se evaluó mediante el filtrado glomerular estimado (FGe), obtenido por la fórmula Chronic Kidney Disease Epidimiology Collaboration (CKD-EPI)8 y la determinación del cociente albúmina/creatinina en la primera orina de la mañana.
Estudios hemodinámicos no invasivosDoce horas antes de la realización de la coronariografía, tras 15 minutos en reposo en decúbito supino, se tomaba la presión arterial (PA) braquial (PAb) (media de tres determinaciones) mediante un Omron M3 IT (Omron electrónica Iberia S.A.U. Madrid).
Para la determinación de la PA central (PAc) se usó el mismo brazo que el de la PAb. La onda de pulso se obtuvo en la arteria radial mediante tonometría de aplanamiento usando un micromanómetro (Millar instruments) conectado a un dispositivo SphygmoCor (AtCor Medical, Sydney, Australia). Para la calibración del sistema, se usaron los valores de PAb. El dispositivo capta una serie de ondas durante 10 segundos; estas son digitalizadas a 128 Hz y ensambladas en una onda promedio. Para convertir la onda de presión radial en presión aórtica (central) el sistema usa una función de transferencia. Solo se aceptaron los registros con un índice de calidad, dado por el propio dispositivo, superior al 85%. Se consideró como valor de los parámetros centrales, el promedio de los derivados de dos registros con buen índice de calidad. De la onda de presión central se obtuvieron la presión sistólica central (PASc), la presión arterial diastólica central (PADc), la presión arterial media central (PAMc), la presión de pulso central (PPc) (diferencia entre PASc y PADc) y el índice de aumento (IA) (diferencia entre el primer y segundo pico sistólico) que se expresa como porcentaje de la PPc. Dado que el IA es influenciado por la frecuencia cardiaca (FC), el sistema aporta el valor de IA normalizado a una FC de 75 L/m (IA75).
Para la determinación de la velocidad de pulso carótida-femoral (Vpc-f) se empleó el mismo dispositivo SphygmoCor. La onda de pulso se obtuvo por tonometría de aplanamiento de forma secuencial sobre la carótida común y la arteria femoral. El tiempo del recorrido entre los dos puntos arteriales se calculó a partir de la diferencia entre la onda R del registro electrocardiográfico simultáneo y el inicio de la onda de pulso en los respectivos sitios arteriales. La distancia entre los dos puntos arteriales se midió cuidadosamente con una cinta métrica, substrayendo la distancia entre el punto carotídeo y la escotadura yugular del manubrio esternal de la distancia entre esta última y el punto femoral. La Vpc-f se calculó de la distancia recorrida por la onda de pulso (m) dividida por el tiempo de retraso (s) entre los dos puntos arteriales. Así la Vpc-f es expresada como metros/segundo (m/s).
Los valores de Vpc-f resultantes se compararon con los de referencia de la Sociedad Europea de Cardiología (SEC), observados en 16.867 sujetos, que tienen en cuenta la edad y la PA, y que usan los valores de Vpc-f obtenidos mediante la medición directa de la distancia entre la arteria carótida y femoral9. Por ello, la distancia sustraída usada por nuestro método, se convirtió en distancia directa por medio de la ecuación10: distancia directa = (0,45 x distancia sustraída) + (0,21 x altura) + 0,08. Dado que el uso de la distancia directa sobreestima la Vpc-f (cuando se obtiene por métodos invasivos o resonancia magnética [RM]), el valor de Vpc-f se multiplicó por 0,811. De la Vpc-f resultante y la Vpc-f de referencia se obtuvo el índice de la Vpc-f, según la SEC (iVpc-fsec) = (Vpc-f medida – Vpc-f de referencia) ÷ (Vpc-f referencia) x 100.
También se calculo el índice teórico de Vpc-f (iVpc-fteórico) que considera otras variables (edad, sexo, PA y FC) que influyen en la Vpc-f. iVpc-f = (Vpc-f medida – Vpc-f teórica) ÷ (Vpc-f teórica) x 100, donde Vpc-f teórica (m/s) = (0,0793 x edad) + (0,0427 x PAM [presión arterial media]) – (0,0014 x período cardiaco [ms]) – (0,415 x sexo) + 2,934 (sexo = 1 hombre; 2 mujer)12.
Usando la misma técnica (salvo los puntos para determinar la distancia), se determinó la velocidad de pulso carótida-radial (Vpc-r) como expresión de la rigidez de arterias musculares periféricas. Se calculó la relación Vpc-f/Vpc-r para valorar el gradiente de rigidez arterial central/periférica13.
La tonometría para la determinación de la hemodinámica central, la Vpc-f y la Vpc-r fue realizada siempre por el mismo investigador (PGF).
CoronariografíaDespués de 12 a 14 horas del ingreso hospitalario, en todos los pacientes se realizó la coronariografía por vía radial o femoral. Todos los angiogramas eran visualizados por un cardiólogo-hemodinamista experto (JOO) que desconocía los resultados de los estudios hemodinámicos no invasivos. Se definió como EC significativa la existencia de, al menos, una lesión con una estenosis ≥ 60%. La extensión de la EC se definió por el número de arterias con obstrucción significativa, considerando las tres arterias coronarias mayores: descendente anterior izquierda, circunfleja y arteria coronaria derecha. La lesión significativa en el tronco coronario izquierdo se consideró como afección de dos arterias.
Análisis estadísticoLas variables categóricas se expresan como frecuencias absolutas y relativas. Las variables cuantitativas como media ± desviación estándar o como mediana (rango intercuartílico [RIQ]), dependiendo de la distribución según el test de Shapiro-Wilk. En algunos casos, las variables no normalmente distribuidas fueron convertidas en sus logaritmos. La comparación de las variables cualitativas entre los grupos se hizo mediante el test X2. Para contrastar las variables continuas normalmente distribuidas se usó el análisis de la varianza (ANOVA) con la prueba de Tukey para comparaciones múltiples post hoc. Para las variables sin distribución normal, se empleó el test de Kruskal-Wallis. El análisis de la relación entre las variables se hizo mediante el coeficiente de correlación de Pearson o Sperman según la distribución de estas. La relación independiente entre variables se investigó mediante regresión lineal múltiple, seleccionando las covariables potenciales que demostraban previamente correlación significativa. Para evaluar los efectos independientes de los parámetros de rigidez arterial en el riesgo de tener EC, se usó la regresión logística por pasos. Se consideró significativo un valor de p < 0,05. Todos los análisis estadísticos se realizaron con el programa estadístico IBM SPSS statistics versión 25 para Windows.
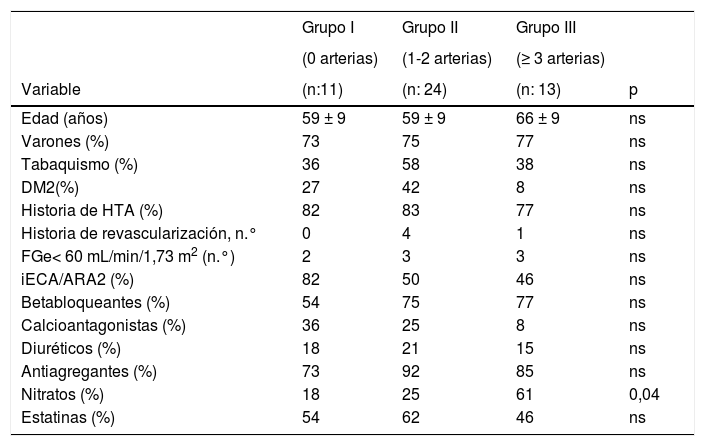
ResultadosLa edad media de los sujetos estudiados fue 61 ± nueve años, 64% eran varones. De los 48 pacientes, 11(23%) no tenían lesiones coronarias significativas (grupo I), 24 (50%) evidenciaron lesiones significativas en una o dos arterias coronarias (grupo II) y 13 (27%) en ≥ tres arterias (grupo III) (tabla 1). No hubo diferencias significativas entre los tres grupos con respecto a la edad, sexo, prevalencia de HTA, DM2, tabaquismo ni insuficiencia renal. El porcentaje de pacientes del grupo III que recibían terapia con nitratos era superior al de los otros grupos.
Parámetros clínicos en los grupos clasificados por el número de arterias coronarias con lesiones significativas
| Grupo I | Grupo II | Grupo III | ||
|---|---|---|---|---|
| (0 arterias) | (1-2 arterias) | (≥ 3 arterias) | ||
| Variable | (n:11) | (n: 24) | (n: 13) | p |
| Edad (años) | 59 ± 9 | 59 ± 9 | 66 ± 9 | ns |
| Varones (%) | 73 | 75 | 77 | ns |
| Tabaquismo (%) | 36 | 58 | 38 | ns |
| DM2(%) | 27 | 42 | 8 | ns |
| Historia de HTA (%) | 82 | 83 | 77 | ns |
| Historia de revascularización, n.° | 0 | 4 | 1 | ns |
| FGe< 60 mL/min/1,73 m2 (n.°) | 2 | 3 | 3 | ns |
| iECA/ARA2 (%) | 82 | 50 | 46 | ns |
| Betabloqueantes (%) | 54 | 75 | 77 | ns |
| Calcioantagonistas (%) | 36 | 25 | 8 | ns |
| Diuréticos (%) | 18 | 21 | 15 | ns |
| Antiagregantes (%) | 73 | 92 | 85 | ns |
| Nitratos (%) | 18 | 25 | 61 | 0,04 |
| Estatinas (%) | 54 | 62 | 46 | ns |
ARA2: antagonistas del receptor de angiotensina II; DM2: diabetes mellitus tipo 2; FGe: filtrado glomerular estimado; HTA: hipertensión arterial; iECA: inhibidores del enzima de conversión de angiotensina; ns: no significativo.
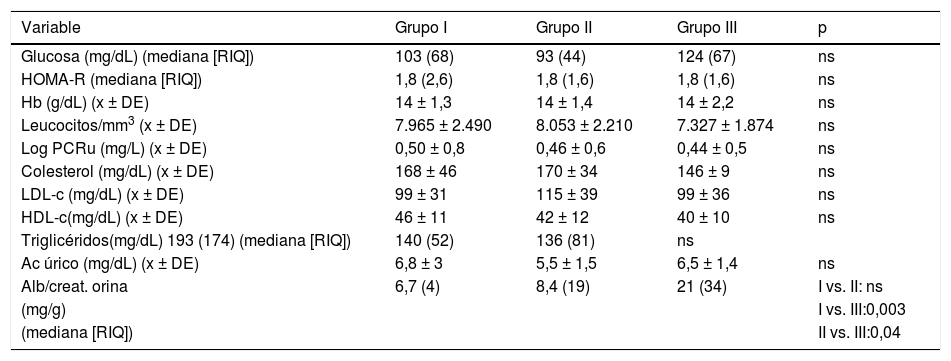
No se observaron diferencias significativas intergrupos en el perfil lipídico, FGe, marcadores de inflamación ni resistencia a la insulina. La excreción de albuminuria, sin embargo, fue significativamente más elevada en el grupo III (tabla 2). Solo cuatro sujetos del grupo II y cinco del grupo III tenían valores de albumina/creatinina ≥ 30 mg/g.
Parámetros de laboratorio
| Variable | Grupo I | Grupo II | Grupo III | p |
|---|---|---|---|---|
| Glucosa (mg/dL) (mediana [RIQ]) | 103 (68) | 93 (44) | 124 (67) | ns |
| HOMA-R (mediana [RIQ]) | 1,8 (2,6) | 1,8 (1,6) | 1,8 (1,6) | ns |
| Hb (g/dL) (x ± DE) | 14 ± 1,3 | 14 ± 1,4 | 14 ± 2,2 | ns |
| Leucocitos/mm3 (x ± DE) | 7.965 ± 2.490 | 8.053 ± 2.210 | 7.327 ± 1.874 | ns |
| Log PCRu (mg/L) (x ± DE) | 0,50 ± 0,8 | 0,46 ± 0,6 | 0,44 ± 0,5 | ns |
| Colesterol (mg/dL) (x ± DE) | 168 ± 46 | 170 ± 34 | 146 ± 9 | ns |
| LDL-c (mg/dL) (x ± DE) | 99 ± 31 | 115 ± 39 | 99 ± 36 | ns |
| HDL-c(mg/dL) (x ± DE) | 46 ± 11 | 42 ± 12 | 40 ± 10 | ns |
| Triglicéridos(mg/dL) 193 (174) (mediana [RIQ]) | 140 (52) | 136 (81) | ns | |
| Ac úrico (mg/dL) (x ± DE) | 6,8 ± 3 | 5,5 ± 1,5 | 6,5 ± 1,4 | ns |
| Alb/creat. orina | 6,7 (4) | 8,4 (19) | 21 (34) | I vs. II: ns |
| (mg/g) | I vs. III:0,003 | |||
| (mediana [RIQ]) | II vs. III:0,04 |
Alb/creat.: albúmina/creatinina; CKD-EPI: Chronic Kidney Disease Epidemiology; Hb: hemoglobina; HOMA-R: homeostatic model assessment insulin resistance; ns: no significativo; PCRu: proteína C reactiva ultrasensible; RIQ: rango intercuartílico; x ± DE: media ± desviación estándar.
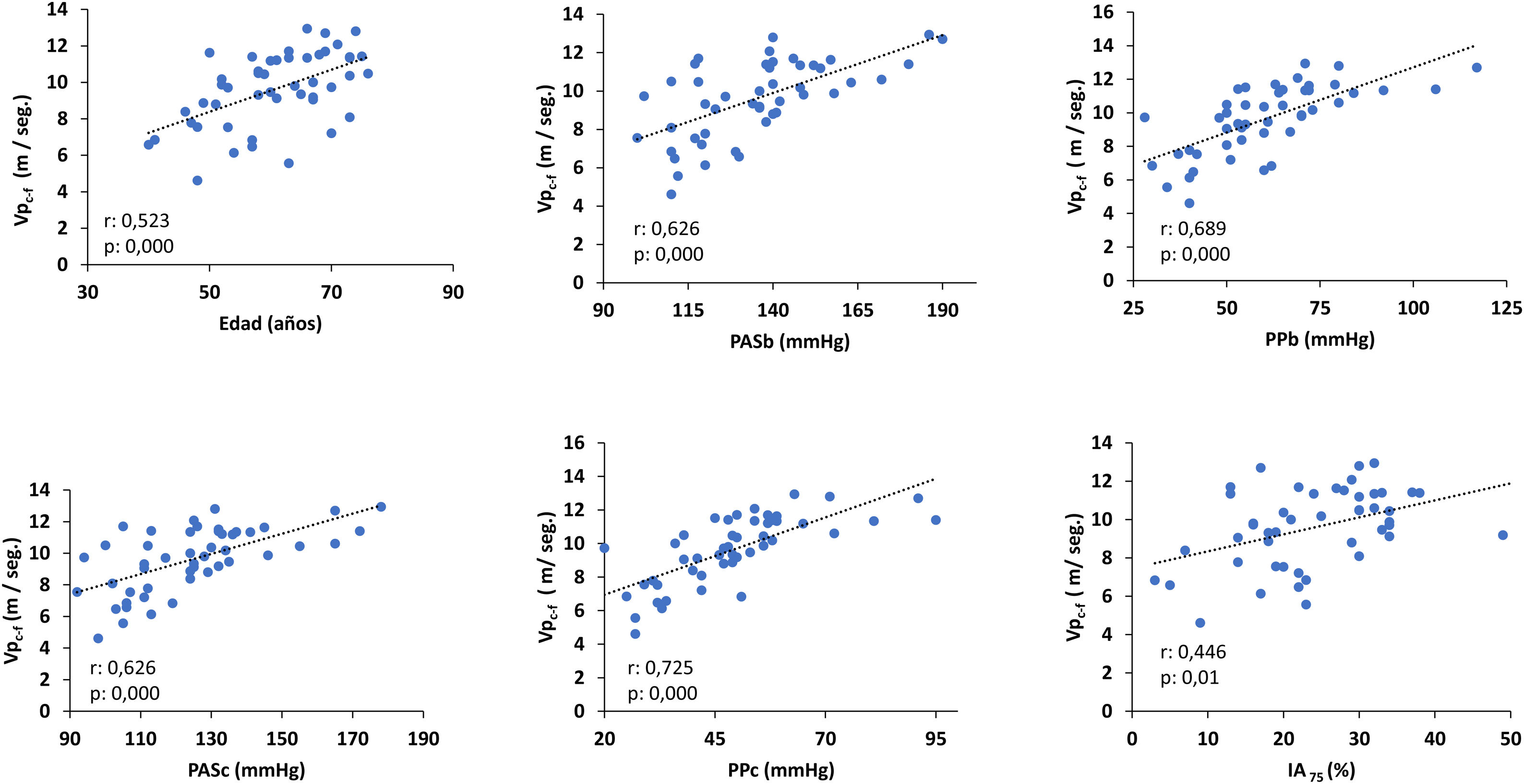
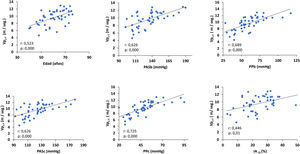
La Vpc-f se correlacionaba directa y significativamente con la edad, la presión arterial sistólica braquial (PASb), la presión de pulso braquial (PPb), PASc, la PPc y el IA75 (fig. 1). Solo la PPc y la edad fueron predictores significativos de la Vpc-f (coeficiente regresión ± ES: 0,09 ± 0,01; ß estandarizado: 0,72, p: 0,000 y 0,76 ± 0,02; ß: 0,35, p: 0,000, respectivamente).
Correlación de la Vpc-f con la edad y los parámetros arteriales.
IA75: índice de aumento normalizado a una frecuencia cardiaca de 75 L/min; PASb: presión arterial sistólica braquial; PASc: presión arterial sistólica central; PPb: presión de pulso braquial; PPc: presión de pulso central; Vpc-f: velocidad de pulso carótida femoral.
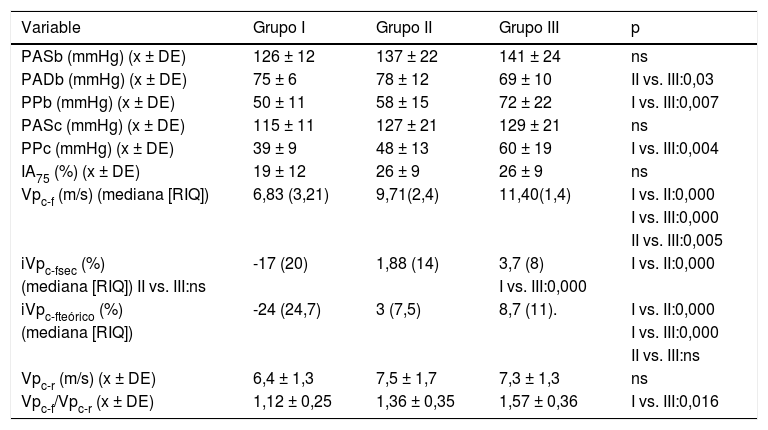
Los parámetros de función arterial en los tres grupos se presentan en la tabla 3. Tanto la PASb como la PASc fueron cuantitativamente más elevadas en los grupos con mayor EC, aunque sin alcanzar significación estadística. El grupo con EC más severa tenía valores de PPb y la PPc mucho más más altos que el grupo sin EC. La Vpc-f y los índices de Vpc-f aumentaban de forma progresiva y significativa con el grado de EC. No hubo diferencias entre los grupos en la Vpc-r, pero el gradiente de rigidez arterial central/rigidez arterial periférica (Vpc-f/Vpc-r) fue mayor en el grupo III.
Parámetros de función arterial
| Variable | Grupo I | Grupo II | Grupo III | p |
|---|---|---|---|---|
| PASb (mmHg) (x ± DE) | 126 ± 12 | 137 ± 22 | 141 ± 24 | ns |
| PADb (mmHg) (x ± DE) | 75 ± 6 | 78 ± 12 | 69 ± 10 | II vs. III:0,03 |
| PPb (mmHg) (x ± DE) | 50 ± 11 | 58 ± 15 | 72 ± 22 | I vs. III:0,007 |
| PASc (mmHg) (x ± DE) | 115 ± 11 | 127 ± 21 | 129 ± 21 | ns |
| PPc (mmHg) (x ± DE) | 39 ± 9 | 48 ± 13 | 60 ± 19 | I vs. III:0,004 |
| IA75 (%) (x ± DE) | 19 ± 12 | 26 ± 9 | 26 ± 9 | ns |
| Vpc-f (m/s) (mediana [RIQ]) | 6,83 (3,21) | 9,71(2,4) | 11,40(1,4) | I vs. II:0,000 |
| I vs. III:0,000 | ||||
| II vs. III:0,005 | ||||
| iVpc-fsec (%) | -17 (20) | 1,88 (14) | 3,7 (8) | I vs. II:0,000 |
| (mediana [RIQ]) II vs. III:ns | I vs. III:0,000 | |||
| iVpc-fteórico (%) | -24 (24,7) | 3 (7,5) | 8,7 (11). | I vs. II:0,000 |
| (mediana [RIQ]) | I vs. III:0,000 | |||
| II vs. III:ns | ||||
| Vpc-r (m/s) (x ± DE) | 6,4 ± 1,3 | 7,5 ± 1,7 | 7,3 ± 1,3 | ns |
| Vpc-f/Vpc-r (x ± DE) | 1,12 ± 0,25 | 1,36 ± 0,35 | 1,57 ± 0,36 | I vs. III:0,016 |
IA75: índice de aumento estandarizado a una frecuencia cardiaca de 75 L/min.; iVPc-f:índice Vpc-f; ns: no significativo; PAD: presión arterial diastólica braquial; PASb: presión arterial sistólica braquial; PASc: presión arterial sistólica central; PPb: presión de pulso braquial; PPc: presión de pulso central; RIQ: rango intercuartílico; sec: Sociedad Europea de Cardiología; Vpc-f: velocidad de pulso carótida-femoral; Vpc-r: velo-cidad de pulso carótida-radial; x ± DE: media ± desviación estándar.
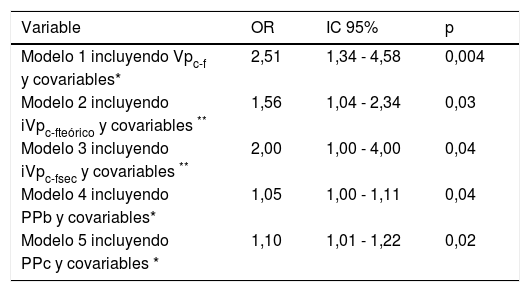
Tras el ajuste a covariables como la edad, el sexo, el tabaquismo, PAM, lipoproteína de baja densidad (LDL-c), DM2 y CKD-EPI, la VPc-f predecía de forma independiente la presencia de EC. El riesgo relativo de EC aumentaba 2,5 veces por cada metro de incremento de la Vpc-f (tabla 4). Pese a que la PPc elevaba el riesgo de EC, este efecto desaparecía cuando se incorporaba en el modelo la Vpc-f. Tanto el iVpc-fteórico como el iVpc-fsec predecían de forma independiente la EC, pero con menor potencia que la Vpc-f (tabla 4).
Predictores de enfermedad coronaria
| Variable | OR | IC 95% | p |
|---|---|---|---|
| Modelo 1 incluyendo Vpc-f | 2,51 | 1,34 - 4,58 | 0,004 |
| y covariables* | |||
| Modelo 2 incluyendo | 1,56 | 1,04 - 2,34 | 0,03 |
| iVpc-fteórico y covariables ** | |||
| Modelo 3 incluyendo | 2,00 | 1,00 - 4,00 | 0,04 |
| iVpc-fsec y covariables ** | |||
| Modelo 4 incluyendo | 1,05 | 1,00 - 1,11 | 0,04 |
| PPb y covariables* | |||
| Modelo 5 incluyendo | 1,10 | 1,01 - 1,22 | 0,02 |
| PPc y covariables * |
IC: intervalo de confianza; OR: odds ratio; PPb: presión de pulso braquial; PPc: presión de pulso central; sec: sociedad europea de cardiología; Vpc-f: velocidad de pulso carótida-femoral; iVpc-f: índice de velocidad de pulso carótida-femoral.
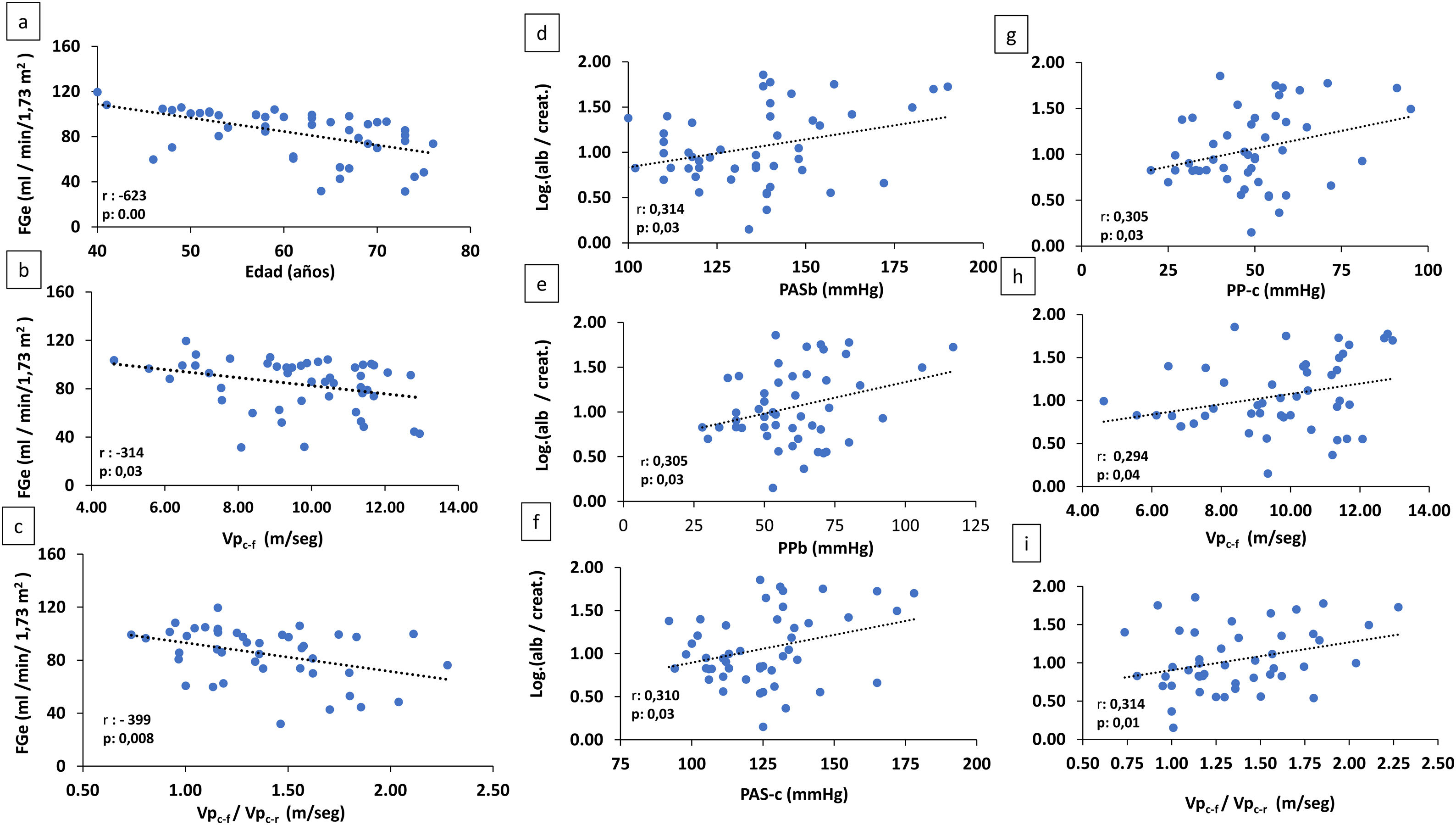
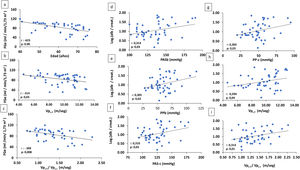
En el análisis conjunto de todos los pacientes, el FGe se correlacionaba de forma negativa y significativa con la edad (r: -623, p: 0,000), la Vpc-f (r: -314, p: 0,03) y el cociente Vpc-f /Vpc-r (r: -399, p: 0,008) (fig. 2).
A-C) Correlación de FGe con la edad y parámetros de rigidez arterial (Vpc-f: velocidad de pulso carótida radial) y cociente Vpc-f/Vpc-r. D-I) Correlación de log alb./creat. con parámetros arteriales.
alb./creat.: albúmina/creatinina en orina; FGe: filtrado glomerular estimado; PASb: presión arterial sistólica braquial; PASc: presión arterial sistólica central; PPb: presión de pulso braquial; PPc: presión de pulso central; Vpc-f/Vpc-r: velocidad de pulso carótida-femoral/velocidad de pulso carótida-radial.
Existía una correlación positiva significativa entre albuminuria y PASb (r: 0,314, p: 0,03), PPb (r: 0,305, p: 0,03), PASc (r: 0,310, p: 0,03), PPc (r: 0,305, p: 0,03) y la Vpc-f (r: 0,294, p: 0,04) y el cociente Vpc-f / Vpc-r (r: 0,314; p: 0,01) (fig. 2).
En el análisis de regresión lineal múltiple, el poder predictor significativo de la Vpc-f sobre el FGe se extinguía cuando se incorporaba en el modelo la edad que sí era predictora independiente del FGe.
La Vpc-f se asociaba a la albuminuria (ß: 0,29, p: 0,04), pero la relación desaparecía cuando en el modelo se introducían los parámetros arteriales condicionados por el aumento de la rigidez arterial (PASb, PASc, PPb y Pc) que sí tenían capacidad predictora de la albuminuria.
El gradiente Vpc-f/Vpc-r se asociaba a la albuminuria independientemente de la PASb, PASc, PPb y PPc (coeficiente ß: 0,31, p: 0,03). La capacidad predictora de estos desaparecía cuando en el modelo se incorporaba el gradiente de rigidez.
Relación entre función arterial y el combinado enfermedad coronaria (EC)-enfermedad renal (ER)Para estudiar esta relación se definió como ER la presencia de un FG < 60 mL/min/1,73 m2 y/o un cociente de albúmina/creatinina en orina ≥ 30 mg/g. Se definieron cuatro grupos: ausencia de EC y de ER (EC-/ER-); presencia de EC y ausencia de ER (EC+/ER-); ausencia de EC y presencia de ER (EC-/ER+); presencia de EC y de ER (EC+/ER+). La Vpc-f en los grupos con EC+/ER+ (n: 12) (11,1 ± 1,6 m/s) y EC+/ER- (n: 25) (9,9 ± 1,4 m/s) fue significativamente mayor (p: 0,000) que la del grupo EC-/ER- (n: 9) (6,9 ± 1,7 m/s). La Vpc-f en el grupo EC-/ER+ fue cuantitativamente superior (9,5 ± 0,4) que la del grupo EC-/ER-, pero la escasa representación numérica de este (n: 2) no permite comparaciones estadísticas.
DiscusiónEl principal hallazgo de nuestro estudio es que en un grupo de pacientes con sospecha de EC estable remitidos para coronariografía, la Vpc-f es mayor cuanto más extensa es la EC y, además, predice de forma independiente la presencia de lesiones coronarias significativas. Por otra parte, en pacientes con EC, el aumento de la Vpc-f y del gradiente de rigidez central/rigidez periférica también puede contribuir al descenso del FGe y al incremento de la albuminuria inducidos, respectivamente, por la edad y por los parámetros arteriales relacionados con el aumento de rigidez central (PAS y PP braquiales y centrales).
La Vpc-f se considera el método de referencia para determinar la rigidez aórtica14. La rigidez arterial se considera un marcador estructural y funcional que puede integrar el efecto de todos los factores de riesgo vascular tradicionales conocidos y es un predictor de mortalidad y de eventos CV15,16.
En nuestro estudio, la Vpc-f no indexada fue significa y progresivamente mayor en los sujetos con mayor extensión de EC. Es de destacar que esto ocurrió, pese a que el grupo III, con lesión en tres o más arterias, era el que recibía mayor tratamiento con nitratos que pueden disminuir la rigidez arterial17.
Dado que la edad, el sexo y la PA son importantes determinantes de la Vpc-f, usamos el iVpc-fteórico y el iVpc-fsec que integran estos factores para valorar el efecto predictivo independiente de la rigidez aórtica sobre la presencia de EC. Aunque el riesgo disminuía en relación con el obtenido cuando se consideraba la Vpc-f sin indexar (odds ratio [OR] [IC 95%]: 1,56 [1,04 a 2,34] y 2,00 [1,00 a 4,00) vs. 2,51 [1,34 a 4,58], respectivamente), persistía su valor predictivo significativo que también era independiente de los otros factores de riesgo vascular tradicionales. Este hecho suscita la posibilidad de que la rigidez aórtica recapitule el efecto que tiene la exposición vascular durante tiempo a factores de riesgo tradicionales conocidos y, posiblemente, a otros desconocidos, sobre la estructura y función vascular.
Otros estudios han demostrado asociación entre Vpc-f y aterosclerosis coronaria y una relación entre Vpc-f y la presencia y severidad de EC demostrada por coronariografía, así como su capacidad predictiva independiente de EC18–22.
Son varios los mecanismos por los que el aumento de la rigidez aórtica puede inducir isquemia miocárdica y EC. Una mayor velocidad de pulso favorece el retorno precoz de la onda refleja y un mayor IA. Consecuentemente, se produce elevación de la PASc, disminución de la PAD y aumento de la PP. Como resultado de estos cambios, aparecen hipertrofia cardiaca e isquemia del miocardio cuya perfusión se produce predominantemente durante la diástole23,24. En nuestro estudio, observamos valores de IA75 y PASc cuantitativamente mayores en el grupo con EC que, sin embargo, no alcanzaron significación estadística, probablemente por el número reducido de casos, y un aumento importante de la PPb y PPc en los sujetos con mayor carga de EC.
Este incremento de la pulsatilidad también puede contribuir a la aterosclerosis. Muchas evidencias experimentales y datos clínicos soportan la participación del componente pulsátil de la PA en la génesis de la aterosclerosis. En animales de experimentación, el aumento de la PP favorece la activación de fenómenos proinflamatorios y el influjo de lipoproteínas de baja densidad oxidadas en la pared arterial25. En modelos experimentales de aterosclerosis, la distensión cíclica de la pared arterial estimula la proliferación celular y la captación de lípidos por la pared vascular26. Células endoteliales sometidas a una fuerza cíclica aumentan la expresión de selectinas y moléculas de adhesión intercelular (ICAM-1), la adhesión de monocitos y la producción de anión superóxido27,28.
Otros estudios han documentado que la PPc y la PPc normalizada a la PAM (pulsatilidad aórtica) se relacionan con la presencia y extensión de EC incluso tras el ajuste a otros factores de riesgo29,30. Una mayor PP también se asocia con enfermedad arterial periférica independiente de la edad, tabaquismo, DM y dislipemia31. En el presente trabajo, la PPc y la PPb también se mostraron como predictores de la existencia de EC, independientemente de otros factores de riesgo. El aumento de la pulsatilidad arterial contribuye a la aterosclerosis y esta aumenta la rigidez arterial y la PP, estableciéndose así una relación bidireccional32.
El aumento de la rigidez arterial central propicia lesiones macrovasculares en el lecho coronario y también puede inducir daño microvascular a nivel renal. En nuestro estudio, se evidenció una correlación significativa inversa del FGe con la edad y la Vpc-f. En la regresión, se observó que la Vpc-f tenía poder predictivo del FGe, sin embargo, este desaperecía cuando en el modelo se incorporaba la edad. Nuestros datos sugieren que el principal determinante del FGe en la población estudiada es la edad que puede ejercer su efecto deletéreo sobre el FG por los cambios en la rigidez arterial inherentes al envejecimiento. Es posible, no obstante, que la ausencia de una asociación independiente entre rigidez arterial y FG en nuestro estudio esté condicionada por la reducida representación de sujetos con deterioro significativo del FG (solo el 16% de los pacientes estudiados tenían basalmente un FGe < 60 mL/min/1,73 m2).
El aumento de la rigidez y de la presión pulsátil aórticas inherente al envejecimiento o potenciado por la presencia de factores de riesgo vascular condiciona cambios estructurales y hemodinámicos a nivel microvascular renal que pueden producir isquemia y descenso del FG. Se ha demostrado una asociación positiva entre el índice de resistencia renal medido por ecografía-doppler y la rigidez aórtica, y una correlación negativa con el FG33. Así, el aumento de resistencia intrarrenal no solo sería una patología intrínseca renal, sino que también sería una adaptación fisiopatológica al incremento de la pulsatilidad vinculado con una mayor rigidez aórtica.
En los enfermos con ERC con reducción severa del FG hay un aumento consistente de la Vpc-f34,35. Sin embargo, en situación de insuficiencia renal ligera-moderada, los estudios transversales que han analizado la relación entre rigidez arterial aórtica y FG han aportado resultados variables. En algunos, se evidenció una asociación de las dos variables independiente de otros factores de riesgo36,37, en otros, la relación no era independiente38–40 y en algunos, la magnitud de la relación entre Vpc-f y FG disminuía de forma considerable cuando en el modelo se incorporaba la edad (OR 1,38 [IC 95% 1,33 a 1,43] vs. 1,13 [IC 95% 1,08 a 1,18])41. Es posible que la variabilidad de resultados dependa de las diferencias en las poblaciones estudiadas y en los métodos de determinación de rigidez arterial, y de los distintos ajustes a covariables. En otros estudios longitudinales se comprobó que el aumento de la rigidez aórtica era determinante de un deterioro más rápido del FG y de una mayor incidencia de ERC40–44. Así, se puede concluir que el aumento de la rigidez aórtica, de forma directa o como mediador de otros factores de riesgo, entre ellos la edad, se vincula con menor FG.
Además del descenso del FG, otro parámetro que define la ERC es la albuminuria. En nuestro estudio se observa que los enfermos con mayor grado de EC eran los que presentaban mayor excreción urinaria de albúmina. Comprobamos una correlación directa entre albuminuria, rigidez arterial y parámetros de función arterial relacionados con aquélla, como son la PASb, PASc, la PPb y la PPc. En el análisis de regresión, la asociación significativa entre la Vpc-f y albuminuria desaparecía cuando se incluía en el modelo la PSb, PASc, PPb o la PPc, lo que sugiere la mediación de estos en la albuminuria relacionada con el aumento de la rigidez arterial. El incremento de la pulsatilidad y la trasmisión de la PAS no amortiguada por una aorta rígida al glomérulo, sobre todo en presencia de una alteración de la autorregulación renal, como puede ocurrir en caso de coexistencia de nefropatía o de factores de riesgo vascular, puede inducir hiperperfusión glomerular, disfunción endotelial, aumento de la permeabilidad glomerular y de la excreción urinaria de albúmina, y, a largo plazo, daño estructural glomerular. En nuestro estudio, comprobamos, en el grupo con más EC, un aumento de la relación Vpc-f/Vpc-r. Por otra parte, la relación Vpc-f/Vpc-r se correlaciona positiva y significativamente con la albuminuria y, además, mostraba una capacidad predictora independiente sobre la misma. Un mayor Vpc-f/Vpc-r expresaría un aumento de la rigidez aortica en relación con la rigidez de arterias musculares periféricas. Este incremento del gradiente de rigidez central/rigidez periférica induciría una mayor transferencia de la energía pulsátil a arterias más pequeñas y a la microcirculación renal13,45.
Muchos estudios han demostrado una asociación entre albuminuria y la morbimortalidad CV, y una relación entre albuminuria y presencia y severidad de EC independiente de otros factores de riesgo vascular46–48. Igual que lo observado en el presente trabajo, otros estudios transversales han comprobado un vínculo entre la rigidez arterial y albuminuria, incluso con valores inferiores a los considerados como microalbuminuria40,49,50. Esta observación es importante, ya que la relación entre el riesgo CV y la albuminuria no es dicotómica sino contínua51.
Nuestro estudio tiene algunas debilidades: un número reducido de enfermos que puede haber condicionado el poder estadístico de algunas comparaciones, el carácter transversal que no permite analizar el impacto pronóstico de la rigidez arterial en eventos cardiorrenales, y la toma por parte de todos los enfermos de fármacos que pueden influir en la rigidez arterial. El hecho de que todos los pacientes incluidos tenían diagnóstico previo de EC estable, excluyéndose los eventos coronarios agudos, la posibilidad de hacer análisis de predicción de asociación transversal y la ausencia de diferencias significativas entre los grupos en los medicamentos recibidos (la toma de nitratos, fármacos que pueden reducir la rigidez arterial, era superior en el grupo con mayor EC y con mayor rigidez aórtica) pueden atenuar las limitaciones señaladas.
El estudio tiene también, a nuestro entender, algunas fortalezas: el diseño previo a su ejecución, la realización del análisis de la función arterial y de la coronariografía por parte de dos investigadores diferentes y desconocedores de los resultados de la prueba que no efectuaban, y el uso de la Vpc-f como método de estudio de la rigidez aórtica. Esta técnica es reconocida como procedimiento adecuado para estudiar la relación entre la rigidez arterial y los eventos CV52.
De nuestro estudio se deduce una interacción dinámica entre función aórtica-EC, y entre función aórtica-función renal, y permite afirmar que el aumento de la rigidez aórtica puede constituir uno de los mecanismos subyacentes del daño macro y microvascular en la EC. La comprobación en nuestro estudio de una Vpc-f cuantitativa y significativamente mayor cuando se combina EC y ER refuerza esta afirmación.
También se derivan algunas aplicaciones para la práctica clínica. La determinación de la Vpc-f podría complementar a otras pruebas de estudio de isquemia miocárdica para reducir coronariografías innecesarias como se ha demostrado en otro trabajo22. Por otra parte, la Vpc-f puede considerarse no solo como biomarcador para una mejor estratificación de riesgo de eventos cardiacos y renales, sino también como potencial diana terapéutica para reducir eventos cardio-renales. Diversos agentes terapeúticos (bloqueantes del sistema renina-angiotensina, las estatinas, los antialdosterónicos y los inhibidores del cotransportador sodio-glucosa [iSGLT2], entre otros) han demostrado capacidad para reducir la rigidez arterial aórtica53–56.
Conclusiones- 1.
En pacientes sometidos a coronariografía por sospecha de EC estable, la Vpc-f, expresión de la rigidez aórtica, se asocia de forma independiente con la existencia de EC y se relaciona con su extensión.
- 2.
El aumento de la rigidez aórtica se asocia con un incremento de los parámetros de la pulsatilidad arterial.
- 3.
El aumento de la rigidez arterial participa en la disminución del FGe que acompaña al envejecimiento y subyace como mecanismo patogénico en el aumento de la albuminuria inducido por una mayor carga pulsátil. Esta mayor carga pulsátil se trasmitiría con mayor facilidad a la microcirculación renal debido a un aumento del gradiente de rigidez central/periférica.
- 4.
En pacientes con EC, el aumento de la rigidez aórtica que podría integrar el efecto, a lo largo del tiempo, de factores de riesgo vascular conocidos y desco-nocidos, puede constituir uno de los mecanismos subyacentes del daño macro y microvascular.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.