Las estatinas han demostrado que reducen la morbilidad y mortalidad cardiovascular en la población general. Además de su efecto hipocolesterolemiante, las estatinas tienen otros efectos pleiotrópicos protectores del sistema cardiovascular. Sin embargo, existe un gran debate sobre el efecto de las estatinas en el riesgo cardiovascular en pacientes con ERC. Además, está poco claro si las estatinas retrasan la progresión de la ERC y qué efecto tienen estos fármacos sobre la proteinuria. Esta revisión se centrará en las alteraciones lipídicas presentes en la ERC y los posibles efectos de las estatinas en este grupo poblacional sobre la inflamación, la progresión de la ERC, la proteinuria y el riesgo cardiovascular.
Statins have been shown to reduce cardiovascular morbidity and mortality in the general population. In addition to their cholesterol-lowering effect, these drugs have other protective pleiotropic effects on the cardiovascular system. However, the effect of statins on cardiovascular risk in patients with chronic renal disease (CRD) is controversial. Moreover, the question of whether statins delay the progression of CRD and the effect of these drugs on proteinuria remain to be elucidated. The present review discusses the lipid alterations present in CRD and the possible effects of statins on inflammation, CRD progression, proteinuria and cardiovascular risk in this population group.
Los inhibidores de la enzima reductasa 3-hidroxi-3-metilglutaril coenzima A2 (estatinas) han demostrado que reducen la morbilidad y la mortalidad cardiovascular en la población general. Consideradas en primer lugar como drogas hipocolesterolemiantes, las estatinas, sin embargo, además de su efecto en el colesterol plasmático, tienen otros efectos protectores del sistema cardiovascular que se han observado en los últimos años. Entre estos efectos llamados pleiotrópicos destacan sus propiedades antiinflamatorias, que regulan la expresión de la proteína 1 quimiotáctica de los monocitos (MCP-1) y varias interleucinas, así como también disminuyen la expresión de moléculas de adhesión en las células endoteliales. Las estatinas pueden inhibir la adhesión leucocitaria mediante interacción con el antígeno de función leucocitaria (LFA-1) e inactivan factores de transcripción, como el factor nuclear kappa B (NF-κB).
Por otra parte, las estatinas regulan la síntesis de isoprenoides a través de la vía del mevalonato y reducen la formación de proteínas isopreniladas y geranilgeraniladas. Mediante la prenilación de pequeñas proteínas, estos compuestos promueven interacciones membrana y proteínaproteína e influyen señales de numerosas vías inflamatorias. Esta inhibición de la isoprenilación previene la translocación de membrana y la activación de Rho afectando a varias funciones celulares y produciendo efectos en la adhesión leucocitaria, la proliferación celular/apoptosis, la actividad fibrinolítica y la producción de la sintasa endotelial del óxido nítrico (eNOS)1.
La amplia bibliografía publicada sobre este tema en los últimos años demuestra claramente que el efecto beneficioso en la morbimortalidad cardiovascular de las estatinas asocia una disminución de las concentraciones plasmáticas de biomarcadores inflamatorios, entre los que destaca la proteína C reactiva (PCR)2. Sin embargo, desde un punto de vista clínico, no es posible diferenciar el efecto beneficioso obtenido a través de la reducción de las concentraciones de colesterol frente a los beneficios antiinflamatorios en la progresión de la arteriosclerosis. Por ello, el beneficio clínico de estos fármacos debe considerarse, mientras no se obtengan otras evidencias, como una combinación de ambos efectos: la reducción en las concentraciones de colesterol unido a lipoproteínas de baja densidad (cLDL) y los efectos pleiotrópicos.
El riesgo de mortalidad cardiovascular aumenta de forma progresiva cuando disminuye la función renal. Por ello, factores modificables, como la dislipemia, deben tratarse de forma agresiva en esta población. Sin embargo, hay un gran debate sobre el efecto de las estatinas en el riesgo cardiovascular en pacientes con enfermedad renal crónica (ERC). Además, está poco claro si las estatinas retrasan la progresión de la ERC y qué efecto tienen estos fármacos en la proteinuria.
La actual bibliografía de que disponemos no ofrece evidencias suficientes para indicar el uso de estatinas en pacientes con ERC, principalmente porque carecemos de estudios diseñados y aleatorizados para este fin y los ensayos clínicos realizados en población general excluyen a los pacientes con ERC3. A pesar de ello, las guías sobre el tratamiento de las dislipemias en pacientes con ERC se publicaron (K/DOQI) en el año 2003, a partir de estudios realizados en población con riesgo cardiovascular alto4.
A lo largo de esta revisión nos centraremos en diferentes aspectos sobre el tratamiento con estatinas en pacientes con ERC: a) potenciales mecanismos beneficiosos renales de las estatinas; b) alteraciones lipídicas en la ERC; c) lípidos y progresión de la ERC; d) efecto de las estatinas en el daño renal: proteinuria y progresión de la ERC; e) efecto antiinflamatorio de las estatinas en pacientes con ERC; f) evidencias en el tratamiento con estatinas en pacientes con ERC estadio 5; g) evidencias en el tratamiento de los pacientes con ERC leve o moderada (estadios 1–4), y h) seguridad en el uso de estatinas en pacientes con ERC.
Potenciales mecanismos beneficiosos renales de las estatinasSe han propuesto varios mecanismos para explicar el efecto beneficioso renal de las estatinas (tabla 1). No está claro si el mecanismo beneficioso se relaciona con el efecto hipolipemiante o con los efectos pleiotrópicos.
Potenciales efectos beneficiosos renales de las estatinas
| Inhibición de la proliferación mesangial |
| Inhibición del TGFB y el aumento de matriz extracelular |
| Inhibición de la inducción de MCP-1 |
| Disminución de la infiltración de macrófagos |
| Disminución de la inflamación y el estrés oxidativo |
| Reducción del daño podocitario |
| Efectos hemodinámicos en la función endotelial y vasodilatación |
| Reducción de la enfermedad renal vascular |
MCP-1: proteína 1 quimiotáctica de los monocitos;
TGFB: factor de crecimiento tumoral B.
Las células mesangiales se unen y captan lipoproteínas de baja densidad (LDL), LDL-oxidada y lipoproteínas de densidad intermedia a través de los receptores. La LDL también se une a la matriz extracelular cuando su concentración es alta. Coritsidis et al5 demostraron que la LDL estimula la proliferación mesangial, mientras que la LDL-oxidada es citotóxica en cultivos celulares. Por lo tanto, es posible que los efectos beneficiosos de las estatinas se deban a su efecto en la concentración de lipoproteínas.
La inhibición de la reductasa HGM-CoA no afecta únicamente a la síntesis de colesterol, sino que también influye en la "vía del mevalonato" que regula la síntesis de isoprenoides, como el farnesil pirofosfato (FPP) y el geranilgeranil pirofosfato (GGPP). Muchos estudios enfatizan la importancia de estos compuestos en la fisiopatología de la arterioesclerosis6, a través de la prenilación de pequeñas proteínas unidas a GTP, como Rho, Ras y Rac. El término "prenilación" describe la adición covalente de farnesil o geranilgeranil a la cisteína residual de las proteínas. Esta modificación postranslaccional promueve interacciones membrana y proteína-proteína, e influye señales de numerosas vías inflamatorias7,8. Las estatinas reducen la formación de proteínas isopreniladas y geranilgeraniladas e interfieren en la vía del mevalonato. Por otra parte, la adición de geranilgeranil exógeno y/o farnesil pirofosfato puede revertir efectos antiinflamatorios de las estatinas. Estos efectos influyen en la adhesión leucocitaria9,10 la proliferación celular/apoptosis11, la actividad fibrinolítica y la producción de la eNOS12. Todos estos efectos se producen bloqueando la geranilgeranilación de Rho.
La mayoría de los estudios experimentales apoyan el efecto antiinflamatorio de las estatinas. De hecho, numerosos estudios demuestran un efecto beneficioso antiinflamatorio independiente del efecto hipolipemiante en el desarrollo, la progresión y las complicaciones de la arterioesclerosis13. En la fase temprana de la arterioesclerosis se puede observar una interacción entre los leucocitos y las células endoteliales, así como una acumulación de células inflamatorias en el espacio subendotelial. Las estatinas interfieren en este proceso inflamatorio, con la disminución de la expresión de moléculas de adhesión en las células endoteliales, así como la de integrinas en los monocitos14. Estas sustancias inhibidoras de la HGM-CoA reductasa también regulan la expresión y función de la MCP-1, varias interleucinas y regulador de la activación de las células T normales expresadas y segregadas (RANTES) expresado en monocitos cultivados y células endoteliales15,16. Además, las estatinas pueden inhibir de forma selectiva la adhesión leucocitaria mediante interacción directa con el antígeno 1 de función leucocitaria (LFA-1)17. Estas acciones de las estatinas, independientes de su efecto hipolipemiante, se extienden más allá de su interacción con el LFA-1. La atorvastatina reduce de forma significativa la infiltración inflamatoria, inhibe la respuesta inmune TH, y disminuye la proliferación de células T en un modelo murino de enfermedad autoinmune18. Este efecto puede depender también de la capacidad de las estatinas para inducir la liberación de citocinas promovidas por TH2 (IL-4 e IL-10) que tienen propiedades antiaterogénicas, así como para reducir la secrección de las del subtipo TH119,20.
Entre los mecanismos que incrementan la expresión de eNOS por las estatinas, se ha descrito la inducción directa de la expresión de eNOS mediante la activación de la cinasa 3 fosfatidilinositol y también a través de la vía de la proteín cinasa Akt21. Esta señal parece influir en otros efectos de las estatinas, como la angiogénesis (vía diferenciación de células progenitoras endoteliales)22, la apoptosis (probablemente a través de p21 (Wif1/Cip1) y de p27 (Kip1)23 o del factor de expresión tisular (a través de la señal de Rho). Otros estudios recientes indican que las estatinas pueden producir efectos beneficiosos en la arterioesclerosis, con la disminución de la actividad de NF-κB y de AP-1, que están implicadas en un amplio espectro de acciones inflamatorias, claramente relacionadas con la enfermedad arterioesclerótica24,25. Estudios recientes indican que las estatinas podrían inhibir NF-κB no sólo directamente, sino también a través de la modulación de los receptores activados de proliferación de los peroxisomas (PPAR) y,a y p26,27. Esta familia de receptores nucleares son capaces de modular numerosos procesos inflamatorios que caracterizan la aterogenia28.
Además de en los estudios experimentales, el efecto antiinflamatorio de las estatinas se ha demostrado en algunos estudios realizados en pacientes con ERC estadio 5 en hemodiálisis29,30. En pacientes con ERC moderada, los datos disponibles son bastante escasos31. Nuestro grupo realizó un estudio en pacientes con ERC estadio 3–4 en el efecto antiinflamatorio de las estatinas, demostrando que 20 mg de atorvastatina disminuye los valores de proteína C reactiva, interleucina 1B y factor de necrosis tumoral alfa a los 6 meses de tratamiento, independientemente del descenso de los valores de colesterol32.
Alteraciones lipídicas en la enfermedad renal crónicaLa dislipemia en la ERC se caracteriza por un aumento de triglicéridos y descenso del colesterol unido a lipoproteínas de alta densidad (cHDL)33. En ausencia de proteinuria, cLDL y colesterol total no suelen modificarse; sin embargo, hay cambios en la composición de lipoproteínas. La disminución del catabolismo de triglicéridos conduce a un aumento de las partículas remanentes y unas LDL ricas en triglicéridos34. Estos hallazgos son más evidentes en los pacientes con nefropatía diabética35. También hay un aumento de LDL pequeñas densas y LDL-oxidada, las cuales aumentan la aterogenicidad36. En el síndrome nefrótico, hay un aumento en colesterol total y cLDL, y el grado de colesterol se correlaciona directamente con el grado de albuminuria e, indirectamente, con el grado de albúmina sérica37.
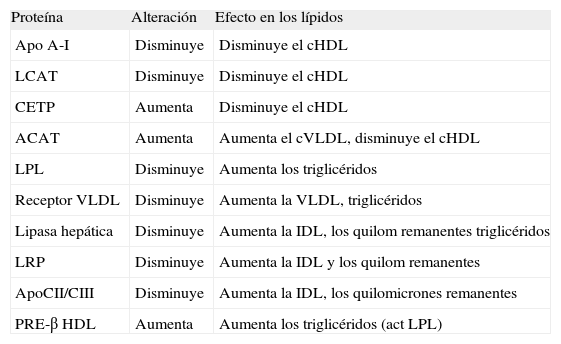
Por lo tanto, en la ERC hay alteraciones importantes en la regulación del metabolismo de las lipoproteínas (tabla 2)38. La dislipemia se desarrolla durante los estadios iniciales de la ERC y, normalmente, los cambios en las lipoproteínas preceden a los cambios en los lípidos plasmáticos39. La disminución de las concentraciones de apoproteína (Apo) A-I y Apo A-II desempeñan un papel importante en la disminución de los valores de cHDL. Otro factor que contribuye a los valores bajos de cHDL es la inflamación crónica que está presente en estos pacientes. La inflamación crónica disminuye los valores de albúmina, y la albúmina sirve de transportador del colesterol libre desde los tejidos periféricos a las partículas HDL40.
Alteraciones de las lipoproteínas en la ERC
| Proteína | Alteración | Efecto en los lípidos |
| Apo A-I | Disminuye | Disminuye el cHDL |
| LCAT | Disminuye | Disminuye el cHDL |
| CETP | Aumenta | Disminuye el cHDL |
| ACAT | Aumenta | Aumenta el cVLDL, disminuye el cHDL |
| LPL | Disminuye | Aumenta los triglicéridos |
| Receptor VLDL | Disminuye | Aumenta la VLDL, triglicéridos |
| Lipasa hepática | Disminuye | Aumenta la IDL, los quilom remanentes triglicéridos |
| LRP | Disminuye | Aumenta la IDL y los quilom remanentes |
| ApoCII/CIII | Disminuye | Aumenta la IDL, los quilomicrones remanentes |
| PRE-β HDL | Aumenta | Aumenta los triglicéridos (act LPL) |
act LPL: actividad de lipoproteinlipasa; Apo: apoproteínas; CETP: estercolesterol transferasa; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; cVLDL: colesterol unido a lipoproteínas de muy baja densidad; ERC: enfermedad renal crónica; HDL: lipoproteínas de alta densidad; IDL: lipoproteína de densidad intermedia; LCAT: acilcolesterol transferasa; LDL: lipoproteína de baja densidad; LPL: lipoproteinlipasa; LRP: receptores de lipoproteínas de baja densidad; quilom: quilomicrones; VLDL: lipoproteína de muy baja densidad.
El aumento de los triglicéridos se puede explicar, en parte, por los aumentos en los valores de Apo C-III. La Apo C-III es un potente inhibidor de la lipoproteinlipasa, que es la causa de la degradación de las partículas ricas en triglicéridos41. La hipertrigliceridemia se ha relacionado con un aumento de riesgo cardiovascular por el aumento de lipoproteínas remanentes, formadas principalmente por colesterol unido a lipoproteínas de muy baja densidad. Esta molécula que no se mide de forma habitual, se puede estimar calculando el colesterol no-HDL (restar el cHDL al colesterol total). De hecho las K/DOQI en sus recomendaciones de tratamiento incluyen el colesterol no-HDL en sus algoritmos4.
Asociación de hiperlipemia y progresión de la enfermedad renal crónicaEl hallazgo de que la dieta rica en colesterol induce o acelera el daño renal data de la década de 196042. La mayoría de estudios experimentales sobre el daño renal de lípidos se ha basado en el daño de las células mesangiales, aunque hay algunos estudios sobre daño podocitario43.
Excepto para enfermedades hereditarias, como el déficit de lecitín-colesterol aciltransferasa44, la enfermedad renal no es una característica común en la hiperlipemia. Pero sí parece que la hiperlipemia acelera el daño renal después de un daño glomerular en estudios experimentales. Sin embargo, los datos en humanos para esta hipótesis no son contundentes45. Valores altos de cLDL predicen el desarrollo de microalbuminuria en pacientes con diabetes mellitus tipo 146. En un pequeño estudio epidemiológico, en pacientes con nefropatía diabética o glomerular, la hiperlipemia predijo el deterioro rápido de la función renal47. Samuelsson et al48, en un estudio de 73 individuos con enfermedad renal no diabética, demostraron que los valores basales de cLDL predecían la tasa de cambio en el filtrado glomerular, independientemente de la proteinuria basal. Krolewski et al49 evaluaron los predictores de deterioro de la función renal en 424 individuos con diabetes mellitus tipo 1 y proteinuria. El colesterol total fue un predictor en el deterioro de la función renal tras 3 años de seguimiento, independientemente del control de la presión arterial, pero sin controlar el grado de proteinuria. En el estudio RENAAL, el colesterol total (hazard ratio [HR] = 1,96 por cada 100 mg/dl) y el cLDL (HR = 1,47 por cada 50 mg/dl) se asociaron con un riesgo alto de progresión a ERC terminal, aunque tampoco está claro si estos datos fueron independientes del grado de proteinuria50. Por lo tanto, en el momento actual, no se conoce si la hiperlipemia sería simplemente un marcador de enfermedad subyacente más severa, más que un mediador de progresión.
Papel de las estatinas en la proteinuria y en la progresión renalEn modelos animales de ERC, el tratamiento con una estatina disminuye la proteinuria y disminuye el daño renal51. La evidencia del efecto de estatinas en la pérdida del FG en estudios humanos es bastante débil. En una búsqueda exhaustiva de la bibliografía, se encuentran 25 estudios aleatorizados que analizan el papel de las estatinas en la progresión de la insuficiencia renal; sin embargo, estos ensayos tienen un número pequeño de pacientes, son de corta duración, algunos sin un grupo control, y otros, subanálisis de grandes ensayos que no fueron diseñados para ese objetivo. El estudio que mostró un beneficio mayor fue el GREACE (Greek Atorvastatin and Coronary Heart Disease Evaluation)52. Este trabajo aleatorizó a los individuos tratados con atorvastatina en 2 grupos: uno con LDL < 100 mg/dl y otro grupo con valores estándar. En el primer grupo, el aclaramiento de creatinina mejoró en un 11,6% (76 ± 13 a 84 ± 8 ml/min) frente a una disminución del aclaramiento en el grupo de tratamiento estándar (77 ± 12 a 74 ± 11 ml/min). Esta diferencia no se explicó por diferencias en el control de la presión arterial o en el uso de inhibidores del sistema renina-angiotensina-aldosteron (SRAA). Sin embargo, otros grandes estudios no han mostrado beneficio de la estatinas en relación con estos temas.
Sandhu et al53 realizan un metaanálisis y concluyen que la simvastatina reduce la tasa de pérdida de filtrado glomerular (FG) en un 1,2 ml/min/año en relación con placebo. Es importante también diferenciar los subgrupos de análisis donde se ha estudiado su efecto. Ya que sólo en el subgrupo de pacientes con enfermedad cardiovascular este efecto se ha confirmado, no siendo así en el subgrupo de pacientes con diabetes mellitus, glomerulonefritis o hipertensión arterial. También hay que tener en cuenta que en estos ensayos clínicos con una gran n, las pequeñas diferencias tienen relevancia estadística. En el TNT Study54 se analiza a 10.000 pacientes con enfermedad coronaria aleatorizados a recibir 10 frente a 80 mg de atorvastatina. En ambos grupos se observó una mejoría en el FG, pero el cambio fue mayor en el grupo de pacientes que recibió más dosis de atorvastatina (3,5 ± 0,14 frente a 5,2 ± 0,14 ml/min por 1,73 m2).
En otro metaanálisis recientemente publicado se analiza la asociación entre el uso de estatinas y la reducción de proteinuria55. En él se indica que las estatinas no cambian la albuminuria en individuos con valores bajos de albúminuria de forma basal (< 30 mg/día). Estos datos son similares a los analizados por Tonelli et al56 en el estudio CARE, en el que se observó que el freno de la progresión en la enfermedad renal fue mayor en pacientes con proteinuria y con un FG menor de 40 ml/min basalmente.
Todos estos resultados indican que el beneficio real de las estatinas depende de la presencia de afectación glomerular intrínseca.
En 4 estudios se ha analizado el efecto de las estatinas en la proteinuria en pacientes tratados con bloqueadores del SRAA. En el estudio PREVEND-IT57 se aleatorizó a los individuos con microalbuminuria a recibir fosinopril y pravastatina. En este estudio, el fosinopril disminuyó la proteinuria, pero la pravastatina no lo hizo. Se realizaron otros 2 estudios en pacientes con macroalbuminuria, en los que la estatina disminuyó la proteinuria en un mayor grado que el placebo58,59. Lee et al60 publicaron recientemente un estudio de seguimiento, donde la pravastatina se suspendió en la mitad de los pacientes y el resto siguió tratándose durante 6 meses. La proteinuria permaneció estable en los pacientes que continuaron con tratamiento, mientras que volvió a valores basales en los pacientes en los que se suspendió el tratamiento.
El metaanálisis de Strippoli et al61 intenta determinar si el tratamiento con estatinas mejora el pronóstico cardiovascular y/o la progresión de la enfermedad renal en pacientes con diferentes grados de ERC. Los autores recogen 50 estudios en los que se compara el tratamiento con estatinas, con placebo u otras estatinas en pacientes con ERC (30.144 en total). Su principal conclusión es que las estatinas reducen los valores lípidicos y episodios cardiovasculares en pacientes con ERC, pero no tienen efecto en la mortalidad global y tampoco se demuestra un efecto renoprotector. La limitación más importante de este estudio es la importante heterogenecidad de los trabajos y una definición muy amplia de ERC (estadios muy diferentes de ERC, diálisis, trasplantes, pacientes con proteinuria y sin ella). A pesar de ello, su conclusión de que las estatinas reducen el riesgo de mortalidad cardiovascular en pacientes en prediálisis concuerda con hallazgos de ensayos no aleatorizados y aleatorizados de la población general.
En la actualidad está en marcha un estudio australiano (LORD study, Lipid lowering and Onset of Renal Disease) aleatorizado y controlado, cuyo objetivo primario es ver el efecto de 10 mg de atorastatina en la progresión de la ERC62.
Evidencias en el tratamiento con estatinas en pacientes con enfermedad renal crónica estadio 5Aunque los pacientes en hemodiálisis tienen un excesivo riesgo de mortalidad cardiovascular, las evidencias en el tratamiento con estatinas no son nada claras. Hay estudios observacionales en los que se observa un beneficio en el tratamiento con estatinas. En el estudio US Renal Data System Dialysis Morbidity and Mortality63, se siguió a 3.700 individuos durante 2 años. Los pacientes tratados con estatinas tuvieron una reducción relativa de riesgo de mortalidad de un 32% frente al tratamiento con fibratos. En otro estudio observacional, The Dialysis Outcomes Practice Patterns Study (DOPPS)64, se realizó el seguimiento de 9.800 pacientes durante 5 años. Los pacientes que fueron tratados con estatinas tuvieron una reducción del riesgo relativo de mortalidad de un 31% respecto a los no tratados.
Sin embargo, el único estudio prospectivo y aleatorizado, el estudio 4D (Die Deutsche Diabetes Dialyse Studie), no demostró ningún efecto beneficioso de las estatinas en 1.200 pacientes con diabetes mellitus tipo 2 en hemodiálisis, sobre la mortalidad cardiovascular65. Probablemente, una de las razones a estos hallazgos sea que la enfermedad coronaria (enfermedad cardiovascular que más se beneficia del tratamiento con estatinas) supuso < 10% de las muertes cardiovasculares en este ensayo.
En la actualidad están en marcha 2 grandes estudios: el estudio AURORA (tratamiento con rosuvastatina en pacientes en diálisis) y el estudio SHARP tanto en pacientes en diálisis, como con ERC aleatorizados a simvastatina o simvastatina más ezetimibe66,67.
Evidencias en el tratamiento de los pacientes con enfermedad renal crónica leve o moderada (estadios 1–4)Los datos de que disponemos en pacientes con ERC estadios más iniciales se han extraído de subanálisis de grandes ensayos clínicos de prevención secundaria realizados en población general. The Heart Protection Study68 incluyó a un subgrupo de 1.329 pacientes con valores de creatinina entre 1,3 y 2,3 mg/dl. Hubo una reducción en el riesgo relativo de un 28% y en el absoluto de un 11% en la tasa de episodios en el grupo tratado con simvastatina (la reducción en el estudio global fue de un 5,4%).
En el ensayo CARE (Cholesterol and Recurrent Events), se analizó a un subgrupo de 1.700 pacientes con aclaramiento de creatinina menor de 75 ml/min. Estos pacientes presentaron una reducción del riesgo relativo de un 28% y del absoluto de un 4% en el objetivo primario (muerte por enfermedad coronaria o infarto agudo de miocardio [IAM]), cuando fueron tratados con 40 mg de pravastatina69.
El único estudio prospectivo y aleatorizado publicado del tratamiento con estatinas en pacientes con ERC moderada es el PREVEND IT. En este estudio, se aleatorizó a 864 pacientes con microalbuminuria a recibir fosinopril 20 mg o placebo y pravastatina 40 mg o placebo. Los individuos fueron seguidos durante 4 años. La pravastatina no redujo de forma significativa la morbimortalidad cardiovascular, aunque este estudio tuvo como principal limitación el número pequeño de episodios cardiovasculares que tuvieron los pacientes del estudio55.
El estudio ALERT se realizó en 2.102 pacientes trasplantados renales aleatorizados a recibir fluvastatina o placebo. A los 5 años de seguimiento, la fluvastatina redujo de forma no significativa el objetivo primario (muerte cardíaca, IAM o procedimientos coronarios) en un 17%. En un subanálisis, redujo el riesgo de presentar muerte cardíaca o IAM no fatal en un 35% (p = 0,005)70.
De los ensayos clínicos en marcha, el estudio SHARP nos dará información en un subgrupo de 6.000 pacientes con ERC moderada tratados con estatinas64.
Seguridad en el uso de estatinas en pacientes con enfermedad renal crónicaExcepto para pravastatina, todas las estatinas se metabolizan por el citocromo P450. La mayoría de las estatinas, incluidas atorvastatina, lovastatina y simvastatinas, son metabolizadas primero por la isoenzima CYP3A4 y, por lo tanto, son susceptibles de presentar interacciones con los fármacos que se metabolizan por esta enzima, como la ciclosporina, el tacrolimus, los antifúngicos, los macrólidos, los fibratos y las warfarinas, principalmente. Sin embargo, la fluvastatina se metaboliza por la enzima CYP2C9 y no interacciona con estos fármacos. Por lo tanto, excepto para fluvastatina y pravastatina, hay que tener en cuenta las interacciones con fármacos, sobre todo en pacientes trasplantados71.
Las estatinas tienen principalmente una eliminación hepática y la proporción de aclaramiento renal es bajo, excepto para pravastatina que es de un 20-60%72 y lovastatina, de un 30%73. Todas las estatinas se unen en una gran proporción (> 90%) a las proteínas plasmáticas, excepto la pravastatina, que lo hace en un 50%, por lo que la eliminación por hemodiálisis es mínima.
La atorvastatina tiene una eliminación renal mínima (< 2%), por lo que no hay que ajustar dosis en pacientes con insuficiencia renal. Los escasos estudios farmacocinéticos realizados no han indicado que se requiera ajuste de dosis con el resto de estatinas en la ERC, aunque los fabricantes han recomendado dosis más bajas en este grupo poblacional. Estas recomendaciones son prudentes, ya que en la insuficiencia renal crónica hay una desrregulación en el sistema enzimático del citocromo, puede haber una alteración en la unión a las proteínas plasmáticas por las toxinas urémicas y, además, estos pacientes están polimedicados33.
Aunque las estatinas pueden aumentar las transaminasas en un 0,5-2% de los pacientes, hay controversia sobre su hepatotoxicidad. Ningún estudio en insuficiencia renal ha demostrado que las estatinas sean hepatotóxicas.
En resumen, las estatinas son fármacos prometedores por sus importantes efectos beneficiosos renales, demostrados en el ámbito experimental. A pesar de los resultados negativos del estudio 4D en diálisis, el tratamiento con estatinas en pacientes con ERC en sus diferentes estadios debería considerarse estándar para conseguir valores de cLDL por debajo de 100 mg/dl, ya que los efectos secundarios son mínimos.
En la actualidad, no hay evidencias suficientes para recomendar el tratamiento con estatinas en la prevención primaria de episodios cardiovasculares en esta población. Tampoco hay datos contundentes que avalen el tratamiento de estatinas para reducir proteinuria y frenar la progresión de la ERC. Los estudios en marcha, como el AURORA y el SHARP, nos ayudarán a resolver estos problemas.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.