El tratamiento con fármacos hipolipemiantes requiere un control sencillo pero imprescindible, tanto si se emplea en monoterapia como si se usa una combinación de fármacos. Las combinaciones más seguras de estatina con fenofibrato no han mostrado efectos adversos significativamente diferentes a los encontrados con monoterapia. No obstante, lo mismo que se controla periódicamente el perfil lipídico y la consecución de objetivos, es preciso en el inicio y en el seguimiento el control de otras variables biológicas, entre las que destacan la función renal y las enzimas de origen muscular o hepático. Por otra parte, son bien conocidas las situaciones clínicas que suponen una contraindicación relativa o absoluta al tratamiento.
¿Qué controles analíticos son necesarios realizar, y cada cuánto tiempo, en un paciente en tratamiento con fibratos?Inicialmente se debe solicitar un patrón lipídico completo de abordaje (colesterol total, cLDL [colesterol unido a lipoproteínas de baja densidad], cHDL [colesterol unido a lipoproteínas de alta densidad], triglicéridos, perfil enzimático hepático y creatincinasa —son posibles elevaciones transitorias al tomar fibratos—). Se debe solicitar también filtrado glomerular y creatinina (ajustar dosis ante una insuficiencia renal leve o contraindicarlos si es grave) y sistemático de sangre (incluyendo glucosa, porque si se usa gemfibrocilo aminora el efecto de la insulina). Posteriormente varían las fechas de las determinaciones según las guías, pero las europeas (entre ellas la de la semFYC)12 solicitan a los 2 meses parámetros analíticos para valorar la efectividad del tratamiento (evitar la inercia terapéutica), así como posibles variaciones valorando tolerancia y cumplimiento. Más adelante se pueden espaciar cada 6-12 meses según el grado de riesgo cardiovascular.
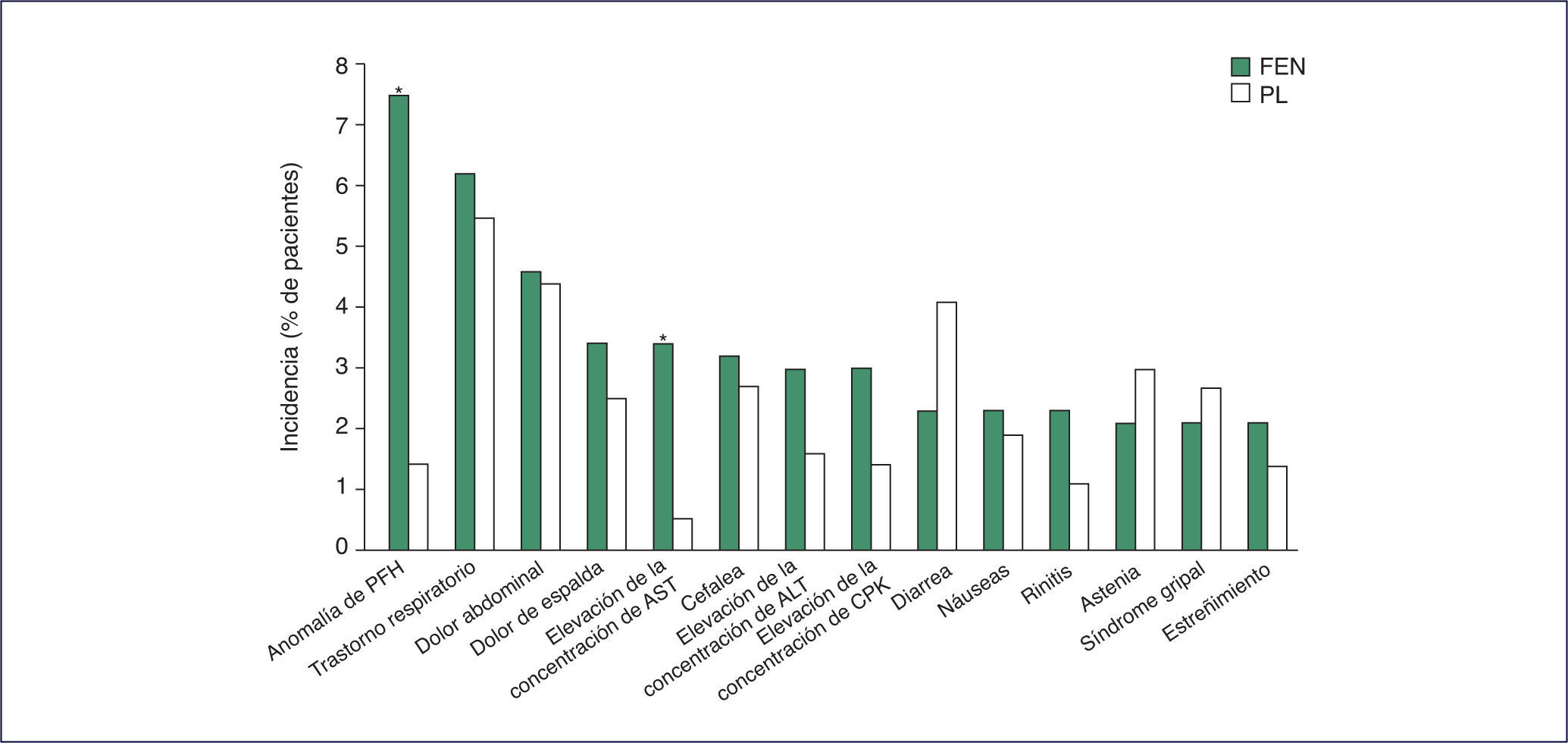
¿Cuáles son los efectos secundarios más frecuentes de los fibratos?Los efectos secundarios más frecuentes de los fibratos, en general son escasos y leves y su seguridad a largo plazo está probada. La información de la tolerabilidad general de fenofibrato se obtuvo inicialmente del análisis conjunto de datos de 804 pacientes y expresados en la ficha técnica del producto1.
De los acontecimientos adversos con fenofibrato, solo las anomalías en las pruebas funcionales hepáticas y la elevación de las concentraciones de aspartato aminotransferasa (AST) se dieron en un número significativamente mayor que en el grupo placebo. En el estudio FIELD2, los diabéticos tipo 2 sufrieron secundarismos relacionados con fenofibrato en un 0,8% y se dieron en el 0,5% del grupo placebo. No se constataron casos de rabdomiólisis en los que recibieron tratamiento combinado con fenofibrato más una estatina, y en conjunto apareció rabdomiólisis en 3 receptores de fenofibrato (0,06%) y 1 de placebo (0,02%), que curaron totalmente. Un número significativamente mayor de receptores de fenofibrato que de placebo presentó embolia pulmonar (el 1,1 frente al 0,7%; p = 0,022) o pancreatitis (el 0,8 frente al 0,5%; p = 0,031), pero la incidencia de estos acontecimientos fue muy baja.
Controles clínicos y analíticos tras instauración de tratamiento ante una dislipemia
| Tipo de paciente | Controles clínicos | Controles analíticos | |
|---|---|---|---|
| Riesgo muy altoa | 3 meses | Reforzar cambios en el estilo de vida, en especial el abandono del tabaco | Cada 2 meses perfil lipídico hasta conseguir objetivo terapéutico. Después cada 6-12 meses |
| Control del peso y de la presión arterial | Si está tratado con fibratos solicitar análisis de transaminasas | ||
| Valorar la tolerancia y el cumplimiento del tratamiento | |||
| Anual | Exploración física | ||
| Riesgo alto | 3-6 mesesb | Reforzar cambios en el estilo de vida, en especial el abandono del tabaco | Cada 2 meses perfil lipídico hasta conseguir objetivo terapéutico. Después cada 6-12 meses |
| Control del peso y de la presión arterial | Si está tratado con fibratos solicitar análisis de transaminasas | ||
| Valorar la tolerancia y el cumplimiento del tratamiento | |||
| Revaluación del RCV | |||
| Anual | Exploración física | ||
| Riesgo moderado | 12 meses | Reforzar cambios en el estilo de vida, en especial el abandono del tabaco | Anualmente, perfil lipídico |
| Control del peso y de la presión arterial | |||
| Revaluación del RCV | |||
| Riesgo bajo | Cada 2 años | Reforzar cambios en el estilo de vida, en especial el abandono del tabaco | Cada 2 años, perfil lipídico |
| Control del peso y de la presión arterial | |||
| Revaluación del RCV |
RCV: riesgo cardiovascular.
Tomada de Blasco Valle et al1.
Otros acontecimientos adversos con importancia clínica que aparecieron en menos del 2% de los pacientes consistieron en trombosis venosa profunda (el 1,4% de los receptores de fenofibrato frente al 1,0% de los de placebo), miositis (el 0,04 frente al 0,02%) y nefropatía con necesidad de diálisis (el 0,3 frente al 0,4%). Menos del 1% de los pacientes de cualquiera de los grupos de tratamiento presentó concentraciones de alanina aminotransferasa (ALT) de 3-5 veces o más de 5 veces el límite superior de la normalidad, o concentraciones de creatinfosfocinasa (CPK) de 5-10 veces o más de 10 veces el límite superior de la normalidad. Al final del estudio, la mediana de las concentraciones de creatinina fue significativamente mayor en los receptores de fenofibrato que en los de placebo (91 frente a 80 mmol/l; p < 0,01). El aumento de las concentraciones de creatinina observado se estimó de escasa importancia clínica y se normalizó tras suspender el tratamiento. En general, fenofibrato fue bien tolerado cuando se administró en combinación con ezetimiba en los pacientes con dislipidemia mixta3 (efectos adversos relacionados con el tratamiento en el 11,4% de los que recibieron fenofibrato 160 mg/día más ezetimiba 10 mg/día, en comparación con el 14,3% de los tratados con fenofibrato en monoterapia, el 6,4% con ezetimiba en monoterapia y el 7,8% con placebo). Tampoco se notificaron miopatías, rabdomiólisis o pancreatitis. En otro ensayo, el perfil de acontecimientos adversos en los pacientes con dislipemia primaria que recibieron tratamiento combinado con fenofibrato más fluvastatina fue semejante al de los tratados con fenofibrato en monoterapia4. Los acontecimientos adversos notificados con más frecuencia fueron digestivos (el 26% de los receptores de fenofibrato 200 mg/día frente al 6% de los de fenofibrato 200 mg/día más fluvastatina 20 mg/día y el 24% de los de fenofibrato 200 mg/día más fluvastatina 40 mg/día), osteomusculares, como mialgias (el 24 frente al 17 y al 15%) y respiratorios (el 15 frente al 11 y al 24%). No se observaron diferencias intergrupales significativas en cuanto a las variaciones con respecto al valor basal de las concentraciones de creatinina, AST, ALT, fosfatasa alcalina, CPK o mioglobina5. En pacientes con síndrome metabólico6, el tratamiento combinado con fenofibrato más simvastatina, fluvastatina, atorvastatina o rosuvastatina no se asoció a variaciones con importancia clínica de las concentraciones de CPK. Se notificaron mialgias en el 1,8-3,3% de los tratados con fenofibrato más rosuvastatina y en ninguno de los que recibieron fenofibrato más atorvastatina (n = 40)7.
Efectos secundarios originados por fibratos
| • Relativamente frecuentes: náuseas; flatulencia; dispepsia (20%); dolor abdominal y diarrea (7-10%); mialgias leves; prurito; eosinofilia; elevación de las transaminasas en cifras menores de 3 veces el límite máximo |
| • Frecuencia media: fotosensibilidad; aumento de transaminasas hepáticas y de creatinina |
| • Muy poco frecuentes: miositis: más frecuente en insuficiencia renal -disminuir dosis- o en asociación con otros hipolipemiantes -asociar solo fenofibrato con estatinas-; colestasis; colelitiasis; colecistitis; disminución de libido; apendicitis; alteración del control de la glucemia en diabéticos; neuritis periférica; pancreatitis; tromboembolia; neumopatía intersticial |
Elaboración propia a partir del texto y las citas bibliográficas.
Fenofibrato conlleva un riesgo de rabdomiólisis inferior que gemfibrozilo, con arreglo a los resultados de un análisis retrospectivo de los datos de acontecimientos adversos de 2 bases de datos de la Food and Drug Administración (FDA) de Estados Unidos (enero de 1999 a diciembre de 2002)8. La tasa de acontecimientos adversos musculares (excluida la rabdomiólisis franca) fue de 15,7 por millón de prescripciones de gemfibrozilo en comparación con 8,8 por millón de prescripciones de fenofibrato, lo que depara una razón de posibilidades (RR) de 1,78 (intervalo de confianza [IC] del 95%, 1,43-2,22). La tasa de rabdomiólisis también fue significativamente mayor con gemfibrozilo que con fenofibrato (59,6 frente a 5,5 por millón de prescripciones; RR: 10,84; IC del 95%, 8,44, 13,95). Se constataron 68 casos de rabdomiólisis en los receptores de fenofibrato y 1.304 en los de gemfibrozilo (en total se cumplimentaron 3.161 impresos de acontecimientos adversos, en los que se incluyó fenofibrato o gemfibrozilo como fármaco sospechoso). En los receptores de fenofibrato, el 24% de los pacientes que experimentaron rabdomiólisis estaba recibiendo cerivastatina de forma concomitante (que ya no se comercializa), el 12% otra estatina, y el 64% no recibía estatinas. Los porcentajes correspondientes en los receptores de gemfibrozilo fueron del 89, 10 y 1%. De manera similar, el uso de fenofibrato más una estatina se acompañó de menos notificaciones de rabdomiólisis que el de gemfibrozilo más una estatina, según los resultados de otro análisis retrospectivo de una de las bases de datos de acontecimientos adversos de la FDA (de enero de 1998 a marzo de 2002)9. Se notificaron 4,5 casos de rabdomiólisis por millón de prescripciones de fenofibrato más una estatina en comparación con 87 casos por millón de prescripciones de gemfibrozilo más una estatina. En particular, de las 606 notificaciones totales de rabdomiólisis, 14 (2%) se relacionaron con fenofibrato más cerivastatina y 533 (88%) con gemfibrozilo más cerivastatina.
Recomendación
La frecuencia y descripción de efectos adversos se basa en evidencias obtenidas de metaanálisis o de ensayos clínicos aleatorios y controlados. El fenofibrato es bien tolerado, tanto en monoterapia como asociado a otros fármacos, y presenta un riesgo bajo de rabdomiólisis (en comparación con gemfibrocilo) cuando se combina con estatinas.
Las contraindicaciones absolutas de un fibrato son: hipersensibilidad a los fibratos o a alguno de los excipientes, insuficiencia renal grave, litiasis biliar, antecedentes de pancreatitis aguda o crónica excepto la debida a hipertrigliceridemia grave, hepatopatía crónica activa, cirrosis biliar primaria, embarazo, lactancia, niños y adolescentes menores de 18 años, reacción fotoalérgica o fototóxica conocida durante el tratamiento con fenofibrato o ketoprofeno, antecedentes de miopatía o rabdomiólisis por fibratos o estatinas o aumento de creatincinasa más de 5 veces la normalidad.
Las contraindicaciones relativas son: insuficiencia renal leve (realizar ajuste de dosis), antecedentes personales o familiares de enfermedad muscular, alcoholismo, antecedentes de embolia pulmonar, hipotiroidismo, personas mayores de 70 años. Si el filtrado glomerular > 60 ml/min se puede utilizar en tratamiento combinado con pravastatina.
En personas mayores hay un estudio donde la utilización de fibratos se asoció con aumento en las derivaciones a nefrología e ingresos hospitalarios por elevación en los valores de creatinina. Con el bezafibrato de eliminación renal, para disminuir el riego de miositis se debe disminuir la dosis y aumentar los intervalos. En el estudio FIELD, el aumento de los valores de creatinina fue reversible al suspender el fibrato.
Si se utiliza un fibrato en asociación con una estatina, el fenofibrato es el más adecuado. Está contraindicado emplear gemfibrocilo.
Con respecto al riesgo de pancreatitis, en un metaanálisis de 7 ensayos clínicos controlados en pacientes con triglicéridos normales o discretamente elevados se encontró un aumento de casos de pancreatitis, probablemente por el aumento de cálculos biliares.
¿Cuáles son las interacciones más frecuentes de los fibratos con otros fármacos?1–5Las interacciones más frecuentes están mediadas por la inhibición competitiva de CYP3A4. Al asociar fibrato con una estatina, la pravastatina y la fluvastatina tienen menos metabolización por la vía CYP3A4 y, por tanto, su asociación es más segura.
Gemfibrozilo disminuye la excreción renal de estatinas lipofílicas, afecta la glucoronidacion de ciertos medicamentos y compite con las estatinas en el metabolismo hepático. Por ello, no debe asociarse con una estatina por aumento del riesgo de miopatía y rabdomiólisis.
Si se toma gemfibrozilo con antidiabéticos (repaglinida, pioglitazona, glimepirida, sitagliptina) se deben monitorizar los valores de glucemia y ajustar las dosis de antidiabético. Gemfibrozilo parece que disminuye el efecto de la insulina.
No se debe utilizar gemfibrozilo y tratamiento antirretroviral (virus de la inmunodeficiencia humana).
Los fibratos interfieren con el metabolismo de la warfarina (por competición en la unión a proteínas), con aumento del cociente internacional normalizado y, por tanto, hay que monitorizar para realizar ajuste de dosis.
Los fibratos y resinas secuestradoras de ácidos biliares interfieren en la absorción, por lo que se recomienda tomarlos 1 h antes o 4-6 h después.
En pacientes en tratamiento con ciclosporina, el fenofibrato disminuye el efecto y aumenta los valores de creatinina.
¿Cómo mejorar la adherencia y el cumplimiento terapéutico?1–8La Organización Mundial de la Salud define la adherencia terapéutica como la magnitud con que el paciente sigue las instrucciones médicas. En el cumplimiento o adherencia terapéutica influyen factores en relación con el paciente, con el profesional, con el sistema sanitario y con los fármacos prescritos. Las causas más frecuentes de falta de adherencia son el olvido de la toma, la aparición de efectos adversos, el desconocimiento de la importancia de tomar esa medicación, el miedo a reacciones adversas, etc.
Como medidas generales debemos individualizar el tratamiento consiguiendo un vínculo fuerte y fortaleciendo la relación médico-paciente. Es importante no culpabilizar y la participación de todos los profesionales sanitarios.
De forma más específica, las estrategias pueden consistir en:
- •
Realizar una prescripción sencilla y fácil de entender y cumplir por el paciente. Explicar los posibles efectos secundarios.
- •
Información individualizada, en grupos y con apoyo familiar.
- •
Intervenciones conductuales: técnica de autocontrol, responsabilización y refuerzo conductual.
- •
Reforzar periódicamente la importancia del cumplimiento y valorar los problemas que han aparecido.
- •
Llamadas telefónicas.
- •
Incentivar al paciente.
- •
Valorar los costes directos e indirectos.
- •
Si es posible, utilizar tecnologías de la información y la comunicación que faciliten el recordatorio de las tomas.
- •
Si es posible, utilizar dosis única diaria o utilizar combinaciones de fármacos que disminuyan el número de comprimidos y el número de tomas.
En la población española esta validado el test de Morinsky Green, que indica el grado de cumplimiento. Es sencillo de realizar y consta de 4 preguntas que el paciente debe contestar (tabla 3).
Test de Morinsky Green (traducido)
| • ¿Se olvida alguna vez de tomar el medicamento? |
| • ¿Toma la medicación a la hora indicada? |
| • Cuando se encuentra bien, ¿deja alguna vez de tomar la medicación? |
| • Si alguna vez se siente mal, ¿deja de tomar la medicación? |
Elaboración propia a partir del texto y las citas bibliográficas.