Durante muchos años, se ha discutido el papel aterogénico de los triglicéridos (TG), como factor de riesgo cardiovascular independiente, en bastante medida porque la hipertrigliceridemia (HTG) es una entidad metabólica compleja, de etiología múltiple en la que intervienen procesos de diversa naturaleza. En este capítulo, discutiremos las recomendaciones actuales para el manejo de las HTG leves-moderadas (150 a 880 mg/dL). El objetivo de las intervenciones disponibles pretende normalizar el colesterol-LDL (c-LDL) y controlar la HTG, lo que conllevará a reducir los niveles de apoproteína B (ApoB), el número de lipoproteínas remanentes ricas en TG (LRP), el colesterol-no HDL (c-no HDL), y aumentar el colesterol-HDL (c-HDL). La estrategia del manejo incluye recomendaciones de un estilo de vida saludable y, posteriormente, el empleo de fármacos, incluyendo las estatinas, los fibratos, los ácidos grasos n-3 y los inhibidores de PCSK9.
The atherogenic role of triglycerides (TG) as an independent cardiovascular risk factor has been discussed for many years, largely because hypertriglyceridaemia (HTG) is a complex metabolic entity of multiple aetiology involving processes of diverse nature. In this chapter, a discussion will be presented on the current recommendations for the management of mild-moderate hypertriglyceridaemia (150-880mg/dL). The aim of the interventions used is to decrease the LDL-cholesterol (c-LDL) and control the HTG. This entails reducing apoprotein B (ApoB) levels, the number of remaining TG-rich lipoproteins (LRP), non-HDL-cholesterol (c-non-HDL), and increasing HDL-cholesterol (c-HDL). The management strategy includes healthy lifestyle recommendations, and subsequent use of lipid-lowering drugs, including statins, fibrates, n-3 fatty acids and PCSK9 inhibitors.
Durante muchos años, se ha discutido el papel aterogénico de los triglicéridos (TG), como factor de riesgo cardiovascular independiente, en bastante medida porque la hipertrigliceridemia (HTG) es una entidad metabólica compleja, de etiología múltiple y en la que intervienen procesos de diversa naturaleza. En este sentido, según las últimas directrices de la Sociedad Europea de Cardiología (ESC) y de la Sociedad Europea de Arteriosclerosis (EAS)1, el nivel deseable de TG en ayunas debería ser inferior a 150 mg/dL, ya que, a partir de dicha cifra, se favorece el desarrollo de alteraciones lipídicas de gran importancia, como es el incremento plasmático de las lipoproteínas de baja densidad (LDL) pequeñas y densas, de gran capacidad aterogénica. En este artículo, nos centraremos en las HTG leves-moderadas (150 a 880 mg/dL). Es importante recordar que la cifra que alcancen no es el hecho fundamental, desde el punto de vista aterogénico, sino que el incremento de TG será potencialmente patógeno cuando cursan con colesterol-HDL (c-HDL) bajo y otros trastornos lipídicos que luego comentaremos y que se discuten en otros capítulos de esta monografía. Lo que sí podemos afirmar con rotundidad, basados en los datos epidemiológicos, genéticos y biológicos, es que cuando la HTG se relaciona con un incremento de las lipoproteínas remanentes ricas en TG (LRT), tanto en ayunas como en situación postprandial, tienen una fuerte relación con la enfermedad cardiovascular (ECV) aterosclerótica y la mortalidad por cualquier causa2. Desafortunadamente, no es fácil identificar en la práctica el incremento de estas LRT en el plasma, al igual que conocer los niveles de LDL pequeñas y densas, pero disponemos de algunos datos para sospechar cuando es así y tomar decisiones clínicas. Este es el caso de las formas de HTG que cursan con niveles elevados del colesterol-no HDL (c-no HDL) y de apoproteína B (ApoB), de descenso de c-HDL, como luego comentaremos y que constituyen un complejo metabólico aterogénico denominado dislipemia aterogénica3.
Entre dichas alteraciones, es fácilmente medible el c-no HDL, de importancia relevante como un factor de riesgo independiente de ECV y, por tanto, un objetivo secundario del tratamiento, tras controlar el colesterol-LDL (c-LDL). Pero además, ahora conocemos que su trascendencia radica en que va ligado al aumento de ApoB, marcador biológico relacionado con la presencia de LRT en el plasma. Un estudio reciente de aleatorización mendeliana objetivó que ciertas variantes genéticas en la lipoproteinlipasa (LPL), reductora de TG, y ciertas variantes en el receptor de LDL, reductores de c-LDL, ejercen el mismo efecto en el riesgo de ECV por unidad de cambio de ApoB, sugiriendo que todas las ApoB tienen el mismo efecto en el riesgo de cardiopatía isquémica4. Estos hechos recientes son muy relevantes porque el incremento de ApoB, fácilmente medible en el laboratorio, es el responsable del riesgo cardiovascular de ciertas HTG y no los niveles de TG, asociándose al resto de alteraciones metabólicas indicadas, como el descenso de c-HDL y LDL pequeñas y densas.
En este artículo discutiremos las recomendaciones actuales para el manejo de las HTG aterogénicas, especialmente en personas de alto riesgo. El objetivo de las intervenciones disponibles pretende normalizar el c-LDL y controlar la HTG, lo que conllevará reducir los niveles de ApoB, el número de LRP, el c-no HDL, y aumentar el c-HDL. La estrategia del manejo incluye recomendaciones de un estilo de vida saludable y, posteriormente, el empleo de fármacos, incluyendo las estatinas, los fibratos, los ácidos grasos n-3 y los inhibidores de PCSK9 en menor medida. Actualmente, se están desarrollando otros fármacos con interesantes mecanismos de acción, que mencionaremos a continuación.
Recomendaciones de estilo de vidaLos pilares fundamentales del estilo de vida son la actividad física, eliminar los hábitos tóxicos, en especial el consumo de tabaco y alcohol, limitar la ingesta calórica excesiva y promover la alimentación saludable. Con ello, se busca el control de los distintos factores de riesgo, mejorar el sistema metabólico del individuo y normalizar el peso corporal. La pérdida de peso mejora la sensibilidad a la insulina y reduce la concentración de TG5. La práctica regular de ejercicio físico reduce la concentración plasmática de TG de manera adicional al efecto que tiene sobre otros factores de riesgo y sobre la pérdida de peso6. El consumo de alcohol tiene un importante efecto negativo en la concentración de TG, sobre todo en personas con HTG7. Dentro de la alimentación saludable, el aspecto más importante es sustituir la grasa saturada por grasa insaturada y, sobre todo, reducir al máximo los hidratos de carbono refinados. Actualmente, se conoce que la dieta rica en hidratos de carbono refinados empeora la HTG, mientras que el efecto es mucho menor cuando los alimentos son ricos en fibra, con índice glucémico bajo. Esto se aplica principalmente a pacientes con diabetes o con síndrome metabólico (SMet)5. El consumo habitual de cantidades significativas de fructosa (> 10% de la energía) contribuye a la elevación de los TG, sobre todo en personas con HTG8. Estos efectos dependen de la dosis, ya que un consumo entre el 15 y el 20% de la energía total puede aumentar hasta un 30 a 40% los TG plasmáticos. La sacarosa, un disacárido compuesto por glucosa y fructosa, es una fuente importante de fructosa en la dieta.
Recomendaciones farmacológicasEl siguiente escalón tras el estilo de vida saludable, según las guías internacionales para pacientes con alto riesgo, implica el empleo de fármacos (tabla 1). Datos recientes de un meta-análisis han demostrado que la reducción de 1 mmol/L del c-no HDL (RR 0,79 [IC 95%, 0,76 a 0,82]; incluyendo 37 ensayos clínicos con estatinas, fibratos, omega-3 y niacina) o 1 mmol/L de TG (RR, 0,84 [IC 95%, 0,75 a 0,94]; incluyendo 44 ensayos clínicos con estatinas, fibratos, omega-3 y niacina) se asoció con un menor riesgo de eventos cardiovasculares mayores, independientemente de la terapia utilizada para ello9. Enseguida, comentaremos los fármacos disponibles con una breve mención a los que actualmente están en desarrollo.
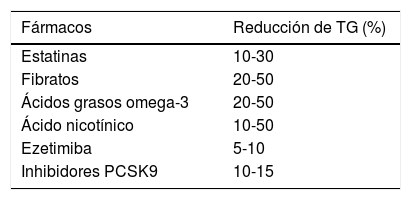
Eficacia de diversas familias de hipolipemiantes sobre los niveles de triglicéridos
| Fármacos | Reducción de TG (%) |
|---|---|
| Estatinas | 10-30 |
| Fibratos | 20-50 |
| Ácidos grasos omega-3 | 20-50 |
| Ácido nicotínico | 10-50 |
| Ezetimiba | 5-10 |
| Inhibidores PCSK9 | 10-15 |
PCSK9: proproteína convertasa subtilisina/kexina tipo 9; TG: triglicéridos.
Estatinas. Las estatinas suelen reducir la concentración de TG de un 10 a 30% del valor basal. Las estatinas más potentes (atorvastatina, rosuvastatina y pitavastatina) han demostrado una mayor capacidad, sobre todo a dosis altas y en pacientes con HTG, en los que el riesgo absoluto es más elevado y, por tanto, la reducción del riesgo absoluto es mayor. El mecanismo de su efecto en los TG no se conoce con exactitud, pero parece ser independiente de la vía del LDLR. Puede estar relacionado con una estimulación de la captación de lipoproteínas de muy baja densidad (VLDL) por los hepatocitos y una disminución de la tasa de producción de VLDL.
Inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9). Los inhibidores de la PCSK9 también reducen la concentración de TG y aumentan la de c-HDL y ApoA-I con una eficacia que depende de la dosis. En los estudios clínicos, el evolocumab y el alirocumab redujeron la concentración de TG en un 10 a 15%, con un aumento del c-HDL en un 5 a 10% y un descenso de la lipoproteína (a) del 25 a 30%10.
Fibratos. Los fibratos son agonistas del receptor alfa activado del proliferador de peroxisoma (PPAR-a) y actúan modulando ciertos factores de transcripción que regulan diferentes etapas del metabolismo lipoproteico. Como consecuencia, reducen eficazmente la concentración de TG, tanto en ayunas como en el período posprandial, y las partículas residuales de LRT. Los efectos clínicos de los fibratos varían según el tipo de fármaco, pero se calcula que pueden disminuir la concentración de TG en un 50%, la de c-LDL en un 20% (aunque se puede producir un pequeño aumento paradójico de c-LDL cuando los TG son altos), y aumentar el c-HDL en un 20%. La magnitud del efecto depende mucho de la concentración lipídica basal. Su efecto sobre las HDL y los TG es significativamente menor (el 5 y el 20%, respectivamente) en los estudios de intervención a largo plazo de pacientes con diabetes mellitus tipo 2 (DM2), que no tienen los TG elevados11,12. En general, los fibratos se toleran bien y solo producen efectos secundarios leves13. Los efectos adversos mejor conocidos son la miopatía, las elevaciones de las enzimas hepáticas y la colelitiasis. Se ha objetivado un mayor riesgo de miopatía (5,5 veces más alto) cuando se usa fibrato como tratamiento único (sobre todo gemfibrozilo) que cuando se usa una estatina. Como el fenofibrato no comparte la ruta farmacocinética del gemfibrozilo, el riesgo de miopatía es mucho menor con esta terapia combinada. Se han descrito trastornos gastrointestinales en menos del 5% de los pacientes y erupciones cutáneas en el 2%. Como clase farmacológica, los fibratos pueden elevar la creatinina y la homocisteína, aunque con poca relevancia clínica.
Los beneficios clínicos de los fibratos derivan fundamentalmente de seis ensayos clínicos prospectivos: los estudios Helsinki Heart Study (HHS), Veterans Affairs High-density lipoprotein Intervention Trial (VAHIT), Bezafibrate Infarction Prevention (BIP), Lower Extremity Arterial Disease Event Reduction (LEADER), Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) y Action to Control Cardiovascular Risk in Diabetes (ACCORD), en el que se añadió el fenofibrato al tratamiento con estatinas14. Los resultados de los mismos arrojan evidencia dispar, sin un beneficio general, aunque parece que en pacientes con TG elevados y c-HDL bajo el beneficio es mayor. Recientemente, un nuevo modulador de PPAR-a más selectivo (pemafibrato) ha mostrado una eficacia significativa en la reducción de LRT15. El Pemafibrate to Reduce Cardiovascular OutcoMes by Reducing Triglycerides IN PatiENts With Diabetes (PROMINENT) es un ensayo clínico de resultados cardiovasculares (CV) actualmente en marcha para evaluar la eficacia del pemafibrato en 10.000 pacientes con diabetes de alto riesgo con TG elevados y c-HDL bajo16. Por lo tanto, la eficacia de los fibratos en la ECV es menos robusta que la de las estatinas y deben confirmarse los posibles beneficios CV de los fibratos en estudios específicamente diseñados para ello.
Ácidos grasos n-3Los ácidos grasos n-3 (ácido eicosapentanoico [EPA] y ácido docosahexanoico [DHA]) se utilizan en dosis farmacológicas (2 a 4 g/día) para reducir los niveles de TG. Su principal efecto es sobre la concentración de VLDL. Estudios recientes en pacientes con TG elevados, tratados con EPA, muestran una reducción de dicho parámetro hasta de un 45%, dependiente de la dosis. Dicha eficacia ha quedado además patente en diversos meta-análisis. Recientemente, el estudio EpanoVa fOr Lowering Very high triglyceridEs II (EVOLVE II) ha confirmado dicha eficacia17 y en el ensayo Rosuvastatin-OMAcor iN residual hyperTrIglyCeridemia (ROMANTIC), aleatorizado y doble ciego frente a placebo, la combinación de 20 mg de rosuvastatina con 4 g de ácidos grasos n-3 (DHA + EPA) logró una mayor reducción de TG y de c-no HDL que el brazo de rosuvastatina en monoterapia, en pacientes con HTG residual, demostrando su seguridad18. La administración de ácidos grasos n-3 es segura y carece de interacciones clínicamente significativas. El principal efecto secundario son los trastornos gastrointestinales y su acción antitrombótica puede favorecer la aparición de hemorragias, sobre todo cuando se administran junto con ácido acetilsalicílico/clopidogrel.
Varios ensayos clínicos y meta-análisis con ácidos grasos n-3 de cadena larga, han mostrado evidencia discrepante en la reducción de eventos cardiovasculares y mortalidad19,20, pero a finales del año 2018, se publicaron los esperados resultados del estudio REDUCE-IT21. En él se demostró una disminución significativa de los episodios vasculares isquémicos, incluyendo la muerte cardiovascular, en aquellos pacientes aleatorizados a 2 g de etilo de icosapento (éster etílico de EPA), dos veces al día (4 g en total), comparados con el placebo. Los pacientes incluidos (n = 8.179) presentaban, tras el tratamiento con estatinas, niveles basales de c-LDL, entre 41 y 100 mg/dL (mediana inicial de 75 mg/dL), y TG entre 150 y 499 mg/dL (mediana inicial de 216 mg/dL), junto con ECV establecida (70,7% en la cohorte de prevención secundaria) o bien con diabetes mellitus y al menos otro factor de riesgo CV asociado (cohorte de prevención primaria). La mediana de seguimiento fue de 4,9 años y la variable principal, que incluía muerte cardiovascular, ictus no mortal, infarto de miocardio no mortal, angina inestable o revascularización coronaria, fue significativamente menor en los pacientes que recibieron etilo de icosapento frente al placebo, con una reducción del riesgo relativo del 25%. Recientemente, el estudio EVAPORATE ha demostrado el beneficio de 4 g al día de IPE frente a placebo, modulando favorablemente la progresión, el volumen y otros componentes de la placa ateroesclerótica con baja atenuación22. Tras varios años de incertidumbre, con resultados contradictorios respecto al efecto beneficioso de los ácidos grasos n-3 sobre la ECV, este último estudio ha demostrado de forma robusta un beneficio sustancial en la reducción de eventos cardiovasculares mayores21. El tipo, la cantidad y la duración para alcanzar estos resultados, así como las poblaciones de pacientes que obtendrán un mayor beneficio con esta estrategia terapéutica y los mecanismos de dicho efecto, aún no se han definido en su totalidad23. Los estudios actualmente en marcha proporcionarán más evidencias en este sentido.
Nuevos fármacos en desarrolloEn la actualidad, hay un gran interés en desarrollar nuevos agentes que reduzcan los niveles de TG. Existe en el mercado un oligonucleótido antisentido, volanesorsén, que inhibe la formación de la ApoC-III, con gran potencia para reducir las concentraciones de TG, y que está indicado en pacientes con síndrome de quilomicronemia familiar (SQF). La tabla 2 resume los principales agentes que se están desarrollando en la actualidad24–26.
Desarrollo de nuevos fármacos reductores de triglicéridos24,25
| Diana terapeútica | Agente | Reducción TG |
|---|---|---|
| PPARα | Modulador selectivo de PPARα: | |
| Pemafibrato | 45% | |
| apoCIII | Oligonucleótido antisentido:Volanesorsén (ya comercializado) | 77% |
| AKCEA-APOCIII-LRX | 71% | |
| ANGPTL3 | Oligonucleótido antisentido:IONIS-ANGPTL3-LRXAnticuerpo monoclonal: | 63% |
| Evinacumab | 47% | |
| apoCII | Péptidos miméticos:D6PV | 50%26 |
| DGAT-1 | Inhibición de la DGAT-1 | |
| Pradigastat | 40-60% |
ANGPTL3: angiopoietin-like 3; apoCII: apolipoproteína CII; apoCIII: apolipoproteína CIII; DGAT-1: Acyl-coA: diacylglycerol acyltransferasa; PPARα: receptor activado por proliferadores peroxisómicos tipo alfa; TG: triglicéridos.
Los objetivos lipídicos forman parte de una estrategia exhaustiva de reducción del riesgo CV (tabla 3). En el caso de la HTG tales objetivos son:
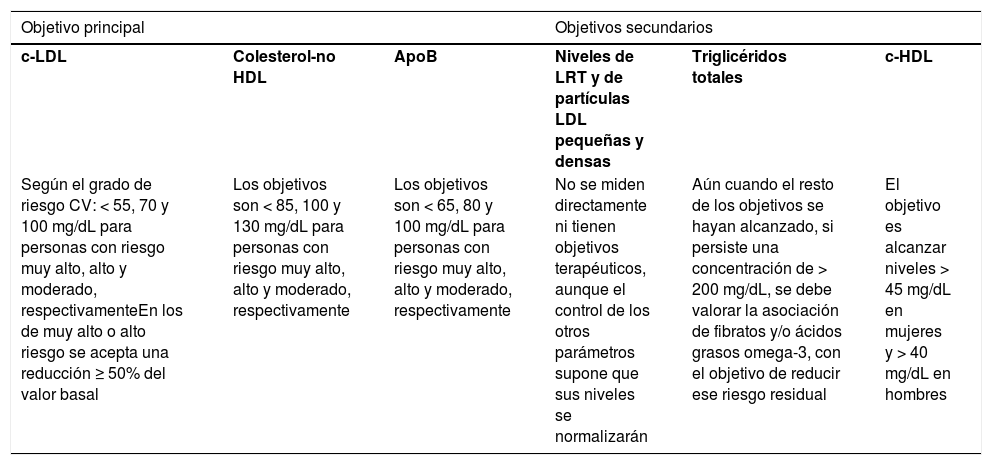
Objetivos lipídicos para reducir el riesgo cardiovascular residual en la hipertrigliceridemia leve-moderada
| Objetivo principal | Objetivos secundarios | ||||
|---|---|---|---|---|---|
| c-LDL | Colesterol-no HDL | ApoB | Niveles de LRT y de partículas LDL pequeñas y densas | Triglicéridos totales | c-HDL |
| Según el grado de riesgo CV: < 55, 70 y 100 mg/dL para personas con riesgo muy alto, alto y moderado, respectivamenteEn los de muy alto o alto riesgo se acepta una reducción ≥ 50% del valor basal | Los objetivos son < 85, 100 y 130 mg/dL para personas con riesgo muy alto, alto y moderado, respectivamente | Los objetivos son < 65, 80 y 100 mg/dL para personas con riesgo muy alto, alto y moderado, respectivamente | No se miden directamente ni tienen objetivos terapéuticos, aunque el control de los otros parámetros supone que sus niveles se normalizarán | Aún cuando el resto de los objetivos se hayan alcanzado, si persiste una concentración de > 200 mg/dL, se debe valorar la asociación de fibratos y/o ácidos grasos omega-3, con el objetivo de reducir ese riesgo residual | El objetivo es alcanzar niveles > 45 mg/dL en mujeres y > 40 mg/dL en hombres |
ApoB: apolipoproteína B; c-LDL: colesterol LDL; CV: cardiovascular; LRT: lipoproteínas remanentes ricas en TG.
Objetivo principal. Se orientará fundamentalmente al control del c-LDL, hasta alcanzar los valores recomendados por los grandes estudios clínicos, aunque cada vez tenemos más evidencias del papel que desempeña el riesgo residual, no relacionado con dicho c-LDL.
Objetivos secundarios. Incluyen todas las alteraciones metabólicas antes indicadas, si bien la evidencia de su tratamiento es menor que las del c-LDL. Todas son factores de riesgo independientes, pero aún no se ha confirmado ampliamente el beneficio de su control en ensayos clínicos. Por ello, alcanzar los objetivos que se indican a continuación debe estar guiado por el juicio clínico del médico, cuando considere modificar o intensificar el tratamiento, sobre todo en pacientes con riesgo CV total alto o muy alto. Desde el punto de vista práctico, los siguientes niveles son orientativos:
ApoB. El objetivo en estos pacientes, según el grado de riesgo es el siguiente: < 65 mg/dL, para personas de riesgo CV muy alto, < 80 mg/dL para los de riesgo alto y < 100 mg/dL para los de riesgo moderado27.
Colesterol-no HDL. El objetivo es el mismo que el objetivo del c-LDL, añadiendo 30 mg/dL. Esto supone que, en el caso de pacientes con riesgo CV muy alto, alto y moderado, se debe alcanzar, respectivamente, los objetivos siguientes: < 85 mg/dL, < 100 mg/dL y < 130 mg/dL27.
Niveles de LRT y de partículas LDL pequeñas y densas. Como antes indicamos, no hay métodos fáciles para aplicarlos a la práctica clínica, por lo que no se miden directamente ni tienen objetivos terapéuticos, aunque el control de los otros parámetros supone que sus niveles se normalizarán.
TG totales. Aún cuando el resto de los objetivos se haya alcanzado, si persiste una concentración de > 200 mg/dL, se debe valorar la asociación de fibratos y/o ácidos grasos omega-3, con el objetivo de reducir ese riesgo residual, así como prevenir el riesgo de aparición de pancreatitis28.
Recomendaciones actuales sobre la elección de fármacos en pacientes con HTGLos criterios que se recogen a continuación son los recomendados en Europa por los paneles de expertos de la EAS y la ESC en su último documento de 20191.
- •
Las estatinas se consideran los fármacos de primera elección, para reducir el riesgo de ECV de los pacientes con riesgo alto y HTG (TG > 200 mg/dL/ > 2,3 mmol/L).
- •
En prevención primaria, se puede considerar el tratamiento con fenofibrato o bezafibrato en combinación con estatinas, para pacientes que cumplan el objetivo de c-LDL y tengan una concentración de TG > 200 mg/dL (2,3 mmol/L).
- •
Para pacientes con riesgo alto, que cumplan el objetivo de c-LDL y tengan una concentración de TG > 200 mg/dL (> 2,3 mmol/L), se puede considerar el tratamiento con fenofibrato o bezafibrato en combinación con estatinas.
- •
Se debe considerar el tratamiento con ácidos grasos poliinsaturados n-3 (4 g/día de éster etílico de EPA) en combinación con estatinas en pacientes con riesgo alto (o superior) que tengan los TG entre 135 a 499 mg/dL (1,5 a 5,6 mmol/L), a pesar del tratamiento con estatinas.
En este artículo analizamos las recomendaciones para el manejo de las HTG leves-moderadas, considerando su mecanismo aterogénico y su grado de alteración metabólica. El objetivo de las intervenciones es normalizar el c-LDL y de forma secundaria controlar la HTG, lo que conllevará reducir el número de LRP y el c-no HDL, incrementando el c-HDL. Pero, sobre todo, especialmente en pacientes de alto riesgo, se trata de reducir la ApoB plasmática a los objetivos indicados, ya que este es el marcador principal relacionado con la aterogénesis de las partículas ricas en TG. La estrategia incluye recomendaciones de un estilo de vida y, posteriormente, el empleo de fármacos, incluyendo las estatinas, los fibratos, los ácidos grasos n-3 y los inhibidores de PCSK9.
FinanciaciónEste artículo ha sido financiado con una ayuda sin restricciones por Akcea Therapeutics. El patrocinador no ha intervenido en la elaboración ni el contenido del mismo, que sólo expresa la opinión de los autores.
Conflicto de interesesP.P.-M. ha impartido conferencias y participado en estudios de investigación esponsorizados por Boehringer Ingelheim, Merck Sharp & Dohme, Novartis, Ferrer, Esteve, Novo Nordisk, GlaxoSmithKline, Amgen, Menarini y Sanofi. F.P.-J. no tiene conflicto de intereses con el contenido incluido en este material.
Nota al suplementoEste artículo forma parte del suplemento «Diagnóstico y tratamiento de las alteraciones del metabolismo de los triglicéridos: de la fisiopatología a la práctica clínica», que cuenta con el patrocinio de Akcea Therapeutics.