La quilomicronemia en ayunas caracteriza a las hiperlipoproteinemias tipo V (quilomicronemia multifactorial) y I, síndrome de quilomicronemia familiar (SQF). La primera de ellas requiere del tratamiento de base de cualquier hipertrigliceridemia con control de la dieta que en general será hipocalórica, baja en azúcares, evitando alcohol, reducir el peso, ajuste de la diabetes mellitus si es el caso y la adición de fármacos que disminuyen los triglicéridos, como son los fibratos y los omega3.
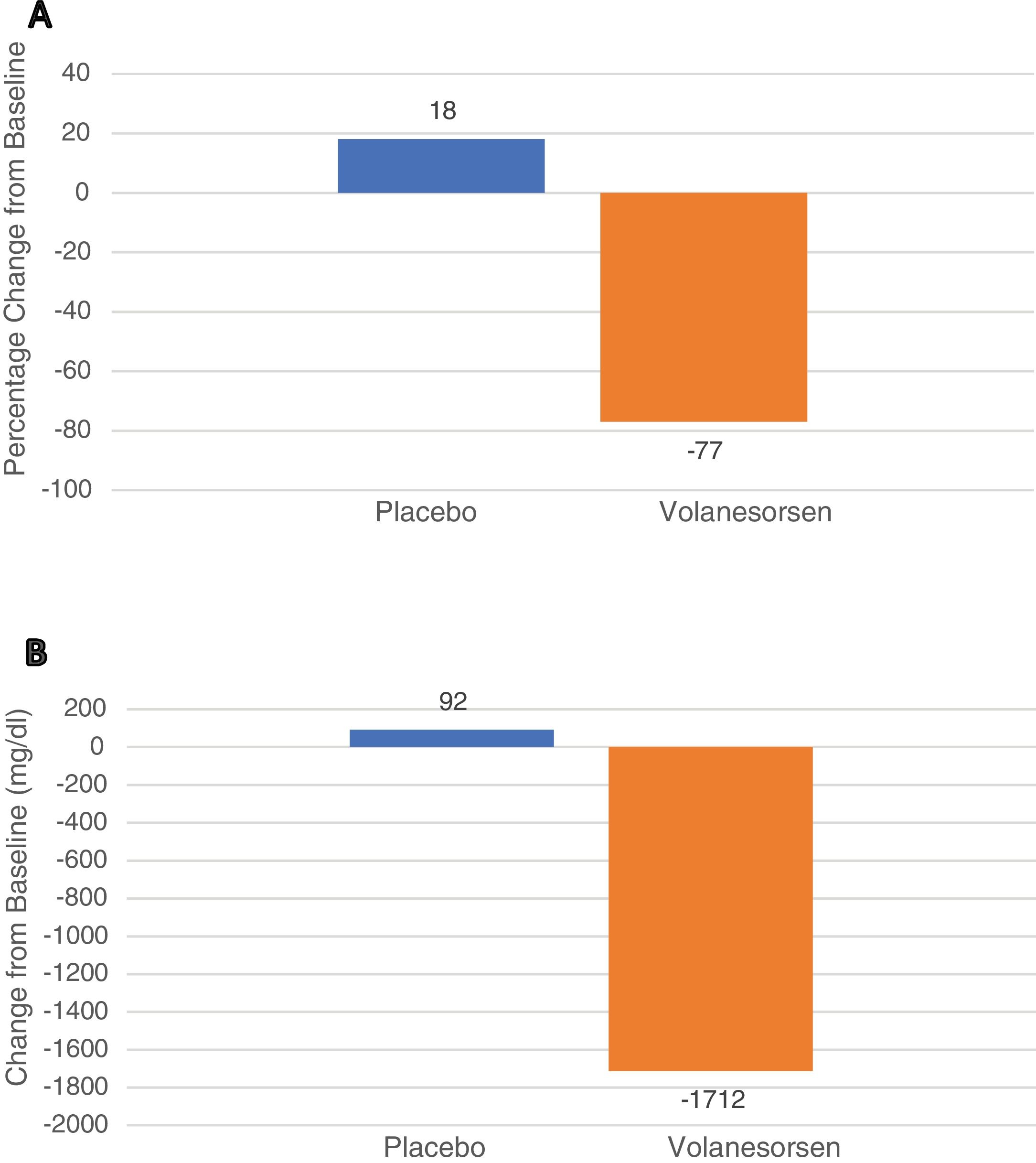
Para el caso de la hiperlipoproteinemia tipo I o SQF, los pacientes deben adherirse estrictamente a una dieta muy baja en grasas, usualmente < 20 g al día. Aún así, muchos pacientes con SQF presentan de forma recurrente dolor abdominal y/o pancreatitis aguda. El único fármaco disponible para tratar este síndrome es volanesorsen, un oligonucleótido antisentido contra la apolipoproteína C-III. Administrado con carácter semanal o quincenal a la dosis de 285 mg, produce descensos de los triglicéridos séricos del 77% y una reducción absoluta de -1712 mg/dL desde su basal, de acuerdo con los resultados del estudio APPROACH. El 77% de los pacientes alcanzaron una concentración de triglicéridos en ayunas inferior a 750 mg/dL. Las reacciones adversas más comunes fueron a nivel de la piel en la zona de inyección y reducción de los niveles de plaquetas, que deben ser monitorizadas.
Fasting chylomicronaemia appears in type V (multifactorial chylomicronaemia syndrome, MCS), and in type I (familial chylomicronaemia syndrome, FCS). MCS needs to be treated as in any general hypertriglyceridaemia: low-calorie diet, avoid sugar and alcohol, reduce body weight, control of diabetes and, in some cases, common lipid lowering-drugs, such as fibrates or omega-3 fatty acids.
For type I HLP, FCS, patients should adhere to a strict very low fat diet, usually less than 15-20 g per day. In spite of this, many patients with FCS suffer from recurrent abdominal pain and/or acute pancreatitis. Volanesorsen, an antisense oligonucleotide against apolipoprotein C-III, is the only drug approved to control the disease. As shown in the APPROACH study, the administration of volanesorsen at a weekly dose of 285 mg induced at three month a reduction of triglycerides of 77% (primary end-point) and a reduction of 1712 mg/dL from the baseline. Among patient receiving volanesorsen, 77% reached a fasting triglyceride value below 750 mg/dL. The most frequent side effects were a skin reaction at injection site and low platelet levels, which should be monitored.
La quilomicronemia acompaña a las hiperlipoproteinemias (HLP) tipo V (cuando va acompañada de elevación de partículas de lipoproteínas de muy baja densidad [Very Low Density Lipoprotein, VLDL]) y más raramente a la HLP tipo I, cuando forma parte del síndrome de quilomicronemia familiar (SQF)1.
En el caso de la HLP tipo V, estamos ante un caso de quilomicronemia multifactorial (QMF), una situación de los pacientes con elevación de triglicéridos (Tg) por acúmulo de VLDL (HLP tipo IV) en la que un aumento de la ingesta de grasas u otro factor ambiental (cetoacidosis diabética entre otros) provoca la retención de quilomicrones (QM)2–4.
Por tanto, consideraremos ambas situaciones, la QMF y el síndrome de quilomicronemia familiar (SQM) y al final resumiremos brevemente las acciones a tomar en caso de una pancreatitis aguda hipertrigliceridémica.
Tratamiento de la QMFEl tratamiento de esta hiperlipemia es la de la hipertrigliceridemia (HTG) moderada (Tg > 500 mg/dL) o grave (Tg > 1.000 mg/dL) que se ha expuesto en el capítulo correspondiente de esta monografía, por lo que no nos vamos a extender. En esencia, los pacientes con esta entidad suelen ser obesos, tener diabetes de tipo 2, consumir elevadas cantidades de carbohidratos o alcohol, o bien estar sometidos a tratamiento hormonal habitualmente con fines anticonceptivos.
Por tanto, aquí el tratamiento tiene una base de dieta y actividad física para reducir las calorías totales y el peso y si no es suficiente añadir tratamiento farmacológico, que como se ha comentado en otros capítulos tiene como base los fibratos o los ácidos omega-35,6. El conjunto de estas medidas reducirán la producción de VLDL y liberarán actividad de lipoproteín-lipasa (LPL) suficiente para catabolizar a los QM. Por supuesto, en una fase de HTG grave (Tg > 1.000 mg/dL), donde siempre están presentes QM en ayunas, se debe llevar una dieta muy baja en grasas. Ello reducirá el riesgo de una complicación potencialmente letal como es la pancreatitis aguda hipertrigliceridémica7. En general, las dietas bajas o muy bajas en calorías son eficaces para reducir las cifras de Tg8.
Tratamiento del SQFEl SQF aparece como consecuencia de una pérdida prácticamente total de actividad de la lipoproteín-lipasa que está anclada en el endotelio de los tejidos muscular y adiposo e hidroliza los Tg de los QM (y de VLDL). La pérdida de esta actividad conlleva el acúmulo de QM incluso días tras la ingesta, cuando en condiciones normales desaparecen del plasma a las ocho horas o todo lo más a las 12 horas de la última ingesta.
Esta pérdida de actividad de LPL está causada por la aparición de dos variantes patogénicas en el gen de LPL o bien por la aparición de mutaciones en otros genes que regulan la actividad de LPL, como son los genes que codifican para apolipoproteína C-II, apo A-5, el factor de maduración de lipasas (LMF-1) y la proteína denominada glicosilfosfatidilinositol HDL binding protein (GIHBP1)9.
Si el SQF es una patología rara, estimada en uno o dos casos por millón de habitantes, aún lo es más los casos de pérdida de función de LPL por la presencia de autoanticuerpos. La diferencia entre SQF y los autoanticuerpos es relativamente fácil por la historia clínica; en el primer caso, los síntomas y los signos de la enfermedad están presentes desde el nacimiento y son obvios en la infancia o adolescencia, mientras que en el segundo caso la HTG grave está relacionada temporalmente con la presencia de los auto Ac, aparece por lo general en la edad adulta y suele asociarse con otras enfermedades autoinmunes sistémicas, del tipo del lupus sistémico, Sjögren etc. Los tratamientos contra la enfermedad de base corrigen la quilomicronemia10,11.
Los pilares del SQF son la dieta y, desde hace pocos años, el tratamiento farmacológico.
Tratamiento dietético del SQFHasta hace poco, sólo estaba disponible la dieta para controlar la cifra de Tg en estos pacientes, ya que la medicación hipolipemiante convencional de cualquier tipo es ineficaz. La dieta recomendada en estos pacientes consiste en una ingesta diaria de < 20 g de grasa al día. Cuando decimos grasa, hablamos de cualquier tipo de grasa, no sólo la grasa trans, o saturada. Ni siquiera la grasa insaturada como los aceites de oliva o girasol son toleradas. Ello obliga a que la fuente de energía en estos pacientes se desplace hacia los hidratos de carbono. Por lo general, estos pacientes con SQF desarrollan desde la infancia episodios recurrentes de dolor abdominal y aprenden a convivir con ellos de tal manera que tienden a evitar comidas que contienen grasa y cuando aparece el dolor a reposar en cama y ayunando 24 o 48 horas. Esto, entre otras causas, conlleva a que los pacientes sean delgados (algo que orienta hacia este diagnóstico, ya que los pacientes con QMF suelen tener sobrepeso u obesidad).
Sin embargo, los pacientes con SQF toleran la ingesta de triglicéridos de cadena media (TCM), que en fórmula líquida puede adquirirse en oficina de farmacia. Los TCM no forman parte de los QM, ya que por su menor tamaño se absorben directamente por los capilares portales llegando al hígado con el resto de los nutrientes. Por el contrario, los Tg de cadena larga se empaquetan en los QM, grandes partículas, que utilizan los linfáticos para luego alcanzar la circulación general a través del conducto linfático torácico. Los TCM son prescritos a estos pacientes como forma de añadir energía a la dieta. La tabla 1 resumen los consejos dietéticos para pacientes con SQF.
Recomendaciones para la dieta de pacientes con síndrome de quilomicronemia familiar
| Limitar la ingesta de grasa a 15-20 g al día (10-15% del total de calorías) |
| Cumplir con las necesidades de ácidos grasos esenciales (linoleico y α-linoleico |
| Escoger de forma preferente carbohidratos complejos, limitando los simpes y refinados |
| Suplementar la dieta con minerales, vitaminas liposolubles y triglicéridos de cadena media, si es necesario |
| Ajustar el total de calorías para mantenimiento del peso |
| Se deben recomendar verduras, legumbres, carnes magras, cereales con fibra, productos lácteos sin grasa y cantidades limitantes de frutas. Deben evitarse el consumo de alcohol y los alimentos ricos en azúcares. |
Tomado de Williams et al.12.
Se ha reportado el beneficio de utilizar suplementos de antioxidantes en estos pacientes con el objetivo de reducir los episodios de pancreatitis aguda hipertrigliceridémica; en concreto, se publicó hace años el beneficio de ANTOX®, un preparado rico en antioxidantes13.
Tratamiento farmacológico: VolanesorsenHasta la fecha, el único fármaco aprobado por la EMA para el tratamiento del SQF es volanesorsen (Waylivra®, Akcea Therapeutics). Volanesorsen es un fármaco antisentido que hibrida al RNA mensajero de la apolipoproteína CIII y fuerza a la célula a su destrucción. Como consecuencia de ello, los niveles de apolipoproteína CIII, un inhibidor de la LPL, se reducen drásticamente. Los resultados de volanesorsen en las hipertrigliceridemias graves son llamativos; en un metaanálisis de tres estudios con una N de 1.156 sujetos, volanesorsen comparado con placebo redujo los niveles de apo CIII un -74% (IC 95, -85,9-63,7), p < 0,01 y los triglicéridos séricos un -68% (IC 95% -85,3, -50,4), p < 0,00114.
En 2014 se publicó que volanesorsen fue eficaz en controlar los niveles de triglicéridos en tres pacientes con SQF15, aunque se desconoce cuál es el mecanismo de acción concreto, ya que el uso de volanesorsen no recupera la actividad deprimida de LPL en estos pacientes. Ya en 2019 se publicó un ensayo clínico de fase 3 con 66 pacientes con SQF aleatorizados 1:1 a recibir volanesorsen 285 mg SC cada semana o placebo durante 52 semanas (APPROACH Study). El desenlace primario fue el descenso porcentual de los triglicéridos a los tres meses. A los tres meses los niveles de apo CIII cayeron un 84% y los triglicéridos lo hicieron un 77%, lo que correspondió a un descenso medio de 1.712 mg/dL. Igualmente, a los tres meses, un 77% de los pacientes con volanesorsen, pero solo un 18% de los asignados a placebo tuvieron unos triglicéridos de < 750 mg/dL, p < 0,0116. Los principales efectos adversos fueron la reacción en la zona de inyección, fundamentalmente enrojecimiento y prurito y la presencia de trombocitopenia < 100,000/mm3, que aconteció en 15 de los 33 pacientes asignados a volanesorsen (fig. 1).
Leyenda: Estudio APPROACH. Cambios en los niveles de triglicéridos a los tres meses. El panel A muestra los cambios porcentuales de los triglicéridos a los tres meses (desenlace primario) en los pacientes que recibieron placebo o volanesorsen a dosis de 300 mg cada semana. El panel B muestra las reducciones expresadas en mg/dL. Los datos muestran los resultados globales expresados como media e IC al 95%.
De acuerdo con la EMA, volanesorsen está indicado como un adyuvante a la dieta en un paciente adulto con diagnóstico genéticamente confirmado de SQF con elevado riesgo de pancreatitis en los cuales la respuesta a la dieta y otros fármacos se ha considerado inadecuada. La prescripción de volanesorsen está sujeta a un control, en principio quincenal, de los niveles de plaquetas y a reajustes de dosis en función de los mismos17.
Otros fármacos ensayados en el tratamiento del SQFVarios fármacos o nuevas terapias han sido evaluadas en el tratamiento de este síndrome. Pradigastat, un inhibidor de la enzima del enterocito DGAT1, que media en la síntesis de los triglicéridos de los QM, resultó en un descenso a las tres semanas de los Tg entre un 40 y un 70% dependiendo que la dosis fuera de 20 o 40 mg al día. Los efectos gastrointestinales, como la diarrea, fueron los efectos adversos más comunes18. Este fármaco no está comercializado.
Glybera®, Alipogen Tiparvovec, una terapia génica mediada por la inyección de adenovirus que contenían la variante genética S447X de ganancia de función en LPL, fue ensayada en pocos pacientes con SQF19, aunque finalmente fue retirada del mercado.
Finalmente, lomitapida, un agente capaz de reducir la actividad de la proteína trasferidora microsomal e inicialmente aprobado para su uso en la forma homocigota de hipercolesterolemia familiar, ha sido utilizado de forma anecdótica en un paciente con SQF con aceptable resultado clínico, pero empeoramiento notable del hígado graso del paciente20.
Tratamiento de la pancreatitis hipertrigliceridemiaLos efectos para la salud más graves del acúmulo de QM es el riesgo de desarrollar una pancreatitis aguda21. Esta complicación es más frecuente y recurrente en los pacientes con SQF que en los de QMF22. Aproximadamente, entre un 4 y un 8% de los sujetos ingresados por pancreatitis aguda lo son por esta causa7,23.
El tratamiento de una pancreatitis hipertrigliceridémica no difiere de la del resto de pancreatitis: dieta absoluta, aliviar el dolor, sueroterapia intravenosa. La formación de QM se reduce con el ayuno y en un plazo, por lo general, inferior a las 24 horas, sus niveles se han reducido por debajo de 1.000 mg/dL7.
La plasmaféresis, en el contexto de una pancreatitis hipertrigliceridémica, consigue reducir en más de un 70% la cifra de Tg y en pocas horas24. No obstante, aún contando con la bondad del procedimiento, no existen ensayos clínicos bien diseñados que permitan concluir con su beneficio. La plasmaféresis, de forma regular junto con nutrición parenteral total, ha sido utilizada para prevenir la pancreatitis aguda que surge en el embarazo de pacientes con SQF25.
FinanciaciónEste artículo ha sido financiado con ayuda sin restricciones por Akcea Therapeutics.
Conflicto de interesesPedro Valdivielso ha recibido honorarios por conferencias y asesorías de Amgen, Sanofi, Amarin, Akcea, Ferrer, MSD, Novartis, Daiichi-Sankyo, Pfizer, Astra-Zeneca.
Dra Alicia Navarro no tiene ningún conflicto de interés.
Nota al suplementoEste artículo forma parte del suplemento «Diagnóstico y tratamiento de las alteraciones del metabolismo de los triglicéridos: de la fisiopatología a la práctica clínica», que cuenta con el patrocinio de Akcea Therapeutics. Therapeutics.