La medicina cardiovascular actual está dirigida a la búsqueda de marcadores de riesgo genético con valor predictivo y/o pronóstico. Entre las variantes de interés se encuentran los polimorfismos G894T en el gen óxido nítrico sintasa endotelial y G1958A en el gen metilentetrahidrofolato deshidrogenasa1. El objetivo de este estudio fue determinar la posible asociación entre estos polimorfismos y la cardiopatía isquémica (CI) en el sureste de México (Yucatán).
MétodosEstudio de casos y controles con pareamiento por edad, sexo y lugar de nacimiento. Se estudiaron 98 pacientes con CI y 101 controles. Todos los participantes fueron evaluados para los factores de riesgo tradicionales. Los polimorfismos se identificaron utilizando la reacción en cadena de la polimerasa mediante análisis de la longitud de los fragmentos de restricción. Se obtuvo el consentimiento informado de todos los participantes.
ResultadosLos polimorfismos G894T y G1958A no mostraron asociación con la CI. Sin embargo, la estratificación según la manifestación clínica mostró que el genotipo TT (G894T) se asoció con la angina (OR=10,2; IC95%, 1,51-68,8; p=0,025). Se observó mayor frecuencia del genotipo GT en los pacientes con historia familiar de enfermedad coronaria. El análisis de regresión logística identificó al tabaquismo (OR=5,21; IC95%, 2,1-12,9; p=0,000), la hipertensión arterial (OR=3,54; IC95%, 1,47-8,56; p=0,005) y la obesidad (OR=1,16; IC95%, 1,1-1,27; p=0,001) como factores predictores de CI.
ConclusionesLos polimorfismos G894T y G1958A no mostraron asociación con la CI. Sin embargo, la homocigosis del alelo 894T (NOS3) confiere riesgo para el desarrollo de angina en Yucatán.
Cardiovascular medicine is focused on the search for genetic risk markers with predictive and/or prognostic value. Among the genetic variants of interest are G894T endothelial nitric oxide synthase and G1958A methylenetetrahydrofolate dehydrogenase1 gene polymorphisms. The aim of this study was to determine the possible association between these polymorphisms and ischemic heart disease in patients from Southern of Mexico (Yucatán).
MethodsCase-control study matched by age, sex and origin was designed. We studied 98 patients with coronary disease and 101 controls. Participants were evaluated for the usual risk factors. The polymorphisms were identified using the polymerase chain reaction/restriction fragment length polymorphism analysis. Informed consent was obtained from all participants.
ResultsThe G894T and G1958A polymorphisms were not associated with ischemic heart disease, however, the TT genotype (G894T) was associated with the angina (OR=10.2; 95%CI, 1.51-68.8; p=0.025). The genotype GT (G894T) was the most frequent in patients with family history of coronary artery disease. Multiple logistic regression analysis identified smoking (OR=5.21; 95%CI, 2.1-12.9; p=0.000), hypertension (OR=3.54; 95%CI, 1.47-8.56; p=0.005) and obesity (OR=1.16; 95%CI, 1.1-1.27; p=0.001) as risk factors predicting the ischemic heart disease.
ConclusionsThe G894T and G1958A polymorphisms showed not association with ischemic heart disease. However, homozygosis for the 894T allele (NOS3) confers at risk to develop angina on Yucatán.
La cardiopatía isquémica (CI) es la segunda causa de muerte en México, ocupando Yucatán el cuarto lugar entre los estados con las mayores tasas de mortalidad1. La medicina cardiovascular actual está interesada en el estudio de variantes genéticas asociadas a los procesos de estrés oxidativo y disfunción endotelial por constituir la génesis de la aterosclerosis2. Entre estas variantes se encuentran los genes candidatos que codifican para las enzimas óxido nítrico sintasa endotelial (NOS3 [NCBI ID: 4847]) y metilentetrahidrofolato deshidrogenasa1 (MTHFD1 [NCBI ID: 4522]).
El óxido nítrico (NO) es el principal regulador de la homeostasis vascular y el más potente vasodilatador endógeno. Es producido en el endotelio vascular, el endocardio, los cardiomiocitos, los monocitos y las plaquetas por la enzima NOS32. El NO posee un efecto ateroprotector y antitrombótico al inhibir la agregación plaquetaria, la adhesión de leucocitos al endotelio y la oxidación del colesterol de baja densidad, modular la proliferación de las células musculares lisas y participar en la angiogénesis y la apoptosis3,4.
Se ha sugerido que la relevancia del NO en la homeostasia vascular se debe a la variabilidad del gen NOS3, localizado en el cromosoma 7q35-36. De los polimorfismos de un solo nucleótido (SNP) identificados con importancia clínica, la única variación que provoca un cambio de aminoácido en la proteína es la variante G894T (rs1799983) en el exón 7, en la cual la sustitución del nucleótido guanina por timina da lugar al cambio del aminoácido glutamato por aspartato en la posición 298 del polipéptido (Glu298Asp)5. Se ha reportado que la actividad enzimática NOS3 está disminuida en los portadores del alelo 894T. Los homocigotos TT y los heterocigotos GT poseen solo el 20 y el 60%, respectivamente, de la actividad que poseen los homocigotos GG6, aunque hay reportes que no han demostrado déficit funcional asociado a este polimorfismo7.
Basado en la hipótesis de que G894T pueda tener un efecto desfavorable en la biodisponibilidad del NO endotelial, numerosos estudios de asociación han relacionado positivamente la presencia de la variante 894T (Asp298) con el riesgo de infarto de miocardio8,9, aterosclerosis carotídea10 y aterogénesis precoz11, aunque otros resultados no han mostrado asociación12,13. Estos estudios se han realizado en individuos caucásicos y asiáticos, siendo las referencias en poblaciones mestizas muy escasas.
La homocisteína (Hcy) es un producto intermedio del metabolismo de la metionina, cuyo aumento se relaciona inversamente con los niveles plasmáticos de folatos14. La hiperhomocisteinemia está considerada entre los nuevos factores de riesgo cardiovasculares al promover la disfunción endotelial y alterar la síntesis de NO. Su efecto provoca el fenómeno de desacoplamiento de la NOS3 haciendo que la enzima produzca superóxido en lugar de NO, propiciando la acumulación de radicales libres, disminución de NO y, por tanto, alteración del estado redox y mayor estrés oxidativo15. Estudios clínicos han confirmado que los pacientes con aumentos moderados de Hcy muestran signos de aterosclerosis a partir de la tercera o cuarta década de la vida, manifestando enfermedad coronaria prematura y episodios de trombosis venosa o arterial recurrente16,17. Aunque el gen MTHFD1 forma parte del metabolismo de la metionina, su efecto ha sido poco abordado en el ámbito de la enfermedad coronaria. El gen MTHFD1 se localiza en el locus 6q25.1 y codifica para una enzima trifuncional dependiente de NADP que actúa como 5,10 metilentetrahidrofolato deshidrogenasa, 5,10 metiletetrahidrofolato ciclohidrolasa y 10-formiltetrahidrofolato sintetasa18. El polimorfismo más estudiado en el gen MTHFD1 es G1958A (rs2236225), en el cual la sustitución del nucleótido guanina por adenina da lugar al cambio del aminoácido arginina por glutamina en la posición 653 del polipéptido (Arg653Glu). Este SNP se localiza dentro del dominio de la enzima 10-formiltetrahidrofolato sintetasa modulando la síntesis de purinas y metionina y afectando la metilación del ADN19,20.
Estudios de asociación de genoma completo han reportado asociación entre la variante G1958A y la enfermedad coronaria en poblaciones europeas21, asiáticas22 y de Norteamérica22,23. Sin embargo, aún no existen resultados concluyentes24,25.
En el sureste de México, la base genética de la CI ha sido muy poco explorada. La diversidad étnica de la población en Yucatán, resultado del mestizaje entre amerindios mayas y españoles predominantemente, y africanos y asiáticos en menor proporción26, hace meritorio un estudio de este tipo.
El objetivo de este trabajo fue determinar la posible asociación de los polimorfismos funcionales G894T en el gen NOS3 y G1958A en el gen MTHFD1 en pacientes con CI en Yucatán.
MétodosPoblación del estudioSe diseñó un estudio de casos y controles con pareamiento por edad, sexo y lugar de nacimiento. Los casos (n=98; 85 hombres, edad hasta 57años) fueron pacientes con diagnóstico de CI seleccionados en los servicios de cardiología del Hospital Regional del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE), y del Hospital General «Dr. Agustín O’Horan» en Mérida, Yucatán, entre agosto de 2012 y septiembre de 2013. Los criterios diagnósticos de CI (ACCF/AHA)27 fueron dolor precordial en reposo o al ejercicio mayor de 20min, con o sin cambios en el electrocardiograma (ECG) basal en reposo, con o sin alteraciones de marcadores enzimáticos, y cuyo diagnóstico fuese confirmado por cateterismo cardiaco. Se incluyeron pacientes con angina estable y síndromes coronarios agudos. La angina estable se diagnosticó como dolor precordial al esfuerzo que cede con el reposo, sin alteraciones electrocardiográficas y marcadores bioquímicos negativos. La angina inestable, como dolor precordial prolongado en reposo, con o sin cambios electrocardiográficos y marcadores bioquímicos positivos. El infarto, como dolor precordial, ECG con o sin elevación del segmento ST en 2 o más derivaciones contiguas de 2mm en V1-3 y 1mm en el resto de las derivaciones, y marcadores bioquímicos positivos para isquemia miocárdica28. Se consideraron marcadores bioquímicos positivos el incremento de la isoenzima MB de la creatinfosfocinasa (CK-MB) y troponinas en el percentil 99 o más.
Los controles (n=101; 87 hombres) se seleccionaron en el Centro Estatal de la Transfusión Sanguínea y en el Hospital Regional Mérida del ISSSTE, entre octubre de 2012 y noviembre de 2013. Se estudiaron sujetos aparentemente sanos, no relacionados, sin manifestaciones clínicas de CI, con ergometría negativa para isquemia miocárdica y sin historia familiar de enfermedad coronaria prematura (evento coronario en familiares de primer y/o segundo grado antes de los 55años en varones y antes de los 65años en mujeres).
A todos los sujetos se les aplicó un cuestionario para el registro de datos demográficos (edad, lugar de nacimiento, modo de vida), antropométricos (peso, talla, índice de masa corporal [IMC]) y epidemiológicos (hipertensión arterial [HTA], dislipidemia mixta, diabetes mellitus [DM], tabaquismo y actividad física). El IMC se calculó como peso/altura al cuadrado, estimándose la obesidad con un índice superior a 30. Se definió HTA como cifras iguales o superiores a 140/90mmHg, la DM como glucemia en ayunas mayor o igual a 200mg/dl, y la dislipidemia mixta cuando el valor del colesterol total plasmático y/o los triglicéridos fueron superiores a 200mg/dl. Se consideró fumador todo sujeto que hubiera consumido tabaco en el último año.
Todos los individuos se definieron étnicamente como mestizos, y declararon haber nacido en Yucatán y ser descendientes de padres y abuelos yucatecos. Previamente, se determinó la ausencia de subestructura dentro de la población de Yucatán, utilizando 15 marcadores autosómicos STR (Short Tandem Repeats)29, para evitar falsas asociaciones positivas por efecto de estratificación.
El estudio fue aprobado por el Comité de Ética de la Investigación del CIR (CEI-CIR-UADY-07-2012) y por los Comités de Investigación en Salud de ambos hospitales. Se obtuvo el consentimiento informado por escrito de todos los participantes.
Obtención de ADN y genotipificaciónEl ADN genómico se obtuvo a partir de 2ml de sangre periférica por un método de precipitación salina descrito por Bunce30. Ambos polimorfismos se determinaron por reacción en cadena de la polimerasa con análisis de la longitud de los fragmentos de restricción (PCR-RFLP). Para G894T (rs1799983) se utilizaron los oligonucleótidos 5’CATGAGGCTCAGCCCCAGACC-3’ (sentido) y 5’CACGCTAAACCCAAATACATCTC 3’ (antisentido). La mezcla de reacción contenía 50ng de ADN, 0,24uM de cada cebador y 1X de GoTaq Green Master Mix para un volumen total de 15ul. Las condiciones para la amplificación fueron: desnaturalización inicial a 95¿C por 5min, seguido de 30 ciclos, 1min a 94¿C, 30s a 59¿C y 1min a 72¿C, con extensión final a 72¿C por 7min. El amplificado de 206pb se digirió con la enzima de restricción MboI (New England BioLabs, Beverly, MA) durante 2h a 37¿C. Los productos obtenidos se separaron mediante electroforesis en gel de poliacrilamida al 12% teñido con nitrato de plata. La enzima MboI produce un único sitio de corte dando lugar a 2 fragmentos de 119 y 87pb, que corresponden con el alelo T.
Para G1958A (rs2236225) se utilizaron los oligonucleótidos (sentido) 5¿CACTCCAGTGTTTGTCCATG¿3 y (antisentido) 5¿GACTCTTGAGAGCCCTGAC¿3. Las condiciones de amplificación fueron: desnaturalización inicial por 5min a 95¿C seguida por 25 ciclos de 50s a 95¿C, 50s de alineación a 58¿C, 72¿C por 1,5min y 5min de extensión final a 72¿C. El amplificado de 330pb se digirió con la enzima de restricción HpaII (Fermentas, Canadá). Los productos obtenidos se separaron mediante electroforesis en gel de poliacrilamida al 12% teñido con nitrato de plata. La enzima HpaII corta el alelo silvestre G en fragmentos de 196, 70, 56 y 8pb.
Análisis estadísticoLos datos se analizaron con los programas SPSS 17.0 y Stata SE 10.1. Las variables continuas se expresaron como media ± desviación estándar, y las discretas, en porcentajes. Se utilizó la prueba de Chi cuadrado para comparar las variables categóricas, para contrastar diferencias en la distribución de los genotipos y los factores de riesgo entre los grupos, y para evaluar el equilibrio de Hardy-Weinberg. Las frecuencias genotípicas se calcularon por recuento directo, y las alélicas, a partir de los genotipos. Como medida de asociación se estimaron los odds ratio (OR) y sus intervalos de confianza del 95% (IC95%) para cada genotipo comparando con el homocigoto silvestre como referencia, considerando el modelo de herencia general (3 genotipos por separado). Se estimaron OR para la asociación entre la CI y la interacción gen-gen, y entre la CI y los factores de riesgo (HTA, dislipidemia mixta, DM, tabaquismo, sedentarismo, consumo de alcohol y obesidad (IMC>30). La interacción gen-ambiente se evaluó mediante análisis de regresión logística. Se consideró un nivel de significación de p<0,05.
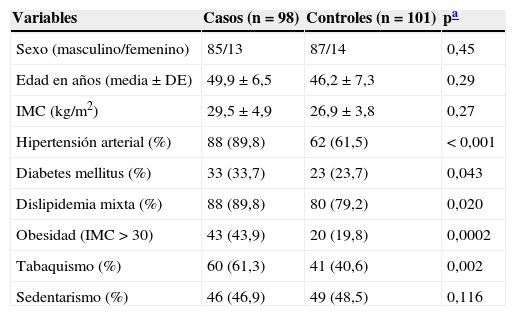
ResultadosCaracterísticas antropométricas, epidemiológicas y clínicas de la población estudiadaEn este estudio casos y controles no mostraron diferencias significativas respecto al sexo y al promedio de edad. Se observó una prevalencia de población urbana (93,9% en los casos vs 95,0% en los controles, p=0,48) con una distribución territorial hacia el noroeste del estado, donde se encuentra la zona metropolitana. La menor edad registrada fue de 28años en los casos y 30años en los controles. Las características antropométricas y epidemiológicas en ambos grupos se muestran en la tabla 1. Los factores de riesgo HTA, dislipidemia mixta, DM, obesidad y tabaquismo fueron significativamente más frecuentes en el grupo con CI. La actividad física y el promedio del IMC fueron similares en ambos grupos, con prevalencia de sobrepeso en la población general.
Comparación de las variables antropométricas y epidemiológicas en la población estudiada
| Variables | Casos (n=98) | Controles (n=101) | pa |
|---|---|---|---|
| Sexo (masculino/femenino) | 85/13 | 87/14 | 0,45 |
| Edad en años (media ± DE) | 49,9 ± 6,5 | 46,2 ± 7,3 | 0,29 |
| IMC (kg/m2) | 29,5 ± 4,9 | 26,9 ± 3,8 | 0,27 |
| Hipertensión arterial (%) | 88 (89,8) | 62 (61,5) | < 0,001 |
| Diabetes mellitus (%) | 33 (33,7) | 23 (23,7) | 0,043 |
| Dislipidemia mixta (%) | 88 (89,8) | 80 (79,2) | 0,020 |
| Obesidad (IMC > 30) | 43 (43,9) | 20 (19,8) | 0,0002 |
| Tabaquismo (%) | 60 (61,3) | 41 (40,6) | 0,002 |
| Sedentarismo (%) | 46 (46,9) | 49 (48,5) | 0,116 |
DE: desviación estándar.
El 79,6% de los pacientes tuvieron infarto de miocardio (con o sin elevación del segmento ST) y el 20,4%, angina. La elevación del segmento ST se presentó en 48 pacientes (49%). Respecto a la localización anatómica, el infarto anterior/lateral (46/78) y el inferior/posterior (29/78) fueron los más frecuentes. El 98,9% de los casos mostraron lesiones obstructivas significativas (mayores del 70%) con diferentes grados de lesión, predominando la enfermedad de 3 vasos (43,9%). La arteria más afectada fue la descendente anterior (69,4%), seguida de la coronaria derecha (57,1%) y la circunfleja (19,4%). Se encontraron diferencias significativas (p<0,001) entre los pacientes con (61,2%) y sin (38,8%) historia familiar de enfermedad coronaria. El 48,9% refirieron haber tenido, al menos, un familiar de primer grado con enfermedad isquémica prematura.
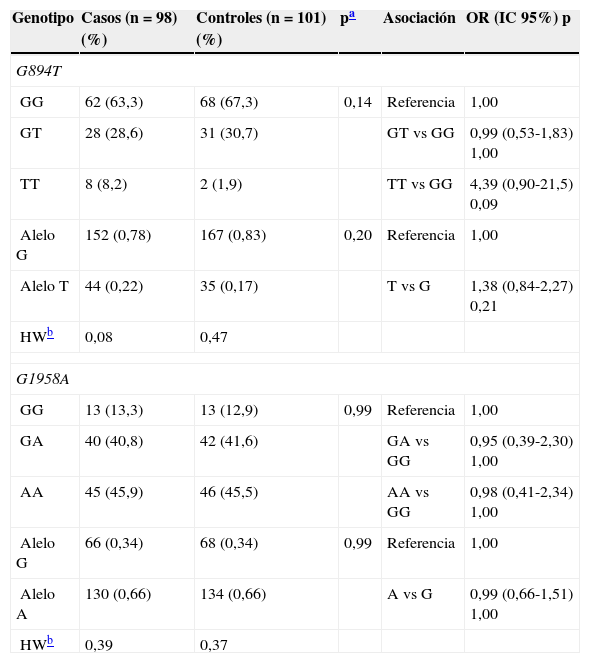
Análisis de asociaciónLa distribución de frecuencias alélicas y genotípicas, el equilibrio de Hardy-Weinberg y la estimación de riesgo para G894T y G1958A en casos y controles se muestra en la tabla 2. En ambos SNP las proporciones de genotipos se ajustaron al equilibrio de Hardy-Weinberg (p>0,05). La distribución de frecuencias de G894T y G1958A no mostró diferencias significativas entre casos y controles. En nuestra población, la frecuencia del alelo 894T (0,17 en controles) fue menor que la descrita en caucásicos (0,33)5,6, mayor que en asiáticos (0,04)31,32 y similar a la reportada en mestizos mexicanos (0,14)33. Por su parte, la frecuencias del alelo 1958A (0,66 en controles) resultó mayor a la observada en caucásicos (0,26)34 y asiáticos (0,19)35 pero similar a la reportada en mexicanos (0,61)36. En población abierta de Yucatán, la única referencia que conocemos procede de nuestro grupo de trabajo (datos no publicados) en 151 mestizos no relacionados, cuyas frecuencias genotípicas y alélicas se mostraron en equilibrio de Hardy-Weinberg (p=0,84), siendo similares (GG: 0,17; GA: 0,48; AA: 0,35; alelo A: 0,59) a las observadas en este estudio. No se encontró asociación significativa de los polimorfismos G894T y G1958A con la CI.
Distribución de frecuencias genotípicas y alélicas de los polimorfismos G894T (NOS3) y G1958A (MTHFD1), equilibrio de Hardy-Weinberg y asociación con la CI
| Genotipo | Casos (n=98) (%) | Controles (n=101) (%) | pa | Asociación | OR (IC 95%) p |
|---|---|---|---|---|---|
| G894T | |||||
| GG | 62 (63,3) | 68 (67,3) | 0,14 | Referencia | 1,00 |
| GT | 28 (28,6) | 31 (30,7) | GT vs GG | 0,99 (0,53-1,83) 1,00 | |
| TT | 8 (8,2) | 2 (1,9) | TT vs GG | 4,39 (0,90-21,5) 0,09 | |
| Alelo G | 152 (0,78) | 167 (0,83) | 0,20 | Referencia | 1,00 |
| Alelo T | 44 (0,22) | 35 (0,17) | T vs G | 1,38 (0,84-2,27) 0,21 | |
| HWb | 0,08 | 0,47 | |||
| G1958A | |||||
| GG | 13 (13,3) | 13 (12,9) | 0,99 | Referencia | 1,00 |
| GA | 40 (40,8) | 42 (41,6) | GA vs GG | 0,95 (0,39-2,30) 1,00 | |
| AA | 45 (45,9) | 46 (45,5) | AA vs GG | 0,98 (0,41-2,34) 1,00 | |
| Alelo G | 66 (0,34) | 68 (0,34) | 0,99 | Referencia | 1,00 |
| Alelo A | 130 (0,66) | 134 (0,66) | A vs G | 0,99 (0,66-1,51) 1,00 | |
| HWb | 0,39 | 0,37 | |||
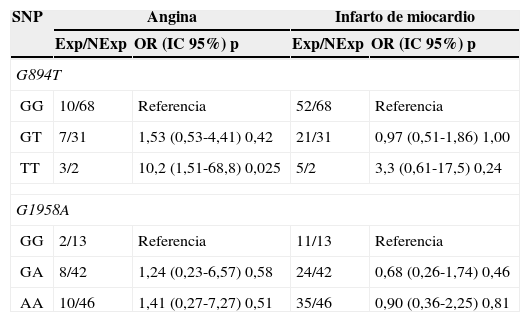
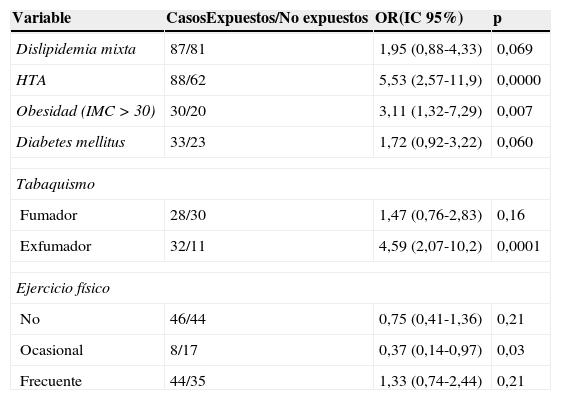
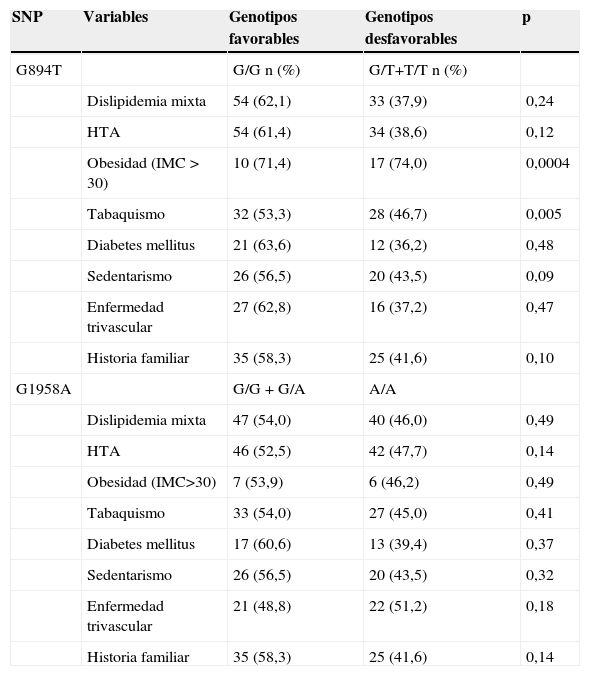
La tabla 3 muestra los riesgos estimados para cada polimorfismo de acuerdo con la manifestación clínica de la CI. Se encontró que el genotipo homocigoto 894TT confiere a sus portadores una susceptibilidad 10,2 veces mayor para angina en comparación con los portadores del genotipo silvestre (OR=10,2; IC95%, 1,51-68,8; p=0,025). La estimación de riesgo entre las variables epidemiológicas y la CI reveló asociación con la HTA (OR=5,53; IC95%, 2,57-11,9; p=0,0000), la obesidad (OR=3,11: IC95%, 1,32-7,29, p=0,007) y el tabaquismo (OR=4,59, IC95%, 2,07-10,2, p=0.0001) (tabla 4). La comparación de los factores de riesgo con las proporciones de polimorfismos favorables y desfavorables en los enfermos solo mostró diferencia significativa para la variante GT+TT (G894T) con la obesidad (p=0,0004) y el tabaquismo (p=0,005) (tabla 5). Por su parte, el análisis de genotipos combinados G894T/G1958A no encontró diferencias significativas entre casos y controles para ninguna de las 9 combinaciones observadas. En ambos grupos, GG/AA (32% vs 35%) y GG/GA (23% vs 24%) fueron las combinaciones más frecuentes, mientras que TT/AA, con los alelos de riesgo en homocigosis, solo se observó en el 3% de los enfermos, estando ausente en los controles.
Odds ratio (OR) de los polimorfismos G894T (NOS3) y G1958A (MTHFD1) con la angina y el infarto de miocardio
| SNP | Angina | Infarto de miocardio | ||
|---|---|---|---|---|
| Exp/NExp | OR (IC 95%) p | Exp/NExp | OR (IC 95%) p | |
| G894T | ||||
| GG | 10/68 | Referencia | 52/68 | Referencia |
| GT | 7/31 | 1,53 (0,53-4,41) 0,42 | 21/31 | 0,97 (0,51-1,86) 1,00 |
| TT | 3/2 | 10,2 (1,51-68,8) 0,025 | 5/2 | 3,3 (0,61-17,5) 0,24 |
| G1958A | ||||
| GG | 2/13 | Referencia | 11/13 | Referencia |
| GA | 8/42 | 1,24 (0,23-6,57) 0,58 | 24/42 | 0,68 (0,26-1,74) 0,46 |
| AA | 10/46 | 1,41 (0,27-7,27) 0,51 | 35/46 | 0,90 (0,36-2,25) 0,81 |
Exp/NExp: casos expuestos/casos no expuestos.
Asociación de factores de riesgo cardiovasculares con la CI
| Variable | CasosExpuestos/No expuestos | OR(IC 95%) | p |
|---|---|---|---|
| Dislipidemia mixta | 87/81 | 1,95 (0,88-4,33) | 0,069 |
| HTA | 88/62 | 5,53 (2,57-11,9) | 0,0000 |
| Obesidad (IMC > 30) | 30/20 | 3,11 (1,32-7,29) | 0,007 |
| Diabetes mellitus | 33/23 | 1,72 (0,92-3,22) | 0,060 |
| Tabaquismo | |||
| Fumador | 28/30 | 1,47 (0,76-2,83) | 0,16 |
| Exfumador | 32/11 | 4,59 (2,07-10,2) | 0,0001 |
| Ejercicio físico | |||
| No | 46/44 | 0,75 (0,41-1,36) | 0,21 |
| Ocasional | 8/17 | 0,37 (0,14-0,97) | 0,03 |
| Frecuente | 44/35 | 1,33 (0,74-2,44) | 0,21 |
Comparación de proporciones de los polimorfismos G894T y G1958A en los casos para las variables epidemiológicas y clínicas
| SNP | Variables | Genotipos favorables | Genotipos desfavorables | p |
|---|---|---|---|---|
| G894T | G/G n (%) | G/T+T/T n (%) | ||
| Dislipidemia mixta | 54 (62,1) | 33 (37,9) | 0,24 | |
| HTA | 54 (61,4) | 34 (38,6) | 0,12 | |
| Obesidad (IMC > 30) | 10 (71,4) | 17 (74,0) | 0,0004 | |
| Tabaquismo | 32 (53,3) | 28 (46,7) | 0,005 | |
| Diabetes mellitus | 21 (63,6) | 12 (36,2) | 0,48 | |
| Sedentarismo | 26 (56,5) | 20 (43,5) | 0,09 | |
| Enfermedad trivascular | 27 (62,8) | 16 (37,2) | 0,47 | |
| Historia familiar | 35 (58,3) | 25 (41,6) | 0,10 | |
| G1958A | G/G + G/A | A/A | ||
| Dislipidemia mixta | 47 (54,0) | 40 (46,0) | 0,49 | |
| HTA | 46 (52,5) | 42 (47,7) | 0,14 | |
| Obesidad (IMC>30) | 7 (53,9) | 6 (46,2) | 0,49 | |
| Tabaquismo | 33 (54,0) | 27 (45,0) | 0,41 | |
| Diabetes mellitus | 17 (60,6) | 13 (39,4) | 0,37 | |
| Sedentarismo | 26 (56,5) | 20 (43,5) | 0,32 | |
| Enfermedad trivascular | 21 (48,8) | 22 (51,2) | 0,18 | |
| Historia familiar | 35 (58,3) | 25 (41,6) | 0,14 |
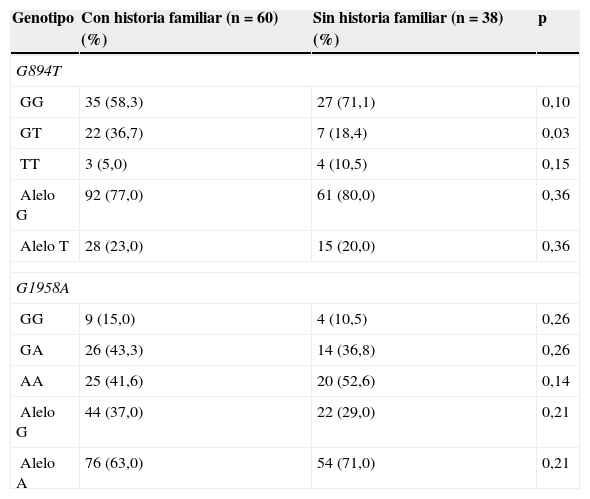
La comparación de frecuencias alélicas y genotípicas para G894T y G1958A entre los pacientes con y sin antecedentes familiares de enfermedad coronaria únicamente mostró una proporción significativamente mayor (p=0,03) del genotipo heterocigoto GT (G894T) en los pacientes con historia familiar de CI (tabla 6).
Comparación de frecuencias alélicas y genotípicas de los polimorfismos G894T y G1958A entre los pacientes con y sin antecedentes familiares de enfermedad coronaria
| Genotipo | Con historia familiar (n=60) (%) | Sin historia familiar (n=38) (%) | p |
|---|---|---|---|
| G894T | |||
| GG | 35 (58,3) | 27 (71,1) | 0,10 |
| GT | 22 (36,7) | 7 (18,4) | 0,03 |
| TT | 3 (5,0) | 4 (10,5) | 0,15 |
| Alelo G | 92 (77,0) | 61 (80,0) | 0,36 |
| Alelo T | 28 (23,0) | 15 (20,0) | 0,36 |
| G1958A | |||
| GG | 9 (15,0) | 4 (10,5) | 0,26 |
| GA | 26 (43,3) | 14 (36,8) | 0,26 |
| AA | 25 (41,6) | 20 (52,6) | 0,14 |
| Alelo G | 44 (37,0) | 22 (29,0) | 0,21 |
| Alelo A | 76 (63,0) | 54 (71,0) | 0,21 |
El análisis de regresión logística ajustado a los factores de riesgo excluyó a todos los genotipos, mostrando evidencia estadística de que G894T y G1958A no poseen capacidad para predecir un evento coronario en esta población. En el análisis multivariado las variables que mostraron asociación fueron el hábito de fumar (OR=5,21; IC95%, 2,1-12,9; p=0,000), la HTA (OR=3,54; IC95%, 1,47-8,56; p=0,005) y la obesidad medida como IMC (OR=1,16; IC95%, 1,1-1,27; p=0,001). El modelo pronóstico clasificó correctamente a 73 individuos de los 101 controles (especificidad, 72,3%) y a 70 enfermos de los 98 estudiados (sensibilidad, 71,4%).
DiscusiónEste estudio encontró que el tabaquismo, la HTA y la obesidad fueron los factores de riesgo cardiovasculares de mayor prevalencia en la población estudiada, y los que mejor predicen riesgo de CI. Los polimorfismos G894T y G1958T no mostraron asociación independiente con la enfermedad, lo cual se confirmó en el análisis multivariado. Sin embargo, el genotipo TT (G894T) mostró asociación (OR=10,2; IC95%, 1,51-68,8; p=0,025) para angina en la población estudiada, mientras que la variante GT se observó en mayor proporción en los pacientes con antecedentes familiares de enfermedad coronaria.
Las características cardiológicas observadas en los pacientes coinciden con resultados del Segundo Registro Nacional de Síndromes Coronarios Agudos (RENASICA-II) realizado en México a 8.098 pacientes37. En RENASICA-II, el tabaquismo (64%) y la HTA (55%) fueron los factores de riesgo de mayor prevalencia, seguidos de la DM (42%) y la hipercolesterolemia (27%). Coincidiendo con nuestros datos, el infarto de localización anterior (56%) se reportó como el más frecuente. Los hallazgos angiográficos del estudio RENASICA-II mostraron que los vasos con mayores lesiones significativas fueron la descendente anterior (62,5%) y la coronaria derecha (51%), seguidos de la circunfleja (40,5%), coincidiendo también con nuestros hallazgos.
Resulta de interés el sobrepeso observado en el grupo control, aun considerando que el IMC pudiera sobreestimar sobrepeso y obesidad en poblaciones de baja talla como la nuestra38. No obstante, en Yucatán este factor de riesgo ocupa el primer lugar nacional, siendo un problema de salud1,39. La elevada prevalencia de sobrepeso y obesidad en población urbana obedece, fundamentalmente, al consumo de una dieta de alto contenido energético, característica de la cultura culinaria de Yucatán, y a un clima que limita la práctica de ejercicio físico40.
La asociación entre G894T y la aterosclerosis coronaria se ha reportado, principalmente, en poblaciones caucásicas y asiáticas7,8,41, aunque otros estudios en estos grupos étnicos no han confirmado tales hallazgos12,13. Un reciente metaanálisis que involucró a 21.068 pacientes asoció significativamente la homocigocidad para el alelo 894T con el riesgo para infarto de miocardio (OR=1,41; IC95%, 1,08-1,84; p=0,012). Sin embargo, al considerar la etnicidad solo se encontró asociación en los asiáticos (p<0,05)42. En México, hasta donde conocemos, existe un solo reporte de asociación del genotipo TT (OR=2,2; IC95%, 1,11-3,6; p=0,03) con el infarto de miocardio a edad temprana en mestizos del centro del país43.
Aunque las asociaciones positivas involucran al genotipo 894TT con mayor disfunción endotelial, no existe consenso de asociación porque las consecuencias bioquímicas que provoca este polimorfismo no han sido totalmente definidas. Fairchild et al.44, mediante experimentos en bacterias transfectadas, demostraron que las enzimas NOS3 purificadas con secuencias Glu298 vs Asp298 resultaron idénticas con respecto a su actividad catalítica, lo cual fue confirmado por otros autores7. Esto no sorprende, ya que ambos aminoácidos en la posición 298 se localizan externamente y distantes del sitio activo de la enzima. Estudios funcionales también documentaron que G894T no influye en la estabilidad, la vida media y la actividad biológica de la enzima aislada, sugiriendo que sus mecanismos de regulación pudieran ser los afectados44. Sin embargo, los estudios sobre regulación han mostrado resultados controvertidos. McDonald et al.45 demostraron en células endoteliales humanas que la sustitución del glutamato por aspartado en la posición 298 del polipéptido no afecta la modulación de su actividad, mientras que Joshi et al.46 evidenciaron una regulación negativa de NOS3 cuando presenta las variantes Glu/Asp y Asp/Asp en comparación con Glu/Glu. Según estos autores, dicho efecto se debe a una interacción deficiente de la enzima con la caveolina-1 (complejo NOS3-Cav-1) en las caveolas endoteliales, observando que en condiciones de alta tensión de rozamiento (shear strees) las cantidades de NOS3 liberada por la Cav-1 son significativamente mayores en las células wild type. Este hallazgo pudiera explicar el creciente número de reportes clínicos que asocian la presencia del genotipo TT (Asp/Asp) con el riesgo de eventos cardiovasculares. El fundamento molecular sería que la interacción entre NOS3 conteniendo la variante aspartato y la caveolina-1 provoque una respuesta disminuida ante condiciones de estrés oxidativo, afectando así la regulación enzimática. Aunque otros estudios han confirmado que la internalización caveolar tiene un papel importante en la regulación de NOS347, debe considerarse que en ella intervienen una compleja cascada de eventos que incluyen la formación de complejos de señalización NOS348, la translocación intracelular49, el grado de fosforilación/desfosforilación sitio-específica, la disponibilidad de cofactores, la nitrosilación y acetilación49-51, así como estímulos externos como el shear strees48, los niveles de Ca++ y los estrógenos52.
Por otra parte, es probable que G894T sea un marcador indirecto de asociación con la enfermedad coronaria, o que ejerza un efecto sinérgico al formar haplotipos con otros polimorfismos (por ejemplo: T-786C, 4a/4b, VNTR de 27 pb), o por estar en desequilibrio de ligamiento con ellos, o bien que sean otras variantes de NOS3 las que impactan en su funcionalidad, como los SNP de la región promotora. Esta sinergia se observó entre el homocigoto 894T con al menos un aleloC del polimorfismo T-786C, el cual se asoció con un mayor riesgo para enfermedad coronaria53, y entre 894T y C4bT o T4bT con la miocardiopatía dilatada54.
Las inconsistencias observadas en los estudios de asociación pudieran atribuirse a las diferencias interpoblacionales encontradas en la distribución de las frecuencias alélicas y genotípicas de las variantes polimórficas, al número de pacientes estudiados y al posible afecto de estratificación entre casos y controles en poblaciones con diversidad étnica.
El polimorfismo G1958A ha sido evaluado en estudios de asociación de genoma completo. La asociación significativa con la enfermedad coronaria se observó en poblaciones caucásicas y asiáticas55, resultados que no se confirmaron en un estudio similar en población de origen afroamericano (RR=1,05; IC95%, 0,90-1,21; p=0,54) y caucásico europeo (RR=0,49; IC95%, 0,93-1,11; p=0,73)22,56. Esta discrepancia pudiera atribuirse a diferencias en el patrón de desequilibrio de ligamiento en la región donde se ubica este polimorfismo, el cual pudiera mostrar correlación con una variante causal en poblaciones caucásicas pero no en africanas o mestizas. Factores ambientales no identificados también pudieran modificar el efecto de esta posible variante de riesgo.
ConclusionesEste estudio no aportó evidencias sobre la asociación de los polimorfismos G894T (NOS3) y G1958A (MTHFD1) con la CI. La asociación encontrada entre el genotipo 894TT y la angina la consideramos un resultado preliminar debido al pequeño tamaño de la muestra, al menos para la variante 894T. Se requieren otros estudios genéticos en poblaciones mestizas y con mayor número de individuos para confirmar nuestros resultados. Este es el primer reporte sobre las frecuencias de estos polimorfismos en Yucatán.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónFondos Sectoriales de Salud-Conacyt 2112 01-180512.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo recibido de la Coordinación de Enseñanza e Investigación y la Jefatura de Medicina Interna del Hospital Regional Mérida del ISSSTE, así como de la Comisión de Investigación y Ética del Hospital General «Dr. Agustín O’Horan».