El consumo de dietas ricas en grasas se relaciona con alteraciones cardíacas caracterizadas por un proceso inflamatorio de baja intensidad mediado por NF-κB. PPARβ/δ ha sido propuesto como potencial diana terapéutica para paliar el proceso inflamatorio asociado a alteraciones cardiovasculares. Sin embargo, se desconoce la implicación de este receptor en la respuesta inflamatoria inducida por lípidos en el corazón.
MétodosSe determinó el perfil inflamatorio en el corazón de ratones alimentados con dieta rica en grasas en presencia o ausencia del activador de PPARβ/δ GW501516, en el corazón de ratones knockout PPARβ/δ, y en células cardíacas humanas AC16 estimuladas con palmitato, en presencia o ausencia de GW501516 y del antagonista de PPARβ/δ GSK0660.
ResultadosEl tratamiento con GW501516 disminuyó la expresión de IL-6, MCP-1 o TNF-α, así como la actividad de unión al ADN de NF-κB en el corazón de ratones tratados con dieta grasa. Además, el corazón de ratones knockout PPARβ/δ presentaba niveles aumentados de expresión de IL-6 y MCP-1, así como una mayor actividad de unión al ADN de NF-κB. En células AC16, el tratamiento con GW501516 disminuyó la expresión de TNF-α y MCP-1, así como el aumento de actividad de unión al ADN de NF-κB inducidos por palmitato. La administración de GW501516 a estas células incrementó la interacción entre PPARβ/δ y la subunidad p65 de NF-κB, y este cambio fue revertido por el antagonista de PPARβ/δ GSK0660.
ConclusionesLa activación de PPARβ/δ reduce la inflamación inducida por lípidos en células cardíacas a través de un mecanismo que implica la interacción física entre PPARβ/δ y p65.
High-fat diet intake is associated with cardiac disorders characterised by a low-grade inflammatory process which involves NF-κB activation. PPARβ/δ has been proposed as a potential therapeutic target to mitigate the inflammatory process related to cardiovascular disorders. However, the involvement of this receptor in lipid-induced inflammatory response in the heart is not yet known.
MethodsThe inflammatory profile was determined in hearts using mice fed with a high-fat diet (HFD) in the presence or absence of the PPARβ/δ agonist GW501516, in hearts from knockout PPARβ/δ mice, and in palmitate-exposed human cardiac AC16 cells in the presence or absence of GW501516 and the PPARβ/δ antagonist GSK0660.
ResultsGW501516 treatment reduced the induction in the cardiac expression of IL-6, MCP-1 and TNF-α, as well as the increase in DNA-binding NF-κB activity, in mice fed the HFD. Furthermore, hearts from knockout PPARβ/δ mice exhibited increased IL-6 and MCP-1 levels, as well as higher NF-κB DNA-binding activity. In AC16 cells, GW501516 treatment reduced the expression of TNF-α and MCP-1, as well as the increase in NF-κB DNA-binding activity caused by palmitate. GW501516 addition to these cells increased the interaction between PPARβ/δ and the p65 subunit of NF-κB, whereas it was prevented in the presence of the PPARβ/δ antagonist GSK0660.
ConclusionsPPARβ/δ activation reduces lipid-induced inflammation in cardiac cells through a mechanism involving the physical interaction between PPARβ/δ and p65.
En situaciones patológicas, el corazón humano puede secretar citocinas y quimiocinas proinflamatorias como el factor de necrosis tumoral-α (TNF-α), la proteína quimotáctica de monocitos-1 (MCP-1) o la interleucina-6 (IL-6)1. Estas moléculas pueden ejercer efectos pleiotrópicos autocrinos en las células cardíacas que contribuyen al desarrollo de alteraciones asociadas con un estado de inflamación del miocardio, como la lesión isquémica del miocardio, la insuficiencia cardíaca o la cardiomiopatía dilatada2,3. Las citocinas proinflamatorias se encuentran bajo el control transcripcional del factor nuclear-κB (NF-κB), factor que se encuentra activado en la miocarditis, la insuficiencia cardíaca congestiva y la hipertrofia cardíaca4.
Debido a su alto contenido en grasa, la clásica dieta Western presenta diferentes efectos sobre la fisiología cardiovascular que parecen estar presentes en el desarrollo de enfermedades cardiovasculares. De hecho, las dietas ricas en grasa han sido relacionadas directamente con una amplia variedad de efectos adversos a nivel cardíaco, incluyendo inflamación, hipertrofia, fibrosis y disfunción contráctil5. Sin embargo, los mecanismos a través de los cuales el consumo de dietas ricas en grasas participa en la progresión de estos trastornos son aún poco conocidos. Los mecanismos subyacentes a estos procesos son complejos, ya que se encuentran unidos a alteraciones sistémicas del metabolismo y cambios en el fenotipo del cardiomiocito. Por ejemplo, durante el desarrollo de la hipertrofia y la insuficiencia cardíaca se observa un desplazamiento del sustrato energético utilizado por el miocardio, desde los ácidos grasos hacia la glucosa6,7. La captación y el metabolismo de estos sustratos se encuentran sometidos al control transcripcional de los receptores activados por proliferadores peroxisómicos (peroxisome proliferator-activated receptors, PPAR). Los PPAR son factores de transcripción activados por ligando que pertenecen a la superfamilia de los receptores nucleares. Para ser transcripcionalmente activos, estos receptores nucleares forman heterodímeros con el receptor del ácido 9-cis retinoico (NR2B), lo que les permite reconocer secuencias específicas de ADN denominadas elementos de respuesta a proliferadores peroxisómicos (PPRE) y situadas en la región promotora de sus genes diana. La subfamilia PPAR consta de 3 isotipos: PPARα (NR1C1), PPARβ/δ (NR1C2) y PPARγ (NR1C3). PPARβ/δ es la forma predominante en células cardíacas y es el único isotipo de PPAR para el que todavía no existen fármacos comercializados. El desarrollo de distintos ligandos sintéticos, como GW0742, GW501516 o L-165041, ha permitido en los últimos años profundizar en el conocimiento de las funciones de PPARβ/δ.
Evidencias recientes sugieren que los PPAR pueden atenuar las vías de señalización inflamatoria y, por lo tanto, interferir en el proceso de remodelación cardíaca. La activación de estos receptores facilita la formación de complejos con otros factores de transcripción, como NF-κB y STAT (signal transducer and activator of transcription), resultando de este modo en una inhibición de su actividad transcripcional8. Estudios previos realizados por nuestro grupo de investigación demostraron que el tratamiento con L-165041 inhibía la activación de NF-κB inducida por fenilefrina y lipopolisacárido en cultivos primarios de cardiomiocitos neonatales de rata, así como en células embrionarias de corazón de rata H9c27. Los efectos anti-hipertróficos de este agonista de PPARβ/δ eran debidos a la atenuación de la vía de señalización de NF-κB a través de un mecanismo que implicaba la interacción física entre la subunidad p65 de este factor de transcripción y PPARβ/δ9.
La alimentación crónica de ratones con una dieta enriquecida en grasa (HFD, del inglés high-fat diet) induce el desarrollo de diabetes y obesidad, mientras que la exposición a esta dieta durante periodos de tiempo más cortos provoca una resistencia a la insulina a nivel sistémico y miocárdico, induciendo un incremento de la remodelación del ventrículo izquierdo y una disfunción cardíaca10. El presente estudio pretende examinar el efecto del agonista de PPARβ/δ GW501516 sobre el proceso inflamatorio inducido en el corazón de ratones alimentados durante 3 semanas con una dieta HFD. Se seleccionó este periodo de tiempo para estudiar los efectos específicos de la inflamación inducida por lípidos en corazón, evitando otros factores que pudieran interferir como la obesidad o la diabetes. No obstante, debido a que los niveles de expresión de los PPAR son más bajos en células humanas que en células de roedores11, y que la expresión génica se encuentra también diferencialmente regulada por los PPAR en estas 2 especies12, los resultados obtenidos en modelos murinos no siempre pueden ser extrapolados a humanos. Para solventar las posibles discrepancias encontradas entre ambas especies se utilizaron células AC16, una línea celular cardíaca de origen humano, que fueron tratadas con el ácido graso saturado palmitato.
MétodosReactivosEl ligando de PPARβ/δ GW501516 fue obtenido de Alexis Biochemicals (Lausen, Suiza). El resto de reactivos proceden de Sigma-Aldrich (St. Louis, Missouri, EE.UU.).
Cultivo celularLas células humanas AC16 fueron cultivadas tal y como se ha descrito previamente13. Brevemente, células AC16 no diferenciadas fueron mantenidas con medio de cultivo DMEM (Dulbecco's modified Eagle's medium):F12 (Invitrogen, Barcelona, España) suplementado con un 12,5% de suero bovino fetal, 1% de penicilina-estreptomicina y 1% de fungizona (Invitrogen), en un incubador a 37°C y 5% de CO2, hasta llegar a un 70-80% de confluencia. Las células fueron entonces estimuladas durante 18h con un medio que contenía palmitato (0,25mM), en presencia o ausencia de GW501516 (10μM) o GSK0660 (1μM). El medio con palmitato fue preparado por conjugación con ácidos grasos libres y BSA según ha sido descrito anteriormente14.
AnimalesLos ratones fueron mantenidos bajo condiciones estándar de iluminación (ciclos de 12h de luz/oscuridad) y temperatura (21±1°C) y alimentados con una dieta estándar hasta el comienzo de los estudios, teniendo acceso ad líbitum a bebida y alimento durante todo el procedimiento. La investigación fue realizada de acuerdo con la Guía para el Cuidado y el Uso de Animales de Laboratorio publicada por el US National Institutes of Health (NIH Publication n.° 85-23, revisada en 1996). Todos los procedimientos fueron aprobados por el Comité Ético de la Universidad de Barcelona, conforme a lo establecido en la Ley 5/21 de julio del 1995 aprobada por la Generalitat de Cataluña y la Comisión de Vigilancia de la Experimentación Animal del Cantón de Vaud (Suiza).
Treinta ratones CD-1 macho de 5 semanas de edad fueron aleatorizados en 2 grupos experimentales (n=15 cada uno) y alimentados con una dieta HFD (35% de peso de grasa, Harlan Ibérica S.A., Barcelona, España) durante 3 semanas. Durante este periodo, los ratones recibieron diariamente una dosis por vía oral del vehículo (0,5% p/v de carboximetilcelulosa de viscosidad media) o una dosis de 3mg/kg/día del agonista de PPARβ/δ GW501516 disuelto en el vehículo. Animales alimentados con una dieta de estándar (4% grasa, Harlan Teklad) fueron utilizados como controles (n=15).
Por otro lado, los ratones transgénicos macho deficientes para el gen PPARβ/δ (KO PPARβ/δ, n=5) fueron alimentados con una dieta estándar. Ratones wild type (n=5) con la misma dotación genética (C57BL76X129/SV) fueron utilizados como controles. La generación y caracterización del ratón KO PPARβ/δ fue previamente realizada en el laboratorio del Dr. Walter Wahli15.
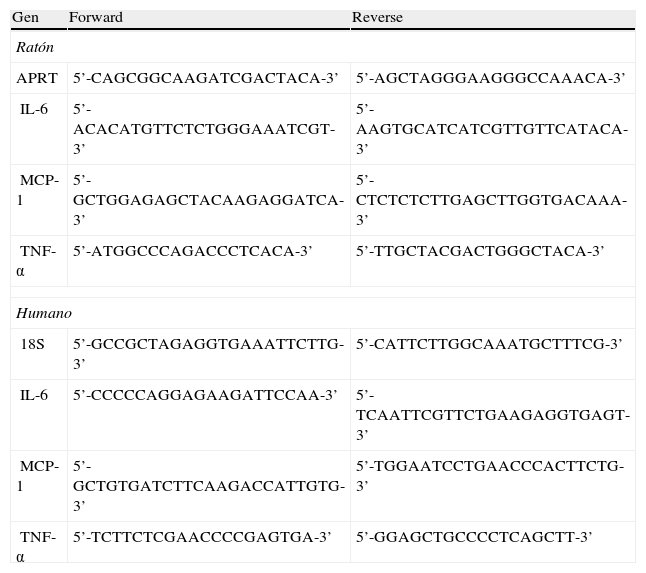
Preparación y análisis del ácido ribonucleicoLos niveles relativos de ARNm fueron analizados mediante la técnica de transcriptasa reversa asociada a la reacción en cadena de la polimerasa a tiempo real (RT [real time] PCR), tal y como se ha descrito previamente13. El ARN total fue aislado utilizando el reactivo Ultraspec (Biotecx, Houston, Texas, EE.UU.), siguiendo las indicaciones del fabricante. Las secuencias utilizadas para la amplificación se muestran en la tabla 1.
Oligonucleótidos utilizados para la reacción en cadena de la polimerasa (PCR)
| Gen | Forward | Reverse |
| Ratón | ||
| APRT | 5’-CAGCGGCAAGATCGACTACA-3’ | 5’-AGCTAGGGAAGGGCCAAACA-3’ |
| IL-6 | 5’-ACACATGTTCTCTGGGAAATCGT-3’ | 5’-AAGTGCATCATCGTTGTTCATACA-3’ |
| MCP-1 | 5’-GCTGGAGAGCTACAAGAGGATCA-3’ | 5’-CTCTCTCTTGAGCTTGGTGACAAA-3’ |
| TNF-α | 5’-ATGGCCCAGACCCTCACA-3’ | 5’-TTGCTACGACTGGGCTACA-3’ |
| Humano | ||
| 18S | 5’-GCCGCTAGAGGTGAAATTCTTG-3’ | 5’-CATTCTTGGCAAATGCTTTCG-3’ |
| IL-6 | 5’-CCCCCAGGAGAAGATTCCAA-3’ | 5’-TCAATTCGTTCTGAAGAGGTGAGT-3’ |
| MCP-1 | 5’-GCTGTGATCTTCAAGACCATTGTG-3’ | 5’-TGGAATCCTGAACCCACTTCTG-3’ |
| TNF-α | 5’-TCTTCTCGAACCCCGAGTGA-3’ | 5’-GGAGCTGCCCCTCAGCTT-3’ |
El ensayo de retardo de la movilidad electroforética (EMSA, del inglés electrophoretic mobility shift assay) se realizó como se ha descrito previamente13. Brevemente, oligonucleótidos de doble cadena para la secuencia consenso de unión de NF-κB (5’-AGTTGAGGGGACTTTCCCAGGC-3’) (Promega, Madison, Wisconsin, EE.UU.) fueron marcados con [γ-32P]ATP (3.000 Ci/mmol a 10 mCi/ml) y purificados mediante columnas Nick (Amersham). Se incubaron 8μg de extractos nucleares con 60.000cpm de sonda marcada y se realizaron ensayos de competición con un exceso de sonda fría y de súper-retardo con anticuerpos específicos contra p65 y Oct-1 (Santa Cruz). Los complejos proteína-ADN fueron separados a 4°C en un gel de acrilamida al 5% (p:v) y sometidos a autorradiografía.
Análisis de Western-blotLas proteínas fueron separadas en geles de SDS-PAGE al 10% (p:v) de acrilamida y transferidas a membranas de polivilideno (Millipore, Bedford, Missouri, EE.UU.). La inmunodetección se realizó utilizando anticuerpos específicos contra IκBα (total y fosforilada en Ser32) (Cell Signaling), p65 (Santa Cruz), lámina B (Sigma) y β-actina (Sigma), y el kit de quimioluminiscencia EZ-ECL (Amersham). El tamaño de las proteínas se determinó utilizando un estándar de pesos moleculares (Invitrogen, Barcelona, España).
Estudios de coinmunoprecipitaciónLos extractos nucleares de células AC16 fueron llevados a un volumen final de 250μl con un tampón que contenía 10mM de PBS, 50mM de KCl, 0,05mM de EDTA, 2,5mM de MgCl2, 8,5% de glicerol, 1mM de dithiothreitol, 0,1% de Triton X-100, 2% de BSA y 1mg/ml de proteínas de leche desnatada durante 18h a 4°C, e incubados con 4μg de anticuerpo contra p65. Los inmunocomplejos fueron captados a través de la incubación de las muestras con 50μl de una solución de proteína A-agarosa (Santa Cruz) durante 6h a 4°C. Las perlas de agarosa fueron recuperadas por centrifugación y lavado. Después de la centrifugación, el pellet fue resuspendido en tampón de carga y hervido durante 5min a 100°C. El sobrenadante resultante fue sometido a electroforesis en geles de proteínas SDS-PAGE al 10% de acrilamida, y transferido a membranas de polivilideno. La inmunodetección se realizó utilizando anticuerpos contra PPARβ/δ siguiendo la metodología explicada en el apartado de Western-blot.
Análisis estadísticosLos resultados se expresan como la media±desviación estándar de al menos 4 experimentos independientes. Las diferencias significativas fueron establecidas mediante los tests estadísticos t de Student o ANOVA, dependiendo del número de grupos comparados, y utilizando el programa informático GaphPad Prism (GraphPad Software Inc, San Diego, California, EE.UU.). En los casos en que se encontraron diferencias significativas, se aplicó el post-test de Tukey-Kramer para comparaciones múltiples. Las diferencias fueron consideradas significativas a partir de p<0,05.
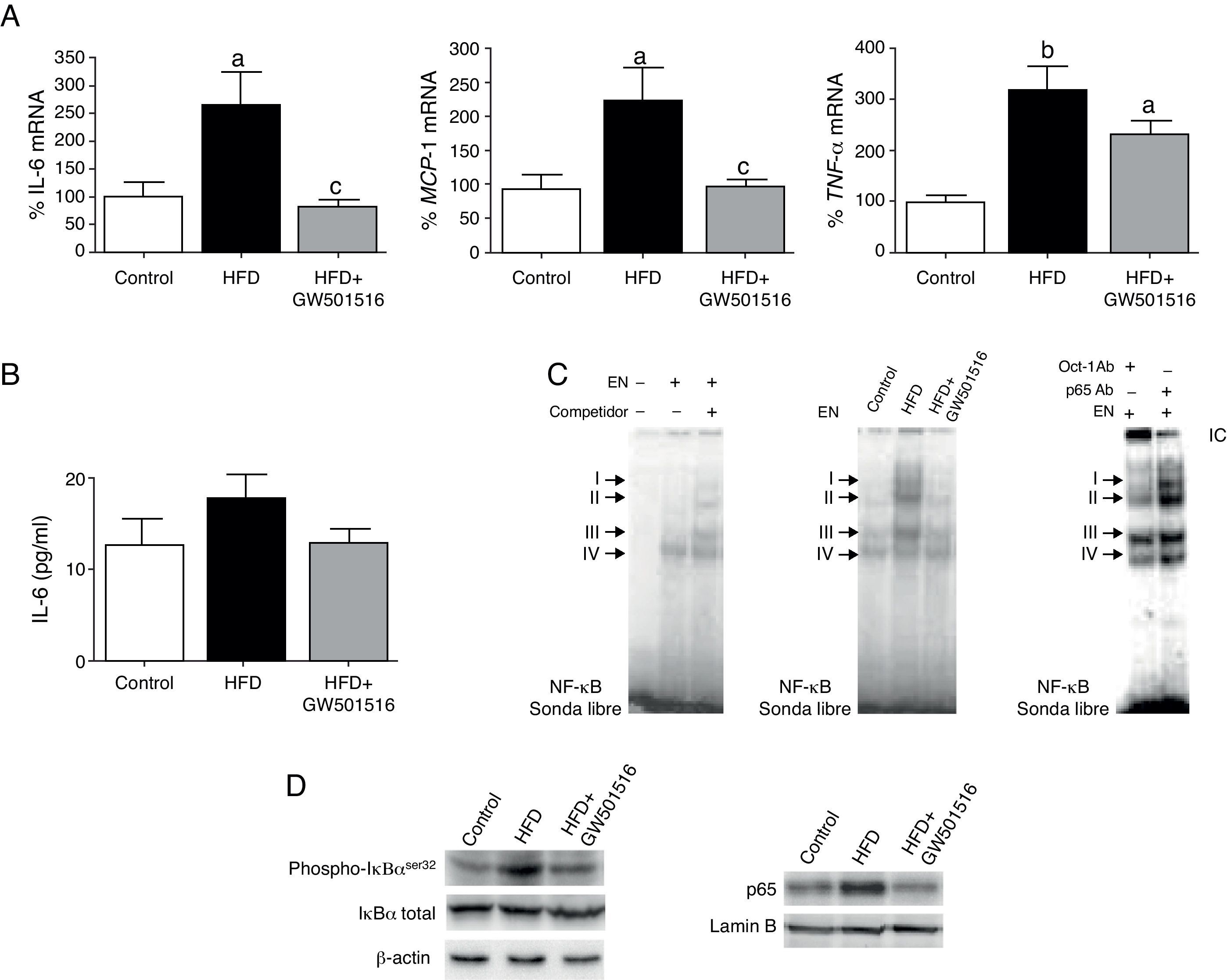
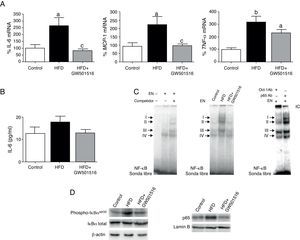
ResultadosGW501516 previene el perfil proinflamatorio inducido por dieta grasa en el corazón de ratonesEl corazón de ratones alimentados con dieta grasa presentaba un aumento significativo en la expresión de distintos marcadores de inflamación, como IL-6, TNF-α y MCP-1 (fig. 1A), a pesar de que los niveles plasmáticos de IL-6 no se encontraban modificados (fig. 1B). Mediante ensayos de EMSA se observó que la dieta grasa incrementaba la actividad de unión al ADN de NF-κB, específicamente de los complejos I, II y III (fig. 1C). Ensayos de súper-retardo demostraron que los complejos I, II y IV y, en menor medida, el complejo III, contenían la subunidad p65 de este factor de transcripción. En estado basal, NF-κB se encuentra inactivo en citoplasma unido a la proteína inhibidora IκB. Al producirse un estímulo, la IκB cinasa fosforila a IκBα en el residuo Serina 32, provocando de este modo su degradación en el proteosoma, y permitiendo que NF-κB transloque al núcleo y estimule la transcripción de sus genes diana. Como se muestra en la figura 1D, la dieta rica en grasa incrementó los niveles de IκBα fosforilada en Ser32 e indujo la translocación nuclear de p65 en células cardíacas. La respuesta proinflamatoria observada en ratones alimentados con una dieta rica en grasas fue prevenida por el tratamiento con GW501516, fármaco que redujo la expresión de citocinas, la actividad de unión al ADN de NF-κB, la fosforilación de IκBα en Ser32 y la translocación nuclear de p65.
El agonista de PPARβ/δ GW501516 previene el perfil proinflamatorio inducido por dieta grasa en el corazón de ratones. A) Efecto de GW501516 sobre la expresión de IL-6 (izquierda), MCP-1 (centro) y TNF-α (derecha) en el corazón de ratones alimentados con una dieta enriquecida en grasa (HFD) o con una dieta HFD que además fueron tratados con GW501516 (HFD+GW501516). Los ratones alimentados con una dieta estándar fueron utilizados como control (Control). La cuantificación relativa de los niveles de ARNm se encuentra normalizada por los niveles de ARNm de APRT. B) Determinación mediante ELISA de los niveles plasmáticos de IL-6 de ratones alimentados con una dieta estándar (control), una dieta HFD o una dieta HFD y tratados con GW501516. C) La autorradiografía representativa del ensayo de EMSA muestra la actividad de unión al ADN de NF-κB en corazón. D) Niveles de proteína IκBα total y fosforilada en Ser32 (extractos de proteína total) y p65 (extractos nucleares) en el corazón de ratones alimentados con una dieta estándar (Control), una dieta HFD o una dieta HFD y tratados con GW501516. Los datos se expresan como la media±desviación estándar de 4 experimentos independientes. ap<0,05; bp<0,01 vs. Control; cp<0,05 vs. HFD.
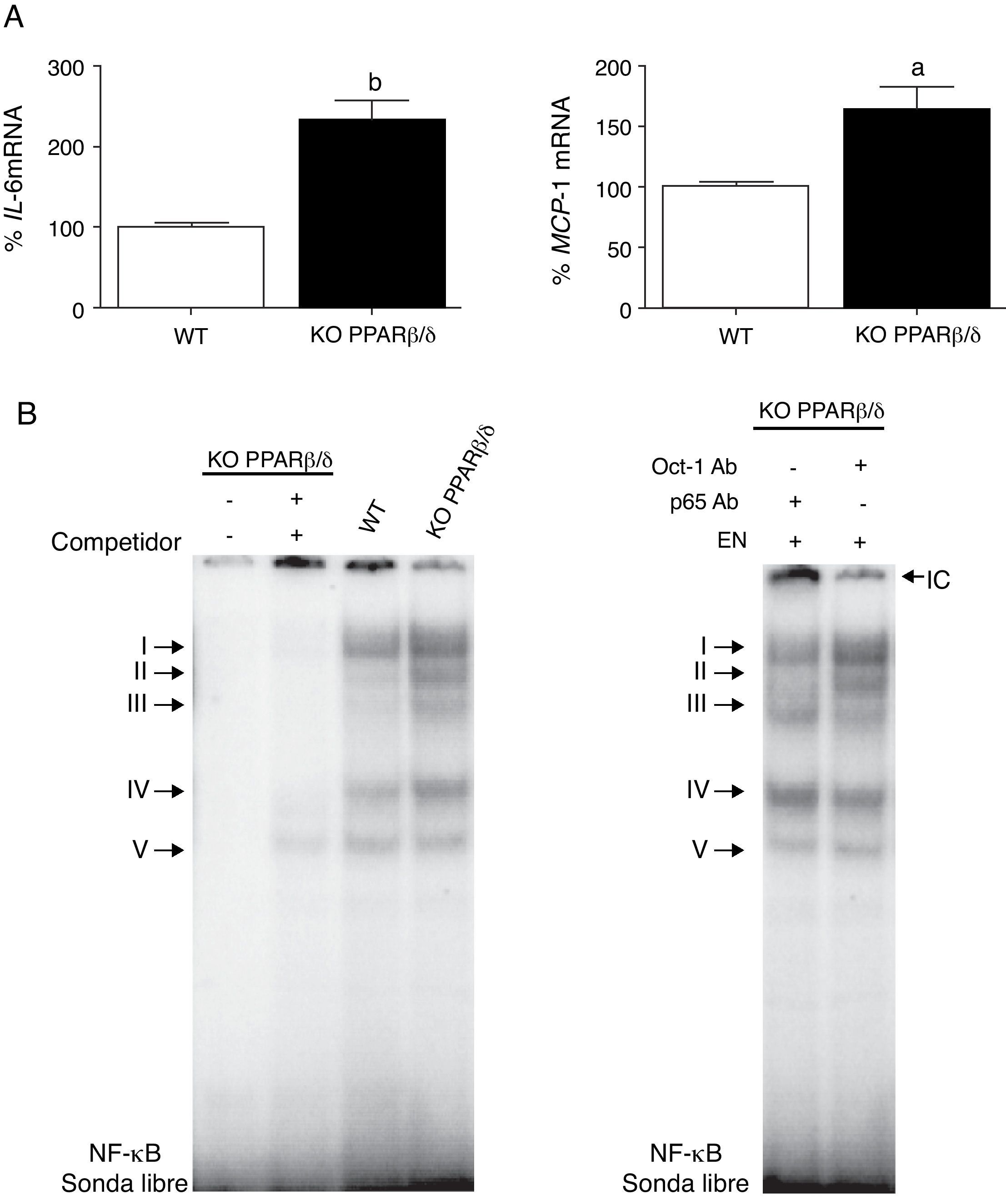
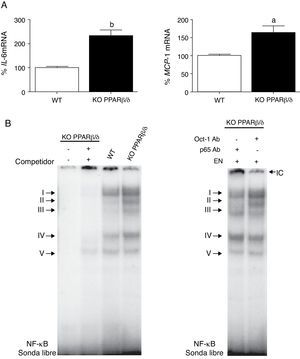
Para explorar los mecanismos subyacentes del bloqueo del perfil proinflamatorio provocado por GW501516, examinamos distintos componentes de la vía de señalización inflamatoria en el corazón de ratones knockout PPARβ/δ. Estos ratones mostraron un incremento en la expresión de IL-6 y MCP-1 al compararlos con ratones wild-type (fig. 2A). La actividad de unión al ADN de NF-κB, específicamente de los complejos I al IV, también se encontró claramente incrementada en el corazón de ratones knockout PPARβ/δ (fig. 2B).
Los ratones knockout PPARβ/δ presentan un perfil proinflamatorio aumentado en el corazón. A) Análisis de los valores de ARNm de IL-6 (izquierda) y MCP-1 (derecha) en el corazón de ratones wild-type (WT) o PPARβ/δ KO. La cuantificación relativa de los niveles de ARNm se encuentra normalizada por los niveles de ARNm de APRT. B) La autoradiografía representativa del ensayo de EMSA muestra la actividad de unión al ADN de NF-κB en corazón de ratones WT y knockout PPARβ/δ. ap<0,05; bp<0,01 vs. WT.
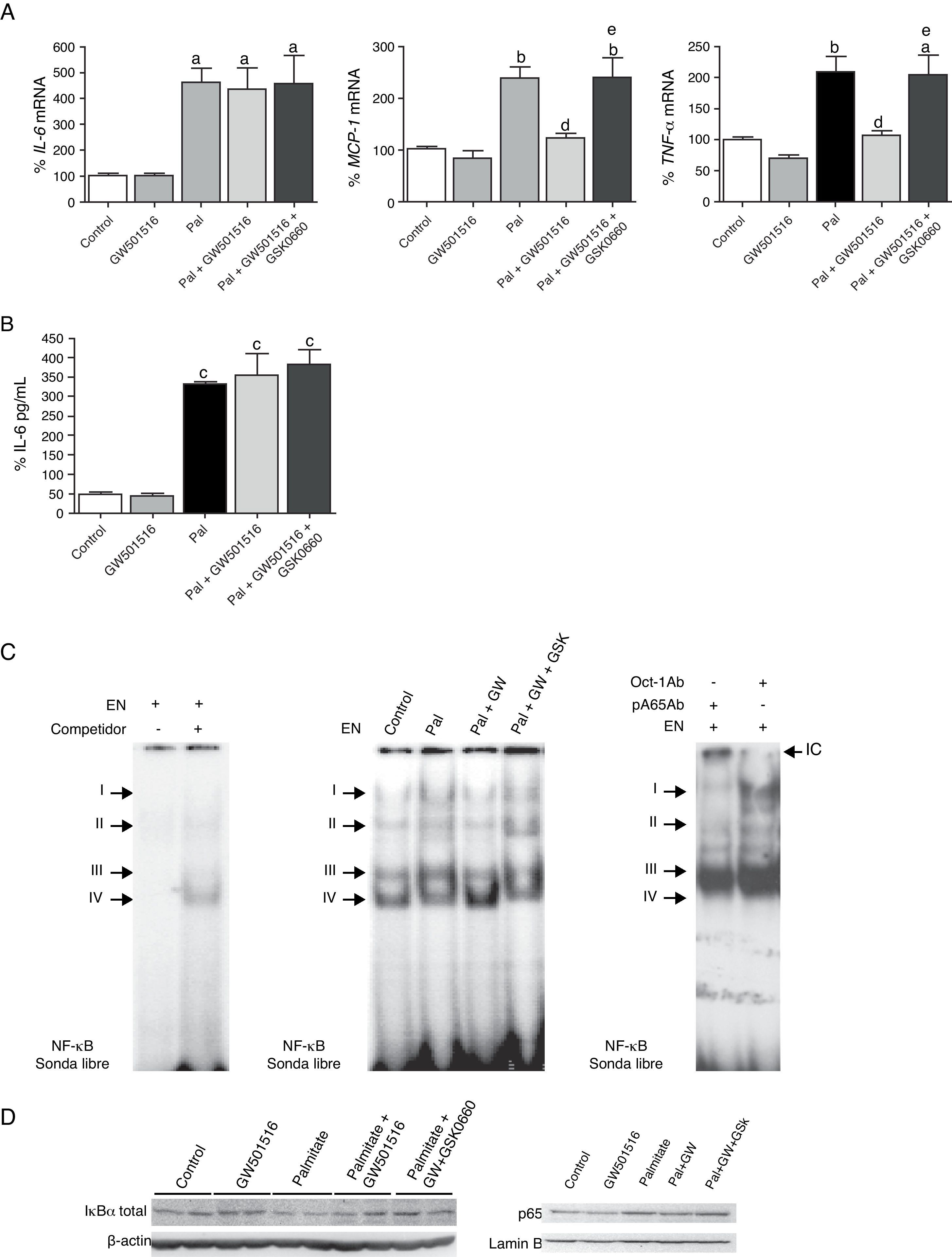
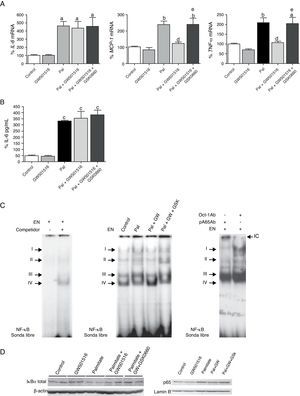
Para estudiar los efectos de los ácidos grasos en células cardíacas humanas, células AC16 fueron expuestas a uno de los ácidos grasos saturados más comunes, el palmitato (0,25mM). Éste indujo la expresión (fig. 3A) y la secreción (fig. 3B) de IL-6 en células AC16, así como la expresión de MCP-1 y TNF-α (fig. 3A). Además, la estimulación con palmitato indujo la actividad de unión al ADN de NF-κB de los complejos I al III (fig. 3C). Del mismo modo que los resultados encontrados con el modelo de ratones alimentados con dieta grasa, el palmitato disminuyó los niveles de proteína IκBα e incrementó los niveles de proteína p65 en extractos nucleares (fig. 3D). La administración de GW501516 a células AC16 bloqueó completamente el incremento en la expresión de MPC-1 y TNF-α (fig. 3A) y el aumento en la actividad NF-κB (fig. 3C y D) inducidos por palmitato. Sin embargo, el tratamiento con GW501516 no revertió el efecto del palmitato sobre la expresión y la secreción de IL-6 (fig. 3A y B). Para elucidar si los efectos del GW501516 sobre los procesos inflamatorios eran consecuencia de cambios en la actividad de PPARβ/δ, utilizamos un antagonista específico de PPARβ/δ, el GSK066016. Este compuesto previno los efectos antiinflamatorios de GW501516 en presencia de palmitato.
La activación de PPARβ/δ previene el perfil proinflamatorio inducido por palmitato en células cardíacas humanas AC16. A) Efecto del GW501516 y del GSK0660 sobre la expresión de IL-6 (izquierda), MCP-1 (centro) y TNF-α (derecha) inducida por palmitato (Pal) en células AC16. La cuantificación relativa de los niveles de ARNm se encuentra normalizada por los niveles de 18S. Los datos se expresan como la media±desviación estándar de 4 experimentos independientes. B) Determinación por ELISA de los niveles de IL-6 secretados al medio de cultivo de células AC16 estimuladas con palmitato en presencia y ausencia de GW501516 y de GSK0660. C)La autorradiografía representativa del ensayo de EMSA muestra la actividad de unión al ADN de NF-κB en células AC16 estimuladas con palmitato (Pal), en presencia y ausencia de GW501516 y de GSK0660. D)Niveles de proteína IκBα (extractos de proteína total) y p65 (extractos nucleares) en células AC16 estimuladas con palmitato (Pal), en presencia y ausencia de GW501516 y de GSK0660. ap<0,05; bp<0,01; cp<0,001 vs. Control; dp<0,05 vs. Pal; ep<0,05 vs. Pal+GW501516.
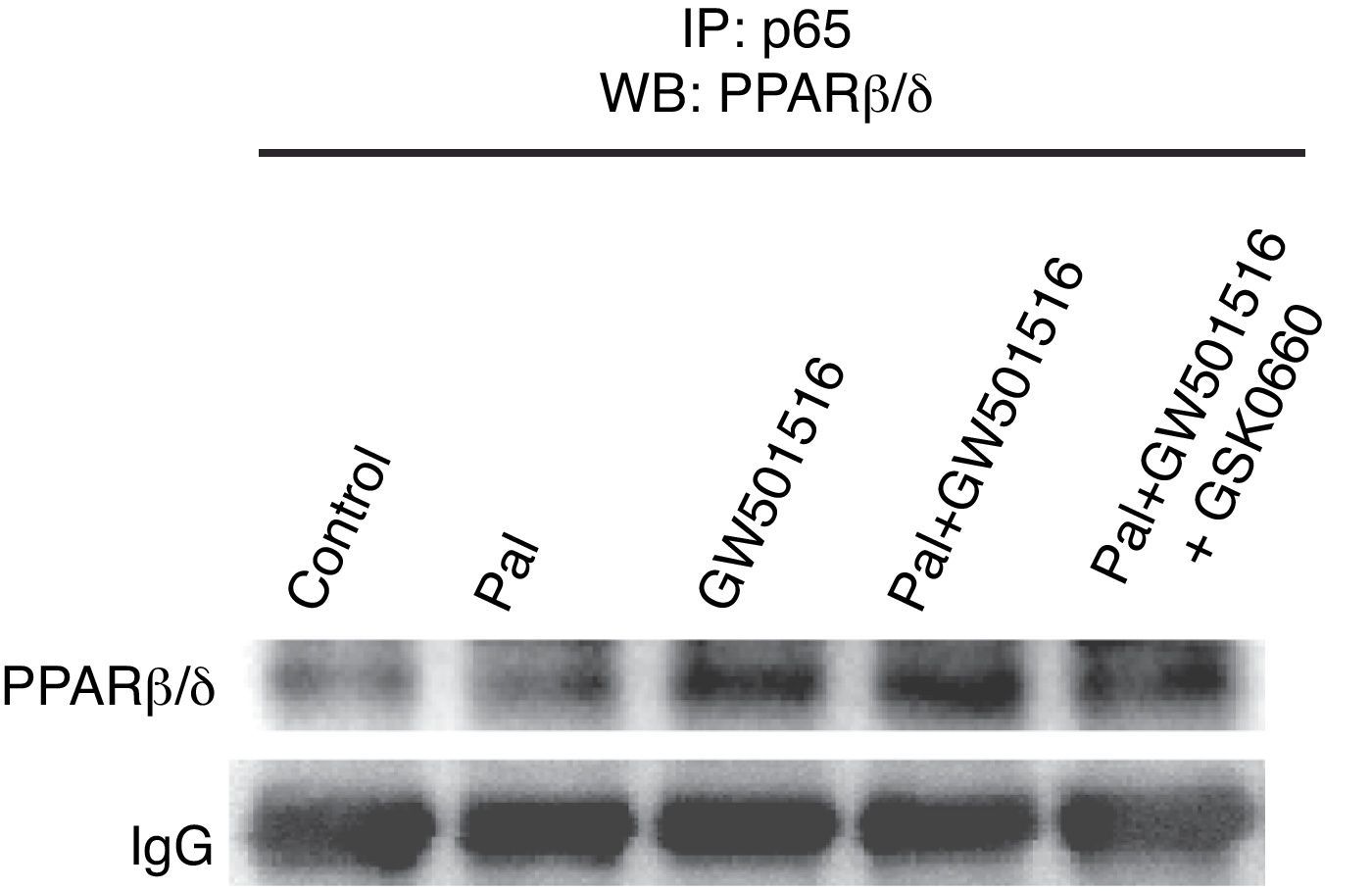
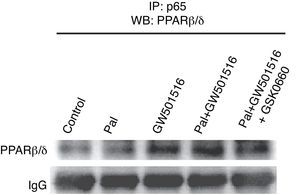
Seguidamente, intentamos determinar el mecanismo molecular a través del cual el agonista de PPARβ/δ GW501516 inhibe la activación de NF-κB por palmitato. Ha sido descrito previamente que los activadores de PPARα inducen la expresión de IκBα, que forma un complejo inactivo con el heterodímero p65-p50 en citoplasma, inhibiendo de este modo la vía de señalización de NF-κB17. A pesar de que el tratamiento con GW501516 indujo los niveles de proteína IκBα en células AC16, la administración del inhibidor de PPARβ/δ GSK0660 no logró revertir el efecto del GW501516 (fig. 3D), hecho que sugiere que la inhibición de NF-κB por PPARβ/δ implica algún mecanismo adicional. Los activadores de PPARα y PPARβ/δ pueden actuar de forma independiente de su unión al ADN, a través de un mecanismo que puede implicar una interacción física con NF-κB7,9,18. Esta asociación previene la unión de NF-κB a su elemento de respuesta y de este modo inhibe su habilidad para inducir la transcripción génica. Los resultados mostrados en la figura 4 demuestran que GW501516 incrementó fuertemente la interacción física entre la subunidad p65 de NF-κB y PPARβ/δ en células cardíacas humanas AC16, sugiriendo así que el incremento de la asociación entre estas dos proteínas es el mecanismo a través del cual la actividad de NF-κB está reducida después del tratamiento con GW501516. Además, la adición de GSK0660 bloqueó parcialmente el incremento de la interacción entre p65 y PPARβ/δ, ligando así esta interacción física con la disponibilidad de PPARβ/δ en el núcleo y su consiguiente actividad.
GW601516 incrementa la interacción proteína-proteína de PPARβ/δ y la subunidad p65 de NF-κB. Autorradiografía representativa del ensayo de inmunoprecipitación realizado con extractos nucleares de células AC16 estimuladas con palmitato (Pal) en presencia y ausencia de GW501516 y GSK0660, y un anticuerpo anti-p65 conjugado con perlas de proteína agarosa A. La detección se realizó con anticuerpo contra PPARβ/δ.
Numerosas evidencias relacionan un estado inflamatorio crónico de baja intensidad con trastornos metabólicos asociados a niveles elevados de ácidos grasos saturados, tales como la resistencia a la insulina, la obesidad y la diabetes mellitus tipo 2. En el corazón, la grasa procedente de la dieta afecta a la expresión, la estructura, el metabolismo y la función contráctil. Así, el metabolismo cardíaco de la glucosa se encuentra reducido en ratones obesos alimentados durante 6 semanas con dieta enriquecida en grasa, en un proceso asociado con un aumento de las citocinas proinflamatorias19. La progresión de la insuficiencia e hipertrofia cardíacas normalmente supone un incremento local de citocinas como la IL-6 y el TNF-α20, las cuales actúan principalmente de manera autocrina provocando la activación posterior de NF-κB21. Tal y como se ha descrito previamente5, ratones alimentados con una dieta grasa mostraron un incremento significativo en la expresión de IL-6, TNF-α y MPC-1 en el corazón. Del mismo modo, la expresión de estas citocinas se encontró incrementada en células AC16 estimuladas con palmitato. Puesto que los ácidos grasos saturados, especialmente el palmitato, provocan un aumento en la secreción de citocinas proinflamatorias en células del músculo esquelético22,23, determinamos los niveles plasmáticos de IL-6 en ratones alimentados con dieta grasa, así como en el medio de cultivo de células AC16 expuestas a palmitato, encontrando un incremento significativo en la liberación de esta citocina en el último caso. De acuerdo con estos resultados, la actividad de unión al ADN de NF-κB y los niveles nucleares de la proteína p65 se encontraron aumentados en el corazón de ratones alimentados con dieta grasa, así como en células AC16, donde la respuesta inflamatoria fue inducida con palmitato. La activación de NF-κB estaba relacionada con un aumento en la degradación de IκBα en células AC16 estimuladas con palmitato, así como con un incremento en la fosforilación de IκBα en Serina 32 en el corazón de ratones expuestos a la dieta grasa. Estos resultados concuerdan con la ligera degradación de IκBα descrita en miotubos C2C12 después de la exposición a palmitato a una concentración superior a 0,75mM24. Los niveles fisiológicos de ácidos grasos circulantes están entre 0,3 y 0,4mM, aumentando hasta 0,6-0,8mmol/l en pacientes obesos o con diabetes tipo 2. Por eso, nuestros resultados sugieren que las células cardíacas humanas AC16 son más sensibles a la inflamación inducida por palmitato que las células de músculo esquelético, pues aquella puede aparecer a niveles de ácidos grasos próximos a los fisiológicos.
El principal objetivo de este estudio fue examinar los efectos del agonista de PPARβ/δ GW501516 en la inflamación inducida por ácidos grasos en células cardíacas. Este agonista es un ligando selectivo con una afinidad superior a 1.000 veces para PPARβ/δ que para otros isotipos de PPAR25. PPARβ/δ desarrolla un importante papel en el corazón, donde presenta funciones similares a PPARα. Es interesante destacar que la activación de PPARβ/δ puede inhibir la vía de señalización de NF-κB, suprimiendo de este modo la hipertrofia de los cardiomiocitos y previniendo la inhibición de los genes implicados en el metabolismo de los ácidos grasos. La actividad antiinflamatoria de PPARβ/δ ha sido descrita en distintas enfermedades inmunológicas26, así como en algunos modelos experimentales. Por ejemplo, la activación de PPARβ/δ por L-165041 inhibe la hipertrofia en cardiomiocitos neonatales de rata en un proceso que implica la inhibición de la vía de señalización de NF-κB7. En este trabajo mostramos que la activación de PPARβ/δ por GW501516 reduce la inducción de los genes diana de NF-κB MCP-1 y TNF-α en células cardíacas humanas estimuladas con palmitato y en el corazón de ratones alimentados con una dieta rica en grasa, hecho que sugiere que PPARβ/δ puede antagonizar la actividad de NF-κB. Además, la expresión de IL-6 y MCP-1, así como la actividad de unión al ADN de NF-κB, se encontraron incrementadas en el corazón de ratones knockout PPARβ/δ al compararlos con ratones wild-type, lo que es consecuente con la actividad antiinflamatoria de PPARβ/δ. De hecho, distintos estudios demuestran que la activación de PPARβ/δ por la administración de ligando o la sobreexpresión mediante adenovirus en cultivos de miocitos cardíacos tiene potentes efectos antiinflamatorios27. El incremento en la expresión de MCP-1 en el miocardio puede permitir la infiltración y la activación de células inflamatorias, contribuyendo de este modo a la remodelación del ventrículo izquierdo y a la insuficiencia cardíaca observados después del infarto de miocardio. De este modo, la activación de PPARβ/δ podría ser útil terapéuticamente para reducir la expresión de MCP-1 en el corazón.
Los resultados anteriores sugieren que los efectos antiinflamatorios de GW501516 pueden ser debidos a mecanismos dependientes de la activación de PPARβ/δ. De hecho, se han propuesto distintos mecanismos para explicar los efectos antiinflamatorios de la activación de PPARβ/δ, como una interacción física entre PPARβ/δ y p65, la inducción de genes con propiedades antioxidantes o la liberación de co-represores nucleares. Además, es posible que PPARβ/δ ejerza sus efectos inhibitorios sobre NF-κB a través de múltiples mecanismos, dependiendo de las condiciones y de los tipos celulares. En este estudio demostramos que la activación de PPARβ/δ por GW501516 incrementa la asociación proteína-proteína entre PPARβ/δ y p65, lo cual indica que este mecanismo podría también interferir con la actividad de transactivación de NF-κB en el corazón diabético. Resultados similares han sido obtenidos en otros tipos de células cardíacas, como en cardiomiocitos neonatales de rata o miotubos H9c27,9. PPARβ/δ también inhibe el incremento en la producción de citocinas en adipocitos a través de la prevención de la activación de NF-κB vía ERK1/2, un efecto que podría ayudar a prevenir la resistencia a la insulina28. Sin embargo, en este estudio no observamos ninguna activación ERK1/2 después del tratamiento con GW501516 ni in vivo ni in vitro (datos no presentados), descartando así la implicación de esta cinasa en los efectos mediados por GW501516 en nuestros modelos experimentales. Serán necesarios más estudios para elucidar si la activación de PPARβ/δ podría inhibir el perfil proinflamatorio inducido en el corazón por palmitato o dietas ricas en grasa a través de mecanismos adicionales.
En resumen, la activación de PPARβ/δ por GW501516 puede atenuar la respuesta inflamatoria en células cardíacas AC16 expuestas al ácido graso saturado palmítico, así como en el corazón de ratones alimentados con una dieta enriquecida en grasa. Puesto que la hipertrofia y la insuficiencia cardíacas han sido relacionadas con un proceso inflamatorio crónico de baja intensidad, y el tratamiento con GW501516 atenúa las alteraciones metabólicas provocadas por dietas ricas en grasa, los resultados presentados en este trabajo sugieren que PPARβ/δ puede convertirse en una nueva diana terapéutica para prevenir la hipertrofia y la insuficiencia cardíaca asociada a trastornos metabólicos. PPARβ/δ presenta distintas funciones fisiológicas beneficiosas, como el incremento del catabolismo de los ácidos grasos, mejorando la sensibilidad a la insulina e inhibiendo la inflamación, mostrando así un potencial papel terapéutico para la prevención y el tratamiento de enfermedades como la diabetes, las dislipidemias o el síndrome metabólico.
FinanciaciónEste estudio ha sido financiado por el Ministerio de Educación y Ciencia (SAF2009-06939). El CIBER de Diabetes y Enfermedades Metabólicas Asociadas es un proyecto del Instituto de Salud Carlos III.
AutoríaD. Álvarez-Guardia, X. Palomer, M.M. Davidson, I. El Kochairi, L. Michalik, W. Wahli y M. Vázquez-Carrera contribuyeron a la obtención de los resultados experimentales del presente estudio. El diseño del mismo, la interpretación de los resultados, la redacción del manuscrito, así como su revisión, fueron realizados por D. Álvarez-Guardia, X. Palomer y M. Vázquez-Carrera
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Una comunicación referente a esta línea de trabajo, titulada «La activación de PPARβ/δ reduce la inflamación inducida por dietas ricas en grasas en células cardíacas», se presentó en el XXIII Congreso Nacional de la SEA (Córdoba, 2010) y fue galardonada con una mención especial.