La prediabetes constituye un importante problema de salud pública. Los objetivos del estudio fueron determinar la prevalencia de prediabetes según dos criterios diagnósticos, y comparar la asociación de factores de riesgo cardiometabólicos y renales entre las poblaciones con y sin prediabetes.
MétodosEstudio observacional transversal realizado en el ámbito de Atención Primaria. Muestra aleatoria de base poblacional: 6.588 sujetos de estudio (tasa de respuesta: 66%). Se utilizaron dos criterios diagnósticos: 1) prediabetes según la Sociedad Española de Diabetes (PRED-SED): glucosa plasmática en ayunas 110–125mg/dL o HbA1c 6,0%–6,4%; 2) prediabetes según la Asociación Americana de Diabetes (PRED-ADA): glucosa plasmática en ayunas 100–125mg/dL o HbA1c 5,7%–6,4%. Se evaluaron las prevalencias crudas y ajustadas por edad y sexo, y las variables cardiometabólicas y renales asociadas con prediabetes.
ResultadosLas prevalencias crudas de PRED-SED y PRED-ADA fueron 7,9% (IC95% 7,3–8,6%), y 22,0% (IC95% 21,0–23,0%) respectivamente, y sus prevalencias ajustadas fueron 6,6% y 19,1% respectivamente. El riesgo cardiovascular alto o muy alto de las poblaciones PRED-SED y PRED-ADA fueron 68,6% (IC95% 64,5–72,6%) y 61,7% (IC95% 59,1–64,1%) respectivamente. La hipertensión, hipertrigliceridemia, sobrepeso, obesidad y el índice cintura-talla aumentado se asociaban independientemente con PRED-SED. Además de estos factores, el filtrado glomerular bajo y la hipercolesterolemia también se asociaban independientemente con PRED-ADA.
ConclusionesLa prevalencia de PRED-ADA triplica a la PRED-SED. Dos tercios de la población con prediabetes tenían un riesgo cardiovascular elevado. Varios factores de riesgo cardiometabólicos y renales se asociaban con la prediabetes. En comparación con los criterios de la SED, los criterios de la ADA facilitan más el diagnóstico de la prediabetes.
Prediabetes is a major public health problem. The aims of the SIMETAP-PRED study were to determine the prevalence rates of prediabetes according to two diagnostic criteria, and to compare the association of cardiometabolic and renal risk factors between populations with and without prediabetes.
MethodsCross-sectional observational study conducted in Primary Care. Based random sample: 6,588 study subjects (response rate: 66%). Two diagnostic criteria for prediabetes were used: 1) prediabetes according to the Spanish Diabetes Society (PRED-SDS): Fasting plasma glucose (FPG) 110–125mg/dL or HbA1c 6.0% –6.4%; 2) prediabetes according to the American Diabetes Association (PRED-ADA): FPG 100–125mg/dL or HbA1c 5.7%–6.4%. The crude and sex- and age-adjusted prevalence rates, and cardiometabolic and renal variables associated with prediabetes were assessed.
ResultsThe crude prevalence rates of PRED-SDS and PRED-ADA were 7.9% (95% CI 7.3–8.6%), and 22.0% (95% CI 21.0–23.0%) respectively, their age-adjusted prevalence rates were 6.6% and 19.1 respectively. The high or very high cardiovascular risk of the PRED-SDS or PRED-ADA populations were 68.6% (95%CI 64.5–72.6%) and 61.7% (95%CI 59.1–64.1%) respectively. Hypertension, hypertriglyceridemia, overweight, obesity, and increased waist-to-height ratio were independently associated with PRED-SDS. In addition to these factors, low glomerular filtration rate and hypercholesterolemia were also independently associated with PRED-ADA.
ConclusionsThe prevalence of PRED-ADA triples that of PRED-SDS. Two thirds of the population with prediabetes had a high cardiovascular risk. Several cardiometabolic and renal risk factors were associated with prediabetes. Compared to the SDS criteria, the ADA criteria make the diagnosis of prediabetes easier.
La prediabetes es un estado metabólico intermedio entre la normoglucemia y la diabetes (DM), en cuyo desarrollo se produce una disfunción de las células beta pancreáticas en respuesta a factores estresantes como lipotoxicidad y/o glucotoxicidad, que afectan a al metabolismo hepático y periférico de la glucosa debido a una disminución de la sensibilidad a la insulina (insulinorresistencia) y un aumento inicial de la secreción de insulina (hiperinsulinemia)1–3.
La presencia de factores de riesgo cardiovascular (FRCV) muy prevalentes durante el periodo prediabético como la obesidad, la hipertensión arterial (HTA) y la dislipidemia aterogénica4–6, en gran parte pueden justificar su relación con el desarrollo de la enfermedad cardiovascular arteriosclerótica (ECVA) y de la enfermedad renal crónica6,7, que favorece un patrón aterogénico que ocasiona un daño estructural y funcional del endotelio vascular7,8. Esto supone un potencial incremento del riesgo cardiovascular4,8–10 (RCV) que se inicia a partir de valores de hemoglobina glicada A1c (HbA1c) de 5,7%, o de concentraciones de glucosa plasmática en ayunas (GPA) tan bajas como 100mg/dl. No obstante, los individuos con prediabetes sin ECVA no tienen necesariamente un RCV elevado10,11, por lo que precisan una valoración del RCV similar al de la población general11.
Los valores de los criterios diagnósticos que utilizan las diferentes sociedades para definir la prediabetes varían según la elección del rango de HbA1c o de las concentraciones de GPA que definen la glucosa basal alterada (GBA), lo que tiene implicaciones en la detección y la carga de prediabetes12, y en el riesgo de desarrollar DM1,2.
La prediabetes constituye un importante problema de salud pública, no solo por su probable evolución hacia DM1,2, sino también por su mayor carga de RCV y por la elevada prevalencia de las comorbilidades asociadas6,8–10. La mayoría de los sujetos con prediabetes desconocen el mayor RCV que conlleva, ni que las modificaciones en el estilo de vida pueden reducir o retrasar la aparición de DM13.
La prevalencia de prediabetes aumenta progresivamente con la edad debido a los cambios en el metabolismo de la glucosa, la composición corporal y el estilo de vida no saludable13. La incidencia anual de DM y prediabetes continúa aumentando a nivel mundial. Si 463 millones de personas padecían DM en el año 2019, esta cifra podría ascender hasta los 578 millones en el 2030 y hasta los 700 millones en el 2045. Paralelamente, la prediabetes considerada como GBA, que afectaba a 374 millones de personas en 2019, podría llegar hasta los 454 millones en el 2030 y hasta los 548 millones en el 204514.
El conocimiento de la situación epidemiológica de la prediabetes y su relación con los factores cardiometabólicos y renales con los que puede estar asociada, constituye un desafío clave para evitar la progresión de la enfermedad y la carga económica que conlleva para el sistema sanitario6, y para implementar medidas de prevención de fácil aplicación, como la cesación del tabaquismo y la intervención sobre la dieta y el ejercicio13.
Los objetivos del estudio SIMETAP-PRED fueron determinar en la población adulta las tasas de prevalencia de prediabetes según dos criterios diagnósticos, y comparar la asociación de los FRCV, cardiometabólicos y renales, entre las poblaciones con y sin prediabetes.
Material y métodosSIMETAP-PRED es un estudio observacional transversal, autorizado por el Servicio de Salud de la Comunidad de Madrid (SERMAS), en el que participaron 121 médicos de familia seleccionados competitivamente hasta alcanzar el tamaño muestral necesario, pertenecientes a 64 centros de atención primaria (25% de los Centros de Salud del SERMAS). La información sobre el material y métodos (diseño, muestreo, reclutamiento, criterios de inclusión y exclusión, recogida de datos, análisis estadístico, y criterios que definen las variables y categorías de RCV) del estudio SIMETAP se han detallado previamente en esta revista15. Se incluyeron 6.588 sujetos de estudio reclutados mediante muestreo aleatorizado simple de la población adulta asignada a los médicos de Atención Primaria del SERMAS que participaban en el estudio, con una tasa de respuesta del 65,8%. Por protocolo, se excluyó a pacientes terminales, institucionalizados, con deterioro cognitivo, embarazadas o sujetos sin información de las variables bioquímicas, y se obtuvo el consentimiento informado de todos los sujetos del estudio.
Los criterios bioquímicos para el diagnóstico de DM fueron los definidos por la Asociación Americana de Diabetes (ADA)16: glucosa plasmática en ayunas (GPA) ≥ 126mg/dl (≥ 7,0 mmol/l) o HbA1c ≥ 6,5% (≥ 48 mmol/mol) confirmadas en al menos en dos ocasiones, o la determinación de glucosa plasmática ≥ 200mg/dl (≥ 11,1 mmol/l), bien aleatoria a cualquier hora del día sin importar el intervalo desde la última comida, o con la prueba de tolerancia oral a la glucosa (2 h después de la administración de 75g de glucosa anhidra disuelta en agua). Asimismo, se consideró que los pacientes padecían DM tras comprobar que este diagnóstico estaba registrado en sus historias clínicas. En los sujetos de estudio que no padecían DM, se utilizaron dos criterios diagnósticos de prediabetes: 1) prediabetes diagnosticada según la Sociedad Española de Diabetes17 (PRED-SED): GPA entre 110 y 125mg/dl (6,1–6,9 mmol/l) o HbA1c entre 6,0% y 6,4% (42–47 mmol/mol). 2) Prediabetes diagnosticada según la ADA16 (PRED-ADA): GPA entre 100 y 125mg/dl (5,6–6,9 mmol/l) o HbA1c entre 5,7% y 6,4% (39–47 mmol/mol).
También se consideraron las siguientes variables cardiometabólicas y renales: índice de masa corporal (IMC): peso/talla2 (kg/m2). Sobrepeso: IMC 25,0–29,9kg/m2. Obesidad: IMC ≥30kg/m2. Adiposidad o índice de grasa corporal CUN-BAE (Clínica Universitaria de Navarra-Body Adiposity Estimator)18:−44,988+(0,503 x edad)+(10,689 x sexo)+(3,172 x IMC)−(0,026 x IMC2)+(0,181 x IMC x sexo)−(0,02 x IMC x edad)−(0,005 x IMC2 x sexo)+(0,00021 x IMC2 x edad); sexo masculino=0; sexo femenino=1. CUN-BAE-obesidad:>25% (hombres);>35% (mujeres). Obesidad central: perímetro abdominal aumentado (≥102cm [hombres] o ≥88cm [mujeres]). Índice cintura-talla (ICT): perímetro abdominal/talla. ICT aumentado: ICT ≥0,6. HTA: presión arterial sistólica ≥140mmHg y/o presión arterial diastólica ≥90mmHg, o tener tratamiento antihipertensivo. HbA1c estandarizada según Diabetes Control and Complications Trial (DCCT). Hipercolesterolemia: colesterol total (CT) ≥200mg/dl. Hipertrigliceridemia (HTG): triglicéridos (TG) ≥150mg/dl. Colesterol unido a lipoproteínas de alta densidad (c-HDL). C-HDL bajo: c-HDL <40mg/dl (hombres); <50mg/dl (mujeres). Colesterol no unido a c-HDL (C-no-HDL). Colesterol unido a lipoproteínas de baja densidad (c-LDL). Colesterol unido a lipoproteínas de muy baja densidad y sus remanentes (c-VLDL). Índice aterogénico de plasma (IAP): log (TG / c-HDL). Índice TG y glucosa (ITyG): Ln [TG x GPA / 2]. Dislipidemia aterogénica: HTG y c-HDL bajo. Síndrome metabólico (SM): consenso armonizado IDF/NHLBI/AHA/WHF/IAS/IASO19. Enfermedad coronaria: cardiopatía isquémica, infarto agudo de miocardio previo, síndromes coronarios agudos, revascularización coronaria. procedimientos de revascularización arterial. Ictus: accidente cerebrovascular, isquemia cerebral o hemorragias intracraneales y ataque isquémico transitorio. Enfermedad arterial periférica: claudicación intermitente o un índice tobillo-brazo ≤0,9. ECVA: enfermedad coronaria, ictus, enfermedad arterial periférica. Albuminuria: cociente albúmina-creatinina (CAC) ≥30mg/g. Filtrado glomerular estimado (FGe) según Chronic Kidney Disease EPIdemiology collaboration (CKD-EPI). FGe bajo: FGe <60mL/min/1,73 m2. Enfermedad renal crónica: FGe bajo y/o albuminuria. RCV según SCORE20,21.
El análisis estadístico se realizó con el programa Statistical Package for the Social Sciences. El análisis descriptivo determinó la media y desviación estándar (±DE) de las variables continuas. Las variables cualitativas se analizaron mediante porcentajes en cada categoría, presentadas con límites inferior y superior del intervalo de confianza (IC) del 95%. Las prevalencias se determinaron como tasas crudas y tasas ajustadas por edad y sexo. El ajuste de tasas por edad y sexo se realizó usando grupos etarios decenales estandarizados con los de la población española mediante método directo. La información de la población española de enero de 2015 se obtuvo de la base de datos del Instituto Nacional de Estadística22.
Las tasas de prevalencia se estandarizaron por edad y sexo según la población española para facilitar la comparación con otras poblaciones. Las comparaciones de las variables continuas se realizaron mediante la prueba t-Student o el análisis de varianza (ANOVA). El análisis de las variables categóricas se realizó mediante la prueba chi-cuadrado. Las odds-ratios (OR) se determinaron con IC del 95%. Para valorar el efecto individual de FRCV y comorbilidades sobre las variables dependientes PRED-ADA y PRED-SED, se realizaron análisis multivariantes de regresión logística mediante el método paso a paso hacia atrás (backward stepwise), introduciendo inicialmente en el modelo todas las variables que mostraran asociación en el análisis univariado hasta un valor de p<0,10, y posteriormente, eliminando en cada paso la variable que menos contribuía al ajuste del mismo. En los análisis multivariados se excluyeron las siguientes variables: CUN-BAE-obesidad18, dislipidemia aterogénica, ECVA y el SM19 por ser variables cuyos componentes ya se incluían en el análisis, y la disfunción eréctil por afectar solo a hombres. Todas las pruebas se consideraron estadísticamente significativas si el valor de p de dos colas era inferior a 0,05. Se realizó una búsqueda bibliográfica en PubMed, Medline, Embase, Google Scholar y Web of Science, para comparar las tasas de prevalencia del presente estudio con otros similares de los últimos 15 años.
ResultadosLa población de estudio fue de 6.588 adultos entre 18,0 y 102,8 años, cuya media (±DE) de edad era 55,1 (±17,5) años. La diferencia del porcentaje entre hombres (44,1% [IC 42,9–45,3%]) y mujeres (55,9% [IC 54,7–57,1%]) era significativa (p <0,001). La diferencia de las medias [±DE] de edad entre las poblaciones masculina (55,3 [±16,9] años) y femenina (55,0 [±18,0] años) no era significativa (p=0,634).
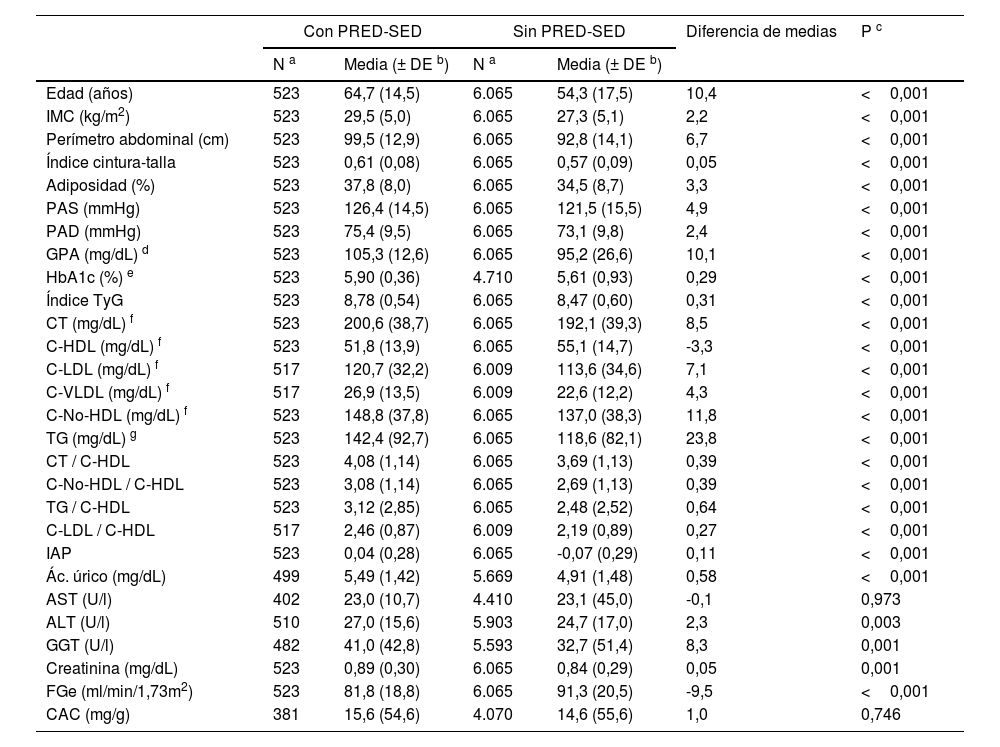
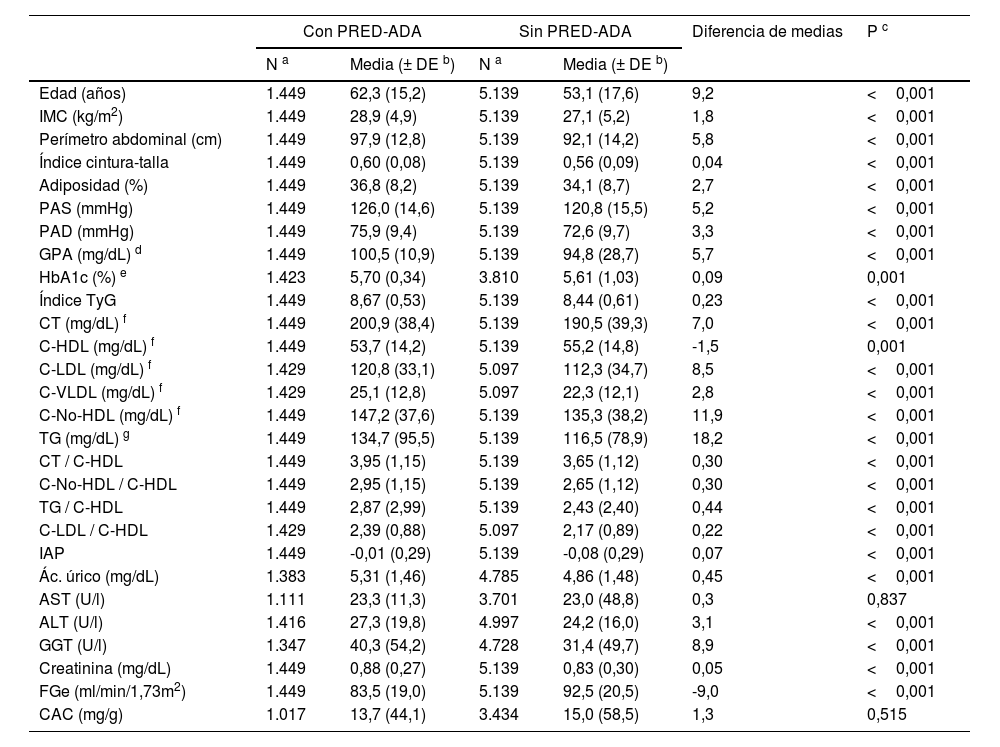
La diferencia del porcentaje de la población masculina entre las poblaciones con PRED-SED (48,4% [IC 44,1–52,7%]) y sin PRED-SED (43,7% [IC 42,5–45,0%]) era significativa (p=0,039). La diferencia del porcentaje de la población masculina entre las poblaciones con PRED-ADA (48,9% [46,4–51,5%]) y sin PRED-ADA (42,7% [41,4–44,1%]) era significativa (p <0,001). La diferencia de las medias de edad entre las poblaciones PRED-SED y PRED-ADA (2,4 [IC95%: 0,9–3,9] años) era significativa (p=0,002). Las diferencias de las características clínicas entre las poblaciones con y sin prediabetes se muestran en las tablas 1 y 2.
Características clínicas de las poblaciones con y sin PRED-SED
| Con PRED-SED | Sin PRED-SED | Diferencia de medias | P c | |||
|---|---|---|---|---|---|---|
| N a | Media (± DE b) | N a | Media (± DE b) | |||
| Edad (años) | 523 | 64,7 (14,5) | 6.065 | 54,3 (17,5) | 10,4 | <0,001 |
| IMC (kg/m2) | 523 | 29,5 (5,0) | 6.065 | 27,3 (5,1) | 2,2 | <0,001 |
| Perímetro abdominal (cm) | 523 | 99,5 (12,9) | 6.065 | 92,8 (14,1) | 6,7 | <0,001 |
| Índice cintura-talla | 523 | 0,61 (0,08) | 6.065 | 0,57 (0,09) | 0,05 | <0,001 |
| Adiposidad (%) | 523 | 37,8 (8,0) | 6.065 | 34,5 (8,7) | 3,3 | <0,001 |
| PAS (mmHg) | 523 | 126,4 (14,5) | 6.065 | 121,5 (15,5) | 4,9 | <0,001 |
| PAD (mmHg) | 523 | 75,4 (9,5) | 6.065 | 73,1 (9,8) | 2,4 | <0,001 |
| GPA (mg/dL) d | 523 | 105,3 (12,6) | 6.065 | 95,2 (26,6) | 10,1 | <0,001 |
| HbA1c (%) e | 523 | 5,90 (0,36) | 4.710 | 5,61 (0,93) | 0,29 | <0,001 |
| Índice TyG | 523 | 8,78 (0,54) | 6.065 | 8,47 (0,60) | 0,31 | <0,001 |
| CT (mg/dL) f | 523 | 200,6 (38,7) | 6.065 | 192,1 (39,3) | 8,5 | <0,001 |
| C-HDL (mg/dL) f | 523 | 51,8 (13,9) | 6.065 | 55,1 (14,7) | -3,3 | <0,001 |
| C-LDL (mg/dL) f | 517 | 120,7 (32,2) | 6.009 | 113,6 (34,6) | 7,1 | <0,001 |
| C-VLDL (mg/dL) f | 517 | 26,9 (13,5) | 6.009 | 22,6 (12,2) | 4,3 | <0,001 |
| C-No-HDL (mg/dL) f | 523 | 148,8 (37,8) | 6.065 | 137,0 (38,3) | 11,8 | <0,001 |
| TG (mg/dL) g | 523 | 142,4 (92,7) | 6.065 | 118,6 (82,1) | 23,8 | <0,001 |
| CT / C-HDL | 523 | 4,08 (1,14) | 6.065 | 3,69 (1,13) | 0,39 | <0,001 |
| C-No-HDL / C-HDL | 523 | 3,08 (1,14) | 6.065 | 2,69 (1,13) | 0,39 | <0,001 |
| TG / C-HDL | 523 | 3,12 (2,85) | 6.065 | 2,48 (2,52) | 0,64 | <0,001 |
| C-LDL / C-HDL | 517 | 2,46 (0,87) | 6.009 | 2,19 (0,89) | 0,27 | <0,001 |
| IAP | 523 | 0,04 (0,28) | 6.065 | -0,07 (0,29) | 0,11 | <0,001 |
| Ác. úrico (mg/dL) | 499 | 5,49 (1,42) | 5.669 | 4,91 (1,48) | 0,58 | <0,001 |
| AST (U/l) | 402 | 23,0 (10,7) | 4.410 | 23,1 (45,0) | -0,1 | 0,973 |
| ALT (U/l) | 510 | 27,0 (15,6) | 5.903 | 24,7 (17,0) | 2,3 | 0,003 |
| GGT (U/l) | 482 | 41,0 (42,8) | 5.593 | 32,7 (51,4) | 8,3 | 0,001 |
| Creatinina (mg/dL) | 523 | 0,89 (0,30) | 6.065 | 0,84 (0,29) | 0,05 | 0,001 |
| FGe (ml/min/1,73m2) | 523 | 81,8 (18,8) | 6.065 | 91,3 (20,5) | -9,5 | <0,001 |
| CAC (mg/g) | 381 | 15,6 (54,6) | 4.070 | 14,6 (55,6) | 1,0 | 0,746 |
Adiposidad: índice de grasa corporal CUN-BAE (Clínica Universitaria de Navarra–Body Adiposity Estimator); ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; CAC: cociente albúmina/creatinina; C-HDL: colesterol unido a lipoproteínas de alta densidad; C-LDL: colesterol unido a lipoproteínas de baja densidad; C-No-HDL: colesterol no unido a lipoproteínas de alta densidad; CT: colesterol total; C-VLDL: colesterol unido a lipoproteínas de muy baja densidad y sus remanentes; FGe: tasa de filtrado glomerular estimado según CKD-EPI; GGT: gamma-glutamil transferasa; IAP: índice aterogénico de plasma (log [TG/cHDL]); IMC: índice de masa corporal; Índice TyG: índice triglicéridos y glucosa (Ln [TGxGPA/2]); PAD: presión arterial diastólica; PAS: presión arterial sistólica; PRED-SED: prediabetes según la Sociedad Española de Diabetes (glucosa plasmática en ayunas [GPA] 110–125mg/dL o hemoglobina glicada A1c [HbA1c] 6,0–6,4%); TG: triglicéridos.
Características clínicas de las poblaciones con y sin PRED-ADA
| Con PRED-ADA | Sin PRED-ADA | Diferencia de medias | P c | |||
|---|---|---|---|---|---|---|
| N a | Media (± DE b) | N a | Media (± DE b) | |||
| Edad (años) | 1.449 | 62,3 (15,2) | 5.139 | 53,1 (17,6) | 9,2 | <0,001 |
| IMC (kg/m2) | 1.449 | 28,9 (4,9) | 5.139 | 27,1 (5,2) | 1,8 | <0,001 |
| Perímetro abdominal (cm) | 1.449 | 97,9 (12,8) | 5.139 | 92,1 (14,2) | 5,8 | <0,001 |
| Índice cintura-talla | 1.449 | 0,60 (0,08) | 5.139 | 0,56 (0,09) | 0,04 | <0,001 |
| Adiposidad (%) | 1.449 | 36,8 (8,2) | 5.139 | 34,1 (8,7) | 2,7 | <0,001 |
| PAS (mmHg) | 1.449 | 126,0 (14,6) | 5.139 | 120,8 (15,5) | 5,2 | <0,001 |
| PAD (mmHg) | 1.449 | 75,9 (9,4) | 5.139 | 72,6 (9,7) | 3,3 | <0,001 |
| GPA (mg/dL) d | 1.449 | 100,5 (10,9) | 5.139 | 94,8 (28,7) | 5,7 | <0,001 |
| HbA1c (%) e | 1.423 | 5,70 (0,34) | 3.810 | 5,61 (1,03) | 0,09 | 0,001 |
| Índice TyG | 1.449 | 8,67 (0,53) | 5.139 | 8,44 (0,61) | 0,23 | <0,001 |
| CT (mg/dL) f | 1.449 | 200,9 (38,4) | 5.139 | 190,5 (39,3) | 7,0 | <0,001 |
| C-HDL (mg/dL) f | 1.449 | 53,7 (14,2) | 5.139 | 55,2 (14,8) | -1,5 | 0,001 |
| C-LDL (mg/dL) f | 1.429 | 120,8 (33,1) | 5.097 | 112,3 (34,7) | 8,5 | <0,001 |
| C-VLDL (mg/dL) f | 1.429 | 25,1 (12,8) | 5.097 | 22,3 (12,1) | 2,8 | <0,001 |
| C-No-HDL (mg/dL) f | 1.449 | 147,2 (37,6) | 5.139 | 135,3 (38,2) | 11,9 | <0,001 |
| TG (mg/dL) g | 1.449 | 134,7 (95,5) | 5.139 | 116,5 (78,9) | 18,2 | <0,001 |
| CT / C-HDL | 1.449 | 3,95 (1,15) | 5.139 | 3,65 (1,12) | 0,30 | <0,001 |
| C-No-HDL / C-HDL | 1.449 | 2,95 (1,15) | 5.139 | 2,65 (1,12) | 0,30 | <0,001 |
| TG / C-HDL | 1.449 | 2,87 (2,99) | 5.139 | 2,43 (2,40) | 0,44 | <0,001 |
| C-LDL / C-HDL | 1.429 | 2,39 (0,88) | 5.097 | 2,17 (0,89) | 0,22 | <0,001 |
| IAP | 1.449 | -0,01 (0,29) | 5.139 | -0,08 (0,29) | 0,07 | <0,001 |
| Ác. úrico (mg/dL) | 1.383 | 5,31 (1,46) | 4.785 | 4,86 (1,48) | 0,45 | <0,001 |
| AST (U/l) | 1.111 | 23,3 (11,3) | 3.701 | 23,0 (48,8) | 0,3 | 0,837 |
| ALT (U/l) | 1.416 | 27,3 (19,8) | 4.997 | 24,2 (16,0) | 3,1 | <0,001 |
| GGT (U/l) | 1.347 | 40,3 (54,2) | 4.728 | 31,4 (49,7) | 8,9 | <0,001 |
| Creatinina (mg/dL) | 1.449 | 0,88 (0,27) | 5.139 | 0,83 (0,30) | 0,05 | <0,001 |
| FGe (ml/min/1,73m2) | 1.449 | 83,5 (19,0) | 5.139 | 92,5 (20,5) | -9,0 | <0,001 |
| CAC (mg/g) | 1.017 | 13,7 (44,1) | 3.434 | 15,0 (58,5) | 1,3 | 0,515 |
Adiposidad: índice de grasa corporal CUN-BAE (Clínica Universitaria de Navarra–Body Adiposity Estimator); ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; CAC: cociente albúmina/creatinina; C-HDL: colesterol unido a lipoproteínas de alta densidad; C-LDL: colesterol unido a lipoproteínas de baja densidad; C-No-HDL: colesterol no unido a lipoproteínas de alta densidad; CT: colesterol total; C-VLDL: colesterol unido a lipoproteínas de muy baja densidad y sus remanentes; FGe: tasa de filtrado glomerular estimado según CKD-EPI; GGT: gamma-glutamil transferasa; IAP: índice aterogénico de plasma (log [TG/cHDL]); IMC: índice de masa corporal; Índice TyG: índice triglicéridos y glucosa (Ln [TGxGPA/2]); PAD: presión arterial diastólica; PAS: presión arterial sistólica; PRED-ADA: prediabetes según la American Diabetes Association (glucosa plasmática en ayunas [GPA] 100–125mg/dL o hemoglobina glicada A1c [HbA1c] 5,7–6,4%); TG: triglicéridos.
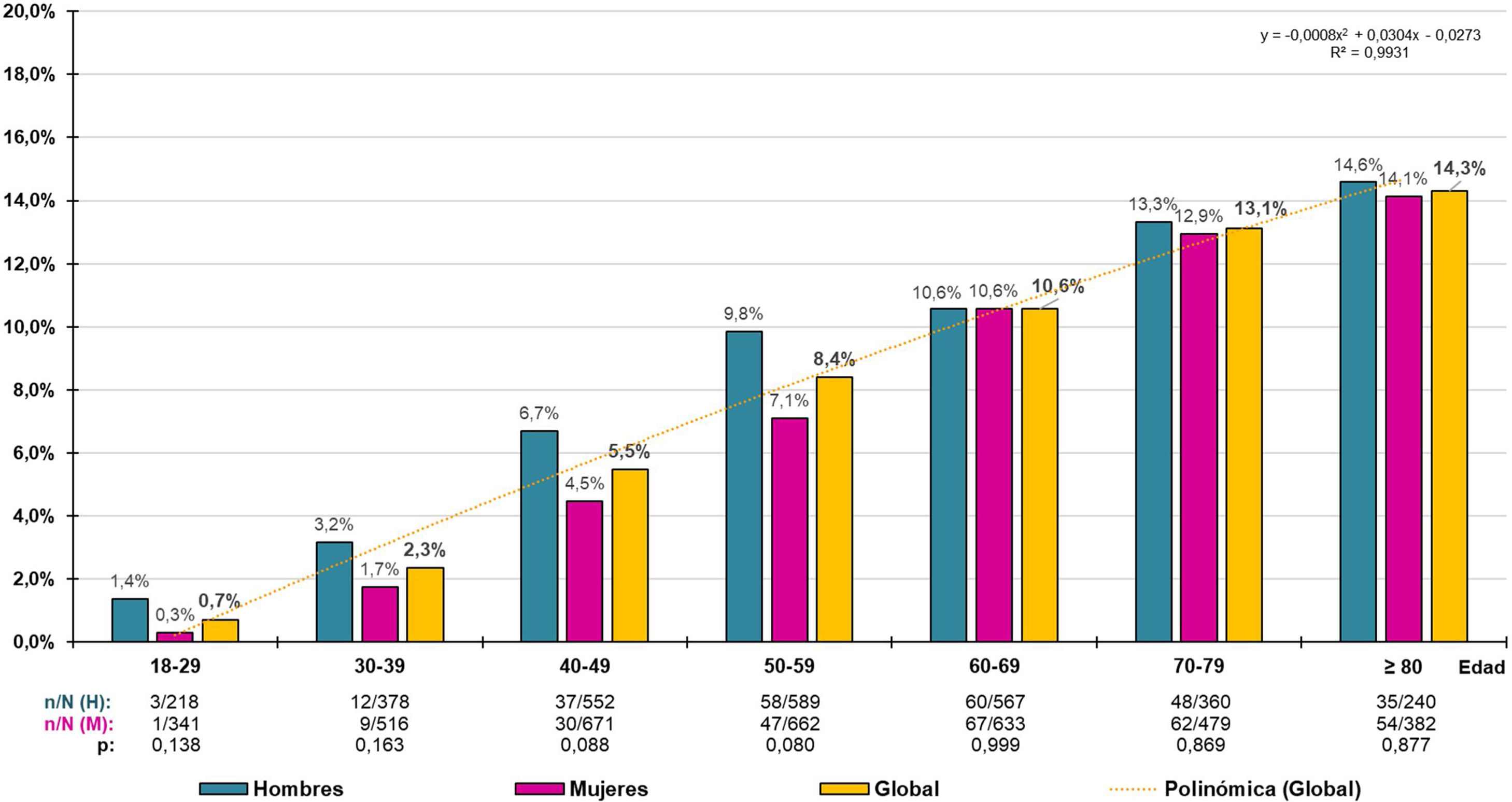
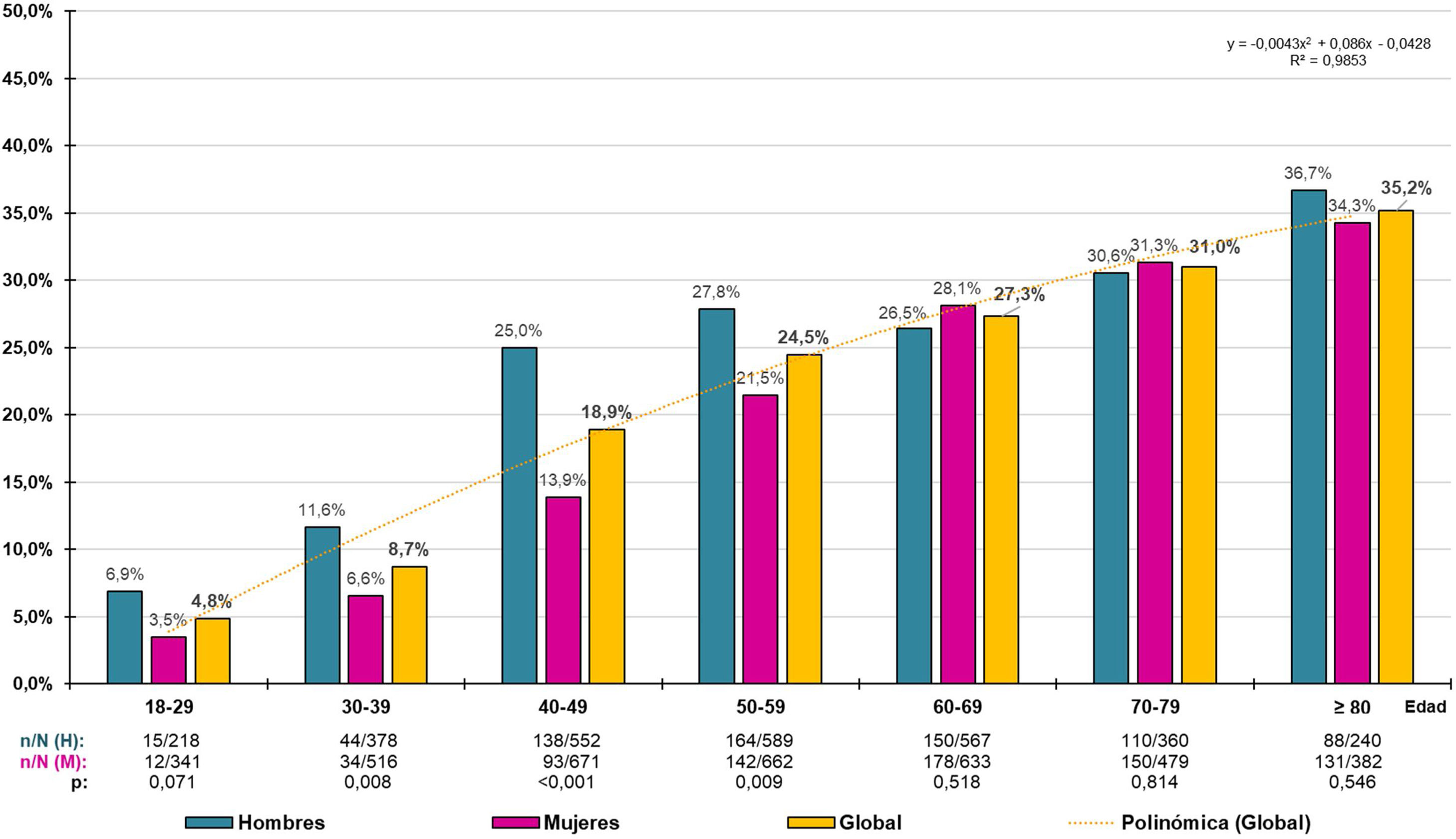
La prevalencia cruda de PRED-SED fue 7,94% (IC95%: 7,29–8,59%), siendo significativa (p=0,040) la diferencia entre hombres (8,71% [IC95%: 7,68–9,74%]) y mujeres (7,33% [IC95%: 6,49–8,17%]). La prevalencia cruda de PRED-ADA fue 21,99% (IC95%: 20,99–22,99%), siendo significativa (p<0,001) la diferencia entre hombres (24,41% [IC95%: 22,85–25,97%]) y mujeres (20,09% [IC95%: 18,00–21,38%]). La tasa de prevalencia ajustada por edad y sexo de PRED-SED fue 6,63% (7,18% en hombres y 6,27% en mujeres). La tasa de prevalencia ajustada de PRED-ADA fue 19,11% (21,26% en hombres y 17,63% en mujeres). Las tasas de prevalencia por grupos etarios decenales en hombres, mujeres y globales de PRED-SED y PRED-ADA se muestran en las figuras 1 y 2 respectivamente.
La distribución de la prevalencia de PRED-SED aumentaba con la edad (R2=0,993), según la función polinómica y=-0,0008x2+0,0304x - 0,0273, sin que existieran diferencias significativas entre hombres y mujeres (fig. 1). De forma similar, la distribución de la prevalencia de PRED-ADA aumentaba con la edad (R2=0,985), según la función polinómica y=-0,0043x2+0,0086x - 0,0428, sin que existieran diferencias significativas entre hombres y mujeres, excepto en los grupos etarios entre 30 y 59 años, en los que las prevalencias eran significativamente mayores en hombres que en mujeres (fig. 2).
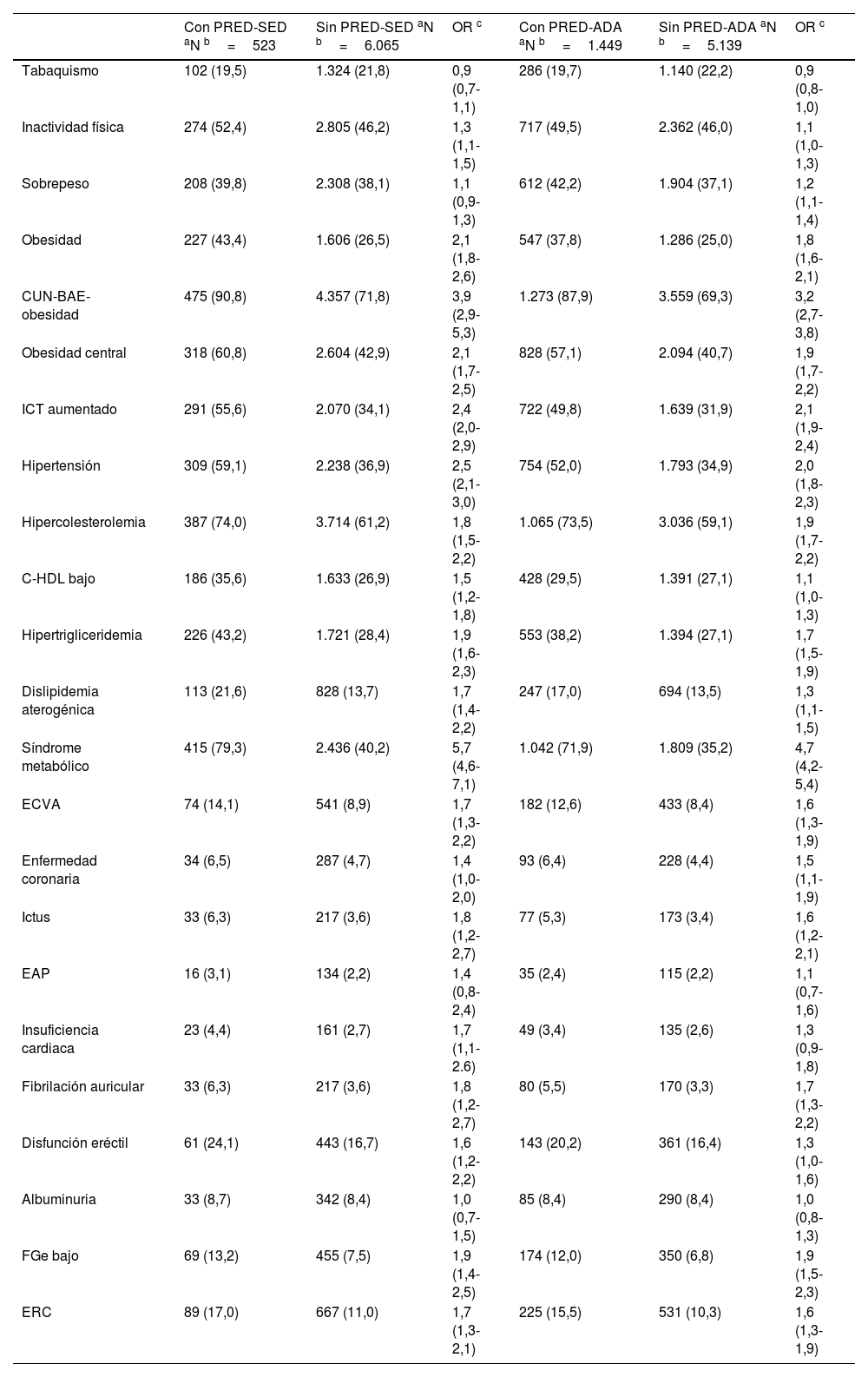
Todos los parámetros evaluados eran significativamente mayores en las poblaciones con prediabetes que en las poblaciones sin prediabetes, excepto las concentraciones de c-HDL y el FGe, que fueron menores en las poblaciones con prediabetes, y las concentraciones de aspartato-aminotransferasa y albuminuria, cuyas diferencias no eran significativas (tablas 1 y 2). Las OR de las comorbilidades asociadas entre las poblaciones con y sin prediabetes se muestran en la tabla 3.
Comorbilidades y FRCV en las poblaciones con y sin prediabetes
| Con PRED-SED aN b=523 | Sin PRED-SED aN b=6.065 | OR c | Con PRED-ADA aN b=1.449 | Sin PRED-ADA aN b=5.139 | OR c | |
|---|---|---|---|---|---|---|
| Tabaquismo | 102 (19,5) | 1.324 (21,8) | 0,9 (0,7-1,1) | 286 (19,7) | 1.140 (22,2) | 0,9 (0,8-1,0) |
| Inactividad física | 274 (52,4) | 2.805 (46,2) | 1,3 (1,1-1,5) | 717 (49,5) | 2.362 (46,0) | 1,1 (1,0-1,3) |
| Sobrepeso | 208 (39,8) | 2.308 (38,1) | 1,1 (0,9-1,3) | 612 (42,2) | 1.904 (37,1) | 1,2 (1,1-1,4) |
| Obesidad | 227 (43,4) | 1.606 (26,5) | 2,1 (1,8-2,6) | 547 (37,8) | 1.286 (25,0) | 1,8 (1,6-2,1) |
| CUN-BAE-obesidad | 475 (90,8) | 4.357 (71,8) | 3,9 (2,9-5,3) | 1.273 (87,9) | 3.559 (69,3) | 3,2 (2,7-3,8) |
| Obesidad central | 318 (60,8) | 2.604 (42,9) | 2,1 (1,7-2,5) | 828 (57,1) | 2.094 (40,7) | 1,9 (1,7-2,2) |
| ICT aumentado | 291 (55,6) | 2.070 (34,1) | 2,4 (2,0-2,9) | 722 (49,8) | 1.639 (31,9) | 2,1 (1,9-2,4) |
| Hipertensión | 309 (59,1) | 2.238 (36,9) | 2,5 (2,1-3,0) | 754 (52,0) | 1.793 (34,9) | 2,0 (1,8-2,3) |
| Hipercolesterolemia | 387 (74,0) | 3.714 (61,2) | 1,8 (1,5-2,2) | 1.065 (73,5) | 3.036 (59,1) | 1,9 (1,7-2,2) |
| C-HDL bajo | 186 (35,6) | 1.633 (26,9) | 1,5 (1,2-1,8) | 428 (29,5) | 1.391 (27,1) | 1,1 (1,0-1,3) |
| Hipertrigliceridemia | 226 (43,2) | 1.721 (28,4) | 1,9 (1,6-2,3) | 553 (38,2) | 1.394 (27,1) | 1,7 (1,5-1,9) |
| Dislipidemia aterogénica | 113 (21,6) | 828 (13,7) | 1,7 (1,4-2,2) | 247 (17,0) | 694 (13,5) | 1,3 (1,1-1,5) |
| Síndrome metabólico | 415 (79,3) | 2.436 (40,2) | 5,7 (4,6-7,1) | 1.042 (71,9) | 1.809 (35,2) | 4,7 (4,2-5,4) |
| ECVA | 74 (14,1) | 541 (8,9) | 1,7 (1,3-2,2) | 182 (12,6) | 433 (8,4) | 1,6 (1,3-1,9) |
| Enfermedad coronaria | 34 (6,5) | 287 (4,7) | 1,4 (1,0-2,0) | 93 (6,4) | 228 (4,4) | 1,5 (1,1-1,9) |
| Ictus | 33 (6,3) | 217 (3,6) | 1,8 (1,2-2,7) | 77 (5,3) | 173 (3,4) | 1,6 (1,2-2,1) |
| EAP | 16 (3,1) | 134 (2,2) | 1,4 (0,8-2,4) | 35 (2,4) | 115 (2,2) | 1,1 (0,7-1,6) |
| Insuficiencia cardiaca | 23 (4,4) | 161 (2,7) | 1,7 (1,1-2.6) | 49 (3,4) | 135 (2,6) | 1,3 (0,9-1,8) |
| Fibrilación auricular | 33 (6,3) | 217 (3,6) | 1,8 (1,2-2,7) | 80 (5,5) | 170 (3,3) | 1,7 (1,3-2,2) |
| Disfunción eréctil | 61 (24,1) | 443 (16,7) | 1,6 (1,2-2,2) | 143 (20,2) | 361 (16,4) | 1,3 (1,0-1,6) |
| Albuminuria | 33 (8,7) | 342 (8,4) | 1,0 (0,7-1,5) | 85 (8,4) | 290 (8,4) | 1,0 (0,8-1,3) |
| FGe bajo | 69 (13,2) | 455 (7,5) | 1,9 (1,4-2,5) | 174 (12,0) | 350 (6,8) | 1,9 (1,5-2,3) |
| ERC | 89 (17,0) | 667 (11,0) | 1,7 (1,3-2,1) | 225 (15,5) | 531 (10,3) | 1,6 (1,3-1,9) |
Albuminuria: cociente albúmina-creatinina ≥30mg/g; C-HDL bajo: colesterol unido a lipoproteínas de alta densidad <40mg/dL (hombres) <50mg/dL (mujeres);CUN-BAE: adiposidad o índice de grasa corporal (Clínica Universitaria de Navarra–Body Adiposity Estimator); CUN-BAE-obesidad:>25% (hombres);>35% (mujeres); Dislipidemia aterogénica: hipertrigliceridemia y c-HDL bajo; EAP: enfermedad arterial periférica; ECVA: enfermedad cardiovascular arteriosclerótica; ERC: enfermedad renal crónica; FGe bajo: filtrado glomerular estimado según CKD-EPI <60mL/min/1,73 m2; FRCV: factores de riesgo cardiovascular; Hipercolesterolemia: colesterol total ≥200mg/dL; Hipertrigliceridemia: triglicéridos ≥150mg/dL; ICT aumentado: índice cintura-talla ≥0,6; Inactividad física: actividad física <150 minutos/semana; Obesidad: IMC ≥30kg/m2; Obesidad central: perímetro abdominal ≥102cm (hombres); ≥88cm (mujeres); PRED-ADA: prediabetes según la American Diabetes Association (GPA: 100–125mg/dL o HbA1c: 5,7–6,4%); PRED-SED: prediabetes según la Sociedad Española de Diabetes (GPA: 110–125mg/dL o HbA1c: 6,0–6,4%); Sobrepeso: IMC 25,0-29,9kg/m2; Tabaquismo: consumo de cualquier cantidad de cigarrillos o tabaco durante el último mes.
Los porcentajes de sujetos de estudio con RCV bajo, moderado, alto y muy alto en la población con PRED-SED eran 7,46% (IC95%: 5,21–9,71), 23,90% (IC95%: 20,25–27,56), 29,83% (IC95%: 25,91–33,75) y 38,81% (IC95%: 34,64–42,99) respectivamente. Los porcentajes de sujetos de estudio con RCV bajo, moderado, alto y muy alto en la población con PRED-ADA eran 11,04% (IC95%: 9,43–12,66), 27,26% (IC95%: 24,97–29,55), 28,02% (IC95%: 25,71–30,33) y 33,68% (IC95%: 31,24–36,11) respectivamente.
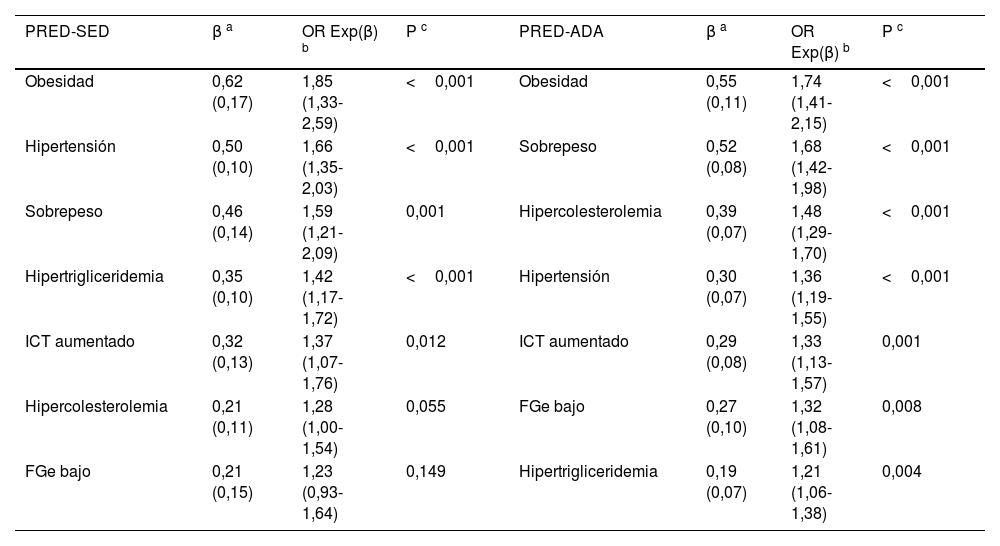
El análisis multivariante mostró que los FRCV y comorbilidades que se asociaban independientemente con la PRED-SED eran HTA, HTG, sobrepeso, obesidad, y el ICT aumentado. Además de estas variables, la hipercolesterolemia y el FGe bajo también se asociaban independientemente con la PRED-ADA (tabla 4).
Análisis multivariante del efecto de comorbilidades y FRCV sobre la prediabetes
| PRED-SED | β a | OR Exp(β) b | P c | PRED-ADA | β a | OR Exp(β) b | P c |
|---|---|---|---|---|---|---|---|
| Obesidad | 0,62 (0,17) | 1,85 (1,33-2,59) | <0,001 | Obesidad | 0,55 (0,11) | 1,74 (1,41-2,15) | <0,001 |
| Hipertensión | 0,50 (0,10) | 1,66 (1,35-2,03) | <0,001 | Sobrepeso | 0,52 (0,08) | 1,68 (1,42-1,98) | <0,001 |
| Sobrepeso | 0,46 (0,14) | 1,59 (1,21-2,09) | 0,001 | Hipercolesterolemia | 0,39 (0,07) | 1,48 (1,29-1,70) | <0,001 |
| Hipertrigliceridemia | 0,35 (0,10) | 1,42 (1,17-1,72) | <0,001 | Hipertensión | 0,30 (0,07) | 1,36 (1,19-1,55) | <0,001 |
| ICT aumentado | 0,32 (0,13) | 1,37 (1,07-1,76) | 0,012 | ICT aumentado | 0,29 (0,08) | 1,33 (1,13-1,57) | 0,001 |
| Hipercolesterolemia | 0,21 (0,11) | 1,28 (1,00-1,54) | 0,055 | FGe bajo | 0,27 (0,10) | 1,32 (1,08-1,61) | 0,008 |
| FGe bajo | 0,21 (0,15) | 1,23 (0,93-1,64) | 0,149 | Hipertrigliceridemia | 0,19 (0,07) | 1,21 (1,06-1,38) | 0,004 |
FGe bajo: filtrado glomerular <60mL/min/1,73 m2 (CKD-EPI); FRCV: factores de riesgo cardiovascular; Hipercolesterolemia: colesterol total ≥200mg/dL; Hipertrigliceridemia: triglicéridos ≥150mg/dL; ICT aumentado: índice cintura-talla ≥0,6; Obesidad: IMC ≥30kg/m2; PRED-ADA: prediabetes según la American Diabetes Association (GPA: 100–125mg/dL o HbA1c: 5,7–6,4%); PRED-SED: prediabetes según la Sociedad Española de Diabetes (GPA: 110–125mg/dL o HbA1c: 6,0–6,4%); Sobrepeso: IMC 25,0–29,9kg/m2.
La prediabetes representa una brecha entre el estado glucémico normal y la DM, que implica un riesgo de enfermedad inherente. Si la progresión desde la normoglucemia a la DM puede tardar varios años, la prediabetes podría ser un estado clínico susceptible de detectar, que permitiría identificar a sujetos con un riesgo aumentado de desarrollar DM y episodios de ECVA4. Por otra parte, la evolución de los sujetos con prediabetes es muy variable. En ausencia de cualquier intervención, algunas personas pueden progresar a DM, otras pueden permanecer con dicha condición el resto de su vida y otras podrían regresar al estado de normoglucemia23.
Las sociedades científicas muestran una heterogeneidad en los valores de los criterios que definen la prediabetes, que conduce a una variabilidad en las tasas de prevalencia de esta entidad. La ADA16 incluye dentro del término prediabetes a la GBA definida como concentraciones de GPA entre 100 y 125mg/dl (5,6–6,9 mmol/l), y a los valores de HbA1c entre 5,7% y 6,4% (39–47 mmol/mol). Por otra parte, la Organización Mundial de la Salud24 (OMS) considera hiperglucemia a las concentraciones de GPA entre 110 y 125mg/dl (6,1–6,9 mml/l), y las guías del National Institute for Health and Care Excellence25 (NICE) y de la Australian Diabetes Society26 consideran prediabetes valores de HbA1c entre 6,0% y 6,4% (42–47 mmol/mol). La SED17, en consenso con otras sociedades científicas españolas, considera prediabetes siguiendo los criterios de la OMS24 y los de la NICE25, ambos criterios también propuestos por la sociedad Canadian Diabetes27.
En el estudio SIMETAP-PRED, la prevalencia de prediabetes era tres veces mayor aplicando los criterios diagnósticos de la ADA16 que aplicando los de la SED17, con alta probabilidad debido a que la población PRED-ADA tiene valores de GPA y/o de HbA1c más amplios que la población PRED-SED. Las prevalencias específicas por grupos etarios en ambas poblaciones aumentaban de forma precisa con la edad probablemente debido a la progresiva acumulación de factores cardiometabólicos, cardiovasculares y renales relacionados con la prediabetes. Las tasas de prevalencias ajustadas de prediabetes eran mayores en hombres que en mujeres, similar a lo que ocurre en la DM14,28, mostrando diferencias más importantes según criterios de la ADA16 (21,3% vs. 17,6%) que los de la SED17 (7,2% vs. 6,3%). Por otra parte, se detectó que la media de edad de la población PRE–ADA era 2,4 años menor que la población PRE–SED y que la proporción de hombres con prediabetes era significativamente mayor en los grupos etarios entre 30 y 59 años de la población PRE–ADA. Por tanto, con la utilización de los criterios diagnósticos más amplios de la ADA16, la detección de la prediabetes sería más precoz e incluiría a una mayor proporción de sujetos, sobre todo varones.
Las tasas de prevalencia ajustadas por edad y sexo del estudio SIMETAP-PRED fueron inferiores a las que muestran otros estudios realizados en otros países26,29–35, bien sea utilizando criterios de la ADA16 o de la SED17. En comparación con otros estudios realizados en España36,37, la tasa de prevalencia ajustada del presente estudio era superior si se utilizaban los criterios de la ADA16,36 e inferior si se utilizaban los criterios de la SED17,37. La prevalencia fue similar a la del estudio PREDIMERC38 realizado en la Comunidad de Madrid. Las diferencias se podrían atribuir a que en el estudio SIMETAP-PRED no se realizó la sobrecarga de glucosa para determinar la intolerancia a la glucosa, a que la mayoría de los estudios se basan en encuestas de salud29–35, y a un mayor rango de edad de la población estudiada con respecto al que analizaron los demás estudios de comparación.
Es conocido que la prediabetes es un estado de resistencia a la insulina3 que se asocia con obesidad, perímetro abdominal aumentado, HTA y dislipidemia aterogénica4–6,16, y que se considera como un factor que aumenta el riesgo de padecer DM1,2 y ECVA8–10,16. El IMC se considera que no es un buen indicador en sujetos con talla baja, edad avanzada, musculados, con retención hidrosalina o gestantes39, pues no informa de la distribución de la grasa corporal ni diferencia entre masa grasa y magra40. Por esta razón, las asociaciones americanas de Endocrinología41 y la Sociedad Española para el Estudio de la Obesidad (SEEDO)42 recomiendan el uso de otros indicadores antropométricos como el perímetro abdominal, el ICT o algoritmos para estimar la masa grasa como el CUN-BAE18. El presente estudio mostró que el sobrepeso, la obesidad y el ICT aumentado eran factores independientes asociados con la prediabetes. A pesar de que la variable CUN-BAE-obesidad no se incluyó en el análisis multivariante por ser una variable compleja que incluye otras variables ya analizadas, esta fue la segunda variable que mostraba mayor asociación con la prediabetes después del SM19.
Las prevalencias de HTA, hipercolesterolemia, FGe bajo y albuminuria de la población PRED-ADA del estudio SIMETAP-PRED eran más frecuentes que en el grupo con prediabetes de la encuesta NHANES6, probablemente debido a que la edad media de la población del presente estudio era 10 años mayor (62 vs. 52 años) que la de la encuesta NHANES6.
La HTA fue un factor independiente que mostraba una importante asociación con la prediabetes en ambos grupos, siendo ligeramente inferior en el grupo PRED-ADA que en el grupo PRED-SED, probablemente debido a que en la población PRE-ADA había un mayor porcentaje de personas entre 40 y 60 años donde la prevalencia de HTA es menor.
Las variables hipercolesterolemia, HTG, c-HDL bajo y dislipidemia aterogénica también mostraban asociación con la prediabetes, siendo la HTG un factor independientemente asociado con PRED-SED y con PRED-ADA, y la hipercolesterolemia con PRED-ADA. Dos estudios recientes han mostrado de forma similar algunas de estas relaciones, siendo la PRED-ADA y no la PRED-SED, un factor independientemente asociado con la HTG y con la dislipidemia aterogénica43,44. Asumiendo que la prediabetes se considera dentro del concepto del SM19, las asociaciones de la obesidad central, HTA, HTG, y c-HDL bajo con PRED-SED y PRED-ADA también podrían justificar que el SM19 fuera la variable que presentaba una mayor asociación con ambos grupos de prediabetes.
Con respecto a la función renal, no se encontró asociación entre albuminuria y prediabetes, aunque sí se observó una asociación con el FGe bajo en ambos grupos, mostrándose como un factor independiente de riesgo de PRED-ADA.
Las variables de la ECVA y sus componentes, insuficiencia cardiaca, y disfunción eréctil mostraron unas moderadas o ligeras asociaciones, aunque ninguna llegó a ser un factor independientemente asociado con la prediabetes. Esto apoyaría la afirmación de que no todas las personas con prediabetes sin ECVA tienen un RCV elevado9,11, y que necesiten una valoración del RCV de la misma manera que la precisa la población general11. Por otra parte, el estudio SIMETAP-PRED muestra que el porcentaje de pacientes con RCV alto o muy alto en las poblaciones PRED-SED y PRED-ADA era del 68,6% y 61,7% respectivamente, y que hay diferencias significativas en las prevalencias de enfermedad coronaria e ictus entre las poblaciones con y sin prediabetes, por lo que se podrían detectar algunos signos de daño vascular arteriosclerótico y evitar su progresión si se interviniera precozmente sobre los factores que la favorecen45.
Una limitación del presente estudio fue la incapacidad para determinar causalidad o estimar tasas de incidencia al tratarse de un estudio transversal. Otras limitaciones tenían relación con el posible infradiagnóstico pues no se realizó ad hoc la sobrecarga oral de glucosa para determinar la intolerancia a la glucosa en pacientes sin DM y un 18,9% de la población de estudio no tenía información sobre HbA1c, aunque todos podían ser diagnosticados de prediabetes utilizando los respectivos criterios de GPA. Por otra parte, por protocolo no se incluyó en el estudio a mujeres en periodo de gestación, pacientes terminales, institucionalizados, o con deterioro cognitivo. Las principales fortalezas del presente estudio fueron la selección aleatoria con base poblacional, una muestra grande que incluyó a toda la población adulta entre 18 y 102 años de edad, y la evaluación de la posible asociación con numerosas variables cardiometabólicas, cardiovasculares y renales.
Las anomalías en el metabolismo hidrocarbonado pueden detectarse hasta 10 años antes del diagnóstico de DM1, por lo que una detección precoz de la prediabetes permitiría aplicar medidas para prevenir su aparición mediante el control del peso, la presión arterial y la dislipidemia. La menor exigencia en los criterios diagnósticos de la ADA16, con un rango de valores de GPA y HbA1c más amplios, posiblemente sean los más adecuados para alcanzar estos objetivos. En resumen, la detección más temprana de la prediabetes y la mayor asociación de factores cardiometabólicos y renales con los parámetros PRED-ADA, podrían inclinar la balanza a su favor a la hora de decidir entre los criterios de la SED17 o de la ADA16.
El estudio SIMETAP-PRED muestra cómo la prediabetes está muy influenciada por la edad, por lo que su prevalencia siempre se debería documentar con tasas ajustadas por edad para poder comparar con otras poblaciones. Por otra parte, también muestra una elevada prevalencia en la población mayor de 60 años por lo que sería necesaria la realización de más estudios epidemiológicos dirigidos a toda la población. La elevada prevalencia de prediabetes repercute sobre las cargas socioeconómica y sanitaria al aumentar el riesgo de DM y la morbimortalidad cardiovascular. La valoración de la prevalencia de prediabetes es muy importante para planificar y optimizar los recursos de salud disponibles, y para mejorar la atención médica implementando medidas de prevención cardiovascular y del riesgo de DM, como son las eficaces modificaciones de los estilos de vida en los pacientes con prediabetes.
ConclusionesLa prevalencia ajustada por edad de prediabetes era 6,6% si se utilizaban los criterios de la SED, y 19,1% si se seguían los criterios de la ADA, incrementándose con la edad, y siendo ligeramente más elevada en los hombres que en las mujeres. El 68,6% de la población con PRED-SED y el 61,7% de la población con PRED-ADA tenían un RCV alto o muy alto. En la población estudiada en el estudio SIMETAP-PRED, los factores cardiometabólicos sobrepeso, obesidad, ICT aumentado, HTA e HTG se asocian independientemente con la prediabetes diagnosticada con los criterios de la SED17 o de la ADA16. Además de estos factores, la hipercolesterolemia y el FGe bajo se asocian independientemente con la prediabetes diagnosticada con criterios de la ADA16. La mayor asociación con factores cardiometabólicos, cardiovasculares y renales, y la mayor detección de prediabetes siguiendo los criterios de la ADA16, mejoraría su diagnóstico precoz y posibilitaría una intervención precoz sobre todos estos factores, con el fin de disminuir la progresión de la prediabetes hacia DM y reducir el riesgo de ECVA en los pacientes con prediabetes.
Comité Ético de InvestigaciónComisión de Investigación de la Gerencia Adjunta de Planificación y Calidad.
Gerencia de Atención Primaria. Servicio Madrileño de Salud (SERMAS).
FinanciaciónLa financiación del estudio SIMETAP (Código Beca: 05/2010RS) fue aprobada según la Orden 472/2010, de 16 de septiembre, de la Consejería de Sanidad, por la que se aprueban las bases reguladoras y la convocatoria de ayudas para el año 2010 de la Agencia «Pedro Laín Entralgo» de Formación, Investigación y Estudios Sanitarios de la Comunidad de Madrid, para la realización de proyectos de investigación en el campo de resultados en salud en atención primaria.
Autoría/colaboradoresEzequiel Arranz-Martínez y Antonio Ruiz-García comparten primer autor.
Conflicto de interesesLos autores declaran no tiener ningún conflicto de intereses.
Se agradece la colaboración prestada por los siguientes médicos que han participado en el Grupo de Investigación del Estudio SIMETAP: Abad Schilling C, Adrián Sanz M, Aguilera Reija P, Alcaraz Bethencourt A, Alonso Roca R, Álvarez Benedicto R, Arranz Martínez E, Arribas Álvaro P, Baltuille Aller MC, Barrios Rueda E, Benito Alonso E, Berbil Bautista ML, Blanco Canseco JM, Caballero Ramírez N, Cabello Igual P, Cabrera Vélez R, Calderín Morales MP, Capitán Caldas M, Casaseca Calvo TF, Cique Herráinz JA, Ciria de Pablo C, Chao Escuer P, Dávila Blázquez G, de la Peña Antón N, de Prado Prieto L, del Villar Redondo MJ, Delgado Rodríguez S, Díez Pérez MC, Durán Tejada MR, Escamilla Guijarro N, Escrivá Ferrairó RA, Fernández Vicente T, Fernández-Pacheco Vila D, Frías Vargas MJ, García Álvarez JC, García Fernández ME, García García Alcañiz MP, García Granado MD, García Pliego RA, García Redondo MR, García Villasur MP, Gómez Díaz E, Gómez Fernández O, González Escobar P, González-Posada Delgado JA, Gutiérrez Sánchez I, Hernández Beltrán MI, Hernández de Luna MC, Hernández López RM, Hidalgo Calleja Y, Holgado Catalán MS, Hombrados Gonzalo MP, Hueso Quesada R, Ibarra Sánchez AM, Iglesias Quintana JR, Íscar Valenzuela I, Iturmendi Martínez N, Javierre Miranda AP, López Uriarte B, Lorenzo Borda MS, Luna Ramírez S, Macho del Barrio AI, Magán Tapia P, Marañón Henrich N, Mariño Suárez JE, Martín Calle MC, Martín Fernández AI, Martínez Cid de Rivera E, Martínez Irazusta J, Migueláñez Valero A, Minguela Puras ME, Montero Costa A, Mora Casado C, Morales Cobos LE, Morales Chico MR, Moreno Fernández JC, Moreno Muñoz MS, Palacios Martínez D, Pascual Val T, Pérez Fernández M, Pérez Muñoz R, Plata Barajas MT, Pleite Raposo R, Prieto Marcos M, Quintana Gómez JL, Redondo de Pedro S, Redondo Sánchez M, Reguillo Díaz J, Remón Pérez B, Revilla Pascual E, Rey López AM, Ribot Catalá C, Rico Pérez MR, Rivera Teijido M, Rodríguez Cabanillas R, Rodríguez de Cossío A, Rodríguez de Mingo E, Rodríguez Rodríguez AO, Rosillo González A, Rubio Villar M, Ruiz Díaz L, Ruiz García A, Sánchez Calso A, Sánchez Herráiz M, Sánchez Ramos MC, Sanchidrián Fernández PL, Sandín de Vega E, Sanz Pozo B, Sanz Velasco C, Sarriá Sánchez MT, Simonaggio Stancampiano P, Tello Meco I, Vargas-Machuca Cabañero C, Velazco Zumarrán JL, Vieira Pascual MC, Zafra Urango C, Zamora Gómez MM, Zarzuelo Martín N.
Agradecemos el esfuerzo y dedicación de los siguientes médicos que han participado en el Grupo de Investigación del Estudio SIMETAP: Abad Schilling C, Adrián Sanz M, Aguilera Reija P, Alcaraz Bethencourt A, Alonso Roca R, Álvarez Benedicto R, Arranz Martínez E, Arribas Álvaro P, Baltuille Aller MC, Barrios Rueda E, Benito Alonso E, Berbil Bautista ML, Blanco Canseco JM, Caballero Ramírez N, Cabello Igual P, Cabrera Vélez R, Calderín Morales MP, Capitán Caldas M, Casaseca Calvo TF, Cique Herráinz JA, Ciria de Pablo C, Chao Escuer P, Dávila Blázquez G, de la Peña Antón N, de Prado Prieto L, del Villar Redondo MJ, Delgado Rodríguez S, Díez Pérez MC, Durán Tejada MR, Escamilla Guijarro N, Escrivá Ferrairó RA, Fernández Vicente T, Fernández-Pacheco Vila D, Frías Vargas MJ, García Álvarez JC, García Fernández ME, García García Alcañiz MP, García Granado MD, García Pliego RA, García Redondo MR, García Villasur MP, Gómez Díaz E, Gómez Fernández O, González Escobar P, González-Posada Delgado JA, Gutiérrez Sánchez I, Hernández Beltrán MI, Hernández de Luna MC, Hernández López RM, Hidalgo Calleja Y, Holgado Catalán MS, Hombrados Gonzalo MP, Hueso Quesada R, Ibarra Sánchez AM, Iglesias Quintana JR, Íscar Valenzuela I, Iturmendi Martínez N, Javierre Miranda AP, López Uriarte B, Lorenzo Borda MS, Luna Ramírez S, Macho del Barrio AI, Magán Tapia P, Marañón Henrich N, Mariño Suárez JE, Martín Calle MC, Martín Fernández AI, Martínez Cid de Rivera E, Martínez Irazusta J, Migueláñez Valero A, Minguela Puras ME, Montero Costa A, Mora Casado C, Morales Cobos LE, Morales Chico MR, Moreno Fernández JC, Moreno Muñoz MS, Palacios Martínez D, Pascual Val T, Pérez Fernández M, Pérez Muñoz R, Plata Barajas MT, Pleite Raposo R, Prieto Marcos M, Quintana Gómez JL, Redondo de Pedro S, Redondo Sánchez M, Reguillo Díaz J, Remón Pérez B, Revilla Pascual E, Rey López AM, Ribot Catalá C, Rico Pérez MR, Rivera Teijido M, Rodríguez Cabanillas R, Rodríguez de Cossío A, Rodríguez De Mingo E, Rodríguez Rodríguez AO, Rosillo González A, Rubio Villar M, Ruiz Díaz L, Ruiz García A, Sánchez Calso A, Sánchez Herráiz M, Sánchez Ramos MC, Sanchidrián Fernández PL, Sandín de Vega E, Sanz Pozo B, Sanz Velasco C, Sarriá Sánchez MT, Simonaggio Stancampiano P, Tello Meco I, Vargas-Machuca Cabañero C, Velazco Zumarrán JL, Vieira Pascual MC, Zafra Urango C, Zamora Gómez MM, Zarzuelo Martín N.