Los objetivos del estudio fueron determinar las tasas de prevalencia brutas y ajustadas por edad y sexo de diabetes mellitus (DM), DM tipo 1 (DM1) y DM tipo 2 (DM2), y comparar la asociación de factores de riesgo cardiovascular, enfermedades cardiovasculares, enfermedad renal crónica y enfermedades metabólicas entre las poblaciones con y sin DM.
MétodosSIMETAP-DM es un estudio observacional transversal realizado en atención primaria, con una muestra aleatoria de base poblacional de 10.579 adultos. Tasa de respuesta: 66%. Los diagnósticos de DM, DM1 y DM2 se basaron en criterios clínicos y bioquímicos y/o en la comprobación de estos diagnósticos en las historias clínicas. Se determinaron las prevalencias brutas y ajustadas por edad y sexo (estandarizadas con la población española).
ResultadosLas prevalencias brutas de DM1, DM2 y DM fueron del 0,87% (intervalo de confianza al 95% [IC 95%]: 0,67-1,13), el 14,7% (IC 95%: 13,9-15,6) y el 15,6% (IC 95%: 14,7-16,5), respectivamente. Las prevalencias ajustadas por edad y sexo de DM1, DM2 y DM fueron del 1,0% (1,3% para hombres y 0,7% para mujeres), el 11,5% (13,6% para hombres y 9,7% para mujeres) y el 12,5% (14,9% para hombres y 10,5% para mujeres), respectivamente. La prevalencia de DM en la población≥70 años era el doble (30,3% [IC 95%: 28,0-32,7]) que en la población entre 40 y 69 años (15,3% [IC 95%: 14,1-16,5%]). La hipertensión arterial, la enfermedad arterial periférica, el índice cintura-talla aumentado, la albuminuria, la enfermedad coronaria, la dislipidemia aterogénica y la hipercolesterolemia se asociaban con la DM.
ConclusionesEn el ámbito de la atención primaria española, las prevalencias ajustadas por edad de DM1, DM2 y DM en la población adulta fueron del 1,0, el 11,5 y el 12,5%, respectivamente. Un tercio de la población mayor de 70 años padecía DM.
The aims of this study were to determine the age- and sex-adjusted prevalence rates of DM, type-1 DM (T1DM), and type-2 DM (T2DM), and to compare the relationship with cardiovascular risk factors, cardiovascular diseases, chronic kidney disease, and metabolic diseases between populations with and without DM.
MethodsSIMETAP-DM is a cross-sectional observational study conducted in a Primary Care setting with a random population-based sample of 10,579 adults. Response rate: 66%. The diagnoses of DM, T1DM and T2DM were based on clinical and biochemical criteria and/or the checking of these diagnoses in the medical records. The crude and age- and sex-adjusted (standardised for Spanish population) prevalence rates were calculated.
ResultsThe crude prevalence rates of T1DM, T2DM, and DM were 0.87% (95% confidence interval [95% CI]: 0.67-1.13), 14.7% (95% CI: 13.9-15.6), and 15.6% (95% CI: 14.7-16.5), respectively. The age- and sex-adjusted prevalence rates of T1DM, T2DM, and DM were 1.0% (1.3% for men and 0.7% for women), 11.5% (13.6% for men and 9.7% for women), and 12.5% (14.9% for men and 10.5% for women), respectively. The prevalence of DM in the population≥70 years was double (30.3% [95% CI: 28.0-32.7]) that of the population between 40 and 69 years (15.3% [95% CI: 14.1-16.5]). Hypertension, peripheral arterial disease, increased waist-to-height ratio, albuminuria, coronary heart disease, atherogenic dyslipidaemia and hypercholesterolaemia were associated with DM.
ConclusionsIn a Spanish primary care setting, the age-adjusted prevalences of T1DM, T2DM and DM in the adult population were 1.0, 11.5, and 12.5%, respectively. One-third (33%) of the population over 70 years had DM.
La diabetes mellitus (DM) está asociada a un riesgo cardiovascular (RCV) alto o muy alto. La principal causa de morbimortalidad en los pacientes con DM es la enfermedad cardiovascular (ECV). Se estima que su presencia triplica el riesgo de mortalidad cardiovascular y duplica el riesgo de mortalidad total en comparación con la población sin DM1. Estos datos se ven magnificados por el constante aumento de su prevalencia y del gasto sanitario ocasionado.
El riesgo de ictus, enfermedad coronaria (EC) o muerte cardiovascular se podría reducir en los pacientes con DM si se cumplieran los objetivos de control de tabaquismo, presión arterial, albuminuria, hemoglobina glucosilada A1c (HbA1c) y colesterol unido a lipoproteínas de baja densidad (c-LDL)2.
La Federación Internacional de Diabetes estimó en 2015 que la prevalencia de DM en la población mundial de 20 a 79 años era de un 8,8% y que generaba un gasto de 673.000 millones de dólares. Se estima que en la actualidad hay 451 millones de personas adultas con DM y que ocasiona 5 millones de muertes. Para el año 2040 se prevé que un 10,4% de la población mundial (642 millones de personas) tendrá DM y que generará un gasto en salud de 802.000 millones de dólares3.
La Encuesta Europea de Salud4 mostró una tendencia progresiva en la prevalencia de DM en la población española mayor de 14 años, aumentando del 4,1% en 1993 hasta casi el 7% en las 2 últimas encuestas de 2011 y 2014. Al comparar los datos de la Encuesta Europea de Salud4 con las tasas de prevalencia de DM de los estudios DARIOS5 (13%) y Di@bet.es6 (13,8%) se puede deducir que cerca de la mitad de los pacientes con DM no saben que padecen esta enfermedad.
Asumiendo una prevalencia de DM del 7,8%, el estudio SECCAID7 calculó en 2013 que los costes directos de DM en España eran de 5.809 millones de euros, y que los costes de DM en atención primaria (consumo de tiras reactivas, determinaciones trimestrales de HbA1c, una visita anual a oftalmología, 8 visitas anuales con enfermería y 4 con el médico de familia) eran de 1.463 millones de euros.
Las principales acciones para la prevención de la ECV son las intervenciones en el estilo de vida, junto con la detección y el control de los factores de riesgo cardiovascular (FRVC). Los estudios de prevalencia de los FRVC son necesarios para mejorar las actividades de prevención cardiovascular, planificar adecuadamente los recursos de salud necesarios, monitorizar y evaluar las estrategias dirigidas hacia la consecución de los objetivos establecidos en el Plan de acción mundial para las enfermedades no transmisibles8.
Los objetivos del estudio SIMETAP-DM fueron determinar en la población adulta con 18 o más años las actuales tasas de prevalencia ajustadas por edad y sexo de DM, DM tipo 1 (DM1) y DM tipo 2 (DM2) en un ámbito de atención primaria española, y comparar la asociación de los FRCV, la ECV, la enfermedad renal crónica (ERC) y las enfermedades metabólicas entre las poblaciones con y sin DM.
Material y métodosEl estudio SIMETAP-DM es un estudio observacional transversal realizado por 121 médicos de familia de 64 centros de atención primaria del Servicio Madrileño de Salud (SERMAS), seleccionados competitivamente hasta alcanzar el tamaño muestral necesario. El estudio SIMETAP-DM está incluido en el estudio SIMETAP, que se llevó a cabo conforme al Código Ético de la Asociación Médica Mundial (Declaración de Helsinki) y fue aprobado por la Comisión de Investigación de la Gerencia de Atención Primaria del SERMAS. La financiación del estudio SIMETAP (código 05/2010RS) fue concedida por la Agencia «Pedro Laín Entralgo» de Formación, Investigación y Estudios Sanitarios de la Comunidad de Madrid, para la realización de proyectos de investigación en el campo de resultados en salud en atención primaria. Se obtuvo el consentimiento informado de todos los sujetos del estudio. El material y los métodos (diseño, muestreo, selección, inclusión y criterios de exclusión de los sujetos del estudio, recopilación de datos y análisis estadísticos) del estudio SIMETAP se han detallado previamente en esta revista9.
Se realizó una muestra aleatoria simple mediante tablas de números aleatorios de la población mayor de 18 años asignada al SERMAS (10.579 personas). Por protocolo de estudio, se excluyeron los pacientes terminales, los institucionalizados, aquellos con deterioro cognitivo y las mujeres en periodo de gestación, obteniéndose una muestra final con 10.084 sujetos de estudio, cuya tasa de respuesta fue del 65,8%.
Los criterios bioquímicos para el diagnóstico de DM fueron los definidos por la Asociación Americana de Diabetes10 o la Asociación Canadiense de Diabetes11: glucosa plasmática en ayunas≥126mg/dL (≥7,0mmol/L) o HbA1c≥6,5% (≥48mmol/mol)10,11 confirmadas en al menos 2 ocasiones, o la determinación de glucosa plasmática≥200mg/dL (≥11,1mmol/L), bien aleatoria a cualquier hora del día sin importar el intervalo desde la última comida, o con la prueba de tolerancia oral a la glucosa (2h después de la administración de 75g de glucosa anhidra disuelta en agua). Se consideró que los pacientes padecían DM si tenían criterios de DM1 o DM2. Se consideró que los pacientes padecían DM1 si tenían los criterios definidos por la Asociación Americana de Diabetes10 o la Asociación Canadiense de Diabetes11: deficiencia en la producción de insulina como consecuencia de destrucción autoinmune o idiopática de células β (incluyendo tipo LADA), con péptido C bajo o indetectable o clínica compatible con hiperglucemia (poliuria, polidipsia, cetoacidosis), y los criterios bioquímicos diagnósticos de DM anteriormente citados10,11. Se consideró que los pacientes padecían DM2 si la enfermedad cursara con resistencia a la insulina sin criterios de DM1 y con los criterios bioquímicos diagnóstico de DM anteriormente citados10,11. Asimismo, se consideró que los pacientes padecían DM1 o DM2, al comprobar que estos diagnósticos o los siguientes códigos de la Clasificación Internacional de Atención Primaria segunda edición (CIAP-2)12 o de la Clasificación Internacional de Enfermedades novena revisión, modificación clínica (CIE-9)13 estaban registrados en sus historias clínicas: DM1: T89 (CIAP-2)12; 250.01 (CIE-9)13; DM2: T90 (CIAP-2)12; 249, 250.02 (CIE-9)13. Por protocolo de estudio, no se incluyeron las mujeres gestantes en el estudio, por lo que no se consideró diabetes gestacional.
El análisis estadístico se realizó con el Statistical Package for the Social Sciences program (IBM® SPSS® Statistical release 20.0, Armonk, NY, EE. UU.). Las variables continuas se analizaron con la media y la desviación estándar (DE), la mediana y el rango intercuartílico. Las variables cualitativas, las estimaciones brutas y las prevalencias específicas por edad se presentaron con los límites inferior y superior del intervalo de confianza al 95% (IC 95%). La prueba t de Student o el análisis de la varianza se usaron para las comparaciones entre grupos para las variables continuas, y la prueba chi-cuadrado para las variables categóricas. Se utilizó el análisis multivariado de regresión logística con el método introducir para evaluar el efecto sobre la variable dependiente (DM) de aquellas variables independientes (FRCV y comorbilidades) cuyo análisis bivariante realizado previamente hubiera mostrado una asociación estadísticamente significativa con la variable dependiente. Por ser variables complejas que engloban a otras ya incluidas en el análisis multivariante, no se incluyeron en este análisis las siguientes variables: índice de adiposidad CUN-BAE (Clínica Universitaria de Navarra-Body Adiposity Estimator), síndrome metabólico (SM) y ECV. Todas las pruebas se consideraron estadísticamente significativas si el valor p de 2 colas era<0,05.
Las tasas de prevalencia se informaron como tasas brutas y tasas ajustadas por edad y sexo, estandarizadas con la población española mediante método directo14. Las distribuciones por edad y sexo de la población española se obtuvieron de la base de datos del Instituto Nacional de Estadística15 de enero de 2015.
Se consideraron las siguientes definiciones:
- -
Tabaquismo: consumo de cualquier cantidad de cigarrillos o tabaco durante el último mes.
- -
Enfermedad pulmonar obstructiva crónica según la guía GOLD16.
- -
Etilismo: consumo de alcohol semanal>21 unidades (>210g) en hombres;>14 unidades (>140g) en mujeres.
- -
Inactividad física: actividad física semanal<150min.
- -
Índice de masa corporal (IMC): peso/altura2. Sobrepeso: IMC 25,0-29,9kg/m2. Obesidad: IMC≥30kg/m2.
- -
Índice de adiposidad CUN-BAE17,18 o porcentaje de grasa corporal:−44,988+(0,503×edad)+(10,689×sexo)+(3,172×IMC)−(0,026×IMC2)+(0,181×IMC×sexo)−(0,02×IMC×edad)−(0,005×IMC2×sexo)+(0,00021×IMC2×edad); sexo masculino=0; sexo femenino=1. CUN-BAE-sobrepeso: 20-25% (hombres); 30-35% (mujeres); CUN-BAE-obesidad:>25% (hombres);>35% (mujeres).
- -
Obesidad central: perímetro abdominal≥102cm (hombres) o≥88cm (mujeres).
- -
Índice cintura-talla (ICT): perímetro abdominal/altura. ICT aumentado: ≥0,6.
- -
Hipertensión arterial (HTA): presión arterial sistólica≥140mmHg y/o presión arterial diastólica≥90mmHg, o tener tratamiento antihipertensivo.
- -
HbA1c estandarizadas según el Diabetes Control and Complications Trial y según la International Federation of Clinical Chemistry.
- -
Hipercolesterolemia: colesterol total (CT)>200mg/dL.
- -
Hipertrigliceridemia (HTG): triglicéridos (TG)>150mg/dL.
- -
Concentraciones bajas de colesterol unido a lipoproteínas de alta densidad (c-HDL): <40mg/dL (hombres); <50mg/dL (mujeres).
- -
Índice aterogénico de plasma (IAP): log (TG/c-HDL).
- -
Índice TG y glucosa: Ln [TG (mg/dL)×glucosa plasmática en ayunas (mg/dL)/2].
- -
Dislipidemia aterogénica: HTG y c-HDL bajo.
- -
SM: según consenso armonizado IDF/NHLBI/AHA/WHF/IAS/IASO19.
- -
ECV: incluye EC, ictus y enfermedad arterial periférica (EAP). EC: incluye cardiopatía isquémica, infarto agudo de miocardio previo, síndromes coronarios agudos, revascularización coronaria y otros procedimientos de revascularización arterial. Ictus: incluye accidente cerebrovascular, isquemia cerebral o hemorragias intracraneales y ataque isquémico transitorio. EAP: incluye claudicación intermitente o un índice tobillo-brazo≤0,9.
- -
Albuminuria: cociente albúmina-creatinina>30mg/g.
- -
Tasa de filtrado glomerular estimado (FGe) según la Chronic Kidney Disease EPIdemiology Collaboration20. FGe bajo: <60mL/min/1,73m2. ERC: FGe bajo y/o albuminuria20.
- -
RCV según SCORE21,22. RCV extremo23: pacientes con DM y ECV.
Se realizó una búsqueda bibliográfica en PubMed, Medline, Embase, Google Scholar y Web of Science para comparar las tasas de prevalencia de DM del presente estudio con las determinadas en los principales estudios realizados en España entre 2000 y 2015 con poblaciones de 18 años o más.
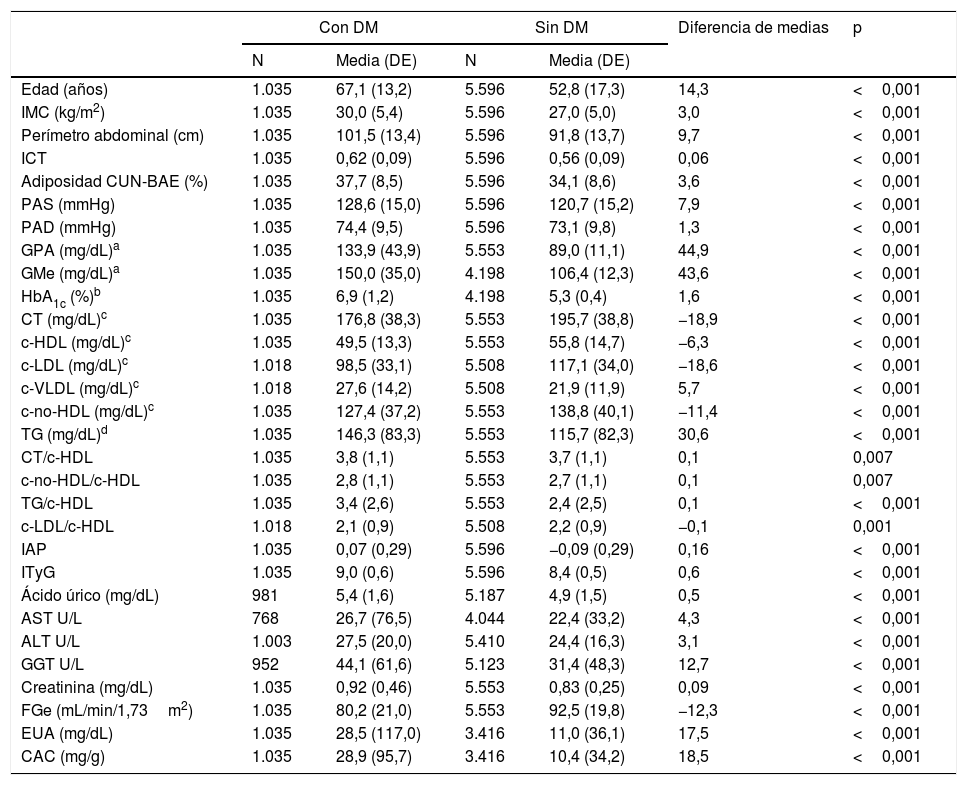
ResultadosLa población de estudio fue de 6.631 adultos, siendo mujeres el 55,8% (IC 95%: 54,6-57,0). La media de edad era de 55,0 años (DE 17,5), la mediana, de 54,6 años, y el rango de edad, de 18,0 a 102,8 años (rango intercuartílico: 41,6; 68,0). La diferencia entre las medias de edad de las poblaciones masculina (55,1 años [DE 16,9]) y femenina (55,0 años [DE 18,0]) no fue significativa (p=0,908). Las diferencias de las medias de edad entre las poblaciones con y sin DM se muestran en la tabla 1. En la población sin DM, la diferencia de las medias de edad entre hombres (52,6 años [DE 16,8]) y mujeres (53,0 años [DE 17,7]) no fue significativa (p=0,416). Sin embargo, la diferencia de las medias de edad entre hombres (65,3 años [DE 13,0]) y mujeres (69,2 años [DE 13,2]) en la población con DM sí fue significativa (p<0,001).
Características clínicas de la población de estudio
| Con DM | Sin DM | Diferencia de medias | p | |||
|---|---|---|---|---|---|---|
| N | Media (DE) | N | Media (DE) | |||
| Edad (años) | 1.035 | 67,1 (13,2) | 5.596 | 52,8 (17,3) | 14,3 | <0,001 |
| IMC (kg/m2) | 1.035 | 30,0 (5,4) | 5.596 | 27,0 (5,0) | 3,0 | <0,001 |
| Perímetro abdominal (cm) | 1.035 | 101,5 (13,4) | 5.596 | 91,8 (13,7) | 9,7 | <0,001 |
| ICT | 1.035 | 0,62 (0,09) | 5.596 | 0,56 (0,09) | 0,06 | <0,001 |
| Adiposidad CUN-BAE (%) | 1.035 | 37,7 (8,5) | 5.596 | 34,1 (8,6) | 3,6 | <0,001 |
| PAS (mmHg) | 1.035 | 128,6 (15,0) | 5.596 | 120,7 (15,2) | 7,9 | <0,001 |
| PAD (mmHg) | 1.035 | 74,4 (9,5) | 5.596 | 73,1 (9,8) | 1,3 | <0,001 |
| GPA (mg/dL)a | 1.035 | 133,9 (43,9) | 5.553 | 89,0 (11,1) | 44,9 | <0,001 |
| GMe (mg/dL)a | 1.035 | 150,0 (35,0) | 4.198 | 106,4 (12,3) | 43,6 | <0,001 |
| HbA1c (%)b | 1.035 | 6,9 (1,2) | 4.198 | 5,3 (0,4) | 1,6 | <0,001 |
| CT (mg/dL)c | 1.035 | 176,8 (38,3) | 5.553 | 195,7 (38,8) | −18,9 | <0,001 |
| c-HDL (mg/dL)c | 1.035 | 49,5 (13,3) | 5.553 | 55,8 (14,7) | −6,3 | <0,001 |
| c-LDL (mg/dL)c | 1.018 | 98,5 (33,1) | 5.508 | 117,1 (34,0) | −18,6 | <0,001 |
| c-VLDL (mg/dL)c | 1.018 | 27,6 (14,2) | 5.508 | 21,9 (11,9) | 5,7 | <0,001 |
| c-no-HDL (mg/dL)c | 1.035 | 127,4 (37,2) | 5.553 | 138,8 (40,1) | −11,4 | <0,001 |
| TG (mg/dL)d | 1.035 | 146,3 (83,3) | 5.553 | 115,7 (82,3) | 30,6 | <0,001 |
| CT/c-HDL | 1.035 | 3,8 (1,1) | 5.553 | 3,7 (1,1) | 0,1 | 0,007 |
| c-no-HDL/c-HDL | 1.035 | 2,8 (1,1) | 5.553 | 2,7 (1,1) | 0,1 | 0,007 |
| TG/c-HDL | 1.035 | 3,4 (2,6) | 5.553 | 2,4 (2,5) | 0,1 | <0,001 |
| c-LDL/c-HDL | 1.018 | 2,1 (0,9) | 5.508 | 2,2 (0,9) | −0,1 | 0,001 |
| IAP | 1.035 | 0,07 (0,29) | 5.596 | −0,09 (0,29) | 0,16 | <0,001 |
| ITyG | 1.035 | 9,0 (0,6) | 5.596 | 8,4 (0,5) | 0,6 | <0,001 |
| Ácido úrico (mg/dL) | 981 | 5,4 (1,6) | 5.187 | 4,9 (1,5) | 0,5 | <0,001 |
| AST U/L | 768 | 26,7 (76,5) | 4.044 | 22,4 (33,2) | 4,3 | <0,001 |
| ALT U/L | 1.003 | 27,5 (20,0) | 5.410 | 24,4 (16,3) | 3,1 | <0,001 |
| GGT U/L | 952 | 44,1 (61,6) | 5.123 | 31,4 (48,3) | 12,7 | <0,001 |
| Creatinina (mg/dL) | 1.035 | 0,92 (0,46) | 5.553 | 0,83 (0,25) | 0,09 | <0,001 |
| FGe (mL/min/1,73m2) | 1.035 | 80,2 (21,0) | 5.553 | 92,5 (19,8) | −12,3 | <0,001 |
| EUA (mg/dL) | 1.035 | 28,5 (117,0) | 3.416 | 11,0 (36,1) | 17,5 | <0,001 |
| CAC (mg/g) | 1.035 | 28,9 (95,7) | 3.416 | 10,4 (34,2) | 18,5 | <0,001 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CAC: cociente albúmina/creatinina; CT: colesterol total; CUN-BAE: índice de adiposidad o porcentaje de grasa corporal; c-HDL: colesterol unido a lipoproteínas de alta densidad; c-LDL: colesterol unido a lipoproteínas de baja densidad; c-no-HDL: colesterol no unido a lipoproteínas de alta densidad; c-VLDL: colesterol unido a lipoproteínas de muy baja densidad; DE: desviación estándar; DM: diabetes mellitus; EUA: excreción urinaria de albúmina; FGe: tasa de filtrado glomerular estimado según CKD-EPI; GGT: gamma-glutamil transferasa; GMe: glucosa media estimada; GPA: glucosa plasmática en ayunas; HbA1c: hemoglobina glucosilada; IAP: índice aterogénico de plasma; ICT: Índice cintura-talla; IMC: Índice de masa corporal; ITyG: índice triglicéridos y glucosa; p: p-valor de la diferencia de medias; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos.
La media del tiempo de evolución de la DM fue 9,2 (DE 6,8) años, siendo significativa (p=0,002) la diferencia entre hombres (8,6 [DE 6,3] años) y mujeres (9,9 [DE 7,4] años). El 63,4% (IC 95%: 60,5-66,3) de la población con DM tenía HbA1c<7,0% (<53mmol/mol), el 21,6% (19,1-24,2%) tenía HbA1c entre 7,0 y 7,9% (53-63mmol/mol) y el 15,0% (12,8-17,2%) tenía HbA1c≥8% (≥64mmol/mol).
Las características clínicas de la población de estudio se muestran en la tabla 1. Todos los parámetros evaluados fueron significativamente mayores en la población con DM, excepto las concentraciones de CT, c-HDL, c-LDL, c-no-HDL, el cociente c-LDL/c-HDL y el FGe, que eran significativamente mayores en la población sin DM.
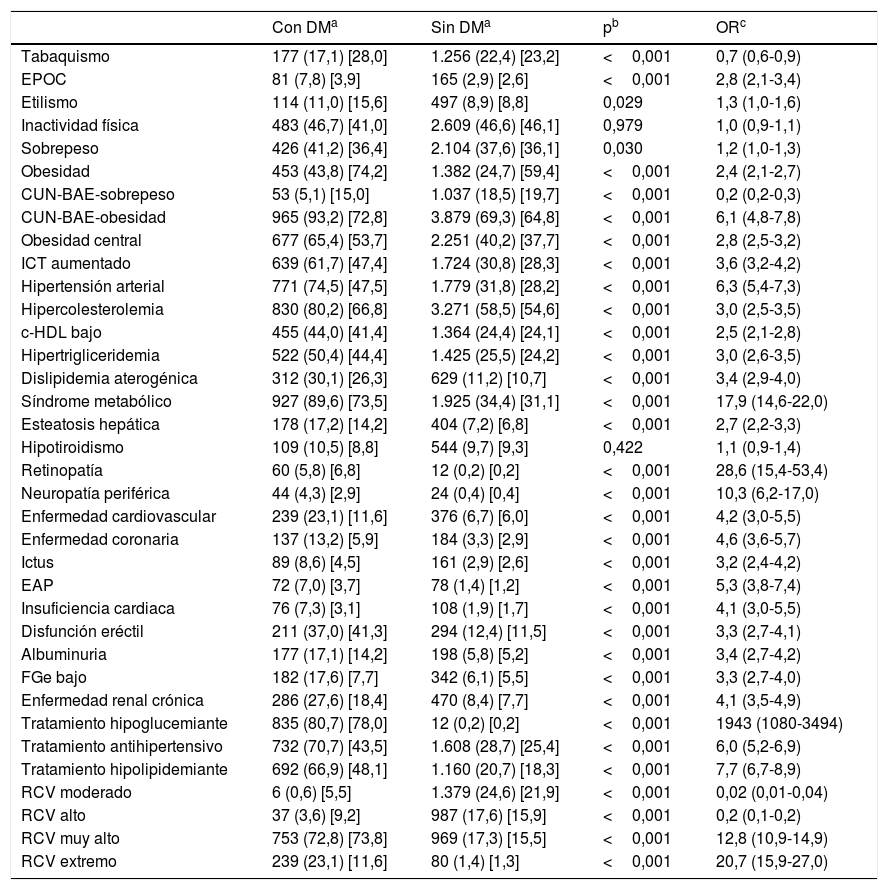
La odds ratio (OR) de la comorbilidad asociada entre las poblaciones con y sin DM se muestra en la tabla 2. El tabaquismo actual, el sobrepeso y los RCV moderado y alto se asociaban significativamente con la población sin DM. La inactividad física y el hipotiroidismo no mostraron asociación con las poblaciones con o sin DM. El resto de los FRCV y comorbilidades se asociaban significativamente con la DM. La retinopatía, la neuropatía periférica y el SM25 fueron las variables que mostraron una mayor asociación con la DM. El 95,8% (IC 95%: 94,4-97,0) de los pacientes diabéticos tenían RCV muy alto21,22, de los que el 24,1% (IC 95%: 21,5-26,9) tenían RCV extremo23 al coexistir con ECV establecida.
Odds ratio de la comorbilidad asociada entre las poblaciones con y sin diabetes mellitus
| Con DMa | Sin DMa | pb | ORc | |
|---|---|---|---|---|
| Tabaquismo | 177 (17,1) [28,0] | 1.256 (22,4) [23,2] | <0,001 | 0,7 (0,6-0,9) |
| EPOC | 81 (7,8) [3,9] | 165 (2,9) [2,6] | <0,001 | 2,8 (2,1-3,4) |
| Etilismo | 114 (11,0) [15,6] | 497 (8,9) [8,8] | 0,029 | 1,3 (1,0-1,6) |
| Inactividad física | 483 (46,7) [41,0] | 2.609 (46,6) [46,1] | 0,979 | 1,0 (0,9-1,1) |
| Sobrepeso | 426 (41,2) [36,4] | 2.104 (37,6) [36,1] | 0,030 | 1,2 (1,0-1,3) |
| Obesidad | 453 (43,8) [74,2] | 1.382 (24,7) [59,4] | <0,001 | 2,4 (2,1-2,7) |
| CUN-BAE-sobrepeso | 53 (5,1) [15,0] | 1.037 (18,5) [19,7] | <0,001 | 0,2 (0,2-0,3) |
| CUN-BAE-obesidad | 965 (93,2) [72,8] | 3.879 (69,3) [64,8] | <0,001 | 6,1 (4,8-7,8) |
| Obesidad central | 677 (65,4) [53,7] | 2.251 (40,2) [37,7] | <0,001 | 2,8 (2,5-3,2) |
| ICT aumentado | 639 (61,7) [47,4] | 1.724 (30,8) [28,3] | <0,001 | 3,6 (3,2-4,2) |
| Hipertensión arterial | 771 (74,5) [47,5] | 1.779 (31,8) [28,2] | <0,001 | 6,3 (5,4-7,3) |
| Hipercolesterolemia | 830 (80,2) [66,8] | 3.271 (58,5) [54,6] | <0,001 | 3,0 (2,5-3,5) |
| c-HDL bajo | 455 (44,0) [41,4] | 1.364 (24,4) [24,1] | <0,001 | 2,5 (2,1-2,8) |
| Hipertrigliceridemia | 522 (50,4) [44,4] | 1.425 (25,5) [24,2] | <0,001 | 3,0 (2,6-3,5) |
| Dislipidemia aterogénica | 312 (30,1) [26,3] | 629 (11,2) [10,7] | <0,001 | 3,4 (2,9-4,0) |
| Síndrome metabólico | 927 (89,6) [73,5] | 1.925 (34,4) [31,1] | <0,001 | 17,9 (14,6-22,0) |
| Esteatosis hepática | 178 (17,2) [14,2] | 404 (7,2) [6,8] | <0,001 | 2,7 (2,2-3,3) |
| Hipotiroidismo | 109 (10,5) [8,8] | 544 (9,7) [9,3] | 0,422 | 1,1 (0,9-1,4) |
| Retinopatía | 60 (5,8) [6,8] | 12 (0,2) [0,2] | <0,001 | 28,6 (15,4-53,4) |
| Neuropatía periférica | 44 (4,3) [2,9] | 24 (0,4) [0,4] | <0,001 | 10,3 (6,2-17,0) |
| Enfermedad cardiovascular | 239 (23,1) [11,6] | 376 (6,7) [6,0] | <0,001 | 4,2 (3,0-5,5) |
| Enfermedad coronaria | 137 (13,2) [5,9] | 184 (3,3) [2,9] | <0,001 | 4,6 (3,6-5,7) |
| Ictus | 89 (8,6) [4,5] | 161 (2,9) [2,6] | <0,001 | 3,2 (2,4-4,2) |
| EAP | 72 (7,0) [3,7] | 78 (1,4) [1,2] | <0,001 | 5,3 (3,8-7,4) |
| Insuficiencia cardiaca | 76 (7,3) [3,1] | 108 (1,9) [1,7] | <0,001 | 4,1 (3,0-5,5) |
| Disfunción eréctil | 211 (37,0) [41,3] | 294 (12,4) [11,5] | <0,001 | 3,3 (2,7-4,1) |
| Albuminuria | 177 (17,1) [14,2] | 198 (5,8) [5,2] | <0,001 | 3,4 (2,7-4,2) |
| FGe bajo | 182 (17,6) [7,7] | 342 (6,1) [5,5] | <0,001 | 3,3 (2,7-4,0) |
| Enfermedad renal crónica | 286 (27,6) [18,4] | 470 (8,4) [7,7] | <0,001 | 4,1 (3,5-4,9) |
| Tratamiento hipoglucemiante | 835 (80,7) [78,0] | 12 (0,2) [0,2] | <0,001 | 1943 (1080-3494) |
| Tratamiento antihipertensivo | 732 (70,7) [43,5] | 1.608 (28,7) [25,4] | <0,001 | 6,0 (5,2-6,9) |
| Tratamiento hipolipidemiante | 692 (66,9) [48,1] | 1.160 (20,7) [18,3] | <0,001 | 7,7 (6,7-8,9) |
| RCV moderado | 6 (0,6) [5,5] | 1.379 (24,6) [21,9] | <0,001 | 0,02 (0,01-0,04) |
| RCV alto | 37 (3,6) [9,2] | 987 (17,6) [15,9] | <0,001 | 0,2 (0,1-0,2) |
| RCV muy alto | 753 (72,8) [73,8] | 969 (17,3) [15,5] | <0,001 | 12,8 (10,9-14,9) |
| RCV extremo | 239 (23,1) [11,6] | 80 (1,4) [1,3] | <0,001 | 20,7 (15,9-27,0) |
Albuminuria: cociente albúmina-creatinina>30mg/g; CUN-BAE obesidad:>25% (hombres); >35% (mujeres); c-HDL bajo: colesterol unido a lipoproteínas de alta densidad<40mg/dL en hombres y<50mg/dL en mujeres; Dislipidemia aterogénica: hipertrigliceridemia y c-HDL bajo; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; EAP: enfermedad arterial periférica; ECV: enfermedad cardiovascular; FGe bajo: filtrado glomerular<60mL/min/1,73m2 según CKD-EPI; Hipercolesterolemia: colesterol total>200mg/dL; Hipertrigliceridemia: triglicéridos>150mg/dL; ICT aumentado: índice cintura-talla≥0,6; Obesidad: IMC≥30kg/m2; Obesidad central: perímetro abdominal≥102cm en hombres y≥88cm en mujeres; Sobrepeso: IMC 25,0-29,9kg/m2; RCV: riesgo cardiovascular; RCV extremo: ECV+DM.
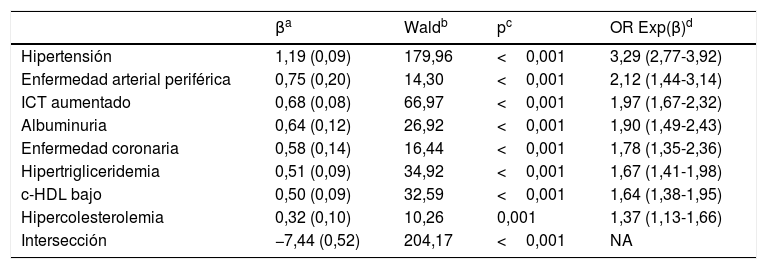
El análisis multivariante muestra que los FRCV y las comorbilidades que se asocian independientemente con la DM son HTA, EAP, ICT aumentado, albuminuria, EC, HTG, c-HDL bajo e hipercolesterolemia (tabla 3).
Análisis multivariante de los factores de riesgo cardiovascular y comorbilidades asociadas a la diabetes mellitus
| βa | Waldb | pc | OR Exp(β)d | |
|---|---|---|---|---|
| Hipertensión | 1,19 (0,09) | 179,96 | <0,001 | 3,29 (2,77-3,92) |
| Enfermedad arterial periférica | 0,75 (0,20) | 14,30 | <0,001 | 2,12 (1,44-3,14) |
| ICT aumentado | 0,68 (0,08) | 66,97 | <0,001 | 1,97 (1,67-2,32) |
| Albuminuria | 0,64 (0,12) | 26,92 | <0,001 | 1,90 (1,49-2,43) |
| Enfermedad coronaria | 0,58 (0,14) | 16,44 | <0,001 | 1,78 (1,35-2,36) |
| Hipertrigliceridemia | 0,51 (0,09) | 34,92 | <0,001 | 1,67 (1,41-1,98) |
| c-HDL bajo | 0,50 (0,09) | 32,59 | <0,001 | 1,64 (1,38-1,95) |
| Hipercolesterolemia | 0,32 (0,10) | 10,26 | 0,001 | 1,37 (1,13-1,66) |
| Intersección | −7,44 (0,52) | 204,17 | <0,001 | NA |
Albuminuria: cociente albúmina-creatinina>30mg/g; c-HDL bajo: colesterol unido a lipoproteínas de alta densidad<40mg/dL en hombres y<50mg/dL en mujeres; DM: diabetes mellitus; FRCV: factores de riesgo cardiovascular; Hipercolesterolemia: colesterol total>200mg/dL; Hipertrigliceridemia: triglicéridos>150mg/dL; ICT aumentado: Índice cintura-talla≥0,6; NA: no aplicable.
En la población con 18 o más años, las prevalencias brutas de DM1, DM2 y DM fueron del 0,87% (IC 95%: 0,67-1,13), el 14,7% (IC 95%: 13,9-15,6) y el 15,6% (IC 95%: 14,7-16,5), respectivamente, y sus prevalencias ajustadas por edad y sexo fueron del 0,95, 11,5 y 12,5%, respectivamente. La prevalencia bruta de DM en hombres fue del 19,4% (IC 95%: 17,9-20,8) y del 12,6% (IC 95%: 11,5-13,7) en mujeres, y sus prevalencias ajustadas por edad fueron del 14,9 y 10,5%, respectivamente.
Las tasas de prevalencia brutas y ajustadas por edad y sexo de DM1, DM2 y DM globales y por grupos etarios (<40, 40-69, y≥70 años) y sus diferencias entre hombres y mujeres se detallan en la tabla 4. La prevalencia de DM en la población entre 40 y 69 años era del 15,3% (IC 95%: 14,1-16,5), siendo el doble en hombres (20,3% [IC 95%: 18,4-22,3]) que en mujeres (10,8% [IC 95%: 8,5-12,3]). La prevalencia de DM en la población≥70 años era del 30,3% (IC 95%: 28,0-32,7), siendo del 33,5% (IC 95%: 29,7-37,4) en hombres y del 28,1% (IC 95%: 25,1-31,2) en mujeres.
Tasas de prevalencia brutas y ajustadas por edad y sexo de DM1, DM2 y DM
| Tipo DM (grupo etario) | Globala | Hombres | Mujeres | Diferenciab | pc | ORd |
|---|---|---|---|---|---|---|
| DM1 (18-39 años) | 17 (1,2) | 12 (2,0) | 5 (0,6) | 1,4 (0,2; 2,6) | 0,015 | 3,4 (1,2-9,7) |
| DM1 (40-69 años) | 35 (0,9) | 16 (0,9) | 19 (1,0) | 0,0 (−0,7; 0,6) | 0,925 | 1,0 (0,5-1,9) |
| DM1 (≥70 años) | 6 (0,4) | 2 (0,3) | 4 (0,5) | −0,1 (−0,9; 0,8) | 0,701 | 0,7 (0,1-3,9) |
| DM1 (≥18 años)e | 58 (0,9) | 30 (1,0) | 28 (0,8) | 0,3 (−0,2; 0,7) | 0,259 | 1,4 (0,8-2,3) |
| DM1 (≥18 años)f | 1,0 | 1,3 | 0,7 | 0,5 | <0,001 | 1,7 |
| DM2 (18-39 años) | 12 (0,8) | 8 (1,3) | 4 (0,5) | 0,8 (0,1; 2,1) | 0,076 | 2,8 (0,9-9,4) |
| DM2 (40-69 años) | 528 (14,3) | 333 (19,4) | 195 (9,9) | 9,5 (7,2; 11,8) | <0,001 | 2,2 (1,8-2,7) |
| DM2 (≥70 años) | 437 (29,9) | 199 (33,2) | 238 (27,6) | 5,6 (0,8; 10,4) | 0,022 | 1,3 (1,0-1,6) |
| DM2 (≥18 años)e | 977 (14,7) | 540 (18,4) | 437 (11,8) | 6,6 (4,8; 8,3) | <0,001 | 1,7 (1,5-1,9) |
| DM2 (≥18 años)f | 11,5 | 13,6 | 9,7 | 3,9 | <0,001 | 1,4 |
| DM (18-39 años) | 29 (2,0) | 20 (3,3) | 9 (1,1) | 2,2 (0,7; 4,0) | 0,003 | 3,2 (1,4-7,0) |
| DM (40-69 años) | 563 (15,3) | 349 (20,3) | 214 (10,8) | 9,5 (7,1; 11,8) | <0,001 | 2,1 (1,7-2,5) |
| DM (≥70 años) | 443 (30,3) | 201 (33,5) | 242 (28,1) | 5,4 (0,6; 10,3) | 0,026 | 1,3 (1,0-1,6) |
| DM (≥18 años)e | 1.035 (15,6) | 570 (19,4) | 465 (12,6) | 6,8 (5,1; 8,6) | <0,001 | 1,7 (1,5-1,9) |
| DM (≥18 años)f | 12,5 | 14,9 | 10,5 | 4,4 | <0,001 | 1,4 |
DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2.
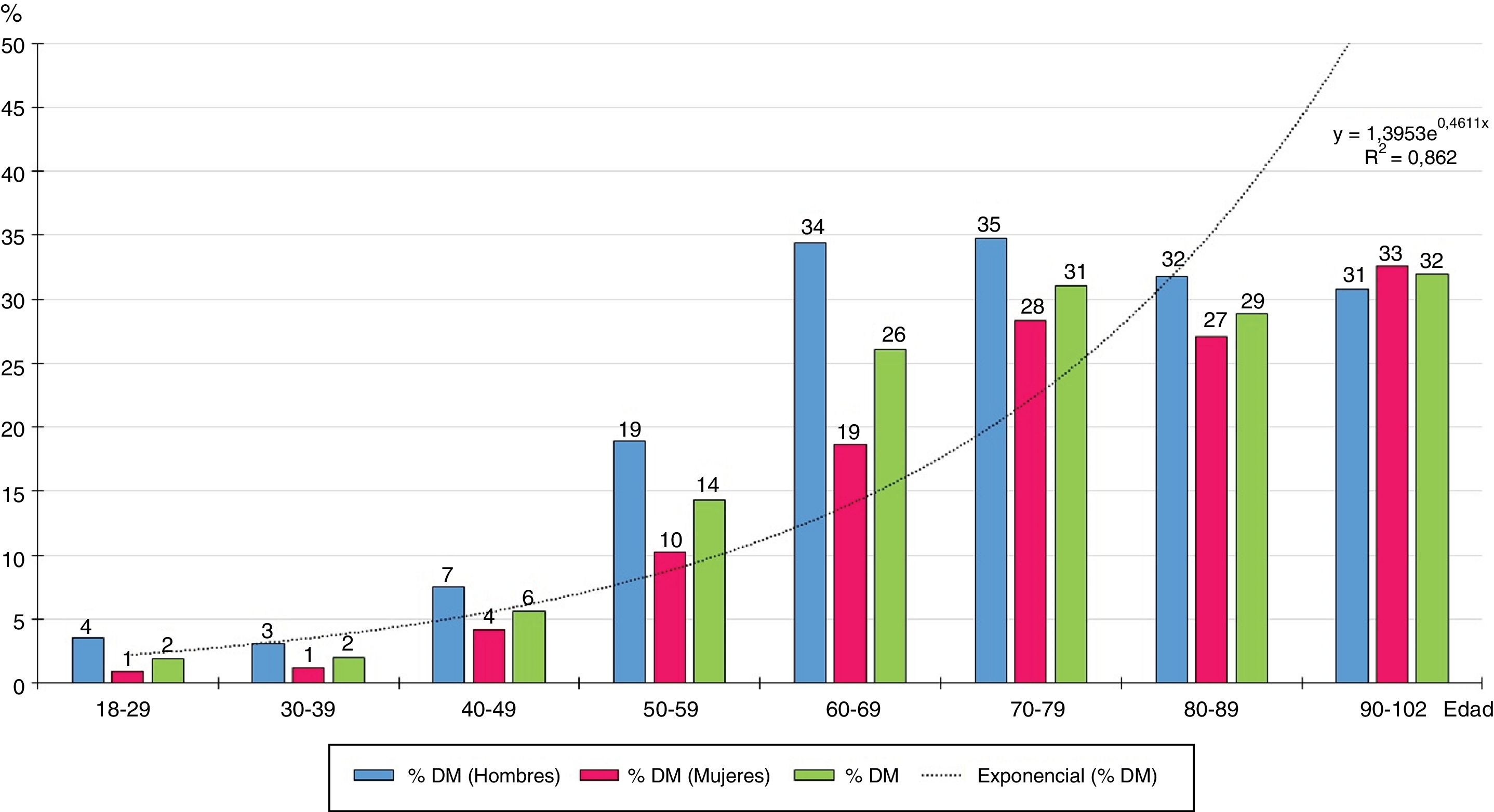
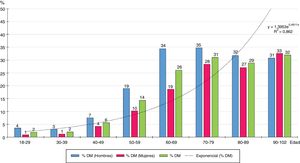
La distribución por grupos etarios decenales de las tasas de prevalencia de DM aumenta con la edad según una función exponencial natural (y=1,3953e0,4611x) (fig. 1), siendo significativas todas las diferencias entre hombres y mujeres, excepto en los mayores de 80 años.
DiscusiónEl presente estudio incluyó a 6.631 personas entre 18 y 102 años. La prevalencia ajustada por edad de DM fue del 12,4% (14,9% hombres; 10,4% mujeres) (tabla 4). Al comparar las tasas de prevalencia de DM determinadas en el estudio SIMETAP-DM con las de otros estudios realizados en España entre los años 2000 y 2015, se pueden valorar algunas similitudes y diferencias. En los siguientes 3 estudios24–26 se determinaron unas tasas de prevalencia más bajas. El estudio MADRIC24 incluyó a 1.344 personas entre 31 y 70 años e informó una prevalencia del 6,6% (7,3% hombres; 5,9% mujeres). El estudio ERICE25 incluyó a 16.240 adultos y determinó una prevalencia ajustada por edad de DM del 6,2%, y unas tasas de prevalencia brutas similares entre hombres (8,9%) y mujeres (8,7%). El estudio PREDIMERC26 incluyó a 2.268 personas entre 30 y 74 años y determinó una prevalencia bruta de DM del 8,1% (10,2% en hombres y 6,0% en mujeres). Estos estudios no incluyeron poblaciones mayores de 70 o 74 años, lo que podría justificar las diferencias entre las tasas de prevalencia de DM en la población adulta y las mostradas en el estudio SIMETAP-DM, cuya prevalencia de DM en la población con 70 años o mayores era del 33,5% (IC 95%: 29,7-37,4).
Por otra parte, otros 2 estudios nacionales5,6 determinaron unas tasas de prevalencia similares a las del presente estudio. El estudio Di@bet.es6 incluyó a 5.072 adultos e informó que la prevalencia de DM era del 13,8%. El estudio DARIOS5 incluyó a 28.887 personas entre 35 y 74 años e informó que la prevalencia de DM era del 13% (16% hombres; 11% mujeres).
El estudio SIMETAP-DM muestra una prevalencia de DM similar a la determinada en EE. UU. mediante la Encuesta Nacional de Examen de Salud y Nutrición27, que informó una prevalencia del 14,0% (15,9% en hombres y 12,2% en mujeres). Las tasas de prevalencia en los principales grupos etarios del estudio SIMETAP-DM también fueron similares a las de la Encuesta Nacional de Examen de Salud y Nutrición27: 2,0 frente a 3,5% en menores de 40 años, respectivamente, 15,3% en población entre 40-69 años frente a 16,3% en población entre 40-59 años27, y 30,3% en mayores de 70 años frente a 28,2% en mayores de 60 años27.
En el presente estudio, la prevalencia de DM en la población entre 40 y 69 años era del 15,3% (IC 95%: 14,1-16,5), siendo destacable que la prevalencia era el doble en hombres (20,3% [IC 95%: 18,4-22,3]) que en mujeres (10,8% [IC 95%: 8,5-12,3]). Asimismo, es relevante que la prevalencia de DM se duplicaba en la población con 70 o más años (30,3% [IC 95%: 28,0-32,7]) (tabla 4).
El estudio SIMETAP-DM muestra una prevalencia bruta de DM1 similar a la prevalencia ajustada por edad y sexo (1,0%), que podría justificarse por el carácter genético y por la escasa influencia de la edad en la prevalencia de la DM1. Sin embargo, las tasas de prevalencia brutas de la DM2 eran más altas que las tasas de prevalencia ajustadas por edad y sexo: 3 puntos porcentuales más en la población con 18 o más años (14,7 frente a 11,5%), 5 puntos porcentuales más en hombres (18,4 frente a 13,6%), y 2 puntos porcentuales más en mujeres (11,8 frente a 9,7%). Consideramos que las prevalencias deben ajustarse por edad y sexo debido a las diferencias inherentes al muestreo, a las diferencias de las pirámides poblacionales entre la población estándar y la población del presente estudio (con mayor edad media) y, finalmente, al efecto confusor de la edad sobre la prevalencia de DM, ya que se ha descrito28 que explica un incremento de las prevalencias brutas de entre el 12,5 y el 31,3%.
La prevalencia de enfermedad pulmonar obstructiva crónica era mayor en la población con DM (OR: 2,8), aunque el tabaquismo actual era menor (OR: 0,7), probablemente por ser una población con una edad media mayor y con menos hábito tabáquico que la población sin DM, más joven y con mayor hábito tabáquico (tabla 2).
Al comparar las tasas de prevalencia entre las poblaciones con y sin DM, las comorbilidades con mayor asociación con DM fueron SM, retinopatía y neuropatía periférica, lo que podría evidenciar la coexistencia de estas entidades en la DM. La fuerte asociación de la DM con el SM (OR: 17,9) puede estar justificada por la importante asociación de la DM con los criterios que definen el SM19: obesidad central (OR: 2,8), HTA (OR: 6,3), HTG (OR: 3,0) y HDL bajo (OR: 2,5) (tabla 2). Es comprensible que el índice IT y glucosa fuera significativamente más elevado en la población con DM al tener concentraciones más altas de TG y glucosa plasmática en ayunas (tabla 1). Por otra parte, la esteatosis hepática estaba más asociada con la DM (OR: 2,7) (tabla 2), lo que podría justificar las concentraciones de transaminasas más elevadas en la población con DM (tabla 1).
La HTA mostraba una fuerte asociación con la población con DM (OR: 6,3), lo que podría justificar que el tratamiento con fármacos antihipertensivos era más frecuente en la población con DM que en la población sin DM (OR: 6,0) (tabla 2). La prevalencia bruta de HTA en pacientes con DM (74,5%) era similar a la del estudio Di@betes29 (79,4%). En el análisis multivariante, la HTA fue la variable independiente que más se asociaba con la DM (OR: 3,3) (tabla 3).
De forma similar, la hipercolesterolemia, la HTG y las ECV mostraban importantes asociaciones con la población con DM (OR: 3,0; 3,0; 4,2 respectivamente), lo que podría justificar que el tratamiento con fármacos hipolipidemiantes fuera más frecuente en la población con DM que en la población sin DM (OR: 7,7) (tabla 2), reforzado por el seguimiento de las recomendaciones de las guías21,23 sobre la intensificación del tratamiento hipolipidemiante en los pacientes con DM. Todo ello justificaría las concentraciones más bajas de CT, c-LDL y c-no-HDL en la población con DM (tabla 1). Sin embargo, los índices aterogénicos CT/c-HDL, c-no-HDL/c-HDL, TG/c-HDL e IAP eran significativamente más altos en la población con DM (tabla 1). Por otra parte, los parámetros hipercolesterolemia, HTG y c-HDL bajo mostraban asociación con la DM tanto al compararlos con la población sin DM (tabla 2) como en el análisis multivariante (tabla 3), pudiendo evidenciar que la dislipidemia aterogénica es el fenotipo lipídico que más se asocia con la DM.
La insuficiencia cardiaca mostraba una importante asociación con la DM (OR: 4,1), apoyando la idea de la existencia de una miocardiopatía diabética30. La disfunción eréctil también mostraba asociación con la DM (OR: 3,3) (tabla 2). Las asociaciones de la EC (OR: 4,6), el ictus (OR: 3,2) y la EAP (OR: 5,3) con la DM (tabla 2) podrían justificar la fuerte asociación de la ECV con la DM (OR: 4,2) y la elevada morbilidad cardiovascular de la DM. En el análisis multivariante, tanto la EAP (OR 2,1) como la EC (OR: 1,8) continuaban mostrando una importante asociación con la DM (tabla 3).
La albuminuria (OR: 3,4) y el FGe bajo (OR: 3,3) se asociaban de forma significativa con la DM (tabla 2), destacando la importancia de la albuminuria, que mantenía la asociación con la DM (OR: 2,0) en el análisis multivariante (tabla 3).
Las variables obesidad, CUN-BAE-obesidad17,18, obesidad central (perímetro abdominal aumentado) y el ICT aumentado se asociaban de forma significativa con la DM (tabla 2), parámetros que podrían tener relación con la mayor prevalencia de dislipidemia aterogénica, HTG, c-HDL bajo, esteatosis hepática y con la mayor necesidad de tratamiento hipolipidemiante y antihipertensivo en la población con DM. Entre los parámetros relacionados con la obesidad, solo la variable ICT aumentado continuaba mostrando dicha asociación en el análisis multivariante (tabla 3), lo que podría apoyar la idea de considerar al ICT aumentado como un factor de riesgo para la DM más importante que la obesidad o el perímetro abdominal aumentado.
Los resultados del estudio SIMETAP-DM apoyan que la DM es una entidad con múltiples comorbilidades crónicas31–33 y, en consecuencia, los pacientes con DM tienen una mayor necesidad de utilizar los servicios de salud34. El 95,9% de la población con DM tenía un RCV muy alto o extremo, en detrimento de los RCV moderado y alto, que eran más frecuentes en la población sin DM. La elevada prevalencia de SM (89,6%) y de los FRCV en la población con DM puede explicar la prevalencia elevada del RCV muy alto (72,8% [IC 95%: 70,0-75,5]) y su fuerte asociación con el RCV muy alto (OR: 12,8) (tabla 2). Además, el 23,1% (IC 95%: 20,5-25,7) de la población con DM tenía ECV y, por lo tanto, un RCV extremo23. La prevalencia elevada de FRCV, SM y ECV en el paciente con DM puede justificar la estrecha asociación con el RCV muy alto o extremo (OR: 100 [IC 95%: 73,2-136,7]) y, por lo tanto, apoyar el mensaje21,23 de conseguir el objetivo terapéutico de c-LDL<70mg/dL (<1,8mmol/L) para la inmensa mayoría de los pacientes con DM (96%), y el objetivo de c-LDL<100mg/dL (<2,6mmol/L) para la menor proporción de pacientes con DM que solo tienen un RCV alto (4%).
La figura 1 muestra como la prevalencia de DM aumenta exponencialmente con la edad, por lo que la prevalencia de DM está fuertemente influida por ella. La prevalencia de DM en la población≥70 años (30,3%) era el doble que en la población entre 40 y 69 años (15,3%).
Las principales limitaciones del presente estudio fueron la incapacidad de un estudio transversal para determinar la causalidad y el posible infradiagnóstico al no realizar ad hoc pruebas de sobrecarga oral de glucosa a pacientes sin DM, y al excluir por protocolo a mujeres en el periodo de gestación y a pacientes terminales, institucionalizados o con deterioro cognitivo. Las principales fortalezas del presente estudio fueron la selección aleatoria con base poblacional, una muestra grande que incluyó a personas de 18 a 102 años de edad y la evaluación de FRCV, ERC, enfermedades metabólicas y ECV.
La elevada prevalencia de DM tiene graves consecuencias socioeconómicas y sanitarias al aumentar la morbimortalidad cardiovascular. La determinación de la prevalencia de DM es muy importante para planificar mejor las políticas de intervención de prevención cardiovascular, optimizar los recursos de salud disponibles y mejorar la atención médica y la calidad de vida de los pacientes con DM.
La DM está fuertemente influida por la edad, por lo que su prevalencia siempre se debería documentar con tasas ajustadas por edad para poder comparar con otras poblaciones. Dada la progresión de la prevalencia de DM en los últimos años, entendemos que es necesaria la realización de más estudios epidemiológicos dirigidos a toda la población. Esperamos que el presente estudio contribuya a mejorar el conocimiento epidemiológico de la DM y a valorar la importancia de la asociación entre la DM y la ECV.
ConclusionesEn el estudio SIMETAP-DM, la HTA, la EAP, el ICT aumentado, la albuminuria, la EC, la dislipidemia aterogénica y la hipercolesterolemia eran las variables que mejor se asociaban con la DM.
La prevalencia bruta de DM era del 15,6% en la población con 18 años o más, del 15,3% en la población entre 40 y 69 años y del 30,3% en la población con 70 años o más. La prevalencia de DM en la población masculina entre 40 y 69 años (20,3%) duplicaba la prevalencia de DM en la población femenina (10,8%).
La prevalencia ajustada por edad de la DM en la población con 18 años o más era 3 puntos porcentuales menor que la prevalencia bruta (12,5 frente a 15,6%), 5 puntos porcentuales menor en la población masculina (14,9 frente a 19,4%) y 2 puntos porcentuales menor en la población femenina (10,5 frente a 12,6%).
FinanciaciónLa financiación del estudio SIMETAP (Código Beca: 05/2010RS) fue aprobada según la Orden 472/2010, de 16 de septiembre, de la Consejería de Sanidad, por la que se aprueban las bases reguladoras y la convocatoria de ayudas para el año 2010 de la Agencia Pedro Laín Entralgo de Formación, Investigación y Estudios Sanitarios de la Comunidad de Madrid, para la realización de proyectos de investigación en el campo de resultados en salud en atención primaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece a todos los médicos que han participado su interés y la colaboración prestada en el desarrollo del Estudio SIMETAP.
Grupo de Investigación del Estudio SIMETAP: Abad-Schilling C, Adrián-Sanz M, Aguilera-Reija P, Alcaraz-Bethencourt A, Alonso-Roca R, Álvarez-Benedicto R, Arranz-Martínez E, Arribas-Álvaro P, Baltuille-Aller MC, Barrios-Rueda E, Benito-Alonso E, Berbil-Bautista ML, Blanco-Canseco JM, Caballero-Ramírez N, Cabello-Igual P, Cabrera-Vélez R, Calderín-Morales MP, Capitán-Caldas M, Casaseca-Calvo TF, Cique-Herráinz JA, Ciria-de-Pablo C, Chao-Escuer P, Dávila-Blázquez G, de-la-Peña-Antón N, de-Prado-Prieto L, del-Villar-Redondo MJ, Delgado-Rodríguez S, Díez-Pérez MC, Durán-Tejada MR, Escamilla-Guijarro N, Escrivá-Ferrairó RA, Fernández-Vicente T, Fernández-Pacheco-Vila D, Frías-Vargas MJ, García-Álvarez JC, García-Fernández ME, García-García-Alcañiz MP, García-Granado MD, García-Pliego RA, García-Redondo MR, García-Villasur MP, Gómez-Díaz E, Gómez-Fernández O, González-Escobar P, González-Posada-Delgado JA, Gutiérrez-Sánchez I, Hernández-Beltrán MI, Hernández-de-Luna MC, Hernández-López RM, Hidalgo-Calleja Y, Holgado-Catalán MS, Hombrados-Gonzalo MP, Hueso-Quesada R, Ibarra-Sánchez AM, Iglesias-Quintana JR, Íscar-Valenzuela I, Iturmendi-Martínez N, Javierre-Miranda AP, López-Uriarte B, Lorenzo-Borda MS, Luna-Ramírez S, Macho-del-Barrio AI, Marañón-Henrich N, Mariño-Suárez JE, Martín-Calle MC, Martín-Fernández AI, Martínez-Cid-de-Rivera E, Martínez-Irazusta J, Migueláñez-Valero A, Minguela-Puras ME, Montero-Costa A, Mora-Casado C, Morales-Cobos LE, Morales-Chico MR, Moreno-Fernández JC, Moreno-Muñoz MS, Palacios-Martínez D, Pascual-Val T, Pérez-Fernández M, Pérez-Muñoz R, Plata-Barajas MT, Pleite-Raposo R, Prieto-Marcos M, Quintana-Gómez JL, Redondo-de-Pedro S, Redondo-Sánchez M, Reguillo-Díaz J, Remón-Pérez B, Revilla-Pascual E, Rey-López AM, Ribot-Catalá C, Rico-Pérez-MR, Rivera-Teijido M, Rodríguez-Cabanillas R, Rodríguez-de-Cossío A, Rodríguez-de-Mingo E, Rodríguez-Rodríguez AO, Rosillo-González A, Rubio-Villar M, Ruiz-Díaz L, Ruiz-García A, Sánchez-Calso A, Sánchez-Herráiz M, Sánchez-Ramos MC, Sanchidrián-Fernández PL, Sandín-de-Vega E, Sanz-Pozo B, Sanz-Velasco C, Sarriá-Sánchez MT, Simonaggio-Stancampiano P, Tello-Meco I, Vargas-Machuca-Cabañero C, Velazco-Zumarrán JL, Vieira-Pascual MC, Zafra-Urango C, Zamora-Gómez MM, Zarzuelo-Martín N.