El incremento de grasa miocárdica ha sido propuesto como uno de los principales precursores de la disfunción miocárdica de etiología diabética independiente de la enfermedad arterial coronaria. Sin embargo, actualmente se carece de biomarcadores que reflejen el contenido de grasa miocárdica para la detección clínica de esta patología.
MétodosLas correlaciones entre el contenido de triglicéridos cardíacos y los niveles plasmáticos de las principales moléculas alteradas durante la diabetes y los niveles cardíacos de ARNm de genes implicados en el metabolismo cardíaco (Cd36 y Pdk4) han sido exploradas en un modelo murino de resistencia a la insulina inducida por una dieta con alto contenido en grasas.
ResultadosEn ratones resistentes a la insulina, la dieta grasa aumentó los niveles de triglicéridos del miocardio, en comparación con animales controles alimentados con una dieta estándar. El contenido de triglicéridos cardíacos se encontró directamente asociado con los niveles plasmáticos de glucosa, triglicéridos, VLDL, resistina y leptina. Además, se observó una correlación inversa entre el contenido de triglicéridos y los niveles cardíacos de ARNm de Cd36 y Pdk4.
ConclusionesNuestros datos revelan que el contenido cardíaco de triglicéridos se encuentra asociado con un perfil bioquímico plasmático alterado y con una reprogramación de la expresión de genes dirigida a atenuar el impacto de la acumulación ectópica de lípidos en miocardio.
The increase in myocardial fat has been proposed as one of the main precursors of myocardial dysfunction due to diabetic aetiology, independently of coronary artery disease. However, biomarkers reflecting the myocardial fat content for the clinical detection of this pathology are currently lacking.
MethodsCorrelations between cardiac triglyceride content and plasma levels of major altered molecules during diabetes and cardiac mRNA levels of genes involved in cardiac metabolism (Cd36 and Pdk4) have been explored in a murine model of insulin resistance induced by a high-fat diet.
ResultsIn insulin-resistant mice, the fatty diet increased myocardial triglyceride levels, compared to control animals fed with a standard diet. The content of cardiac triglycerides was directly associated with plasma levels of glucose, triglycerides, VLDL, resistin and leptin. In addition, an inverse correlation was observed between the content of cardiac triglycerides and the cardiac mRNA levels of Cd36 and Pdk4.
ConclusionsOur data reveal that the cardiac triglyceride content is associated with altered plasma biochemical profile and reprogramming of gene expression aimed to mitigate the impact of ectopic lipid accumulation in the myocardium.
La resistencia a la insulina ha sido propuesta como un importante factor de riesgo de insuficiencia cardíaca (IC), la principal causa de muerte en individuos con diabetes mellitus (DM)1. Los individuos diabéticos presentan entre 2y 5veces más riesgo de IC2. La principal alteración miocárdica relacionada con esta enfermedad es la enfermedad arterial coronaria. Sin embargo, la IC ha sido asociada con alteraciones metabólicas independientes de la lesión vascular3. Específicamente, se ha observado una acumulación de triglicéridos a nivel miocárdico en pacientes con miocardiopatía no isquémica en estado terminal4. La acumulación de lípidos a nivel cardíaco se conoce comúnmente como esteatosis cardíaca y se ha visto independientemente asociada con una función contráctil alterada y con el inicio de la disfunción miocárdica5-8. De hecho, el incremento de grasa miocárdica es evidente en ausencia de IC y precede la disfunción del miocardio6,8, siendo propuesto como uno de los principales precursores de la disfunción miocárdica debida a la diabetes4-8.
Los mecanismos subyacentes a la acumulación ectópica de grasa en miocardio no son plenamente conocidos en la actualidad. El incremento de ácidos grasos circulantes observado durante la DM facilita la utilización de los mismos como sustrato energético preferente para la producción de energía en las células cardíacas. Sin embargo, la captación de los ácidos grasos supera la capacidad que tiene la célula para metabolizarlos9, de manera que se acumulan intracelularmente como metabolitos lipídicos bioactivos, contribuyendo directamente a la activación de rutas moleculares que conducen al bloqueo de la vía de señalización de la insulina10. Además, el tejido adiposo libera a la circulación una gran cantidad de moléculas bioactivas llamadas adipoquinas, que pueden participar en el control del metabolismo energético, regulando la preferencia del sustrato utilizado para la producción de energía en sus tejidos diana. De esta manera, las adipoquinas se postulan como moléculas claves en la red de comunicación entre el tejido adiposo y los tejidos periféricos, incluido el corazón11, aunque su potencial papel como biomarcadores de la grasa miocárdica no ha sido explorado en profundidad.
A pesar de las evidencias que sustentan la acumulación de grasa cardíaca como potencial agente causal de la disfunción miocárdica independiente de la enfermedad isquémica en individuos diabéticos, en la actualidad se carece de biomarcadores que reflejen el contenido de triglicéridos miocárdicos para el diagnóstico de esta patología.
En este trabajo se analizan las asociaciones entre el contenido de triglicéridos cardíacos y el perfil bioquímico plasmático en ratones alimentados con una dieta grasa (HFD).
MétodosAnimalesRatones C57BL/6J macho de 6semanas de edad fueron mantenidos en condiciones estándar de luz/oscuridad (ciclos de 12 h) y temperatura (21±1°C) con acceso ad libitum a agua y comida. Los animales se distribuyeron de manera aleatoria en 2grupos experimentales (10 animales/grupo) y fueron alimentados con una dieta estándar (STD) (10% de kcal de grasa; Panlab; Barcelona, España) o con una HFD (60% kcal de grasa Panlab; Barcelona, España) durante 12 semanas12. A las 12 semanas, los animales fueron sacrificados y los corazones fueron inmediatamente congelados en nitrógeno líquido y conservados a —80°C para futuros análisis. Se obtuvieron muestras de plasma, donde se determinaron los niveles de glucosa (Spinreact; Barcelona, España), ácidos grasos libres (AGL) (Wako; Osaka, Japón), colesterol total y lipoproteínas de alta densidad (HDL, del inglés high-density lipoproteins) (Spinreact; Barcelona, España) utilizando un autoanalizador Cobas Mira Plus (Roche Diagnostics, Barcelona, España). Los niveles de lipoproteínas de baja densidad (LDL, del inglés low-density lipoproteins) y muy baja densidad (VLDL, del inglés very low-density lipoproteins) fueron determinados por Fridewald13. Los niveles de insulina, resistina, leptina y adiponectina fueron determinados mediante kits comerciales (Milliplex®, Millipore; Billerica, MA, EE. UU.). La resistencia a la insulina se evaluó mediante el índice HOMA utilizando la siguiente ecuación: (glucosa en ayuno [mmol/l]×insulina en ayuno [μU/ml]/22,5)14. La manipulación y los experimentos con animales se realizaron de acuerdo con la Guía para el cuidado y el uso de animales de laboratorio publicada por el U.S. National Institutes of Health (NIH publicación n.° 85-23, revisada en 1996). Todos los procedimientos fueron aprobados por el comité de Bioética de la Universidad Rovira i Virgili, tal y como se encuentra establecido en la Ley 5/12 de julio de 1995, y fueron aprobados por la Generalitat de Cataluña.
Tinción del contenido lipídicoEl contenido lipídico fue determinado en secciones de 5mm de corazones congelados de ratón utilizando el colorante Oil Red O (Sigma-Aldrich; Madrid, España) siguiendo el protocolo descrito por Mehlem et al.15. Las imágenes fueron capturadas con un microscopio Olympus IX71 (Madrid, España).
Determinación de los triglicéridos miocárdicosEl contenido de lípidos cardíaco fue extraído en metanol al 0,1% de ácido fórmico. La muestra se fragmentó mediante vórtex, inversión en N2 líquido y ultrasonicación. Seguidamente, se añadieron 3 volúmenes de diclorometano y un volumen de agua de manera secuencial. Las muestras fueron incubadas a 4°C durante 20 min y centrifugadas a 15.000rpm durante 15 min a 4°C. La fase orgánica fue recogida y secada bajo una corriente de nitrógeno. Los pellets lipídicos fueron resuspendidos en metanol:tolueno (9:1) para análisis por cromatografía líquida/espectrometría de masas (LC/MS).
Los análisis de LC/MS fueron realizados utilizando un sistema UHPLC (1200 series, Agilent Technologies) acoplado a un MS 6550 ESI-QTOF (Agilent Technologies, Madrid, España) operando en un modo de ionización positiva por electroespray (ESI+). Los lípidos fueron separados por una cromatrografía de fase reversa con un Acquity UPLC C18-RP (ACQUITY UPLC BEH C18 1.7μM, Waters, Barcelona, España).
Mediante el análisis por MS/MS se identificaron 36 triglicéridos incrementados por la HFD. Los datos de LC/MS fueron procesados utilizando el software XCMS (versión 1.34.0, SCIEX, Madrid, España)16. Se realizó el sumatorio de las intensidades de las especies individuales como indicador del contenido total de los triglicéridos identificados en cada grupo experimental. El rendimiento de la plataforma se evaluó calculando la desviación estándar relativa de estas características en muestras agrupadas (CVQC)17.
Preparación del ácido ribonucleico y análisis de la expresión génica mediante reacción en cadena de la polimerasa cuantitativa a tiempo realLos niveles relativos de ácido ribonucleico mensajero (ARNm) fueron analizados por transcriptasa reversa-reacción en cadena de la polimerasa a tiempo real (RT-real time PCR), como se ha descrito previamente18,19. El ARN total se aisló utilizando el reactivo TRITM (Sigma-Aldrich; Madrid, España), de acuerdo con las recomendaciones del fabricante. La integridad de ARN se determinó mediante electroforesis en gel de agarosa y se cuantificó con un espectofotómetro NanoDrop 1000 Spectrophotometer (Thermo Scientific; Madrid, España); 1μg de ARN total fue retrotranscrito utilizando el PrimeScript RT Reagent Kit (Takara Bio; Saint-Germain-en-Laye, Francia). Los niveles de ARNm fueron determinados por PCR a tiempo real en un equipo ABI PRISM 7900 (Applied Biosystems; Waltham, Massachusetts, EE. UU.). Se utilizaron sondas TaqMan (IDT; Leuven, Bélgica) de ratón para la detección de la expresión génica de Cd36 (Mm.PT.58.7548967) y Pdk4 (Mm.PT.58.9453460). Se analizó el nivel de expresión de TBP (TATA-binding protein) como referencia para la normalización de los resultados19-21.
Análisis estadísticosLos resultados se expresan como la mediana y rango intercuartílico. Las diferencias significativas fueron establecidas mediante U de Mann-Whitney. Las asociaciones entre las variables fueron analizadas mediante el test de correlación de Spearman. Los análisis estadísticos fueron realizados utilizando el programa informático SPSS (IBM SPSS Statistics, versión 22.0; Nueva York, EE. UU.). Las diferencias fueron consideradas significativas a partir de p<0,05.
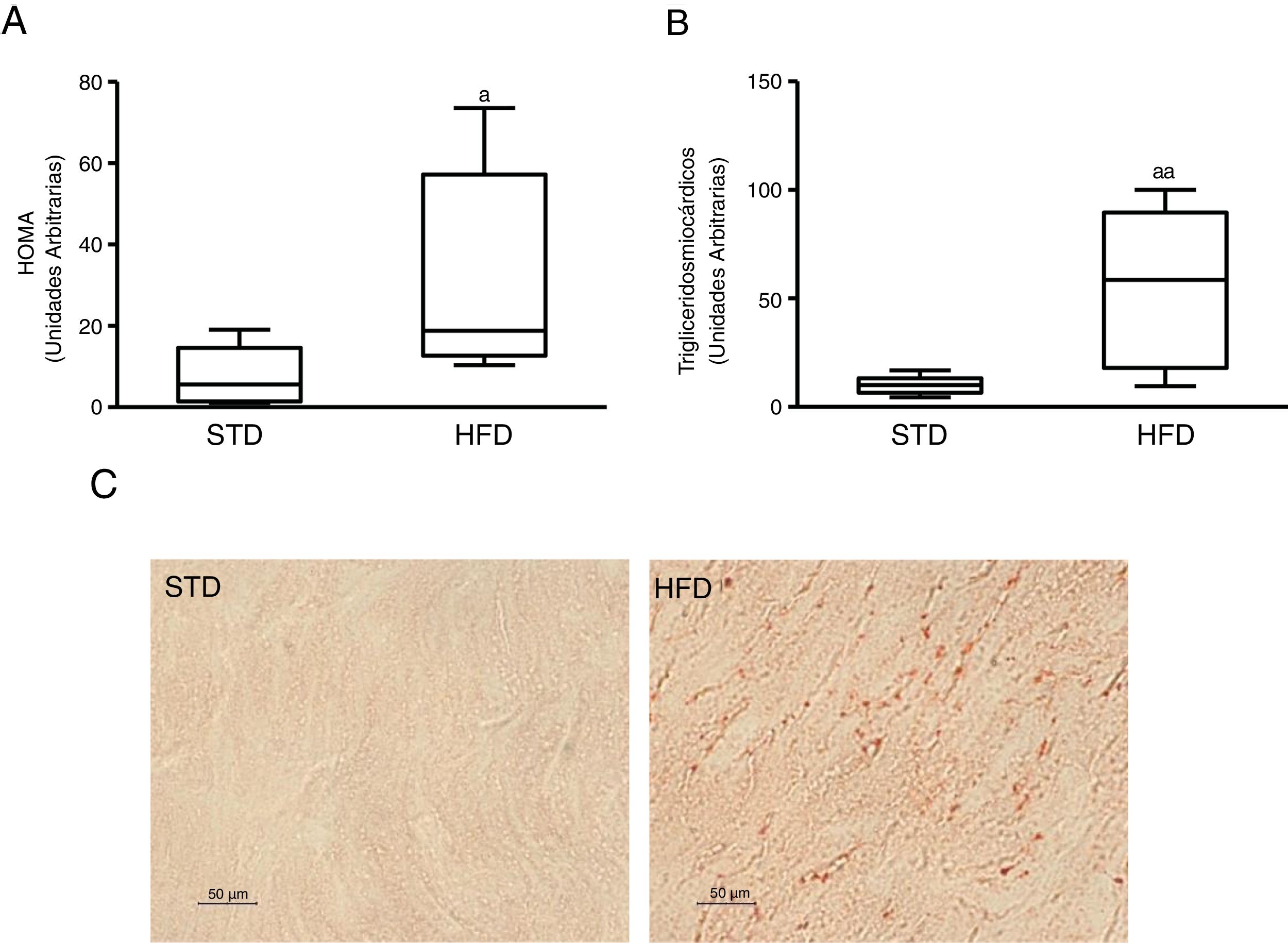
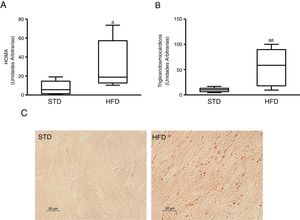
ResultadosLa resistencia a la insulina inducida por dieta grasa incrementa el contenido lipídico miocárdicoPara inducir resistencia a la insulina alimentamos ratones con HFD. Los animales alimentados con esta dieta mostraron niveles plasmáticos aumentados de glucosa (mediana 360,00; rango intercuartílico 243,00-487,00mg/dl) e insulina (mediana 70,50; rango intercuartílico 23,79-158,29 pg/dl) comparados con los animales control alimentados con una STD (glucosa: mediana 185,00; rango intercuartílico 127,00-223,00mg/dl) (insulina: mediana 23,79; rango intercuartílico 7,12-68,52 pg/dl) (p<0,05). Como consecuencia, los animales alimentados con HFD presentaban un índice HOMA de resistencia a la insulina superior a los animales control (fig. 1A). Estos animales mostraron un contenido miocárdico de lípidos superior a los animales control (fig. 1C). Mediante una aproximación metabolómica, se observó que los animales alimentados con HFD presentaban un contenido miocárdico de triglicéridos incrementado ∼6 veces respecto a los animales alimentados con la dieta control (fig. 1B).
Ratones resistentes a la insulina presentan niveles de lípidos miocárdicos aumentados. Los animales fueron alimentados con una dieta estándar (STD) o grasa (HFD) durante 12 semanas. A) Índice HOMA de resistencia a la insulina. B) Niveles de triglicéridos miocárdicos. C) Imágenes representativas de la tinción de lípidos por Oil Red O en corazones de ratones alimentados con STD o HFD.
Los datos se expresan como la mediana y rango intercuartílico.
* p <0,05.
** p <0,01 vs. STD.
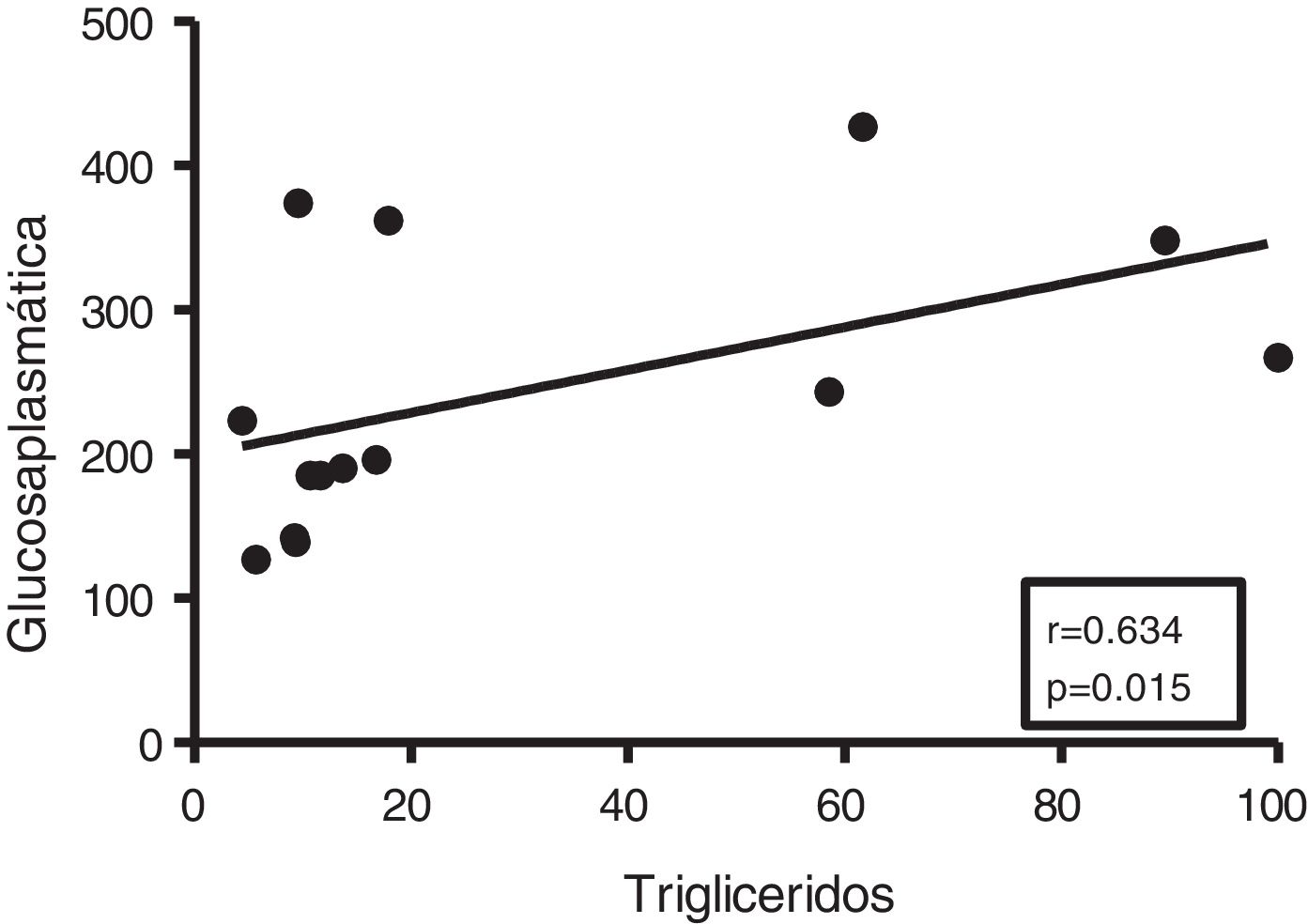
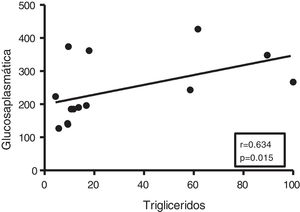
Dada la estrecha relación entre la DM y la acumulación de grasa ectópica en miocardio, en primer lugar analizamos las potenciales asociaciones entre el contenido miocárdico de triglicéridos y el metabolismo de la glucosa. Aunque no se encontraron correlaciones entre los triglicéridos cardíacos y los niveles plasmáticos de insulina, estos se encontraron positivamente asociados con los niveles plasmáticos de glucosa (r=0,634, p=0,015) (fig. 2).
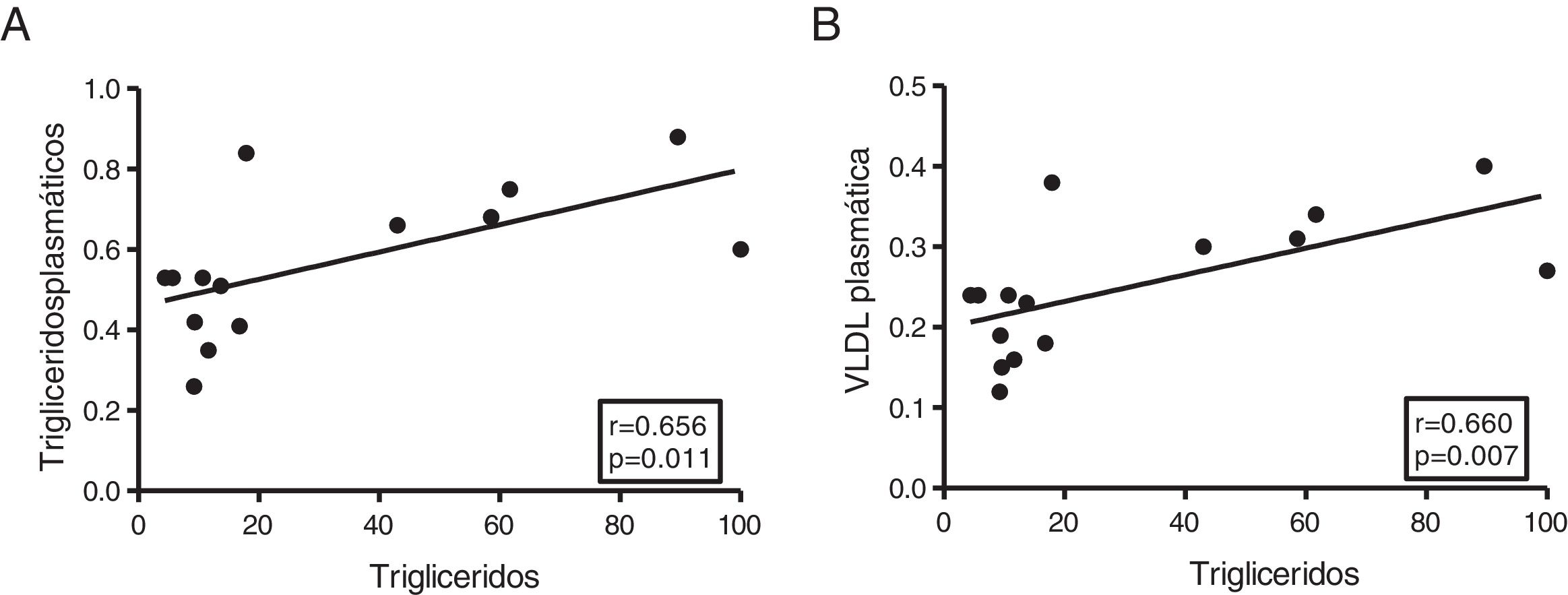
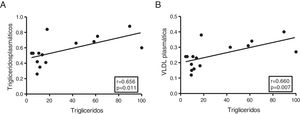
El contenido miocárdico de triglicéridos se asocia con los niveles plasmáticos de triglicéridos y lipoproteínas de muy baja densidadA continuación, determinamos la asociación de los triglicéridos cardíacos con el metabolismo lipídico y del colesterol. Como muestra la figura 3, los triglicéridos cardíacos se asociaron de manera directa con los niveles plasmáticos de triglicéridos (r=0,656, p=0,011) (fig. 3A) y VLDL (r=0,660, p=0,007) (fig. 3B). Sin embargo, no se encontraron asociaciones significativas entre estas moléculas y los niveles plasmáticos de AGL, colesterol total, LDL ni HDL.
El contenido miocárdico de triglicéridos se asocia con los niveles plasmáticos de triglicéridos y VLDL. Resultados del test de la correlación de Spearman mostrando la asociación entre el contenido miocárdico de triglicéridos miocárdico y los niveles plasmáticos de triglicéridos (A) y VLDL (B).
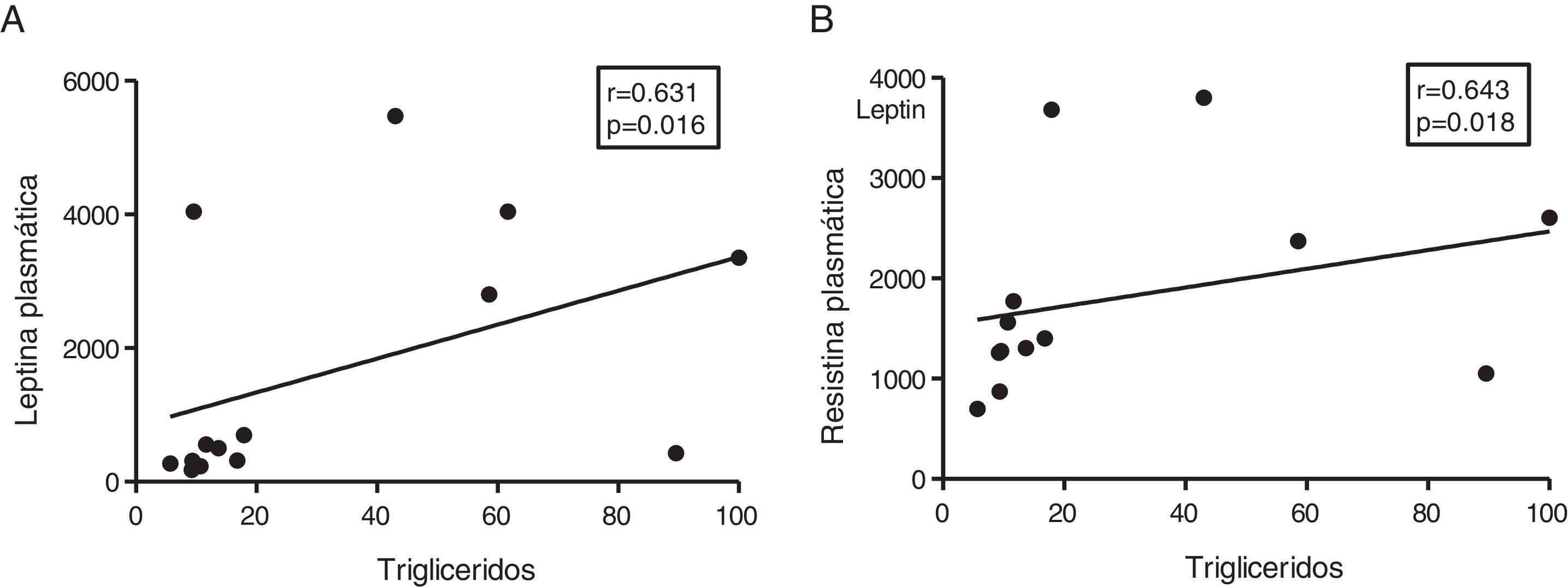
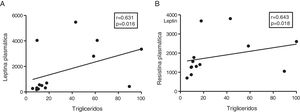
Dada la función de las adipoquinas como potenciales reguladores del metabolismo energético en corazón, seguidamente analizamos las asociaciones entre los triglicéridos cardíacos y estas moléculas. Los triglicéridos cardíacos no se asociaron con los niveles plasmáticos de adiponectina. Sin embargo, se encontró una correlación directa entre estas moléculas y los niveles plasmáticos de leptina (r=0,631, p=0,016) (fig. 4A) y resistina (r=0,643, p=0,018) (fig. 4B).
El contenido miocárdico de triglicéridos se asocia con los niveles plasmáticos de leptina y resistina. Resultados del test de la correlación de Spearman mostrando la asociación entre el contenido miocárdico de triglicéridos miocárdico y los niveles plasmáticos de leptina (A) y resistina (B).
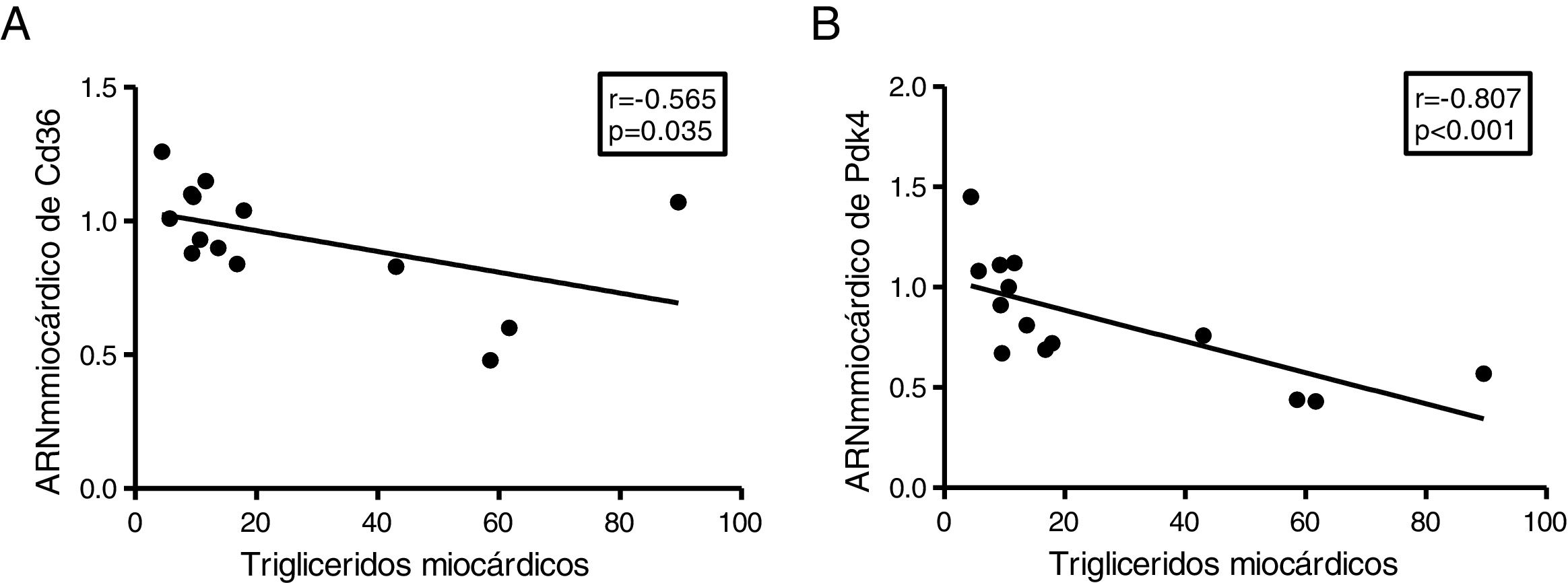
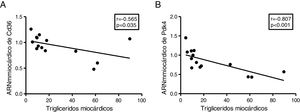
Puesto que la acumulación ectópica de grasa en miocardio se encuentra finamente regulada por la utilización preferente de los sustratos metabolizados para la producción de energía, finalmente analizamos el contenido de triglicéridos cardíacos con la expresión de 2genes claves en la regulación de estos procesos. Los triglicéridos cardíacos se encontraron inversamente relacionados con la expresión cardíaca del transportador de ácidos grasos Cd36 (r=–0,565, p=0,035) (fig. 5A) y con la piruvato deshidrogenasa cinasa 4 (Pdk4) (r=–0,807, p <0,001) (fig. 5B).
El contenido miocárdico de triglicéridos se encuentra inversamente asociados a la expresión de Cd36 y Pdk4. Resultados del test de la correlación de Spearman mostrando la asociación entre el contenido miocárdico de triglicéridos miocárdico y los niveles cardíacos de ARNm de Cd36 (A) y Pdk4 (B).
Numerosas evidencias proponen la acumulación ectópica de grasa en corazón como uno de los principales precursores de la disfunción miocárdica de etiología diabética4-8. Sin embargo, los mecanismos moleculares que subyacen al acúmulo intramiocelular de lípidos en individuos diabéticos no son plenamente conocidos y, hasta el momento, ninguna de las moléculas propuestas como potenciales biomarcadores del contenido de grasa miocárdica ha sido utilizada para el diagnóstico clínico de esta patología. En este trabajo, estudiamos las potenciales asociaciones entre el contenido miocárdico de triglicéridos y distintos componentes plasmáticos en un modelo murino de resistencia a la insulina inducido por HFD.
Tal y como describimos previamente, la HFD indujo resistencia a la insulina en nuestros animales, evidenciada por un aumento en los niveles plasmáticos de glucosa e insulina, así como un índice HOMA incrementado, en comparación con los animales alimentados con una STD22. Los animales resistentes a la insulina presentaban un perfil bioquímico plasmático característico de la DM, caracterizado por niveles plasmáticos elevados de AGL, triglicéridos, resistina y leptina, y niveles reducidos de adiponectina plasmática22. Además, estos animales mostraban niveles plasmáticos aumentados de VLDL, sin mostrar cambios en los niveles de colesterol total, LDL y HDL. Interesantemente, los animales alimentados con HFD presentaban el contenido de triglicéridos cardíacos aumentados, sugiriendo que la acumulación de lípidos observada en estos animales podía predisponer a un mayor riesgo de IC en estados más avanzados de la patología.
Con el objetivo de identificar potenciales biomarcardores plasmáticos relacionados con la acumulación ectópica de grasa en corazón, realizamos estudios de asociación entre el contenido cardíaco de triglicéridos y los principales componentes plasmáticos que se encuentran alterados en la DM. En primer lugar, exploramos la asociación entre estas moléculas y los niveles plasmáticos de insulina y de glucosa. A pesar de no encontrar asociaciones significativas entre los triglicéridos cardíacos y la insulina, estos se encontraron directamente asociados con la glucosa plasmática, subrayando la relación existente entre la DM y la esteatosis del miocardio. Además, los triglicéridos cardíacos se encontraron directamente asociados con los niveles plasmáticos de triglicéridos y VLDL, indicando que estas moléculas podrían vehiculizar el transporte de los triglicéridos hacia el miocardio.
Puesto que el tejido adiposo participa en la regulación de distintos procesos metabólicos, como la resistencia a la insulina en tejidos periféricos, decidimos explorar si este tejido podría participar además en la acumulación ectópica de grasa en corazón, a través de la utilización de distintas adipoquinas como agentes implicados en la comunicación entre ambos tejidos. Nuestros resultados mostraron una correlación positiva entre los niveles plasmáticos de leptina y resistina con el contenido de triglicéridos cardíaco, sugiriendo una participación directa de estas moléculas en la acumulación ectópica de grasa en corazón.
Finalmente, para explorar los mecanismos moleculares implicados en la acumulación de lípidos cardíacos, analizamos las potenciales asociaciones de los triglicéridos cardíacos con la expresión de 2de los principales genes implicados en la regulación del sustrato utilizado para la producción de energía en corazón, el transportador de ácidos grasos Cd36 y Pdk4. Mientras que Cd36 facilita la captación de los ácidos grasos por el cardiomiocito y, por lo tanto, la utilización de los mismos, Pdk4 inhibe la entrada de piruvato a la mitocondria a través de la inhibición de la piruvato deshidrogenasa, bloqueando, por tanto, la obtención de energía procedente de la glucosa. Nuestros resultados muestran que la expresión de ambos genes se encuentra inversamente relacionada con el contenido de triglicéridos cardíacos, sugiriendo que un contenido elevado de estas moléculas podría estar relacionado con una adaptación metabólica a nivel transcripcional dirigida a preparar a la célula para reducir la captación de ácidos grasos y potenciar la utilización de glucosa.
En resumen, nuestros resultados muestran que el contenido de triglicéridos cardíaco se encuentra asociado con un perfil bioquímico alterado y con una reprogramación de la expresión de genes dirigida a atenuar el impacto de la acumulación ectópica de lípidos en miocardio. Sin embargo, se necesitan más estudios para validar nuestros resultados en humanos y explorar si la adaptación transcripcional es suficiente para revertir/atenuar el impacto de la resistencia a la insulina en cuanto a la utilización de sustrato y la acumulación intracelular de lípidos se refiere.
FinanciaciónEste estudio ha sido financiado por una beca FEA/SEA para Investigación Básica en aspectos básicos de la arteriosclerosis y sus factores de riesgo (convocatoria 2015), el Instituto de Salud Carlos III (ISCIII) (PI15/00627), el CIBER de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) (CB07/08/0028 y CB07/08/0014) y el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesNo existe.