Los pacientes con ictus presentan un elevado riesgo de sufrir nuevas recurrencias o aparición de otros episodios cardiovasculares o de mortalidad cardiovascular.
Se estima que un porcentaje elevado de ictus isquémicos no cardioembólicos pueden ser prevenido mediante un adecuada modificación del estilo de vida (dieta y ejercicio), reducción de la presión arterial (PA) con medicación antihipertensiva, antiagregantes plaquetarios, estatinas y reducción del consumo elevado de alcohol. Desgraciadamente el grado de control de los distintos factores de riesgo en la prevención secundaria del ictus es muy bajo. Las guías de practica clínica, muestran recomendaciones claras, con sus correspondientes niveles de evidencia, pero solo si se implementan de un forma general conseguirán una mejor prevención primaria y secundaria del ictus.
Stroke patients are at high risk for recurrence or new occurrence of other cardiovascular events or cardiovascular mortality. It is estimated that a high percentage of non-cardioembolic ischemic stroke can be prevented by a suitable modification of lifestyle (diet and exercise), reducing blood pressure (BP) with antihypertensive medication, platelet aggregation inhibitors, statins and high intake reducing consumption of. Unfortunately the degree of control of the different risk factors in secondary prevention of stroke is low. The clinical practice guidelines show clear recommendations with corresponding levels of evidence, but only if implemented in a general way they will get a better primary and secondary stroke prevention.
El ictus es la tercera causa más frecuente de mortalidad, después del cáncer y de la enfermedad cardiaca, tanto en los países desarrollados como en los países en vías de desarrollo1. En España, el ictus representa la primera causa de mortalidad en las mujeres y la segunda en los hombres, siendo una causa importante de incapacidad, y por otra parte, uno de los factores que contribuye al desarrollo de alteración de la función cognitiva y demencia2.
Los pacientes con ictus presentan un elevado riesgo de sufrir nuevos episodios cardiovasculares, incluyendo la recurrencia del ictus, y de mortalidad cardiovascular. El riesgo medio anual de padecer una recurrencia tras un episodio inicial de ictus isquémico o AIT es aproximadamente del 3-4%, aunque el riesgo individual viene determinado por distintos factores como la edad, comorbilidad y adherencia al tratamiento3. En un amplio estudio observacional4 en el que se estudió el riesgo de ictus recurrente, infarto de miocardio, mortalidad vascular o total después de un ictus, se observó que el riesgo acumulativo de ictus recurrente fue del 5% a los 6 meses, y del 8% al año, el riesgo de mortalidad cardiovascular del 14,8 y 17,1%, y el de mortalidad total del 20,6 y 24,5%, respectivamente. Posteriormente, Mohan et al.5 han publicado los resultados de una revisión sistemática y metaanálisis, con inclusión de 13 estudios y 9.115 pacientes que sobrevivieron al ictus, y han mostrado también un elevado riesgo acumulado de recurrencia del ictus: 11,1% al año, 26,4% a los 5 años y 39,2% a los 5 años. Es especialmente importante implantar medidas de prevención, porque se ha observado que los ictus recurrentes tienen peor pronóstico, con una mayor mortalidad hospitalaria y una menor frecuencia de ausencia de limitación al alta6.
Los factores de riesgo de ictus incluyen los no modificables, como la edad, que dobla el riesgo de ictus por cada década sucesiva a partir de los 55 años, y la historia familiar, y los modificables, que son fundamentalmente la hipertensión arterial (HTA), la diabetes mellitus, el tabaquismo, o el elevado consumo de alcohol. Se estima que un porcentaje elevado de ictus puede ser prevenido mediante un adecuado uso de medidas preventivas: modificación del estilo de vida (dieta y ejercicio), reducción de la presión arterial (PA) con medicación antihipertensiva, antiagregantes plaquetares, estatinas y reducción del consumo elevado consumo de alcohol3,7–9. Desgraciadamente el grado de control de los distintos factores de riesgo en la prevención secundaria del ictus es muy bajo. Estudios llevados a cabo en nuestro país han mostrado un grado de control de los principales factores de riesgo menor del 10% en pacientes que han sufrido un ictus10,11. Los datos del EUROASPIRE III12 no son tampoco muy alentadores, pues en un total de 881 pacientes con una media de edad de 66 años, que habían sufrido un ictus y que fueron entrevistados a los 550 días, un 17,6% continuaban fumando, un 35,5% presentaban un índice de masa corporal ≥30kg/m2 un 62,4% presentaban elevación de la PA y un 75,5% elevación de los niveles de colesterol LDL (cLDL). A pesar de que un 87,2% recibían medicación antihipertensiva y un 84,4% eran tratados con estatinas, el porcentaje de pacientes que alcanzaron la meta terapéutica fue del 34,3 y 34,4% respectivamente.
Tratamiento de la hipertensión arterial en la prevención secundaria del ictus isquémicoLa HTA es el factor más importante susceptible de intervención: su relación con el riesgo de sufrir eventos cardiovasculares ha sido bien establecida en diversos estudios poblacionales así como en estudios de intervención13–15. Los mecanismos etiopatogénicos por los que la HTA provoca patología cerebrovascular son diversos, complejos y no completamente aclarados. Los últimos estudios ponen de manifiesto la importancia no solo del valor de la PA per se, sino de su variabilidad16, la cual podría ser modificada de forma diferente según el fármaco o esquema terapéutico antihipertensivo utlizado17.
Estudios observacionales han demostrado que la relación de la elevación de la PA con el riesgo de morbimortalidad cardiovascular es de tipo continua a partir de niveles de PA por encima de 115/75mmHg. Un estudio llevado a cabo en nuestro país ya observó hace más de 2 décadas que una mejoría notable en el control de la HTA a nivel poblacional18 se tradujo en una reducción en la mortalidad por ictus19. Más recientemente se ha observado una relación entre los niveles de PA y grado de control de la HTA con la mortalidad por ictus, siendo esta inferior en países como EE. UU. y Canadá respecto a España y otros países europeos en los que las tasas de control de la HTA fueron más bajas20. Un estudio llevado a cabo en España21 también mostró una asociación entre el distinto grado de control de la HTA y la prevalencia de hipertrofia ventricular izquierda en las diferentes zonas de España, con la mortalidad por ictus.
Diversos estudios observacionales y ensayos clínicos han mostrado un beneficio del tratamiento antihipertensivo, iniciado tras la fase aguda, en la prevención secundaria del ictus22. Dos revisiones sistemáticas23,24 de los distintos ensayos clínicos mostró que diversos fármacos antihipertensivos produjeron una reducción en la recurrencia del ictus y otros episodios cardiovasculares, y que la magnitud de la reducción en el riesgo de ictus estaba relacionada con la reducción de la PA sistólica (Recomendación clase I, nivel de evidencia A).
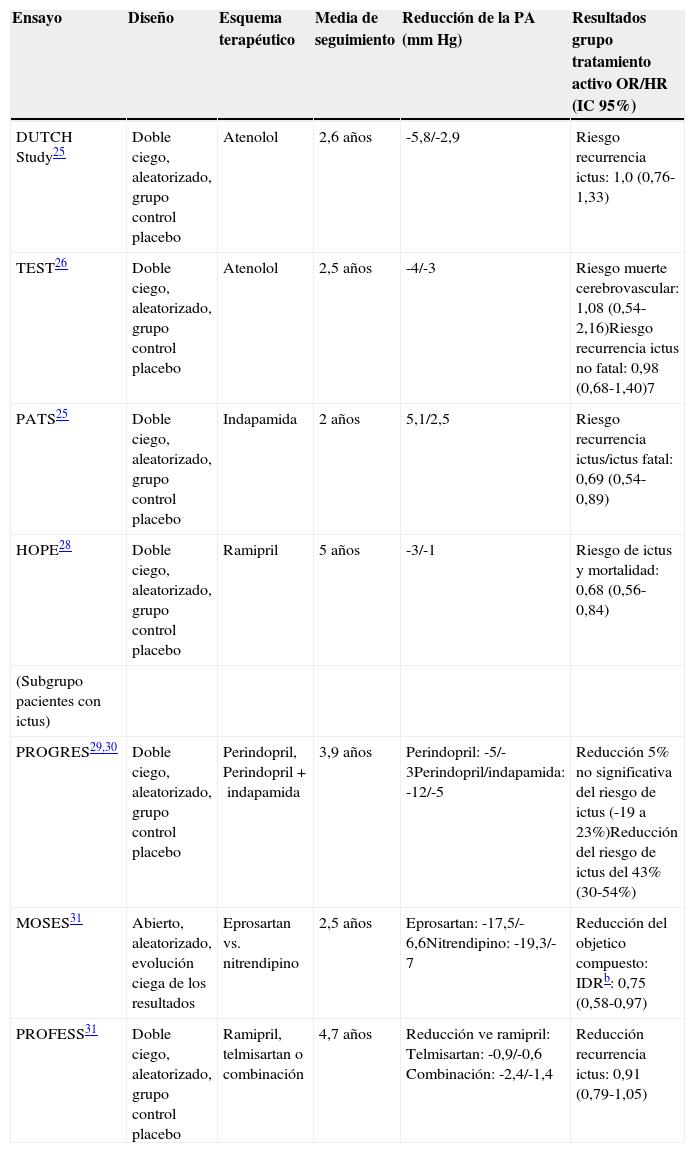
En la tabla 1 se resumen los ensayos clínicos con asignación aleatoria de los pacientes y un seguimiento medio de 2-5 años, con grupo control con placebo, o en los que se han comparado distintos fármacos o esquemas terapéuticos antihipertensivos, y que han sido llevados a cabo en pacientes que han padecido un ictus o AIT25–32. Según los resultados de los estudios DUTCH25 y TEST26 y una revisión sistemática de la Cochrane33, no se recomienda el uso de los betabloqueantes como fármacos de primera línea para la prevención de la recurrencia del ictus. Basados en los resultados del estudio PROGRESS29,30, el uso de una combinación de inhibidor de la ECA y diurético (indapamida) mostró una reducción significativa de la recurrencia del ictus, pero la evidencia global es insuficiente para sustentar la superioridad de algunos antihipertensivos sobre otros en la prevención secundaria del ictus34. Para una mayor información sobre los distintos ensayos clínicos aleatorizados con tratamiento antihipertensivo para la prevención secundaria del ictus remitimos a una excelente revisión reciente sobre el tema35.
Ensayos clínicos con fármacos antihipertensivos en la prevención secundaria del ictus
| Ensayo | Diseño | Esquema terapéutico | Media de seguimiento | Reducción de la PA (mm Hg) | Resultados grupo tratamiento activo OR/HR (IC 95%) |
|---|---|---|---|---|---|
| DUTCH Study25 | Doble ciego, aleatorizado, grupo control placebo | Atenolol | 2,6 años | -5,8/-2,9 | Riesgo recurrencia ictus: 1,0 (0,76-1,33) |
| TEST26 | Doble ciego, aleatorizado, grupo control placebo | Atenolol | 2,5 años | -4/-3 | Riesgo muerte cerebrovascular: 1,08 (0,54-2,16)Riesgo recurrencia ictus no fatal: 0,98 (0,68-1,40)7 |
| PATS25 | Doble ciego, aleatorizado, grupo control placebo | Indapamida | 2 años | 5,1/2,5 | Riesgo recurrencia ictus/ictus fatal: 0,69 (0,54-0,89) |
| HOPE28 | Doble ciego, aleatorizado, grupo control placebo | Ramipril | 5 años | -3/-1 | Riesgo de ictus y mortalidad: 0,68 (0,56-0,84) |
| (Subgrupo pacientes con ictus) | |||||
| PROGRES29,30 | Doble ciego, aleatorizado, grupo control placebo | Perindopril, Perindopril+indapamida | 3,9 años | Perindopril: -5/-3Perindopril/indapamida: -12/-5 | Reducción 5% no significativa del riesgo de ictus (-19 a 23%)Reducción del riesgo de ictus del 43% (30-54%) |
| MOSES31 | Abierto, aleatorizado, evolución ciega de los resultados | Eprosartan vs. nitrendipino | 2,5 años | Eprosartan: -17,5/-6,6Nitrendipino: -19,3/-7 | Reducción del objetico compuesto: IDRb: 0,75 (0,58-0,97) |
| PROFESS31 | Doble ciego, aleatorizado, grupo control placebo | Ramipril, telmisartan o combinación | 4,7 años | Reducción ve ramipril: Telmisartan: -0,9/-0,6 Combinación: -2,4/-1,4 | Reducción recurrencia ictus: 0,91 (0,79-1,05) |
a La reducción del riesgo solo fue significativa en el grupo con tratamiento combinado. Perindopril+indapamida.
Respecto al tratamiento antihipertensivo en la prevención secundaria del ictus isquémico quedarían 2 temas por resolver. El primero es cuándo iniciar o reintroducir el tratamiento antihipertensivo tras el ictus, que debe hacerse en general al cabo de unos días36 tras la fase aguda del ictus. No obstante, se ha de individualizar en cada caso según el tipo ictus y su grado de extensión y evolución clínica, pudiéndose valorar la reintroducción del tratamiento a partir de las primeras 24 horas3 excepto en aquellas situaciones, como el uso de tratamiento fibrinolítico, elevación importante de la PA o complicaciones vitales asociadas en que sea necesario un tratamiento precoz de la elevación tensional37.
El segundo tema por resolver es conocer el grado de reducción de la PA tras la fase aguda del ictus38, pues un descenso de la PA sistólica por debajo de 130mmHg no parece estar indicado en pacientes con enfermedad cardiovascular establecida39. En el estudio SPS340 se compararon 2 objetivos terapéuticos para la PA sistólica: 130-149mm Hg frente a una PA sistólica<130mm Hg en pacientes con infarto lacunar reciente confirmado por resonancia magnética nuclear (RMN). Se observó una reducción no significativa (HR 0,81, IC 95% 0,64-1,03) en la tasa de recurrencia total del ictus, siendo significativa la reducción de ictus hemorrágicos. No obstante, estos datos no pueden ser extrapolados a otros infartos cerebrales más extensos. Un estudio muy reciente ha mostrado que un descenso intenso de la PA sistólica (<120mmHg) se asoció a un peor pronóstico a los 5 años de seguimiento41.
Por lo que respecta a la prevención secundaria del ictus tras haber padecido un infarto lacunar, diversos artículos de opinión han mostrado opiniones contradictorias sobre cuál debería ser la meta de la terapéutica antihipertensiva42,43.
Siguiendo las recomendaciones de las guías más recientes3, el objetivo terapéutico es reducir la PA sistólica a<140mm Hg y la PA diastólica a<90mm Hg (Recomendación clase IIa, nivel de evidencia B). Para los pacientes con infarto lacunar reciente, podría ser razonable reducir la PA sistólica a<130mm Hg (Recomendación clase IIb, nivel de evidencia B). En caso de presencia de oclusión o estenosis carotídea o intracraneal severa, podría estar indicado mantener cifras de PA por encima de estos límites, individualizando en cada caso, dado el riesgo de provocar isquemia transitoria por baja perfusión.
Tratamiento de la dislipemia en la prevención secundaria del ictusUn 25-30% de los ictus corresponden a recurrencias de la enfermedad7 lo cual puede explicarse en parte por la elevada prevalencia de factores de riesgo cardiovascular y el control deficiente de los mismos. En una serie se observó que casi la mitad de los pacientes con ictus isquémico no eran tratados con estatinas, y solo una tercera parte de ellos tenían el cLDL dentro de los objetivos terapéuticos12. El exceso de colesterol y de cLDL se asocia a un mayor riesgo de ictus isquémico44,45, al igual que el exceso de triglicéridos y el déficit de colesterol HDL (c-HDL)46,47. Así mismo, en los análisis agrupados de los datos de los ensayos clínicos con estatinas en pacientes con enfermedad coronaria se ha observado que el tratamiento de la hipercolesterolemia con estos fármacos disminuye el riesgo de ictus y que cuanto mayor es la disminución del colesterol, mayor es la disminución del riesgo48.
Las evidencias sobre el efecto preventivo del tratamiento con estatinas en los pacientes con ictus isquémico son más limitadas, pero también concluyentes. En el Stroke Prevention by Aggressive Reduction in Cholesterol Level (SPARCL)49 se trataron 4.731 personas con ictus o AIT, sin enfermedad coronaria y con un cLDL entre 100-190mg/dL (2,6-4,9mmol/L) con atorvastatina 80mg/día o placebo durante casi 5 años. El riesgo de ictus mortal o no mortal disminuyó un 16% (HR 0,84; IC 95% 0,71-0,99; p=0,03) y el número de pacientes que sería necesario tratar durante 5 años para evitar un episodio de ictus fue de 45. El riesgo de padecer un episodio de enfermedad cardiovascular disminuyó en mayor medida, un 20% (HR 0,80; IC 95% 0,69-0,92; p=0,002), que el riesgo de ictus, lo que podría atribuirse a la alta prevalencia de coronariopatía subclínica que suelen presentar estos pacientes. En este estudio los pacientes que lograron una disminución del cLDL igual o superior al 50%, o un cLDL<70mg/dL (1,8mmol/L) experimentaron un mayor efecto preventivo cardiovascular global y en particular frente al ictus. Por otro lado, el tratamiento con atorvastatina se asoció a un ligero incremento del riesgo de hemorragia intracerebral, siendo el número de pacientes que sería necesario tratar durante 5 años para provocar un ictus hemorrágico de 107. Cabe destacar que el riesgo ligeramente mayor de hemorragia cerebral asociado al tratamiento con atorvastatina en el estudio SPARCL no fue mayor en los pacientes que experimentaron mayores descensos del colesterol. La edad, la HTA, en particular si era de grado 2 del Joint National Committe 7 y los antecedentes de ictus hemorrágico previo sí aumentaban el riesgo de sufrir dicha complicación50. Por ello, no se considera indicado el tratamiento con estatinas en los pacientes que han sufrido una hemorragia intracerebral, salvo que existan otras patologías que justifiquen su uso. Así mismo, en los pacientes con ictus isquémico, es necesario controlar adecuadamente la HTA antes de iniciar un tratamiento hipolipemiante, en particular si esta es severa (tabla 2).
Recomendaciones sobre el tratamiento de la hipertensión arterial (PA). Guía 2014 para la prevención del ictus en pacientes que han padecido un ictus o un ataque isquémico transitorio. American Heart Association/American Stroke Association
| 1. El inicio del tratamiento antihipertensivo está indicado para los sujetos previamente no tratados con ictus isquémico o AIT, que después de los primeros días, tiene una PA sistólica ≥140mmHg o una PA diastólica ≥90mmHg (Recomendación clase I; nivel de evidencia B). El inicio del tratamiento antihipertensivo en los pacientes con PA sistólica<140mmHg y PA diastólica<90mmHg es de beneficio incierto (Recomendación IIb; nivel de evidencia C) |
| 2. La reinstauración del tratamiento antihipertensivo en sujetos con tratamiento previo, que han padecido un ictus isquémico o AIT, está indicada, después de los primeros días, para la prevención de la recurrencia del ictus y de otros eventos cardiovasculares. (Clase I; nivel de evidencia A) |
| 3. El objetivo terapéutico de PA o reducción del nivel basal pretratamiento es incierto, y debe ser individualizado, pero es razonable conseguir una PA sistólica<140mmHg y una PA diastólica<90mmHg (Clase IIa; nivel de Evidencia B). Para los pacientes con un ictus lacunar reciente, podría ser razonable un objetivo de PA<130mmHg (Clase IIB; nivel de evidencia B) |
| 4. Varias modificaciones del estilo de vida se han asociado con una reducción de la PA y es razonable que formen parte del tratamiento antihipertensivo global (Clase IIa; nivel de evidencia C). Estas modificaciones deben ser la reducción de la ingesta de sal, pérdida de peso; consumo de una dieta rica en frutas y vegetales y baja en productos lácteos; actividad física aeróbica de forma regular; y reducción del consumo de alcohol |
| 5. El esquema terapéutico óptimo para conseguir el nivel de PA recomendado es incierto, debido a que las comparaciones directas entre distintos esquemas son limitadas. Los datos disponibles indican que los diuréticos o la combinación de un diurético y un inhibidor del sistema renina-angiotensina es útil (Clase I; nivel de evidencia A) |
| 6. La elección del esquema terapéutico específico y del objetivo terapéutico debe ser individualizado con base en las propiedades farmacológicas, mecanismos de acción, y consideraciones específicas de las características del paciente que determinan que fármacos específicos estén indicados (p. ej. enfermedad cerebrovascular extracraneal obstructiva, enfermedad renal, insuficiencia cardiaca o diabetes mellitus) (Clase IIa, nivel de evidencia B). |
PA: presión arterial.
Fuente: Kernan3.
Las recomendaciones para el tratamiento de las dislipemias en los pacientes con ictus se sintetizan en la tabla 3. Atendiendo a los datos de los estudios mencionados, la American Heart Association y la American Stroke Association (AHA/ASA) aconsejan el tratamiento con estatinas de alta potencia en todos los pacientes sin enfermedad coronaria que hayan sufrido un ictus isquémico o un AIT, en los que existan evidencias de arteriosclerosis y el cLDL sea igual o superior a 100mg/dL (1,8mmol/L) (Recomendación clase I; Nivel de evidencia B51. En ellos se recomienda disminuir el cLDL al menos un 50% o bien conseguir que el cLDL sea igual o inferior a 70mg/dL (1,7mmol/L) (Recomendación clase IIa; Nivel de evidencia B). En las mismas recomendaciones se aconseja que los pacientes que presentan un ictus y tienen antecedentes de enfermedad coronaria el tratamiento de las dislipemias se lleve a cabo siguiendo las recomendaciones del National Cholesterol Education Program III (NCEP-III) para los pacientes con cardiopatía isquémica52. En la tabla 4 se muestra la potencia hipolipemiante de las distintas estatinas53,54. En unas recomendaciones anteriores del Reino Unido55 se fijaban unos objetivos menos ambiciosos de colesterol total y de cLDL para los pacientes con ictus que eran de 155mg/dL (4,0mmol/L) y 77mg/dL (2mmol/L), respectivamente. En nuestro medio, las guías que cuentan con mayor aceptación son las guías europeas de prevención cardiovascular56. En ellas los pacientes con ictus isquémico de origen no cardioembólico se consideran que tienen un riesgo equivalente al de los pacientes con enfermedad coronaria, es decir que son de muy alto riesgo cardiovascular y que por ello son tributarios de ser tratados con estatinas, con independencia de las cifras de colesterol. El objetivo es alcanzar un cLDL<70mg/dL (1,8mmol/L) o bien disminuir el cLDL al menos un 50%. (Recomendación de clase I; Nivel de evidencia A). En las mismas guías se desaconseja el uso de estatinas en los pacientes con ictus hemorrágico, salvo que se haya demostrado arteriosclerosis de algún territorio o exista un alto riesgo cardiovascular.
Recomendaciones para el tratamiento de las dislipemias en pacientes con ictus isquémico según las guías de las sociedades europeas
| - Tratar a todos los pacientes con ictus isquémico con una estatina, con independencia de los valores basales de c-LDL |
| - Disminuir el c-LDL ≤70mg/dL (1,8mmol/L) o al menos un 50% |
| - En los pacientes con hipertrigliceridemia utilizar el c-No HDL en lugar del c-LDL y disminuirlo ≤100mg/dL (2,6mmol/L) |
| - Si una vez alcanzado el objetivo de c-LDL o de c-No HDL persiste un déficit de c-HDL (≤40mg/dL-1,1mmol/L) o un exceso de triglicéridos (>150mg/dL-1,7mmol/L) y no existen causas corregibles de dislipemia secundaria, pueden considerarse 2 opciones: |
| A. Intensificar el tratamiento hipocolesteremiante |
| B. Asociar con un fibrato o ácidos grasos omega-3 |
En los pacientes con hipertensión arterial no controlada priorizar el tratamiento de la hipertensión antes de tratar la hipercolesterolemia.
En los pacientes con ictus hemorrágico no administrar estatinas, salvo que exista cardiopatía isquémica u otros problemas clínicos tributarios de ser tratados con estos fármacos.
Adaptado de Chapmanet al.56.
Efecto de las estatinas sobre el cLDL atendiendo a la dosis
| Estatina | 20-25% | 26-30% | 31-35% | 36-40% | 41-50% | 51-55% | 56-60% |
|---|---|---|---|---|---|---|---|
| Pravastatina | 10mg | 20mg | 40mg | ||||
| Fluvastatina | 20mg | 40mg | 80mg | ||||
| Lovastatina | 10mg | 20mg | 40mg | 80mg | |||
| Simvastatina | 10mg | 20mg | 40mg | ||||
| Atorvastatina | 10mg | 20mg | 40mg | 80mg | |||
| Rosuvastatina | 5mg | 10mg | 20mg | 40mg* | |||
| Pitavastatina | 1mg | 2mg | 4mg |
Aunque el déficit de cHDL y el exceso de triglicéridos son factores de riesgo independientes de ictus y enfermedad cardiovascular, en las guías europeas56 y de la AHA/ASA51 no se indican unos objetivos específicos, por la falta de evidencias de alta calidad sobre la utilidad de tratar estas alteraciones lipídicas. Sin embargo, en las guías europeas de prevención cardiovascular y de forma más específica en las guías de un comité de expertos de la Sociedad Europea de Arteriosclerosis sobre triglicéridos y cHDL57, se establece que en los pacientes de alto riesgo cardiovascular tratados con estatinas y con un cLDL en objetivos, en los que el cHDL es<40mg/dL (1,1mmol/L) o los triglicéridos ≥150mg/dL (1,7mmol/L) puede considerarse añadir un fibrato, como el fenofibrato a dosis de 145mg/día58, o el ácido nicotínico, aunque este último no está comercializado en España. Los ácidos grasos omega-3 a dosis de 2-4g al día son eficaces para la hipertrigliceridemia, logrando descensos cuando esta es severa cercanos al 50%. Una segunda opción en estos pacientes, en lugar de asociar un segundo fármaco, es intensificar el tratamiento, o bien aumentando la dosis de estatina o bien asociando un potenciador de su efecto, en particular la ezetimiba a dosis de 10mg/día, o bien la colestiramina a dosis de 5-10g al día. Ambos tratamientos incrementan el descenso del cLDL logrado con las estatinas entre un 20 y un 25%. Por último, es necesario destacar que en los pacientes con hipertrigliceridemia la ecuación que se utiliza habitualmente para calcular el cLDL pierde precisión e infraestima los valores en un grado proporcional al exceso de triglicéridos, de modo que cuando las concentraciones de estos últimos son>400mg/dL (4,5mmol/L), no puede utilizarse. Por ello, se aconseja que en los pacientes con hipertrigliceridemia en lugar del cLDL se utilice el colesterol No HDL59, un parámetro que predice el riesgo cardiovascular de forma igual o superior al cLDL. El c-No HDL se calcula restando al valor del colesterol total el valor del cHDL. Los objetivos de colesterol No HDL, se obtienen sumando 0,8mmol (30mg/L) a los objetivos indicados para el c-LDL60.
Tratamiento antiagregante en la prevención secundaria del ictusEl tratamiento antiagregante es uno de los pilares para la prevención secundaria del ictus isquémico no cardioembólico. Se recomienda antiagregar a cualquier paciente que haya sufrido un ictus o Trial Study Group (TIA) no cardioembólico (aterotrombótico, lacunar o infarto criptogenético) y que no tenga contraindicación para ello3. Actualmente la Food and Drug Administration (FDA) acepta 4 fármacos que han demostrado ser eficaces para la prevención de nuevos eventos vasculares y que conllevan una reducción relativa del riesgo de ictus, infarto de miocardio o muerte de hasta un 22%61. Estos son: aspirina, dipiridamol en combinación con aspirina, clopidogrel y ticlopidina. En Europa se incluye también la prevención con triflusal.
AspirinaAunque el uso de la aspirina en la prevención primaria de eventos cardiovasculares en pacientes con bajo riesgo sigue siendo controvertida, su beneficio en la prevención de eventos secundarios entre los pacientes con enfermedad cerebrovascular está bien establecido3,62.
En los ensayos clínicos en que se comparó el tratamiento preventivo para el accidente cerebrovascular con aspirina respecto a placebo, la reducción del riesgo relativo para cualquier tipo de accidente cerebrovascular (hemorrágico o isquémico) se estimó en un 15% (IC del 95%, 6-23%63. La magnitud del beneficio es similar para dosis que van de 50mg a 1.500mg63–66. En contraste, la toxicidad varía según la dosis; la toxicidad principal de la aspirina es la hemorragia gastrointestinal, y se ha comprobado un mayor riesgo de sangrado cuanto mayores sean las dosis de aspirina. En el estudio holandés TIA65 con 3.131 pacientes con ictus o AIT, aleatorizados a dosis de 30mg/d o 283mg/d, no hubo diferencias significativas en los resultados de accidente cerebrovascular o infarto agudo de miocardio no fatal o muerte vascular, pero la dosis más baja produjo un 24% menos de complicaciones hemorrágicas y un 41% menos de sangrado menor respecto la dosis más alta65. Para los pacientes a los que se les administra dosis bajas de aspirina (325mg) durante intervalos prolongados, el riesgo anual de hemorragia gastrointestinal grave es aproximadamente 0,4%, que es 2,5 veces el riesgo de la población normal65,67.68. Debe también tenerse en cuenta que el tratamiento con aspirina se asoció con un mayor riesgo de accidente cerebrovascular hemorrágico, pero en un porcentaje muy inferior y que, a su vez, es menor que el riesgo de ictus isquémico, lo que resulta en un beneficio neto69,70.
TiclopidinaLa ticlopidina es un antagonista del receptor del ADP de las plaquetas que ha sido evaluado en 3 ensayos aleatorizados en pacientes con enfermedad cerebrovascular71–73. En un estudio la ticlopidina fue superior al placebo73 y a la aspirina en otro18, pero un tercer ensayo no encontraron beneficio en comparación con la aspirina71.
Por otra parte, la ticlopidina tiene un mal perfil en efectos adversos70, incluyendo erupciones cutáneas y diarrea, así como neutropenia, que puede ser grave en aproximadamente el 1% de los pacientes tratados62. Aunque estos efectos parecen ser reversibles, son una causa de preocupación, especialmente cuando se combina con el riesgo de púrpura trombótica trombocitopénica en un ratio de un caso por cada 1.600-5.000 pacientes70. Debido a los efectos secundarios y la disponibilidad de nuevos agentes, la ticlopidina cada vez es menos utilizada en la práctica clínica actual3.
ClopidogrelSe trata de otro antagonista del receptor del ADP de las plaquetas con eficacia demostrada para la prevención secundaria del ictus3. En monoterapia ha sido probado para la prevención secundaria del ictus en 2 ensayos, uno comparando con aspirina sola (CAPRIE)68 y el segundo comparándola con la combinación aspirina/dipiridamol (PRoFESS)74. El estudio CAPRIE incluyó más de 19.000 pacientes con accidente cerebrovascular, infarto de miocardio o enfermedad vascular periférica a los que se designó aleatoriamente a aspirina 325mg/día o clopidogrel 75mg/d. No se encontró diferencia estadísticamente significativa de beneficio de clopidogrel sobre aspirina. La tasa anual de accidente cerebrovascular isquémico, infarto de miocardio o muerte vascular fue del 5,32% entre los pacientes asignados a clopidogrel en comparación con el 5,83% entre los pacientes asignados a la aspirina (RRR, el 8,7%, IC del 95%, 0,3-16,5%; p=0,043).
El clopidogrel se comparó con la combinación de aspirina y dipiridamol de liberación prolongada en el estudio PRoFESS74 que fue diseñado como un estudio de no inferioridad. Entre los 20.332 pacientes con accidente cerebrovascular isquémico no cardioembólico que fueron seguidos durante una media de 2,5 años, el accidente cerebrovascular recurrente ocurrió en el 9,0% de los participantes asignados a la aspirina/dipiridamol en comparación con el 8,8% asignado a clopidogrel (HR, 1,01; 95% CI, 0,92-1,11).
Aunque el riesgo de hemorragia intracraneal no fue significativamente diferente con los 2 tratamientos, el riesgo de hemorragia gastrointestinal se incrementó notablemente con aspirina más dipiridamol de liberación prolongada en comparación con clopidogrel.
En el estudio (MATCH)75 de 7.599 pacientes con historial de accidente cerebrovascular, AIT u otros factores de riesgo vascular se asignaron al azar 2 grupos de tratamiento con clopidogrel solo o clopidogrel más aspirina. El objetivo fue valorar la rehospitalización por algún evento isquémico, ictus, IAM o muerte vascular. Durante un seguimiento medio de 18 meses, hubo solo un pequeño beneficio no significativo para el clopidogrel más aspirina. Sin embargo, la combinación de clopidogrel - aspirina se asoció a una tasa significativamente más alta de episodios de sangrado que el clopidogrel solo (2,6 vs. 1,3%, respectivamente).
En general, la seguridad de clopidogrel es comparable a la de la aspirina, con escasas diferencias14, asumiendo tasas parecidas en el riesgo hemorrágico. Al igual que con la ticlopidina se pueden detectar casos de diarrea o rash cutáneo, pero la incidencia de neutropenia es similar a aspirina o placebo. Por otra parte se han referenciado algunos casos de púrpura trombótica trombocitopénica.
Dipiridamol/aspirinaEl efecto de dipiridamol combinado con aspirina en pacientes con AIT o ictus ha sido examinado en 4 grandes estudios. Valorados conjuntamente3, estos ensayos indican que la combinación es al menos tan eficaz como la aspirina sola para la prevención secundaria del ictus, pero menos tolerado por los pacientes, por efectos gastrointestinales y cefalea. Entre los pacientes asignados a clopidogrel y los asignados a la combinación dipiridamol y aspirina76–78.
TriflusalEl triflusal es un antiagregante plaquetario que fue valorado en Europa (1996-1999) en el estudio Triflusal versus Aspirin in Cerebral Infarction Prevention (TACIP)79, con una muestra de más de doce mil pacientes aleatorizados entre triflusal 600mg/d o aspirina 325mg/d. No se pudo demostrar superioridad respecto aspirina aunque sí que la incidencia de hemorragia fue inferior en el grupo tratado con el triflusal.
Nuevos fármacos3Se están investigando nuevos agentes antiplaquetarios en la prevención secundaria del ictus. El cilostazol es un fármaco aprobado para el tratamiento de la claudicación intermitente pero se están llevando a cabo estudios en prevención secundaria de la enfermedad cerebrovascular. La eficacia de cilostazol en comparación con la aspirina se ha valorado en varios estudios consiguiendo de momento resultados de no inferioridad. Otro nuevo fármaco antiplaquetario en fase de estudio es el terutroban, que se comparó con aspirina en un gran ensayo que incluyó a más de 19.000 pacientes con accidente cerebrovascular isquémico y TIA. Terutroban no demostró «no inferioridad» en comparación con la aspirina por lo que el estudio tuvo que detenerse. Otro reciente estudio con sarpogrelate tampoco pudo demostrar «no inferioridad» contra aspirina. Hasta el momento, ninguno de estos nuevos agentes han sido aprobados por la FDA para la prevención de accidente cerebrovascular recurrente.
De todas formas es alentador que cada vez haya más estudios preclínicos y clínicos con nuevos compuestos antiagregantes. Ejemplos de algunos de ellos son RHA-Infestin-4, nanocuerpos o aptámeros que inhiben GPIb del factor von Willebrand (VWF) o anticuerpos humanizados anti-VWF que inhiben la adhesión de plaquetas mediada por el VWF80.
A partir de ahora se necesitan grandes ensayos para validar estos nuevos enfoques en el accidente cerebrovascular para confirmar su seguridad y su eficacia.
Recomendaciones en el uso de antiagregantesRecientemente se han publicado las nuevas guías3 de la AHA/ASA sobre prevención secundaria del ictus en las que se incluyen las recomendaciones para el uso de antiagregantes.
- 1.
Se recomienda el uso de antiagregantes en pacientes afectos de un accidente cerebrovascular isquémico no cardioembólico o AIT en lugar de la anticoagulación oral para reducir el riesgo de recurrencia de ictus u otros eventos cardiovasculares. (Recomendación clase I; Nivel de evidencia A).
- 2.
El tratamiento de elección para la prevención de nuevos accidentes cerebrovasculares con posterioridad a un AIT o ictus isquémico es aspirina (50-325mg/d) en monoterapia (Recomendación clase I; Nivel de evidencia A) o la combinación de aspirina 25mg y dipiridamol de liberación prolongada de 200mg 2 veces al día (Recomendación clase I; Nivel de evidencia B).
- 3.
El tratamiento con clopidogrel (75mg) en monoterapia es una opción razonable para la prevención secundaria del ictus en lugar de aspirina o combinación de aspirina/dipiridamol (Recomendación clase IIa; Nivel de evidencia B). Esta recomendación también se aplica a los pacientes que son alérgicos a la aspirina.
- 4.
La selección de un agente antiagregante plaquetario debe ser individualizada con base en el perfil de los factores de riesgo del paciente, el coste, la tolerancia, la eficacia relativa conocida de los agentes y otras características clínicas (Recomendación clase I; Nivel de evidencia C).
- 5.
La combinación de aspirina y clopidogrel puede utilizarse como tratamiento inicial dentro de las primeras 24 horas de un accidente cerebrovascular isquémico menor o AIT y mantenerlo durante 90 días (Recomendación clase IIb; Nivel de evidencia B).
- 6.
El tratamiento combinado de aspirina y clopidogrel, iniciado ya sea días o años después de un accidente cerebrovascular menor o AIT y continuado durante 2 o 3 años, incrementa el riesgo de hemorragia en comparación con cualquiera de los tratamientos por sí solos. La combinación no se recomienda de forma rutinaria para la prevención secundaria a largo plazo después del accidente cerebrovascular isquémico o TIA (Recomendación clase III; Nivel de evidencia A). Los resultados del estudio CHANCE81 llevado a cabo en 5.170 pacientes de 114 centros en China, han mostrado que el tratamiento combinado con clopidogrel y AAS en pacientes con AIT o ictus minor, podría ser superior a la AAS sola en la reducción del riesgo de ictus durante los primeros 90 días, sin incremento del riesgo de hemorragia.
- 7.
En pacientes con historia de ictus isquémico o TIA, fibrilación auricular y enfermedad coronaria, la utilidad de añadir tratamiento antiagregante al tratamiento antivitamina K previo es incierta para reducir el riesgo de enfermedad cardiovascular isquémica y eventos cerebrovasculares (Recomendación clase IIb; Nivel de evidencia C). Los casos de angina inestable y stent de la arteria coronaria representan circunstancias especiales en los que se justifica la terapia antiagregante/antivitamina K.
La evidencia respecto a las intervenciones sobre los estilos de vida proviene principalmente de estudios desarrollados en prevención primaria, siendo escasos los estudios previstos específicamente para prevención secundaria.
Diabetes: la diabetes es un factor de riesgo independiente muy importante para el ictus. Además de una mayor susceptibilidad a padecer aterosclerosis, en los hombres con diabetes, el riesgo de ictus82 aumenta entre 2,5-4,1 veces y, en mujeres, entre 3,6-5,8 veces; en cambio, asociado a con otros factores de riesgo, este es 2 veces superior. Dada la alta prevalencia de diabetes en la población, se recomienda realizar un cribado3 en el contexto de un ictus isquémico o TIA, con medida de glucosa sanguínea y de hemoglobina glicosilada (HbA1) o test de tolerancia oral a la glucosa. En general la mejor medida de control debería ser la HbA1c.
Obesidad: la obesidad también se asocia con un mayor riesgo de accidente cerebrovascular. Estudios epidemiológicos83,84 sugieren que el riesgo aumenta en forma casi lineal a partir de un IMC de 20kg/m2 de manera que un aumento de 1kg/m2 en el IMC se asocia con un aumento del 5% en el riesgo de accidente cerebrovascular. La asociación entre adiposidad y el riesgo de accidente cerebrovascular es más evidente para la obesidad central que la general y la asociación también es más evidente para los adultos de mediana edad que para los adultos mayores. A pesar de esta relación, sin embargo, la obesidad no se ha establecido como un factor de riesgo para el accidente cerebrovascular recurrente.
Alcohol: la asociación de ictus con el consumo de alcohol actualmente es una cuestión controvertida3. Se han realizado algunos estudios observacionales que analizaron específicamente el riesgo de ictus para diferentes niveles de consumo de alcohol y para el tipo de bebida. En general, las revisiones muestran una relación en forma de «J» para el riesgo de morbimortalidad coronaria y el consumo de alcohol, es decir, consumos pequeños (hasta una unidad/d para las mujeres y hasta 2 unidades/día para los hombres) podrían tener un efecto protector frente a un efecto perjudicial con consumos mayores3,85.
Tabaco: es ampliamente conocido que el abandono del hábito tabáquico reduce el riesgo vascular86. Esta disminución es proporcional a la duración del cese del hábito. No hay estudios sobre la eficacia de diferentes medidas de deshabituación tabáquica en pacientes que han sufrido previamente un ictus. No obstante se ha observado que de 2-4 años después de abandonar el hábito tabáquico el riesgo de ictus se reduce un 27%, y los pacientes que continúan fumando tras un ictus presentan una mayor mortalidad (RR: 2,27) comparado con no fumadores o ex fumadores87.
La enfermedad aterosclerótica de gran vaso es la responsable del 33% de los ictus isquémicos. Se asocia a la presencia de factores de riesgo vascular como hipertensión, consumo de tabaco, dislipemia, edad o diabetes entre los más prevalentes. Su forma de expresión más frecuente es la afectación carotídea extracraneal en forma estenosis u oclusión en la bifurcación carotídea, siendo la afectación carotídea intracraneal o de otros vasos intracraneales menos frecuente.
La importancia de su hallazgo en el diagnóstico de la etiología del ictus radica en el alto porcentaje de recurrencia en este subgrupo etiológico y el importante beneficio que supone su tratamiento precoz en forma de cirugía carotídea o intervencionismo extraintracraneal en los pacientes candidatos.
Estenosis carotídea extracranealLa bifurcación carotídea y más concretamente el origen de las carótidas internas es el lugar donde se localiza la mayor parte de estenosis carotídeas de etiología aterosclerótica. Es donde tiene lugar la aparición de las placas carotídeas aterosclerótica, ya que es donde más sufre las fuerzas de shear stress (fuerzas de fricción) consecuencia de la disposición anatómica de la bifurcación carótida interna y externa. Una de las formas de presentación clínica es consecuencia de un crecimiento de la placa, que suele ser lentamente progresivo hasta presentar una estenosis crítica causando un problema hemodinámico por baja perfusión cerebral. Aunque el mecanismo más frecuente es la rotura de la capa fibrosa en la superficie de la placa y exposición del material lipídico de su core graso lo que desencadena la formación de un trombo in situ con riesgo de oclusión del vaso o embolismo arteria-arteria de fragmentos del coagulo o placa.
Su diagnóstico se realiza de forma sencilla con el uso de ecografía de troncos supraaórticos (ECOTSA). Esta exploración permite valorar con el modo B ecográfico, la longitud de la placa, densidad (calcificación, hiperecoica o hipoecoica), irregularidad (lisa, ulcerada), así como su asociación a engrosamientos de la capa íntima media en la región media y distal de la carótida común. El valor de índice íntima-media se ha asociado a control metabólico de factores de riesgo vascular, equivalente a daño de órgano diana, o como un valor de control para una intervención o tratamiento de los factores de riesgo vascular.
La determinación mediante modo color-doppler permite registrar la velocidad del flujo e inferir el grado y porcentaje de estenosis en relación con una placa visualizada en el modo B. Sin embargo, puede presentar ciertas limitaciones cuando hay placas severamente calcificadas, cuellos hostiles o bifurcaciones carotídeas altas que hace difícil su visualización. A su vez en caso de oclusión carotídea contralateral los parámetros de velocidad pueden verse alterados dificultando el cálculo exacto de la estenosis. Por ello la ecodoppler de troncos supraaórticos es una excelente prueba de despistaje para el diagnóstico de estenosis carotídea aunque debe confirmarse, sobre todo en caso de ser positiva o tener mala ventana ultrasonográfica, con una angio-TAC o angio-RM de troncos supraaórticos. Solo la arteriografía debería utilizarse ante dudas diagnósticas de las anteriores dado su riesgo de complicaciones aunque sea relativamente baja.
Aunque como recomendación no deber realizarse ECOTSA como prueba de cribado en prevención primaria, sí puede ser útil como seguimiento de cambios en índice íntima-media en pacientes con factores de riesgo vascular. (Recomendación clase III, nivel de evidencia C).
La presencia de estenosis de carótida interna igual o superior al 70% de su luz se considera severa, y cuando se asocia a clínica neurológica ya sea transitoria o persistente (AIT o infarto cerebral) se califica como de sintomática y por consiguiente posible candidata a intervención siempre que hayan pasado menos de 6 meses desde la presentación clínica.
Grandes estudios randomizados, como el americano NASCET y el europeo ECST, demostraron como la intervención mediante endarterectomía de estenosis severa de carótida sintomática reducía de forma considerable el riesgo de recurrencia de un nuevo ictus o AIT, con una reducción del riesgo absoluto del 16% en 5 años respecto los no intervenidos (9 vs. 26%). Destaca el bajo número de pacientes necesarios a tratar (NNT), tan solo 6, para evitar un ictus. Esta debería realizarse en centros que presenten una morbimortalidad igual o inferior al 6%88,89 (Recomendación clase I, nivel de evidencia A).
En realidad ambos estudios valoraron la efectividad de intervenciones incluso en estenosis inferiores al 50%. Sin embargo, además de las estenosis severas solo la endarterectomía de estenosis entre el 50-69% presentarían cierta rentabilidad terapéutica si se realizaba en centros donde esta intervención quirúrgica tuviera una morbimortalidad inferior al 3% y en pacientes muy seleccionados90. Estas intervenciones deben realizarse en las primeras 2 semanas tras el ictus o el AIT si la clínica residual es leve o fue transitoria. Pero no antes del primer mes si el infarto es extenso o hay clínica importante dado el riesgo de síndromes de reperfusión o transformaciones hemorrágicas. (Recomendación clase IIa, nivel de evidencia B).
Diferentes estudios han evaluado la efectividad de la angioplastia y stenting carotídeo en pacientes con estenosis carotídea sintomática91,92. El estudio más importante fue el CAVATAS que demostró como la angioplastia presentaban los mismos resultados en prevención de ictus o mortalidad que la endarterectomía (6,4 vs. 5,9% respectivamente)93–95. Así mismo, si bien la cirugía presentaba un 8,7% de neuropatía craneal por afectación de pares craneales y hematoma cerebral en el 6,7%, la angioplastia/stenting solo presentó complicaciones en forma de hematomas inguinales en el 1,2%. Sin embargo, el índice de reestenosis carotídea es 3 veces superior tras la angioplastia que con la endarterectomía (30,7% 10,5% vs. a los 5 años) aunque con un leve incremento en la tasa de ictus ipsilateral a la restenosis95,96(Recomendación clase IIa, nivel de evidencia B).
Por este motivo en centros donde la endarterectomía carotídea presenta una baja comorbilidad el uso de angioplastia o stenting queda relegada a situaciones de alto riesgo quirúrgico con base en los estudios SHAPPIRE97 o CREST97,98:
- -
Alto riesgo anestésico (p. ej.: paciente cardiopatía insuficiencia respiratoria severa).
- -
Dificultad anatómica para la cirugía en bifurcaciones de localización alta en el cuello.
- -
Oclusiones carotídeas contralateral y baja compensación del flujo ipsilateral.
- -
Estenosis carotídea postrádica (dificultad para disecar planos musculares y cicatrización poscirugía).
- -
Lesión del laríngeo recurrente contralateral y riesgo de paresia cuerda vocal bilateral.
- -
Reestenosis de cirugía carotídea previa.
En el caso de la edad mayor de 70 años la endarterectomía presenta menor tasa de eventos vasculares e infartos perioperatorios que la angioplastia (Recomendación clase IIa, Nivel de evidencia B).
En los casos en que se practica una angioplastia+/-stent la utilización de sistemas de protección distal periprocedimiento son útiles para minimizar el riesgo de embolismos durante la manipulación y tratamiento de la estenosis carotídea99.
A pesar de estas recomendaciones, en los centros que disponen de mayor experiencia en intervencionismo la angioplastia y stenting podría ser una opción si disponen de bajas tasas de complicaciones (morbimortalidad <6%) y no es posible la cirugía carotídea (Recomendación clase IIa, nivel de evidencia B). Por otra parte, pacientes con alto riesgo anestésico pueden ser intervenidos con endarterectomía mediante anestesia local de acuerdo a estudio recientes (GALA trial) dado la menor tasa de complicaciones isquémicas periprocedimiento tanto neurológicas como cardiacas99. Aún en presencia de carótida contraleteral ocluida el uso de shunts quirúrgicos transitorios durante el momento del clampaje en la intervención permite realizar la endarterectomía con seguridad. Una alternativa en casos de dificultad anatómica cervical para la cirugía y a su vez dificultad de utilizar angioplastia con sistemas de protección cerebral es la realización de angioplastia+/-stent a través de punción de carótida común con flujo inverso que protege de embolismo distales durante la colocación del stent100,101.
No es infrecuente en centros donde disponen de unidades de riesgo vascular o servicios de neurología con estudio avanzado de patología vascular realizar exploraciones complementarias ECOTSA en pacientes sin clínica ictal previa y encontrar estenosis carotídeas asintomáticas. En estos casos, los estudio ACAS y ACST demostraron la efectividad de la endarterectomía ante estenosis carotídea asintomática (estenosis superior al 70%) en pacientes con bajo riesgo quirúrgico, edad menor de 75 años y buena situación funcional previa102. Sin embargo, los resultados no son tan notables como cuando se realizaba sobre carótida sintomática (reducción del riesgo absoluto de eventos isquémicos del 5,9% durante 5 años; 5,1 vs. 11% del tratamiento médico) con un NNT de 21, con subgrupos como el de las mujeres que presentaban un menor beneficio de esta cirugía (Recomendación clase I, nivel de evidencia A).
La angioplastia de estenosis de vertebrales en su porción proximal de los ostiums solo se plantea como opción terapéutica ante clínica de repetición claramente vertebrobasilar y fracaso del tratamiento médico cuando la otra arteria vertebral es hipoplásica sin contactar con la basilar o está ocluida (Recomendación clase IIb, nivel de evidencia C).
Debería individualizarse la indicación de otro tipo de tratamientos quirúrgicos vasculares como el bypass carotídeo-subclavio ante la oclusión de carótida común, reimplantación de carótidas o angioplastia de subclavia en situaciones de robo de subclavia103. En la mayoría de las ocasiones se opta por estos tratamientos ante el fracaso de las mejores opciones de tratamiento médico actual. Al igual que en el resto de pacientes con enfermedad vascular aterosclerótica debería utilizarse la combinación de diferentes tratamientos para estabilización y control de la patología aterosclerótica (uso de estatinas a altas dosis, antiagregación y mejor control de factores de riesgo vascular entre ellos la hipertensión con el uso de fármacos bloqueadores del eje renina-angiotensina aldosterona que mantienen una correcta perfusión cerebral) (Recomendación clase I, nivel de evidencia A).
En otro tipo de patología no aterosclerótica como la disección carotídea, enfermedad de Takayasu u otras patología inflamatorias solo estaría indicado el intervencionismo vascular mediante angioplastia o stent si presenta clínica ictal importante en la fase aguda del mismo y con hipoperfusión cerebral marcada dependiente de ese vaso (demostrada mediante secuencias perfusión en TAC o RM).
Estenosis intracranealesLa patología aterosclerótica intracraneal presenta la misma fisiopatología que la extracraneal, aunque es más frecuentes en razas asiáticas y en nuestro entorno en pacientes diabéticos. En estos casos de estenosis severas intracraneales las técnicas quirúrgicas son excepcionales siendo en todo caso posible el tratamiento endovascular o neurointervencionismo.
Existen escasas publicaciones y estudios del tratamiento de las estenosis intracraneales mediante intervencionismo con stent o angioplastia que no sea en la fase hiperaguda del ictus. El SAMPPRIS104 es el único estudio randomizado y multicéntrico sobre el tratamiento en prevención secundaria de las estenosis intracraneales donde se valoraba la eficacia del mejor tratamiento médico frente a su uso asociado a la utilización del stent wingspan en estenosis intracraneales, en pacientes que ya habían presentado un evento isquémico cerebral104. Sus resultados demostraron que el grupo de utilización de stent tenía una mayor tasa de recurrencia de eventos vasculares ictales en los 3 años siguientes al procedimiento (23 vs. 15%). A su vez la realización del procedimiento iba acompañado de una importante tasas de complicaciones. El beneficio del mejor tratamiento médico se conseguía ya desde el primer mes tras a la randomización y por lo tanto la angioplastia+stent wingspan no está recomendado de entrada en los casos de estenosis intracraneal 70-99% (Clase III, nivel de evidencia B).
En estos casos la utilización de aspirina o clopidogrel son de elección sobre cualquier anticoagulante como tratamiento inicial (Clase I, nivel de evidencia B). Solo la combinación de ambos tipos de antiagregantes podría utilizarse en estenosis severas intracraneales (70-99%) durante los primeros 30 días tras un evento isquémico (Clase IIb, nivel de evidencia B). Sin embargo, un subgrupo que presentaba cierto beneficio en la aplicación del stent fueron los pacientes que habían presentado importante número de eventos previos a la colocación del stent y con estenosis muy severa. Por este motivo serán subsidiarios de ser tratados con métodos intervencionistas los pacientes con fracaso del mejor tratamiento médico (best medical treatment) y progresión clínica o repetición debido a una estenosis aterosclerótica severa (70-99%) de arteria intracraneal accesible al neurointervencionismo. En estos casos se podría valorar la angioplastia aislada como alternativa a la utilización de stent que no fuera del tipo wingspan (Recomendación clase IIb, nivel de evidencia C).
Tratamientos como el bypass carotídeo-intracraneal mediante ramas de la temporal a arteria cerebral media ha demostrado resultados favorables cuando se aplican a situaciones de baja perfusión cerebral como los síndromes de Moya-Moya, que asocian oclusiones o estenosis severa de las terminaciones carotídeas intracraneales105,106.
La utilización de bypass en patología aterosclerótica intracraneal o extracraneal es anecdótica (18) (Clase IIb, nivel de evidencia B). Sin embargo, podrían valorarse ante oclusión del eje carotídeo y clínica de baja perfusión cerebral en situaciones de fracaso de los tratamientos médicos a pesar de intentar mantener una correcta perfusión cerebral mediante suspensión de antihipertensivos, gran aporte líquido y uso de tratamientos antitrombóticos incluso combinaciones de los mismos (Recomendación clase IIb, nivel de evidencia B).
ConclusionesLos pacientes con ictus presentan un elevado riesgo de sufrir nuevas recurrencias o aparición de otros eventos cardiovasculares o de mortalidad cardiovascular. Es especialmente importante implantar medidas de prevención, porque se ha observado que los ictus recurrentes tienen peor pronóstico, con una mayor mortalidad hospitalaria y una menor frecuencia de ausencia de limitación al alta. Desafortunadamente el grado de control de los distintos factores de riesgo en la prevención secundaria del ictus es muy bajo. Las guías de práctica clínica, muestran recomendaciones claras, con sus correspondientes niveles de evidencia, pero solo si se implementan de una forma general conseguirán una mejor prevención primaria y secundaria del ictus.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.