Estudiar los efectos de la rosuvastatina sobre la resistencia a la insulina en un modelo de sobrepeso inducido por dieta, así como los mediadores implicados.
MétodosSe utilizaron ratas macho Wistar alimentadas con dieta estándar (CT) o con una dieta con alto contenido en grasa (33,5% del contenido calórico) (SBP). La mitad de los animales SBP fueron tratados con rosuvastatina (15mg/kg/día) (SBP+Rosu) durante 7semanas.
ResultadosLas ratas alimentadas con la dieta grasa presentaron un aumento del peso corporal, del tejido adiposo blanco epididimal y del lumbar. El tratamiento con Rosu no modificó ni el peso corporal ni el peso de los paquetes adiposos en ratas SBP. Los niveles plasmáticos de glucosa, insulina y el índice HOMA aumentaron en las ratas SBP respecto a los animales CT, y el tratamiento con Rosu los redujo. El cociente leptina/adiponectina en plasma y en el tejido adiposo lumbar fue mayor en las ratas SBP; Rosu redujo dicho cociente. La expresión proteica de SIRT1, PPAR-γ y GLUT-4 en tejido adiposo lumbar fue menor en ratas SBP y Rosu normalizó la expresión de estos 3 mediadores.
ConclusionesRosuvastatina mejora la sensibilidad a la insulina en ratas con sobrepeso inducido por dieta con alto contenido en grasa. Este efecto está mediado por varios mecanismos como la reducción de los niveles de leptina y el aumento en la expresión de SIRT1, PPAR-γ y GLUT-4 en tejido adiposo blanco. SIRT1 podría considerarse un importante mediador de los efectos beneficiosos de la rosuvastatina sobre la sensibilidad a la insulina en ratas con sobrepeso inducido por dieta.
To study the effects of rosuvastatin on insulin resistance in overweight rats induced by high fat diet, as well as potential mediators.
MethodsWe used male Wistar rats fed with a standard diet (CT) or high fat diet (33.5% fat) (HFD); half of the animals HFD were treated with rosuvastatin (15mg/kg/day) (HFD+Rosu) for 7 weeks.
ResultsHFD rats showed increased body, epididymal and lumbar adipose tissue weights. Treatment with Rosu did not modify body weight or the weight of the adipose packages in HFD rat. Plasma glucose and insulin levels and HOMA index were higher in HFD rats, and rosuvastatin treatment reduced them. Leptin/adiponectin ratio in plasma and lumbar adipose tissue were higher in HDF rats, and were reduced by rosuvastatin. SIRT-1, PPAR-γ and GLUT-4 protein expression in lumbar adipose tissue were lower in HFD rats and Rosu normalized expression of the three mediators.
ConclusionsRosuvastatin ameliorates insulin sensitivity induced by HFD in rats. This effect is mediated by several mechanisms including reduction of leptin and enhancement of SIRT-1, PPAR-γ and GLUT-4 expression in white adipose tissue. SIRT1 could be considered a major mediator of the beneficial effects of rosuvastatin on insulin sensitivity in overweight rats induced by diet.
La alimentación inadecuada parece ser una de las causas principales del incremento de la prevalencia de sobrepeso y obesidad en la actualidad, especialmente por el aumento en el consumo de dietas hipercalóricas con alto contenido en grasa. Diversos estudios en roedores muestran que el consumo crónico de dietas con alto contenido en grasa induce sobrepeso, junto con alteraciones metabólicas tales como resistencia a la insulina y dislipidemia1. La resistencia a la insulina es una alteración con origen multifactorial. Una de las principales características de la resistencia a la insulina es la disminución en la fosforilación de los sustratos de los receptores de insulina (IRS), inhibición de la vía fosfatidilinositol 3-cinasa-AKT/proteína cinasa B (PKB) y disminución de la captación de glucosa debido a alteraciones en la expresión del transportador de glucosa 4 (GLUT-4) en los tejidos diana de la insulina2. El receptor activado por el proliferador de peroxisomas gamma (PPAR-γ) se expresa principalmente en el tejido adiposo, en el hígado y en el músculo esquelético. Este factor desempeña un papel principal en la regulación de la expresión de genes que controlan el metabolismo lipídico y glucídico. En este sentido, cuando la expresión y/o activación de PPAR-γ está reducida disminuye la expresión de GLUT-4 contribuyendo a la resistencia a la insulina2,3.
La sirtuina 1 (SIRT1) es una deacetilasa dependiente de nicotinamida adenín nucleótido (NAD+) y ha sido relacionada con el control de una gran cantidad de procesos metabólicos en diferentes tejidos tales como el hígado, el tejido adiposo y el músculo esquelético4. SIRT1 interacciona con diversos factores de transcripción implicados en la resistencia a la insulina, la inflamación y la dislipidemia (PPARs, coactivador 1 alfa del receptor activado por proliferación de peroxisomas gamma; PGC1α, proteínas de unión al elemento de respuesta a esteroles; SREBP, NFκB, receptor X hepático; LXR y otros) y su actividad puede estar afectada por la dieta. Estudios previos han demostrado que animales alimentados con dieta rica en grasa presentan una expresión y actividad de SIRT1 reducida, mientras que la restricción calórica estimula la actividad de dicho factor5.
El tejido adiposo es un importante órgano metabólico y endocrino que secreta numerosos factores denominados colectivamente adipoquinas. Entre ellas hay que destacar: leptina, adiponectina, resistina, visfatina, TNF-α e IL-66,7. El exceso de tejido adiposo, especialmente el visceral, tanto en humanos como en animales, se asocia a concentraciones circulantes elevadas de muchas de estas adipoquinas. El aumento sistémico de adipoquinas se asocia a alteraciones del metabolismo glucídico como la resistencia a la insulina. Esto parece ser debido a acciones de ciertas adipoquinas tales como la leptina, que en una situación de hiperleptinemia, la leptina deja de inhibir la producción de insulina por el páncreas, conduciendo a una fase de hiperinsulinemia y finalmente a la aparición de resistencia a la insulina. Por el contrario, la adiponectina, que se encuentra reducida en situaciones de obesidad y sobrepeso, parece proteger frente a la aparición de la resistencia a la insulina y tiene acciones opuestas a la leptina. Además, el aumento en la relación leptina/adiponectina tiene un importante papel en las alteraciones metabólicas asociadas a la obesidad8.
Numerosos estudios han demostrado que las estatinas previenen los eventos cardiovasculares, debido principalmente a que reducen los niveles de colesterol total y colesterol LDL9. Además del efecto hipolipemiante, las estatinas ejercen una serie de acciones directas o mediadas por la reducción de la producción de los isoprenoides, denominadas pleiotrópicas. Los efectos pleiotrópicos de las estatinas incluyen, entre otros: la mejora de la disfunción endotelial, la reducción del proceso oxidativo e inflamatorio y acciones antitrombóticas10,11. Todas estas acciones parecen contribuir a sus efectos beneficiosos sobre la enfermedad cardiovascular. Algunos estudios, tanto clínicos como en modelos animales, han descrito una gran variedad de efectos, beneficiosos, neutros y adversos, de diversas estatinas sobre el control de la glucemia12–14. Por ello, parece necesario identificar de forma más concreta los efectos de las estatinas sobre la sensibilidad a la insulina y la homeostasis de la glucosa.
En este sentido, el objetivo del presente trabajo fue estudiar los efectos del tratamiento con rosuvastatina sobre los factores que intervienen en el metabolismo de la glucosa en el tejido adiposo de ratas con sobrepeso inducido por dieta. Para ello valoramos la expresión de leptina, adiponectina, SIRT1, PPAR-γ y GLUT-4 en tejido adiposo lumbar de ratas alimentadas con dieta alta en grasa.
Materiales y métodosAnimales y diseño experimentalSe utilizaron ratas macho Wistar de 250-300g de peso (n=30), alimentadas con dieta estándar (control: CT) o con una dieta con alto contenido en grasa (33,5% del aporte calórico total; Harlan Teklad #TD.03307, MN, EE. UU.) durante 7 semanas. La mitad de los animales alimentados con dieta grasa (sobrepeso: SBP) fueron tratados con rosuvastatina (15mg/kg/día) (SBP+Rosu) durante 7 semanas. La dosis de rosuvastatina se eligió a partir de estudios piloto en ratas alimentadas con dieta grasa, en los cuales fue capaz de reducir los niveles plasmáticos de colesterol total. El uso de los animales se hizo de acuerdo a las recomendaciones del comité de manipulación animal de la Universidad Complutense de Madrid, según las guías de la Unión Europea.
El peso corporal se midió una vez a la semana. El día del sacrificio se determinaron los siguientes parámetros: peso corporal, peso de los paquetes de tejido adiposo blanco (epididimal y lumbar), tejido adiposo marrón (interescapular). Los tejidos fueron inmediatamente congelados y guardados a –80°C para su posterior análisis.
Parámetros metabólicosLa concentración plasmática de glucosa e insulina, colesterol total, triglicéridos, leptina y adiponectina fue determinada mediante inmunoanálisis enzimático cuantitativo con anticuerpos específicos de rata utilizando técnicas colorimétricas de espectrofotometría (R&D System, MN, EE. UU.). La sensibilidad periférica a la insulina fue evaluada al final del experimento, según el modelo homeostático o índice HOMA.
Expresión de la proteína por Western blotLas muestras de tejido adiposo lumbar fueron homogeneizadas en un tampón de lisis. Se extrajeron las proteínas y se cuantificaron por el método de Bradford. A continuación se realizó una electroforesis en geles de poliacrilamida en condiciones desnaturalizantes (SDS-PAGE) y las proteínas se transfirieron a membranas de polivinildifluoruro (PVDF). Se realizó el bloqueo o saturación de todos los sitios inespecíficos de unión de proteínas en la membrana y posteriormente se incubaron con el anticuerpo primario correspondiente. Tras esta incubación se realizaron lavados sucesivos y las membranas se incubaron con el anticuerpo secundario conjugado con peroxidasa. Finalmente las proteínas específicas se detectaron por quimioluminiscencia (ECL kit, Millipore-Bedford, MA, EE. UU.). La detección de quimioluminiscencia y su posterior cuantificación se realizó utilizando el sistema informático GeneGnome5 (Syngene Bio Imagin; Synoptics Ltd. CB, Reino Unido). Las proteínas constitutivas β-actina y α-tubulina se utilizaron como control de carga.
Análisis estadísticoTodos los resultados se expresaron como la media±el error estándar de la media. Las comparaciones de variables individuales se realizaron mediante un análisis de la varianza de una vía (ANOVA), seguido de una prueba de comparación múltiple de medias (test de Newman-Keuls). Un valor de p de 0,05 o menor se consideró significativo. Todos los análisis y los gráficos se realizaron utilizando el programa GraphPad Prism 5 (GraphPad Software Inc. CA, EE. UU.).
ResultadosCaracterísticas generalesLas ratas alimentadas con una dieta con alto contenido en grasa presentaron un incremento de peso corporal mayor que las ratas alimentadas con una dieta control a lo largo del período de evolución de 7 semanas, alcanzando por tanto un mayor peso corporal (SBP: 420±12g vs CT: 318±10g, p<0,01), lo que supuso una diferencia de peso del 31%. El tratamiento con rosuvastatina no tuvo efectos sobre el aumento del peso corporal en las ratas con sobrepeso (SBP+Rosu: 422±8,3g).
Las ratas con SBP presentaron un aumento del peso relativo de los paquetes de tejido adiposo epididimal y lumbar, que no se redujeron por el tratamiento con rosuvastatina (tabla 1). Ni la dieta ni el tratamiento produjeron cambios significativos en el peso relativo del tejido adiposo marrón (tabla 1).
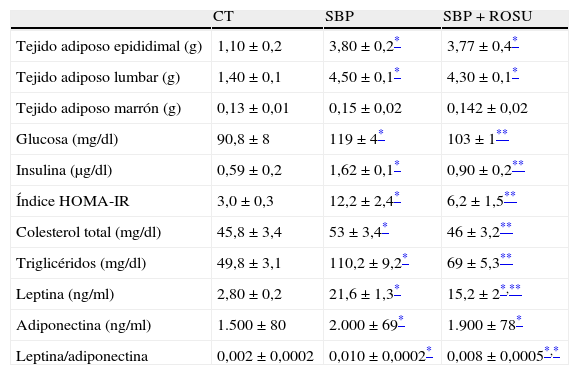
Peso de los paquetes de tejido adiposo y parámetros metabólicos en plasma
| CT | SBP | SBP+ROSU | |
| Tejido adiposo epididimal (g) | 1,10±0,2 | 3,80±0,2* | 3,77±0,4* |
| Tejido adiposo lumbar (g) | 1,40±0,1 | 4,50±0,1* | 4,30±0,1* |
| Tejido adiposo marrón (g) | 0,13±0,01 | 0,15±0,02 | 0,142±0,02 |
| Glucosa (mg/dl) | 90,8±8 | 119±4* | 103±1** |
| Insulina (μg/dl) | 0,59±0,2 | 1,62±0,1* | 0,90±0,2** |
| Índice HOMA-IR | 3,0±0,3 | 12,2±2,4* | 6,2±1,5** |
| Colesterol total (mg/dl) | 45,8±3,4 | 53±3,4* | 46±3,2** |
| Triglicéridos (mg/dl) | 49,8±3,1 | 110,2±9,2* | 69±5,3** |
| Leptina (ng/ml) | 2,80±0,2 | 21,6±1,3* | 15,2±2*,** |
| Adiponectina (ng/ml) | 1.500±80 | 2.000±69* | 1.900±78* |
| Leptina/adiponectina | 0,002±0,0002 | 0,010±0,0002* | 0,008±0,0005*,* |
El peso de los paquetes de tejido adiposo blanco (epididimal y lumbar) y tejido adiposo marrón (interescapular) se expresa en g/cm de tibia. Concentración plasmática de glucosa, insulina, colesterol total, triglicéridos, leptina y adiponectina. Índice de resistencia a la insulina (HOMA-IR) y relación leptina/adiponectina en ratas alimentadas con dieta estándar (CT), dieta con alto contenido en grasa (SBP) y ratas alimentadas con dieta con alto contenido en grasa tratadas con rosuvastatina (SBP+ROSU; 15mg/kg/día) durante 7 semanas. Los datos están expresados como la media±el error estándar de la media.
Las ratas con sobrepeso presentaron niveles plasmáticos de glucosa e insulina mayores (p<0,05) que las ratas control. El tratamiento con rosuvastatina redujo significativamente la concentración plasmática de glucosa y de insulina en las ratas alimentadas con la dieta grasa (tabla 1). El índice HOMA fue mayor (p<0,05) en los animales con sobrepeso comparado con los animales control y el tratamiento con rosuvastatina redujo (p<0,05) el índice HOMA, y en consecuencia el grado de resistencia a la insulina (tabla 1). Los niveles plasmáticos de colesterol total y triglicéridos fueron mayores (p<0,05) en las ratas con sobrepeso, y el tratamiento con rosuvastatina redujo ambos significativamente (tabla 1).
Concentración plasmática de adipoquinasLa dieta con un alto contenido en grasa aumentó (p<0,01) los niveles plasmáticos de leptina. Los niveles plasmáticos de adiponectina fueron comparables en los 2 grupos de animales, CT y SBP. La relación leptina/adiponectina fue mayor (p<0,001) en las ratas con sobrepeso y el tratamiento con rosuvastatina lo redujo significativamente (p<0,01) (tabla 1). Este cambio fue debido principalmente a una reducción de los niveles de leptina y no al aumento de los niveles de adiponectina.
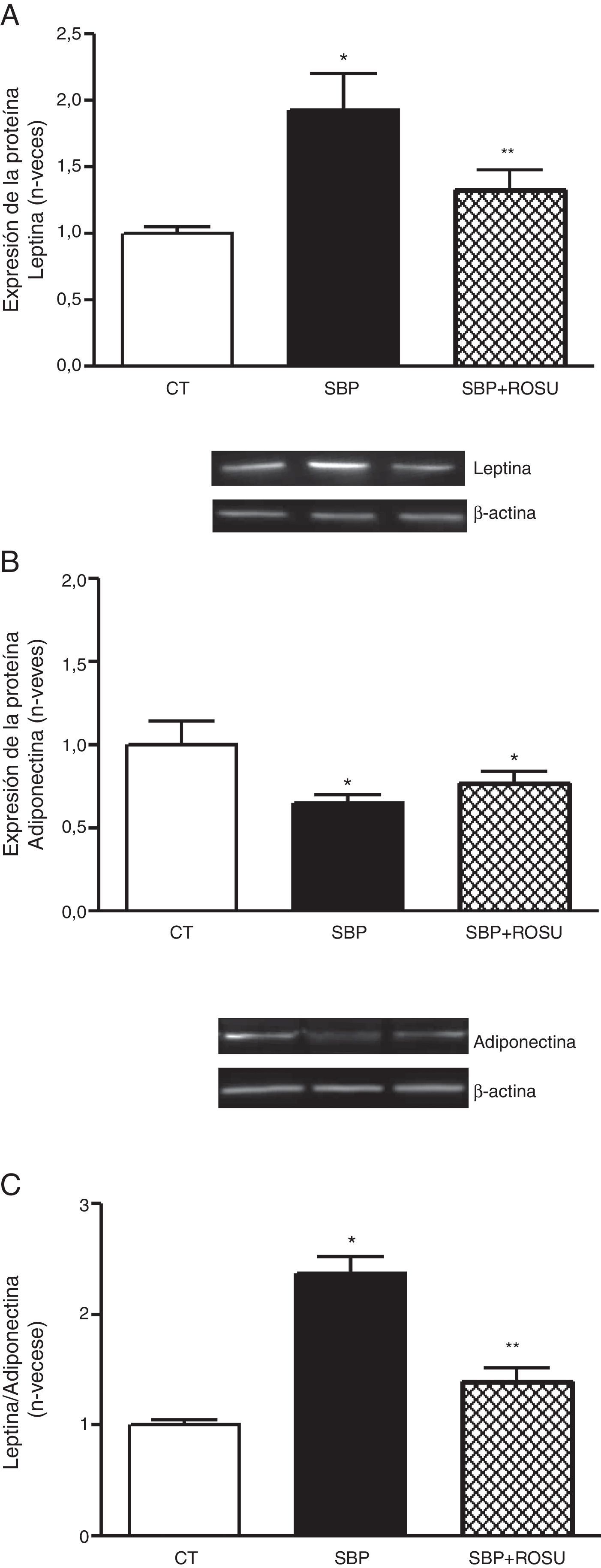
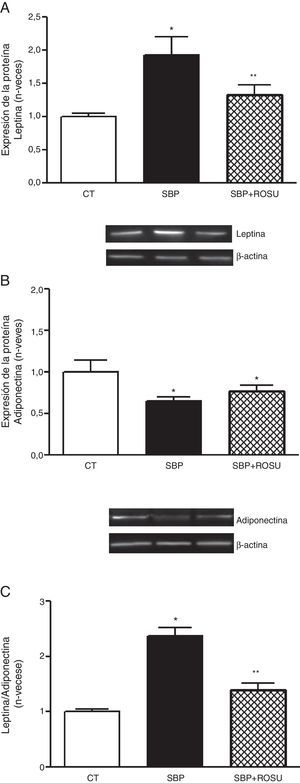
Expresión de adipoquinasEl análisis cuantitativo de los niveles de proteína en tejido adiposo lumbar mostró que la expresión de leptina fue mayor (p<0,05) (fig. 1 A) y la de adiponectina (fig. 1 B) menor (p<0,05) en las ratas con sobrepeso que en las ratas control.
Expresión de la proteína. A. Leptina. B. Adiponectina. C. Relación leptina/adiponectina en tejido adiposo lumbar de ratas alimentadas con dieta estándar (CT), dieta con alto contenido en grasa (SBP) y ratas alimentadas con dieta con alto contenido en grasa tratadas con rosuvastatina (SBP+ROSU; 15mg/kg/día) durante 7 semanas. Los datos están expresados como la media±el error estándar de la media
*p<0,05 vs. CT; **p<0,05 vs. SBP.
La relación leptina/adiponectina fue mayor (p<0,05) en las ratas con SBP que en el grupo control (fig. 1C). El tratamiento con rosuvastatina disminuyó (p<0,05) los niveles de leptina y la relación leptina/adiponectina en las ratas con SBP, sin modificar de manera significativa los niveles de adiponectina (fig. 1).
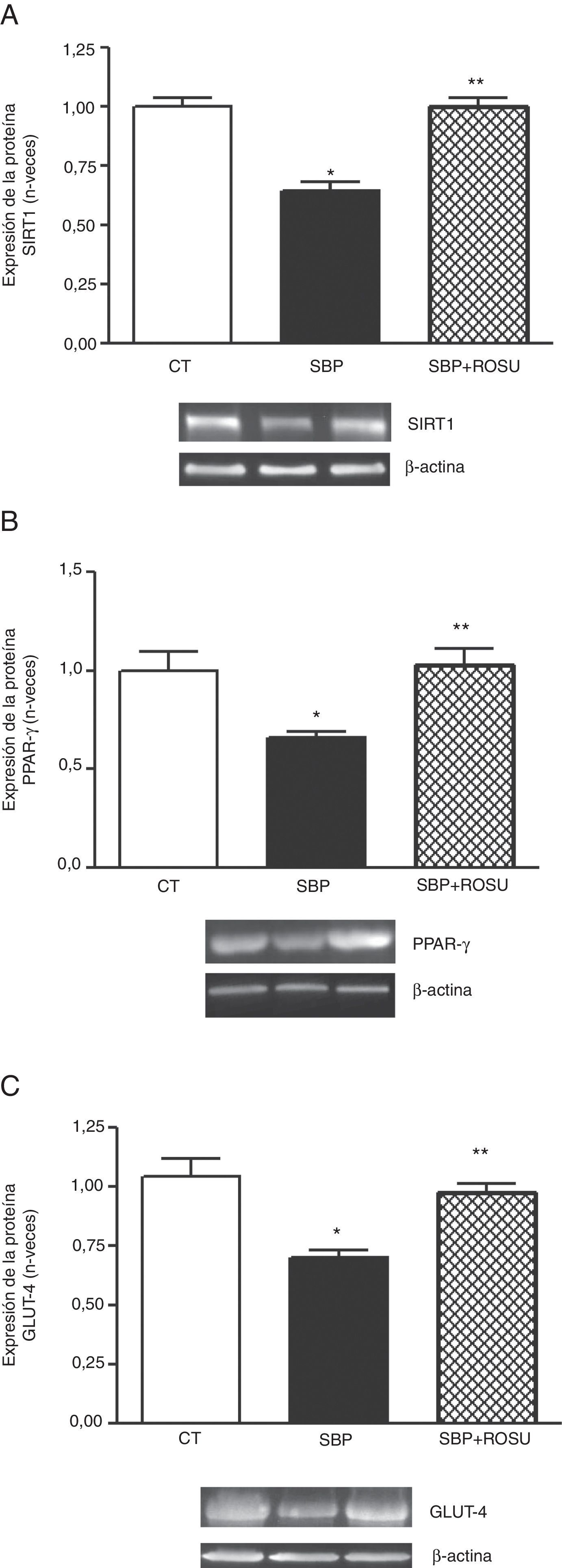
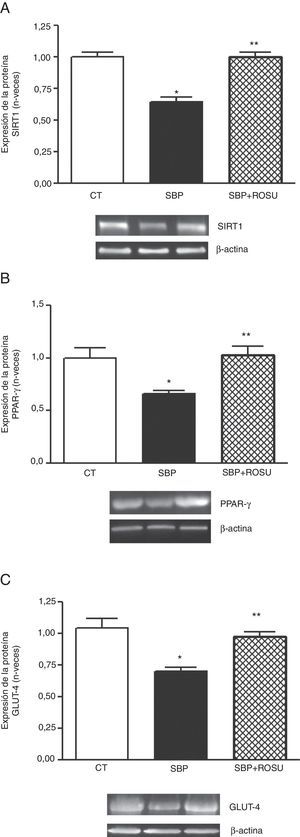
Expresión de sirtuina 1, el receptor activado por el proliferador de peroxisomas gamma y el trasnportador de glucosa 4En las ratas alimentadas con una dieta con alto contenido en grasa la expresión proteica de SIRT1, PPAR-γ >y GLUT-4 (figs. 2A-C respectivamente) en tejido adiposo lumbar disminuyó (p<0,05) respecto a las ratas control. El tratamiento con rosuvastatina normalizó (p<0,05) estos parámetros (fig. 2).
Expresión de la proteína. A. Sirtuina 1 (SIRT1). B. Receptor activado por el proliferador de peroxisomas gamma (PPAR-γ). C. Transportador de glucosa 4 (GLUT-4) en tejido adiposo lumbar de ratas alimentadas con dieta estándar (CT), dieta con alto contenido en grasa (SBP) y ratas alimentadas con dieta con alto contenido en grasa tratadas con rosuvastatina (SBP+ROSU; 15mg/kg/día) durante 7 semanas. Los datos están expresados como la media±el error estándar de la media.
*p<0,05 vs. CT; **p<0,05 vs. SBP.
El presente estudio muestra que el tratamiento con rosuvastatina aumentó la expresión de PPAR-γ y de GLUT-4, y disminuyó la expresión de leptina en tejido adiposo blanco de ratas con sobrepeso inducido con dieta con alto contenido en grasa. Además, este estudio demuestra por primera vez que el tratamiento con rosuvastatina normalizó la expresión de SIRT1 en tejido adiposo blanco de ratas con sobrepeso, lo cual podría explicar la normalización de la expresión de PPAR-γ y GLUT-4. Todos estos cambios se acompañaron de una reducción en el índice de resistencia a la insulina y de los niveles plasmáticos de colesterol y triglicéridos, sin modificaciones en el peso corporal ni en el peso del tejido adiposo blanco.
Los efectos de las estatinas sobre el metabolismo de la glucosa y la resistencia a la insulina sigue siendo un tema controvertido12–15. Diversos estudios en roedores muestran resultados contradictorios. Un estudio con ratas obesas de la cepa Zucker demuestra que el tratamiento con atorvastatina mejora la sensibilidad a la insulina16. Por el contrario, otros autores demuestran que atorvastatina reduce la sensibilidad a la insulina en ratas diabéticas inducida por estreptozotocina17. Nuestro estudio muestra que el tratamiento con rosuvastatina reduce el índice HOMA en ratas con sobrepeso, confirmando una mejora en la sensibilidad a la insulina. Por lo tanto, las diferencias entre los estudios podrían ser atribuidas a los diferentes modelos y condiciones experimentales estudiados, tales como la presencia o ausencia de obesidad, sobrepeso, diabetes o aumento de tejido adiposo, entre otros.
Los niveles circulantes de triglicéridos se relacionan con la captación de glucosa de una manera inversa18,19. En este sentido se ha demostrado que la reducción de la concentración plasmática de triglicéridos en plasma conduce a la mejora de la resistencia a la insulina en diferentes condiciones18,20. La existencia de tejido adiposo disfuncional se relaciona con alteraciones en el metabolismo de lípidos, tales como la hipertrigliceridemia, debido al aumento de la producción hepática de lipoproteínas de muy baja densidad y la disminución de la hidrólisis de los triglicéridos. Aunque las estatinas no tienen un efecto muy potente en la reducción de los triglicéridos plasmáticos, siguen siendo la base del tratamiento para la reducción del riesgo cardiovascular en pacientes de alto riesgo. Nuestros resultados muestran que el tratamiento con rosuvastatina redujo los niveles plasmáticos de triglicéridos en ratas con sobrepeso, sugiriendo un posible mecanismo adicional en la mejora de la resistencia a la insulina.
Diversas adipoquinas derivadas del tejido adiposo, leptina y adiponectina especialmente, participan en la regulación del metabolismo de la glucosa. La reducción de leptina y/o aumento de adiponectina están asociadas a una mejora de la sensibilidad a la insulina21,22. En un estudio previo demostramos que el tratamiento con un antagonista de los receptores AT1 de angiotensina ii mejoraba el desequilibrio leptina/adiponectina en ratas con sobrepeso inducido por dieta23. Diversos estudios con estatinas han mostrado una gran variedad de efectos sobre los niveles de leptina y adiponectina, que parecen estar relacionados con las diferentes condiciones experimentales, las características metabólicas, la presencia de obesidad, diabetes y dislipidemia, entre otros13,24. En el presente estudio el tratamiento con rosuvastatina redujo la concentración plasmática de leptina elevada y la expresión de la proteína en tejido adiposo lumbar de ratas con sobrepeso, sin afectar a los niveles plasmáticos de adiponectina y su expresión en el tejido adiposo lumbar. Los resultados sugieren, por tanto, la importancia de la reducción de los niveles de leptina para mejorar la sensibilidad a la insulina en ratas con sobrepeso. Nuestros resultados apoyan un estudio realizado en niños obesos con niveles elevados de leptina, donde la reducción de leptina mejoraba la concentración de lípidos en plasma y la sensibilidad a la insulina25.
La expresión reducida de GLUT-4 en los principales órganos diana de la insulina (hígado, músculo esquelético y tejido adiposo blanco) es uno de los principales mecanismos responsables de la resistencia a la insulina2. Es bien conocido que la expresión de GLUT-4 está modulada por la activación de PPAR-γ. En este sentido, se ha demostrado que la activación de PPAR-γ con glitazona aumenta la expresión de GLUT-4 y mejora la resistencia a la insulina3,26. Nuestros resultados muestran que la expresión de PPAR-γ y GLUT-4 en tejido adiposo lumbar fue menor en ratas con sobrepeso. Algunos estudios previos que han analizado los efectos de las estatinas sobre la expresión de PPAR-γ y GLUT-4 muestran resultados controvertidos24,25. En nuestro trabajo el tratamiento con rosuvastatina aumentó la expresión de ambos, lo que podría contribuir a la mejora observada de la sensibilidad a la insulina en nuestro modelo experimental27.
El ayuno induce la expresión de SIRT1 en los órganos diana de la insulina5. SIRT1 interactúa con una gran variedad de proteínas relacionadas con la homeostasis energética, tales como SREBP- 1, proteína desacoplante-2 (UCP2), PGC1-α, PPAR-γ y otros, en diferentes tejidos. En un modelo experimental de restricción calórica28 SIRT1 reprimió la expresión de PPAR-γ por acoplamiento con sus cofactores, el receptor nuclear co-represor (NCoR) y el mediador de silenciamiento de retinoides y los receptores de la hormona tiroidea (SMRT). En ratones SIRT1+/-la restricción calórica afectó la movilización de los ácidos grasos en el tejido adiposo blanco, y en adipocitos 3T3-L1 la represión de PPAR-γ por SIRT1 fue también evidente. Por el contrario, nuestros resultados muestran que la expresión de SIRT1 en tejido adiposo blanco disminuye en ratas con sobrepeso, siendo acompañado por una menor expresión de GLUT-4 y PPAR-γ. Las discrepancias de los resultados parecen ser debidas a las diferentes condiciones experimentales, el tipo de animales, los estudios en adipocitos y otros. Por lo tanto, podría proponerse que en las ratas con una alta ingesta calórica (principalmente de grasa saturada) la reducción en la expresión de SIRT1 en tejido adiposo blanco podría ser un mecanismo clave relacionado con algunas de las proteínas de señalización que intervienen en el proceso de la resistencia a la insulina. De hecho, este estudio demuestra por primera vez que el tratamiento con rosuvastatina normalizó la expresión de SIRT1, lo que podría también contribuir a la normalización de la expresión tanto de PPAR-γ y GLUT-4, como a la mejora de la sensibilidad a la insulina en el tejido adiposo.
Dado que todos los efectos de la rosuvastatina mencionados en el tejido adiposo se produjeron en ausencia de pérdida de peso corporal total o de tejido adiposo blanco, podríamos considerar que la rosuvastatina ejerce una cierta acción molecular sobre el tejido adiposo disfuncional con relevancia en la resistencia a la insulina.
En resumen, el tratamiento con rosuvastatina redujo la resistencia a la insulina sin afectar al peso corporal o a la pérdida de tejido adiposo blanco en ratas con sobrepeso inducido por una dieta con alto contenido en grasa. Algunos mecanismos, tales como la disminución de leptina y el aumento en la expresión de SIRT1, PPAR-γ y GLUT-4 en tejido adiposo blanco podrían contribuir a la mejora en la sensibilidad a la insulina. La normalización en la expresión de SIRT1 en el tejido adiposo blanco es un nuevo mecanismo que ayuda a explicar los efectos beneficiosos de la rosuvastatina en la mejora del metabolismo de los hidratos de carbono en ratas con sobrepeso inducido por dieta.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesMaría Valero Muñoz recibió una beca de AstraZeneca Pharmaceutical Spain, S.A. El resto de autores declara no tener ningún conflicto de intereses.
El presente trabajo fue premiado con una Mención Especial a mejor comunicación oral presentada en el XXV Congreso Nacional de la SEA (Reus, 2012).