La participación monocitaria en la progresión aterosclerótica y sus efectos pro- o antiinflamatorios dependen de las subpoblaciones circulantes. El objetivo de este estudio es la caracterización de dichas subpoblaciones y su asociación con los factores de riesgo cardiovascular.
MétodosEstudio transversal que incluye 102 pacientes seleccionados; edad media: 65 años (rango 41-86 años), 69% varones. Se utilizó un panel de anticuerpos específicos frente a monocitos clásicos (Mon1, CD14+CD16− CD300e+HLADR+), intermedios (Mon2, CD14+CD16+CD300e+HLADR+) y no clásicos (Mon3, CD14−CD16+CD300e+HLADR+).
Se establecieron tres grupos de estudio; grupo 1: sujetos asintomáticos con más de un factor de riesgo cardiovascular (n=17); grupo 2: sujetos asintomáticos, pero con patología vascular por ecografía o microalbuminuria (n=56); y grupo 3: pacientes con algún evento vascular aterotrombótico previo (n=19). Asimismo, se calculó el riesgo cardiovascular mediante las escalas Framingham y REGICOR.
ResultadosSe observó una asociación entre las subpoblaciones Mon1 y Mon2 y los grupos del estudio (ANOVA, p<0,05), independiente de la edad y el sexo para los Mon2. Asimismo, las subpoblaciones Mon1 y Mon 2 se asociaron con eventos vasculares adversos (β=0,86, p=0,02 y β=0,1 p=0,002, respectivamente), siendo la asociación de Mon2 independiente de la edad y el sexo. Además, el porcentaje de Mon3 se asoció con la presencia de más de 2 factores de riesgo cardiovascular (β=0,21, p=0,04) en el análisis univariante. Finalmente, se halló una correlación entre los niveles de Mon1 y Mon2 con el número de leucocitos (r=0,7, p<0,001 y r=0,26 p<0,01, respectivamente).
ConclusionesEl análisis de subpoblaciones monocitarias es de gran interés clínico, ya que permite establecer un diferente perfil inflamatorio según los grupos de riesgo cardiovascular establecidos.
Monocytes play an important role in atherosclerotic progression having both pro and anti-inflammatory effects depending on different circulating monocyte subpopulations. The objective of this study is to characterize these subpopulations and their association with cardiovascular risk factors.
MethodsTransversal study including 102 selected patients, mean age: 65 years-old (range 41-86), 69% males. A set of specific antibodies against classical monocytes (Mon1, CD14+CD16− CD300e+HLADR+), intermediate (Mon2, CD14+CD16+CD300e+HLADR+) and non-classical (Mon3, CD14−CD16+CD300e+HLADR+) was assayed.
Three groups of patients were included: 17 asymptomatic with more than one cardiovascular risk factor (group 1), 56 subjects asymptomatic but with vascular pathology assessed by ultrasound or microalbuminuria (group 2) and 19 patients with a previous atherothrombotic event (group 3). The cardiovascular risk was determined by Framingham and REGICOR scores.
ResultsAn association between study groups and the percentage of Mon1 and Mon2 was observed (ANOVA, p<.05), being independent of age and sex for Mon2. Likewise Mon1 and Mon2 subpopulations were associated with cardiovascular adverse events (β=0.86, p=.02 y β=0.1 p=.002, respectively), independently of age and sex in the case of Mon2.
Moreover the percentage of Mon3 was associated with the presence of several cardiovascular risk factors (β=0.21, p=.04) in the univariate analysis. In addition, there was a correlation between the levels of Mon1 and Mon2 and leukocytes (r=0.7, p<.001 and r=0.26, p=.01, respectively).
ConclusionsThe analysis of monocyte subpopulations may be clinically useful to stratify the inflammatory profile related to the different cardiovascular risk groups.
Las enfermedades cardiovasculares (ECV) son responsables de 3,9 millones de muertes en Europa cada año, siendo la principal causa de mortalidad mundial1.
La aterosclerosis representa el principal sustrato de las ECV y la inflamación crónica de la pared vascular tiene un papel central en su patogenia. Los factores de riesgo cardiovascular (FRCV) clásicos están asociados con la activación de las células del sistema inmunitario que están presentes en las lesiones ateroscleróticas y favorecen su progresión2. Los monocitos constituyen un componente crítico de la respuesta inmune a la inflamación, ya que una vez reclutados por el endotelio, gracias a la acción de citoquinas y moléculas de adhesión, adoptan un cambio de fenotipo a un perfil inflamatorio que juega un papel importante en la progresión de la placa aterosclerótica y remodelado miocárdico3,4.
Tradicionalmente los monocitos se han dividido en 2 poblaciones según la expresión de CD14 y CD16, con funciones claramente diferenciadas: monocitos tipo 1 o clásicos, cuyo papel era inflamatorio, y monocitos tipo 2 o no clásicos, que tenían una función antiinflamatoria y patrullera eliminando células endoteliales dañadas y manteniendo la integridad del vaso. Sin embargo, en 2010, se estableció una nueva clasificación con 3 subpoblaciones de monocitos: clásicos (Mon1, CD14+CD16−), intermedios (Mon2, CD14+ CD16+) y no clásicos (Mon3, CD14+CD16+)5,6 con claras diferencias tanto en fenotipo, función y expresión génica como en respuestas a estímulos entre los grupos de monocitos CD165. Los monocitos intermedios se han propuesto como un monocito en transición de monocito clásico a no clásico4. En base a sus antígenos de superficie y a su función celular, los monocitos intermedios tienen tanto una función fagocítica y efectos antiinflamatorios como niveles altos de IL-1β y factor de necrosis tumoral (TNF)-α7. Sin embargo, estudios recientes indican que los monocitos CD16+, es decir, tipos 2 y 3, están implicados en procesos inflamatorios e infecciosos7, tienen capacidad de secretar moléculas proinflamatorias como IL-6, MMP-9 y CCR2 y presentan gran afinidad por el endotelio activado8, siendo los monocitos tipo 3 (CD14+) los que tienen mayor actividad inflamatoria y producción de citoquinas en respuesta a ligandos del TLR (toll like receptor) y los primeros en llegar al lugar de la lesión7.
En los últimos años, se están desarrollando estrategias para poder identificar de forma precoz a los pacientes con mayor riesgo de desarrollar ECV con la finalidad de poder realizar una mejor prevención9. Debido al distinto perfil inflamatorio expresado por las distintas poblaciones monocitarias y su relación con el riesgo cardiovascular, el objetivo del estudio fue analizar las subpoblaciones monocitarias en sangre periférica en distintos grupos de pacientes establecidos en base a FRCV.
Sujetos y métodosDiseño de estudio y pacientesEntre abril de 2016 y diciembre de 2017 se incluyeron un total de 102 pacientes con edades comprendidas entre los 45 y 86 años con FRCV y aterosclerosis subclínica y clínica reclutados en las consultas de Medicina Interna, Área de Medicina Vascular y Medicina del Trabajo de la Clínica Universidad de Navarra (CUN) y del servicio de Medicina Interna del Complejo Hospitalario de Navarra (CHN).
Se incluyeron pacientes mayores de 45 años con 2 o más FRCV. Los criterios de exclusión fueron: presentar una enfermedad tumoral activa, inflamatoria aguda o crónica de cualquier etiología y haber recibido tratamiento con AINE o esteroides en las 2 semanas previas a la extracción analítica.
El Biobanco de la Universidad de Navarra proporcionó los datos de los pacientes incluidos en el estudio que fueron procesados siguiendo los procedimientos operativos estándar aprobados por los Comités Ético y Científico.
Factores de riesgo y grupos de riesgoSe consideró de forma global como hipertenso a aquellos pacientes que presentaban presión arterial sistólica >140, o diastólica >90 y/o si tomaban antihipertensivos; dislipidémicos si tenían colesterol total >200, LDL>130 y HDL<59 o tomaban hipolipemiantes; hipertrigliceridemia si los triglicéridos resultaban >150; diabéticos si el diagnóstico era establecido por curva de glucosa o toma de antidiabéticos orales o insulina. Se valoró la obesidad según el índice de masa corporal (IMC) o según el perímetro abdominal.
Se registró como fumador a aquellos pacientes que continuaban fumando o que lo habían abandonado menos de un año antes de la inclusión en el estudio, según lo reportado en los cuestionarios.
Los pacientes se clasificaron en 3 grupos en función de los datos clínicos recogidos:
- -
Grupo 1: pacientes asintomáticos con 2 o más FRCV (n=17).
- -
Grupo 2: pacientes asintomáticos a los que se había detectado patología vascular por prueba de imagen o microalbuminuria (ateroesclerosis subclínica, n=56).
- -
Grupo 3: pacientes con manifestaciones clínicas de ECV (n=19).
Asimismo, se calculó el riesgo cardiovascular según las escalas de riesgo Framingham y REGICOR.
Anamnesis y exploración físicaSe realizó una valoración clínica mediante entrevista médica y exploración física con toma de presión arterial y frecuencia cardiaca, se recogieron datos antropométricos calculándose el IMC.
Se procedió a una recogida de parámetros demográficos y antropométricos (edad, sexo, IMC), patologías previas (accidente cerebrovascular, cardiopatía isquémica, enfermedad arterial periférica e insuficiencia renal), FRCV (hipertensión, dislipidemia, diabetes mellitus y tabaquismo), medicación habitual y antecedentes familiares. Se determinó la presencia de placas ateroscleróticas por ecografía carotídea, abdominal y femoral y medición del espesor íntima-media carotídea mediante ecógrafo Siemens S2000 y S3000.
Estudio analíticoSe realizó un estudio analítico (tras ayunas de al menos 8h) dentro del proceso asistencial habitual de valoración de FRCV: perfil lipídico (colesterol total, LDL, HDL y triglicéridos), niveles de creatinina sérica y urinaria, albúmina en orina, pruebas de función hepática, perfil glucídico (hemoglobina glucosilada y glucemia basal en ayunas), así como parámetros inflamatorios como la proteína C reactiva.
Las muestras de sangre venosa se obtuvieron en ayunas en tubos que contenían EDTA 1g/l y heparina sódica (17U/ml), así como una muestra de orina de una micción aislada. Se separó el plasma de la sangre total por centrifugación a 1.500×g durante 15min a 4°C.
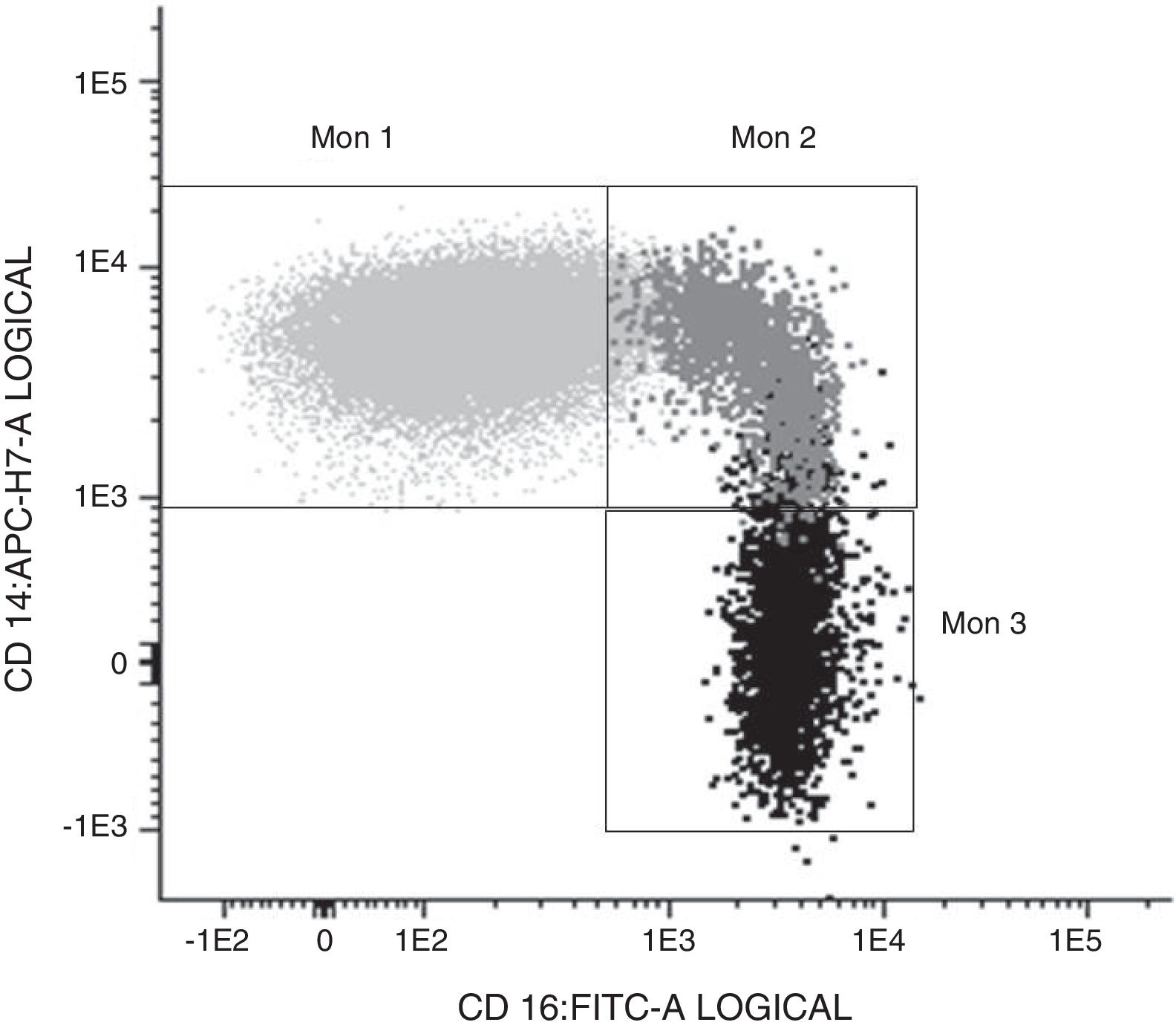
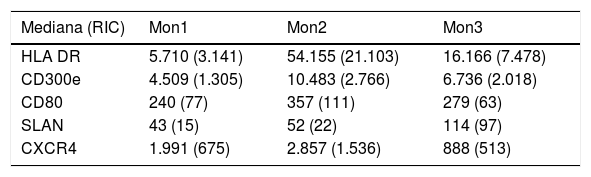
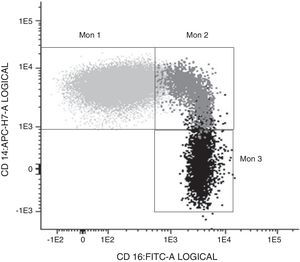
Determinación de las subpoblaciones monocitarias por citometría de flujoLa caracterización de los monocitos se realizó mediante citometría de flujo en una muestra en sangre periférica fresca anticoagulada en EDTA, adquiriéndose las muestras en un citómetro FACS Canto II y usando el software FACSDiva (Becton Dickinson Bioscience, San José, CA). Los datos fueron analizados con el software Infinicyt (Cytognos, Salamanca). En el trabajo se utilizó la clasificación establecida en el documento de consenso de la European Society of Cardiology5 empleando un panel de anticuerpos comunes a las células presentadoras de antígeno (HLADR), otros específicos frente al compartimento monocito/macrófago (CD14, CD16, CD80, CD163, CD300e, SLAN) así como el receptor 4 de quimiocinas (CXCR4). Los monocitos clásicos (Mon1) se caracterizaban por ser CD14++CD16−,CD300e+HLADR+, los intermedios (Mon2) por ser CD14+CD16+CD300e+HLADR+, y los no clásicos (Mon3) eran CD14loCD16++CD300e+HLADR+, como se observa en la tabla 1 y en la figura 1.
Caracterización de las subpoblaciones monocitarias según los marcadores de superficie
| Mediana (RIC) | Mon1 | Mon2 | Mon3 |
|---|---|---|---|
| HLA DR | 5.710 (3.141) | 54.155 (21.103) | 16.166 (7.478) |
| CD300e | 4.509 (1.305) | 10.483 (2.766) | 6.736 (2.018) |
| CD80 | 240 (77) | 357 (111) | 279 (63) |
| SLAN | 43 (15) | 52 (22) | 114 (97) |
| CXCR4 | 1.991 (675) | 2.857 (1.536) | 888 (513) |
Valores de intensidad de fluorescencia expresados como mediana y rango intercuartil (RIC).
Los datos fueron recogidos y analizados con el paquete estadístico STATA versión 13.0. Se realizó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de la distribución de los parámetros investigados. Los datos fueron expresados como media±desviación estándar. Se realizó la prueba t de Student para la comparación entre medias de 2 grupos y ANOVA de un factor para la comparación de las variables respecto al grupo de riesgo establecido, seguido de corrección por Bonferroni para comparaciones múltiples. Para corregir por factores de confusión como edad y sexo se utilizó el análisis por ANCOVA. Para determinar la asociación de cada una de las subpoblaciones monocitarias con los factores de riesgo se utilizó el test de regresión lineal ajustado para edad y sexo. Además, se calculó la correlación de Pearson para determinar la asociación entre variables numéricas continuas, y la χ2 para las variables categóricas. Fueron consideradas significativas todas aquellas diferencias con p<0,05.
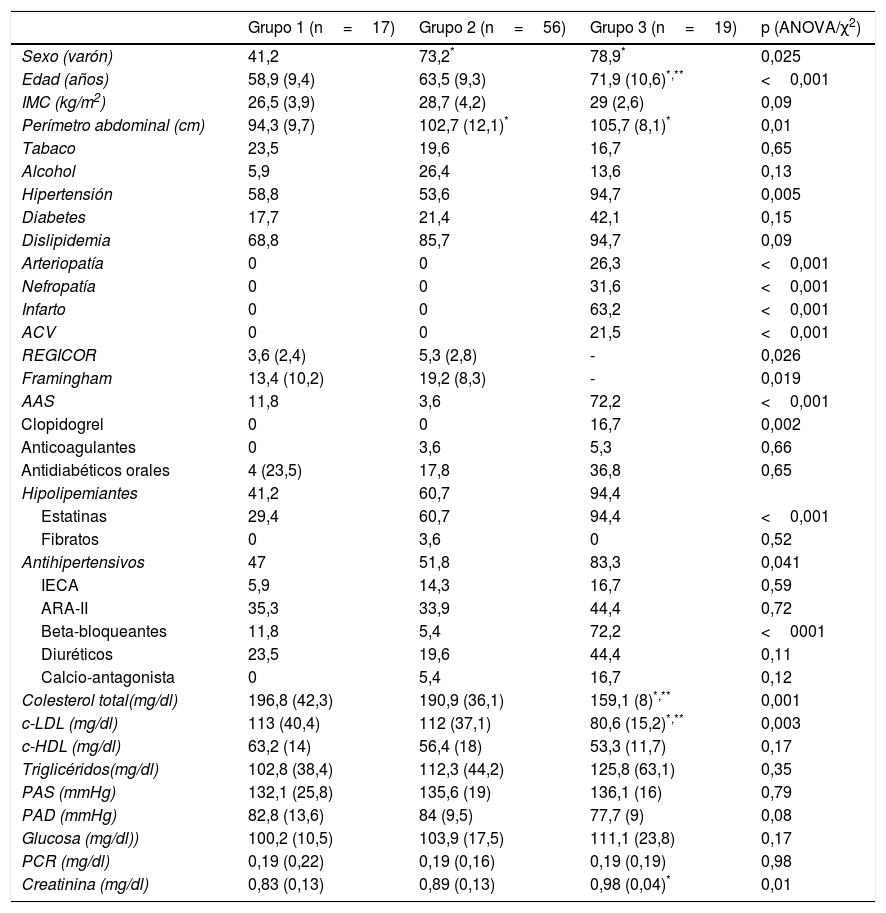
ResultadosSe incluyeron un total de 102 pacientes con una edad media de 64,4 años (rango 45-86 años); un 68,5% eran varones. Fueron clasificados en 3 grupos de riesgo en base a los datos clínicos; grupo 1 (n=17, 18%): sujetos asintomáticos con más de un FRCV; grupo 2 (n=56, 61%): sujetos asintomáticos, pero con patología vascular por prueba de imagen o microalbuminuria; y grupo 3 (n=19, 21%): pacientes con algún evento vascular aterotrombótico. Se excluyeron del estudio 10 pacientes al no disponer del hemograma o de resultados de citometría. Las características demográficas, factores de riesgo, medicación concomitante y parámetros analíticos están descritos en la tabla 2. Se observaron diferencias entre los grupos de riesgo en el porcentaje de varones, edad, perímetro abdominal, niveles de colesterol y creatinina. Los pacientes de los grupos 2 y 3 presentaban una mayor frecuencia de varones y un mayor perímetro de cintura respecto al grupo 1. Los pacientes del grupo 3 tenían una edad más avanzada y mayores niveles de colesterol total y c-LDL respecto a los dos grupos anteriores, y presentaban mayor nivel de creatinina respecto al grupo 1. No se encontraron diferencias en el resto de los factores estudiados. En cuanto a la medicación, se observó que los pacientes del grupo 3 tomaban más antiagregantes (tanto aspirina como clopidogrel), estatinas y beta-bloqueantes que los pacientes de los otros grupos. Los índices Framingham y REGICOR fueron significativamente superiores en el grupo 2 con relación al grupo 1 (p=0,019 y p=0,026, respectivamente).
Características demográficas de la población
| Grupo 1 (n=17) | Grupo 2 (n=56) | Grupo 3 (n=19) | p (ANOVA/χ2) | |
|---|---|---|---|---|
| Sexo (varón) | 41,2 | 73,2* | 78,9* | 0,025 |
| Edad (años) | 58,9 (9,4) | 63,5 (9,3) | 71,9 (10,6)*,** | <0,001 |
| IMC (kg/m2) | 26,5 (3,9) | 28,7 (4,2) | 29 (2,6) | 0,09 |
| Perímetro abdominal (cm) | 94,3 (9,7) | 102,7 (12,1)* | 105,7 (8,1)* | 0,01 |
| Tabaco | 23,5 | 19,6 | 16,7 | 0,65 |
| Alcohol | 5,9 | 26,4 | 13,6 | 0,13 |
| Hipertensión | 58,8 | 53,6 | 94,7 | 0,005 |
| Diabetes | 17,7 | 21,4 | 42,1 | 0,15 |
| Dislipidemia | 68,8 | 85,7 | 94,7 | 0,09 |
| Arteriopatía | 0 | 0 | 26,3 | <0,001 |
| Nefropatía | 0 | 0 | 31,6 | <0,001 |
| Infarto | 0 | 0 | 63,2 | <0,001 |
| ACV | 0 | 0 | 21,5 | <0,001 |
| REGICOR | 3,6 (2,4) | 5,3 (2,8) | - | 0,026 |
| Framingham | 13,4 (10,2) | 19,2 (8,3) | - | 0,019 |
| AAS | 11,8 | 3,6 | 72,2 | <0,001 |
| Clopidogrel | 0 | 0 | 16,7 | 0,002 |
| Anticoagulantes | 0 | 3,6 | 5,3 | 0,66 |
| Antidiabéticos orales | 4 (23,5) | 17,8 | 36,8 | 0,65 |
| Hipolipemiantes | 41,2 | 60,7 | 94,4 | |
| Estatinas | 29,4 | 60,7 | 94,4 | <0,001 |
| Fibratos | 0 | 3,6 | 0 | 0,52 |
| Antihipertensivos | 47 | 51,8 | 83,3 | 0,041 |
| IECA | 5,9 | 14,3 | 16,7 | 0,59 |
| ARA-II | 35,3 | 33,9 | 44,4 | 0,72 |
| Beta-bloqueantes | 11,8 | 5,4 | 72,2 | <0001 |
| Diuréticos | 23,5 | 19,6 | 44,4 | 0,11 |
| Calcio-antagonista | 0 | 5,4 | 16,7 | 0,12 |
| Colesterol total(mg/dl) | 196,8 (42,3) | 190,9 (36,1) | 159,1 (8)*,** | 0,001 |
| c-LDL (mg/dl) | 113 (40,4) | 112 (37,1) | 80,6 (15,2)*,** | 0,003 |
| c-HDL (mg/dl) | 63,2 (14) | 56,4 (18) | 53,3 (11,7) | 0,17 |
| Triglicéridos(mg/dl) | 102,8 (38,4) | 112,3 (44,2) | 125,8 (63,1) | 0,35 |
| PAS (mmHg) | 132,1 (25,8) | 135,6 (19) | 136,1 (16) | 0,79 |
| PAD (mmHg) | 82,8 (13,6) | 84 (9,5) | 77,7 (9) | 0,08 |
| Glucosa (mg/dl)) | 100,2 (10,5) | 103,9 (17,5) | 111,1 (23,8) | 0,17 |
| PCR (mg/dl) | 0,19 (0,22) | 0,19 (0,16) | 0,19 (0,19) | 0,98 |
| Creatinina (mg/dl) | 0,83 (0,13) | 0,89 (0,13) | 0,98 (0,04)* | 0,01 |
AAS: ácido acetilsalicílico; ACV: accidente cerebrovascular previo; ARA II: antagonistas de los receptores de la angiotensina II; c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; IECA: inhibidores de la enzima convertidora de angiotensina; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva.
Las variables continuas se presentan como media y desviación estándar. Las variables cualitativas, en porcentajes.
Test de Bonferroni: * p<0,05 vs. grupo 1; ** p<0,05 vs. grupo 2.
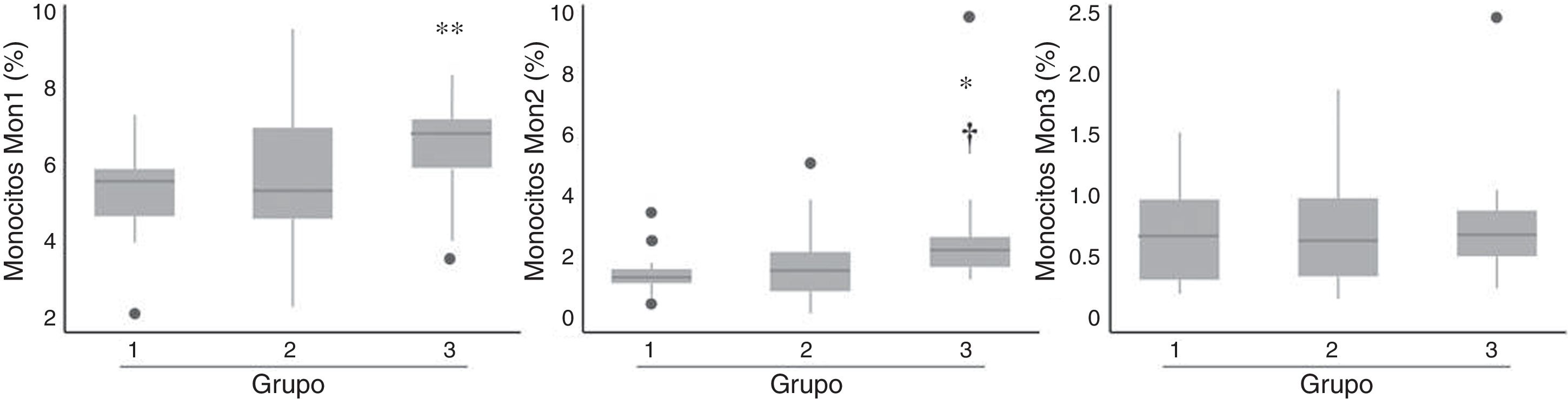
Los pacientes de grupo 3 presentaron un incremento significativo en el porcentaje de células con fenotipo tanto Mon1 y Mon2 respecto al grupo 1, así como de Mon2 respecto al grupo 2 (fig. 2), mientras que no se observaron diferencias en cuanto a la distribución de células Mon3. Tras ajustar por edad y sexo, únicamente los Mon2 se asociaron de forma independiente con los grupos de riesgo establecidos (p=0,029).
Porcentaje de las distintas subpoblaciones de monocitos según los grupos de riesgo cardiovascular establecidos.
Se calcularon las diferencias mediante ANOVA realizando corrección por Bonferroni para comparaciones múltiples.
*p=0,038 vs. grupo 1; **p=0,014 vs. grupo 1; †p=0,042 vs. grupo 2.
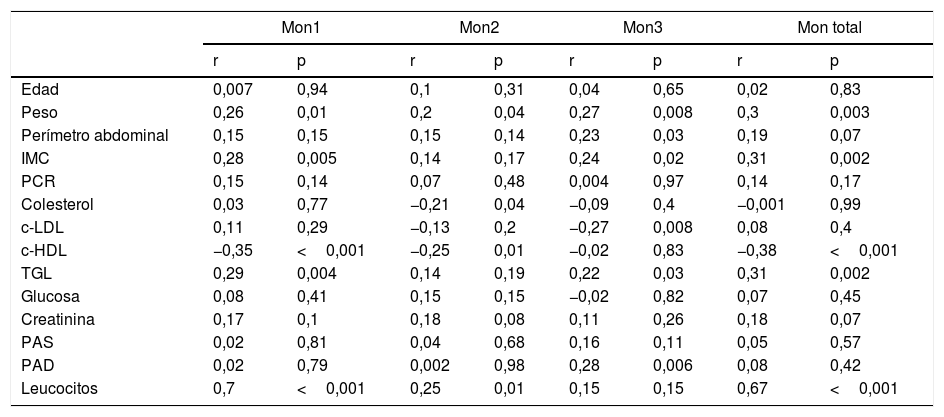
La tabla 3 muestra la correlación entre los FRCV y las distintas subpoblaciones monocitarias en la población total del estudio.
Correlaciones de factores de riesgo cardiovascular y número de monocitos de cada subpoblación en el total de pacientes analizados (n=92)
| Mon1 | Mon2 | Mon3 | Mon total | |||||
|---|---|---|---|---|---|---|---|---|
| r | p | r | p | r | p | r | p | |
| Edad | 0,007 | 0,94 | 0,1 | 0,31 | 0,04 | 0,65 | 0,02 | 0,83 |
| Peso | 0,26 | 0,01 | 0,2 | 0,04 | 0,27 | 0,008 | 0,3 | 0,003 |
| Perímetro abdominal | 0,15 | 0,15 | 0,15 | 0,14 | 0,23 | 0,03 | 0,19 | 0,07 |
| IMC | 0,28 | 0,005 | 0,14 | 0,17 | 0,24 | 0,02 | 0,31 | 0,002 |
| PCR | 0,15 | 0,14 | 0,07 | 0,48 | 0,004 | 0,97 | 0,14 | 0,17 |
| Colesterol | 0,03 | 0,77 | −0,21 | 0,04 | −0,09 | 0,4 | −0,001 | 0,99 |
| c-LDL | 0,11 | 0,29 | −0,13 | 0,2 | −0,27 | 0,008 | 0,08 | 0,4 |
| c-HDL | −0,35 | <0,001 | −0,25 | 0,01 | −0,02 | 0,83 | −0,38 | <0,001 |
| TGL | 0,29 | 0,004 | 0,14 | 0,19 | 0,22 | 0,03 | 0,31 | 0,002 |
| Glucosa | 0,08 | 0,41 | 0,15 | 0,15 | −0,02 | 0,82 | 0,07 | 0,45 |
| Creatinina | 0,17 | 0,1 | 0,18 | 0,08 | 0,11 | 0,26 | 0,18 | 0,07 |
| PAS | 0,02 | 0,81 | 0,04 | 0,68 | 0,16 | 0,11 | 0,05 | 0,57 |
| PAD | 0,02 | 0,79 | 0,002 | 0,98 | 0,28 | 0,006 | 0,08 | 0,42 |
| Leucocitos | 0,7 | <0,001 | 0,25 | 0,01 | 0,15 | 0,15 | 0,67 | <0,001 |
c-HDL: colesterol ligado a lipoproteínas de alta densidad; c-LDL: colesterol ligado a lipoproteínas de baja densidad; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva; TGL: triglicéridos.
El número de células Mon1 correlacionó de forma positiva con el peso, el IMC y los triglicéridos, y de forma negativa con el c-HDL. No se encontró asociación con la diabetes, el tabaco, la hipertensión, ni con el resto de FRCV.
Los Mon2 presentaron una correlación negativa con los niveles de colesterol total y c-HDL, pero no se asociaron con el resto de FRCV.
Por su parte, los Mon3 correlacionaron de forma positiva con el IMC, el perímetro abdominal, los triglicéridos y la presión arterial diastólica, y de forma negativa con el c-LDL, pero no se asociaron con el resto de FRCV.
Asimismo, se analizaron las subpoblaciones monocitarias en relación con la presencia de más de 2 FRCV (hipertensión, diabetes, dislipidemia, obesidad y tabaco) y se observó que los Mon3 se asociaban con la presencia de 2 o más factores (β=0,2; p=0,04), pero dicha asociación era dependiente de la edad.
Asociación de las diferentes subpoblaciones monocitarias con la presencia de placas y eventos vasculares adversosLas subpoblaciones Mon1 y Mon2 correlacionaron con la cifra de leucocitos (r=0,7 y r=0,26, respectivamente, p<0,01), pero no con la proteína C reactiva ni con los niveles de creatinina.
No se observó asociación entre ninguna población monocitaria y la presencia de placas de ateroma.
Por último, se encontró una asociación entre los eventos vasculares adversos (definido como única variable compuesta que incluía: infarto de miocardio, accidente cerebrovascular agudo, enfermedad arterial periférica o nefropatía) y el porcentaje de Mon1 (β=0,86; p=0,02) y Mon2 (β=0,1; p=0,002); dicha asociación se mantenía tras ajustar por edad y sexo para los Mon2 (β=0,1; p=0,013), pero no así para Mon1 (β=0,79; p=0,11). Estos resultados indicarían que los pacientes con eventos secundarios presentan un mayor porcentaje de Mon2 que los pacientes sin eventos.
DiscusiónEste trabajo muestra que el estudio de las subpoblaciones monocitarias circulantes, Mon1, Mon2 y Mon3, mediante citometría de flujo puede ser de utilidad para valorar el diferente perfil inflamatorio de los pacientes según los grupos establecidos en este trabajo en base a los FRCV. De esta forma se observa una asociación independiente de edad y sexo de la subpoblación monocitaria Mon2 con los grupos de riesgo establecidos en el estudio, así como con haber tenido un evento cardiovascular previo. Sin embargo, la subpoblación Mon3 se asoció con la presencia de 2 o más factores de riesgo independientemente del sexo, no así de la edad.
De forma consistente, en la literatura se describe que los monocitos, independientemente del subtipo, se elevan ante estímulos inflamatorios y/o infecciosos, así como con la obesidad10,11. Asimismo, el estudio Tromsø12 demostró, en una amplia cohorte de pacientes, que la elevación de monocitos se asociaba con la aparición de nuevas placas ateroscleróticas detectadas mediante ecografía. De igual forma, en nuestra cohorte encontramos un diferente perfil de subpoblaciones monocitarias según los distintos grupos de riesgo establecidos en el estudio. Además, aquellos pacientes que ya habían tenido eventos (grupo 3) presentaron unos niveles de monocitos Mon2 más elevados respecto a pacientes de los restantes grupos de estudio.
En la actualidad, en la era de la medicina personalizada, se están buscando marcadores fiables que de forma individual predigan la inflamación residual de los pacientes y con ello nos informen sobre qué pacientes se beneficiarían de tratamientos más intensivos con el fin de prevenir la aparición de complicaciones cardiovasculares. En este contexto se han propuesto los monocitos como posibles marcadores de inflamación residual9. Hasta la fecha, se utilizaba el nivel de proteína C reactiva como medida de inflamación en diversos estudios de intervención (JUPITER, CANTOS)13-15. Sin embargo, en nuestra cohorte de pacientes con los FRCV controlados con fármacos, los niveles de proteína C reactiva fueron similares en los 3 grupos de riesgo9. En este contexto, la valoración de las subpoblaciones monocitarias podría aportar información adicional sobre la inflamación residual existente, pudiendo guiarnos sobre la necesidad de optimización del tratamiento médico.
Los monocitos están involucrados en procesos inflamatorios y contribuyen a la aterogénesis favoreciendo el reclutamiento de leucocitos en las placas7. De las distintas subpoblaciones, son los Mon1 la subpoblación predominantemente identificada en las placas ateroscleróticas y los que se consideran mediadores inflamatorios11. Algunos estudios indican que son los primeros monocitos en aparecer en sangre periférica6 y su aumento se relaciona con la aparición de placas ateroscleróticas16. Sin embargo, en nuestro estudio no observamos dicha asociación, ya que al tratarse de un estudio transversal no es posible establecer una asociación con la evolución de la placa aterosclerótica.
En los últimos años ha aumentado de forma considerable el interés por el papel de los monocitos Mon2 en el riesgo cardiovascular; parece demostrado en la literatura que los Mon2 se encuentran de forma recurrente elevados en pacientes con eventos cardiovasculares previos y que podrían tener un impacto pronóstico en pacientes que ya han padecido un infarto de miocardio previo17. Así como en nuestro estudio, Marsh et al.17 habían observado que los pacientes que habían tenido un evento cardiovascular previo presentaban un mayor porcentaje de Mon2. Dichos hallazgos podrían ser debidos a una mayor expresión en los Mon2 de receptores de membrana con capacidad de adhesión al endotelio activado como demuestran los estudios de Rogacev et al.8 y, por tanto, podrían favorecer el proceso aterogénico5,8,16. Su determinación podría ser de interés para reclasificar los pacientes con inflamación residual, permitiendo identificar aquellos que requieren especial atención y seguimiento8.
Recientemente, se ha propuesto que los Mon3 (no clásicos), denominados típicamente como patrulleros, es la subpoblación que migra de forma precoz a la lesión, transformándose de forma local en las otras subpoblaciones y parecen tener un papel ateroprotector, tanto en situación basal como durante procesos inflamatorios5,18. Dichos datos apoyarían el hecho de que en nuestro estudio se observase una expresión diferente en el número de Mon3 en aquellos pacientes que presentaban 2 o más FRCV y que existiese una correlación significativa con los valores de IMC, perímetro abdominal, presión arterial diastólica e hipertrigliceridemia.
Las limitaciones del estudio son aquellas propias de un estudio transversal y el relativamente bajo tamaño muestral con distribución no homogénea entre grupos, en el que podemos establecer asociaciones, pero no causalidad. Asimismo, se encuentra una gran heterogeneidad en los pacientes dentro de un mismo grupo, predominantemente en el grupo 2, ya que en dicho grupo los pacientes muestran una gran variabilidad de carga aterosclerótica que incluye la presencia de placas independientemente del número y las regiones afectas. Sin embargo, estos resultados abren las puertas a nuevas hipótesis para futuros estudios prospectivos sobre el papel de monocitos como predictores de eventos vasculares mayores y posibles dianas terapéuticas.
ConclusionesLa cuantificación de subpoblaciones monocitarias y específicamente de los Mon2 puede ser de gran utilidad en el estudio de pacientes con FRCV, puesto que podría ser indicativo de la inflamación residual y por tanto podría contribuir a elaborar una medicina más personalizada, identificando mejor aquellos pacientes que requieran un tratamiento más intensivo.
FinanciaciónBeca Sociedad Española de Arteriosclerosis (FEA clínico-Epidemiológica 2017).
Conflicto de interesesNinguno.
Agradecemos particularmente a los pacientes su participación y al Biobanco de la Universidad de Navarra su colaboración.