En pacientes con enfermedad coronaria se ha observado una disminución de la actividad fibrinolítica y aumento del grosor del tejido adiposo epicárdico. El objetivo del estudio fue determinar la relación entre la grasa epicárdica y la actividad fibrinolítica, midiendo la concentración del inhibidor del activador del plasminógeno tipo-1 (PAI-1).
MétodosEstudio transversal que incluyó a 56 mujeres aparentemente sanas, con edad de 45-60 años. A las participantes se les realizaron mediciones antropométricas y bioquímicas, la actividad fibrinolítica se determinó midiendo PAI-1 por la técnica de ELISA. El grosor epicárdico se evaluó por ecocardiografía transtorácica.
ResultadosLa concentración de PAI-1 se asoció directamente con el grosor del tejido adiposo epicárdico (r=.475, p=.001), glucosa, triglicéridos, resistencia a la insulina, IMC, tejido adiposo visceral y grasa corporal total. El análisis de regresión multivariado indicó que la grasa epicárdica predice en forma independiente el valor de PAI-1.
ConclusionesLas mujeres con incremento de tejido adiposo epicárdico muestran menor actividad fibrinolítica por presentar niveles aumentados de PAI-1 y, en consecuencia, un posible mayor riesgo trombótico.
A decrease in fibrinolytic activity and an increase in the thickness of the epicardial adipose tissue have been observed in patients with coronary artery disease. The aim of this study was to determine the association between epicardial adipose tissue and fibrinolytic activity by measuring the concentration of plasminogen activator inhibitor-1 (PAI-1).
MethodsA cross-sectional study was conducted on 56 apparently healthy women aged 45 to 60 years. Anthropometric measurements and biochemical determinations were performed on all participants. The fibrinolytic activity was determined by measuring PAI-1 by ELISA. Epicardial thickness was assessed by transthoracic echocardiography.
ResultsThe concentration of PAI-1 was directly associated with the thickness of the epicardial adipose tissue (r=0.475, P=.001), body mass index (BMI), visceral adipose tissue, insulin resistance, glucose, and HDL-cholesterol. The multivariate regression analysis indicated that epicardial fat independently predicts the concentrations of PAI-1.
ConclusionsWomen with thicker epicardial adipose tissue have reduced fibrinolytic activity, and consequently greater thrombotic risk.
En México, de acuerdo a la Encuesta Nacional de Salud y Nutrición de Medio Camino 2016 (ENSANUT MC), la prevalencia de sobrepeso y obesidad en mujeres es del 75,6% y es mayor en el grupo de edad de 40 a 79 años1. La obesidad representa un factor de riesgo mayor para la enfermedad coronaria, un índice de masa corporal>29 (IMC) aumenta 3 veces la probabilidad de presentar un evento cardiovascular2,3. La enfermedad coronaria se asocia aún más con la obesidad abdominal que con el IMC, lo que revela que además de la cantidad de tejido adiposo, el riesgo cardiovascular depende también de la distribución del mismo4. El tejido adiposo visceral abdominal produce una gran cantidad de adipocinas proinflamatorias que tienen efectos locales y sistémicos, que favorecen al desarrollo de la enfermedad cardiovascular5.
El tejido adiposo epicárdico es otro depósito de grasa visceral, se localiza en los surcos auriculoventriculares e interventriculares y se extiende por el ápex, rodeando las arterias coronarias. Una característica de este tipo de tejido adiposo epicárdico es que comparte la circulación con el miocardio6. En individuos sanos el tejido adiposo epicárdico proporciona al miocardio los lípidos necesarios para la oxidación y obtención de energía y lo protege de la lipotoxicidad7,8. En condiciones como la obesidad, se presenta disfunción de la grasa epicárdica y se producen mayor cantidad de adipocinas proinflamatorias, que potencialmente participan en el proceso de ateromatosis coronaria9,10.
Las mujeres mayores de 50 años de edad muestran un aumento considerable del riesgo cardiovascular11, y esto se puede explicar entre otros factores por la disminución en la producción de estrógenos, que implica una redistribución de la grasa corporal hacia un patrón de obesidad abdominal, modificaciones en la hemostasia y en el perfil de lípidos séricos, conduciendo a un estado protrombótico12,13.
Un marcador de riesgo trombótico es el inhibidor del activador del plasminógeno tipo 1 (PAI-1), que es la principal proteína de la fibrinólisis14. En pacientes con obesidad y síndrome metabólico la concentración de PAI-1 se encuentra aumentada15. Este incremento produce un estado de hipofibrinólisis al inhibir al activador tisular del plasminógeno (t-PA) y aumentar los depósitos de fibrina en la placa aterosclerótica, y eventualmente a la formación de un trombo oclusivo14,16,17.
El objetivo de este estudio fue determinar la relación entre la grasa epicárdica y la actividad fibrinolítica midiendo la concentración PAI-1 en mujeres de 45 a 60 años de edad.
Material y métodosSe realizó un estudio transversal en 56 mujeres aparentemente sanas, con un rango de edad de 45-60 años que acudieron a la Unidad de Investigación Médica en Enfermedades Endocrinas del Hospital de Especialidades del Centro Médico Nacional del IMSS, de febrero de 2013 al mes de agosto de 2016. Ninguna de las participantes recibía terapia hormonal. Las mujeres con diagnóstico establecido de diabetes, insuficiencia renal y hepática, endocrinopatías, enfermedades hematológicas, historia previa de enfermedad cardiovascular y trombosis fueron excluidas del estudio. Este protocolo de estudio fue aprobado por el Comité de Investigación del Hospital de Especialidades del IMSS. Las participantes fueron informadas y firmaron la correspondiente carta de consentimiento.
Evaluación clínicaA todas las pacientes se les realizó historia clínica y se tomaron las medidas antropométricas. Se midió el peso y la talla sin zapatos y con ropa ligera en la báscula y estadímetro Bame. Se determinó la presión arterial con baumanómetro aneroide. El IMC se calculó con el peso (kg) dividido entre la talla (m2); se consideró obesidad cuando las pacientes mostraban un IMC>30 y sobrepeso con un IMC de 25 a 29,9.
Análisis bioquímicoSe obtuvieron muestras de sangre venosa antecubital entre las 7:00-8:00a.m., después de al menos un ayuno de 12horas. Las muestras se colectaron en tubos sin anticoagulante y con citratos. La glucosa, HDL-colesterol y triglicéridos se determinaron en suero por métodos enzimáticos mediante el analizador químico semiautomatizado Ekem Kontrol Lab. La determinación de estradiol se realizó en suero mediante quimioluminiscencia con el equipo IMMULITE 1000. Las concentraciones plasmáticas de PAI-1 se midieron mediante ensayo por inmunoadsorción ligado a enzimas (ELISA) (Bio, Vendor EE. UU.). La resistencia a la insulina se evalúo mediante la fórmula de Matthews: HOMA-IR=insulina (μU/ml)×glucosa en ayunas (mmol/l)/22,518.
Análisis corporalSe realizó el análisis corporal mediante impedancia bioeléctrica (Analizador de Composición Corporal 353ioi JAWON). El análisis se llevó a cabo por la mañana con ayuno de 12horas. Se obtuvo el valor del tejido adiposo visceral abdominal y el porcentaje de grasa corporal total.
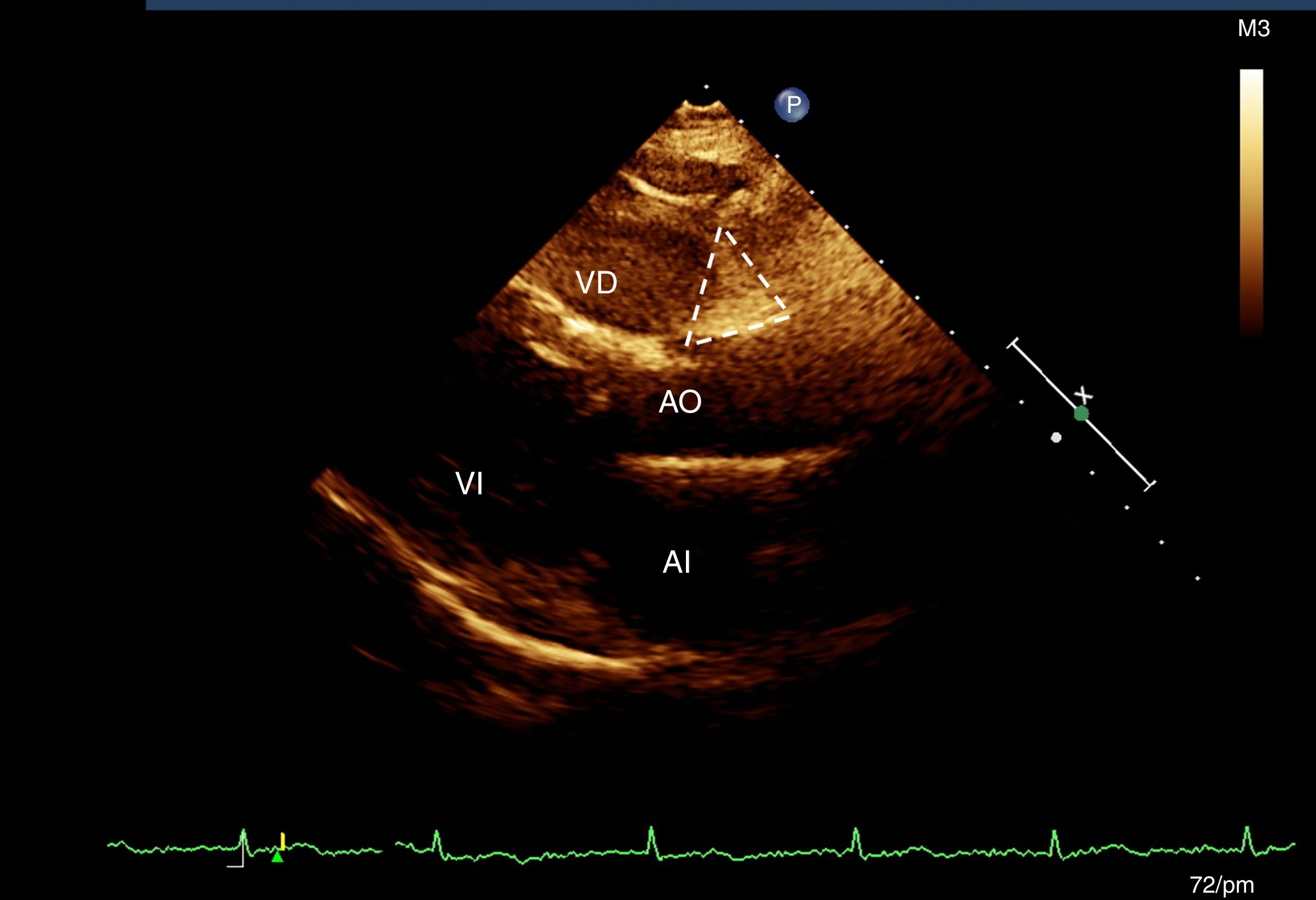
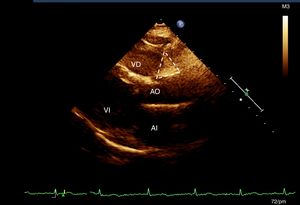
Evaluación del tejido adiposo epicárdicoA todas las participantes se les realizó un ecocardiograma transtorácico modo M, bidimensional y Doppler (Ecocardiógrafo Phillips IE33, versión 5.2.0.289). De acuerdo con la técnica previamente descrita19 se seleccionaron 2 sitios de depósito de la grasa epicárdica utilizando la profundidad de campo para mejorar la visualización bidimensional19. Con la vista de eje largo longitudinal se ubicó el surco entre la raíz de la aorta y el ventrículo derecho, que forma un triángulo justo en la unión de la aorta con el ventrículo derecho (AoVD)19. En la ventana de 4 cámaras se midió la grasa epicárdica a nivel apical, que se observa igualmente con morfología de triángulo, en el sitio de la unión de las regiones apicales de ambos ventrículos (fig. 1). El mismo cardiólogo ecocardiografista realizó todas las mediciones19.
Análisis estadísticoLas variables se expresan como media±desviación estándar. Para identificar la correlación entre las variables se utilizó la prueba de Spearman y para identificar las diferencias entre los grupos la prueba de U Mann-Whitney. El análisis multivariado se efectuó para identificar el efecto de las diferentes variables sobre la concentración de PAI-1. Se utilizó como programa de cómputo estadístico SPSS v.21 y se consideró un valor significativo cuando p≤0,05.
En función de los resultados del presente estudio y del número de pacientes incluidas se calculó el poder estadístico de la asociación entre grasa epicárdica y PAI-1 en 0,98.
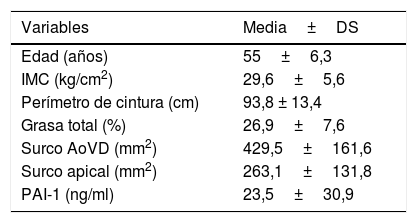
ResultadosSe estudiaron 56 mujeres con edad promedio de 55,0±6,3 años, con IMC de 29,6±5,6. Del total de las participantes el 72,3% presentó obesidad o sobrepeso y el 27,7% peso normal; las características generales de las participantes se muestran en la tabla 1.
Características generales de las participantes
| Variables | Media±DS |
|---|---|
| Edad (años) | 55±6,3 |
| IMC (kg/cm2) | 29,6±5,6 |
| Perímetro de cintura (cm) | 93,8 ± 13,4 |
| Grasa total (%) | 26,9±7,6 |
| Surco AoVD (mm2) | 429,5±161,6 |
| Surco apical (mm2) | 263,1±131,8 |
| PAI-1 (ng/ml) | 23,5±30,9 |
AoVD: tejido adiposo aortoventricular derecho; IMC: índice de masa corporal; PAI-1: inhibidor del activador plasminógeno tipo 1.
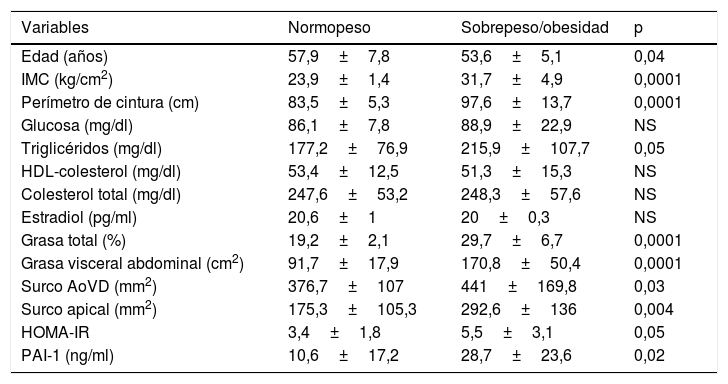
El grupo de participantes con obesidad y sobrepeso mostró un incremento del tejido adiposo epicárdico en los surcos AoVD y apical; también presentó aumento de la concentración de triglicéridos, grasa total, grasa visceral abdominal y PAI-1 (tabla 2).
Clasificación de las participantes de acuerdo a IMC
| Variables | Normopeso | Sobrepeso/obesidad | p |
|---|---|---|---|
| Edad (años) | 57,9±7,8 | 53,6±5,1 | 0,04 |
| IMC (kg/cm2) | 23,9±1,4 | 31,7±4,9 | 0,0001 |
| Perímetro de cintura (cm) | 83,5±5,3 | 97,6±13,7 | 0,0001 |
| Glucosa (mg/dl) | 86,1±7,8 | 88,9±22,9 | NS |
| Triglicéridos (mg/dl) | 177,2±76,9 | 215,9±107,7 | 0,05 |
| HDL-colesterol (mg/dl) | 53,4±12,5 | 51,3±15,3 | NS |
| Colesterol total (mg/dl) | 247,6±53,2 | 248,3±57,6 | NS |
| Estradiol (pg/ml) | 20,6±1 | 20±0,3 | NS |
| Grasa total (%) | 19,2±2,1 | 29,7±6,7 | 0,0001 |
| Grasa visceral abdominal (cm2) | 91,7±17,9 | 170,8±50,4 | 0,0001 |
| Surco AoVD (mm2) | 376,7±107 | 441±169,8 | 0,03 |
| Surco apical (mm2) | 175,3±105,3 | 292,6±136 | 0,004 |
| HOMA-IR | 3,4±1,8 | 5,5±3,1 | 0,05 |
| PAI-1 (ng/ml) | 10,6±17,2 | 28,7±23,6 | 0,02 |
AoVD: aortoventricular derecho; HOMA: homeostatic model assessment; IMC: índice de masa corporal; PAI-1: inhibidor del activador de plasminógeno tipo 1.
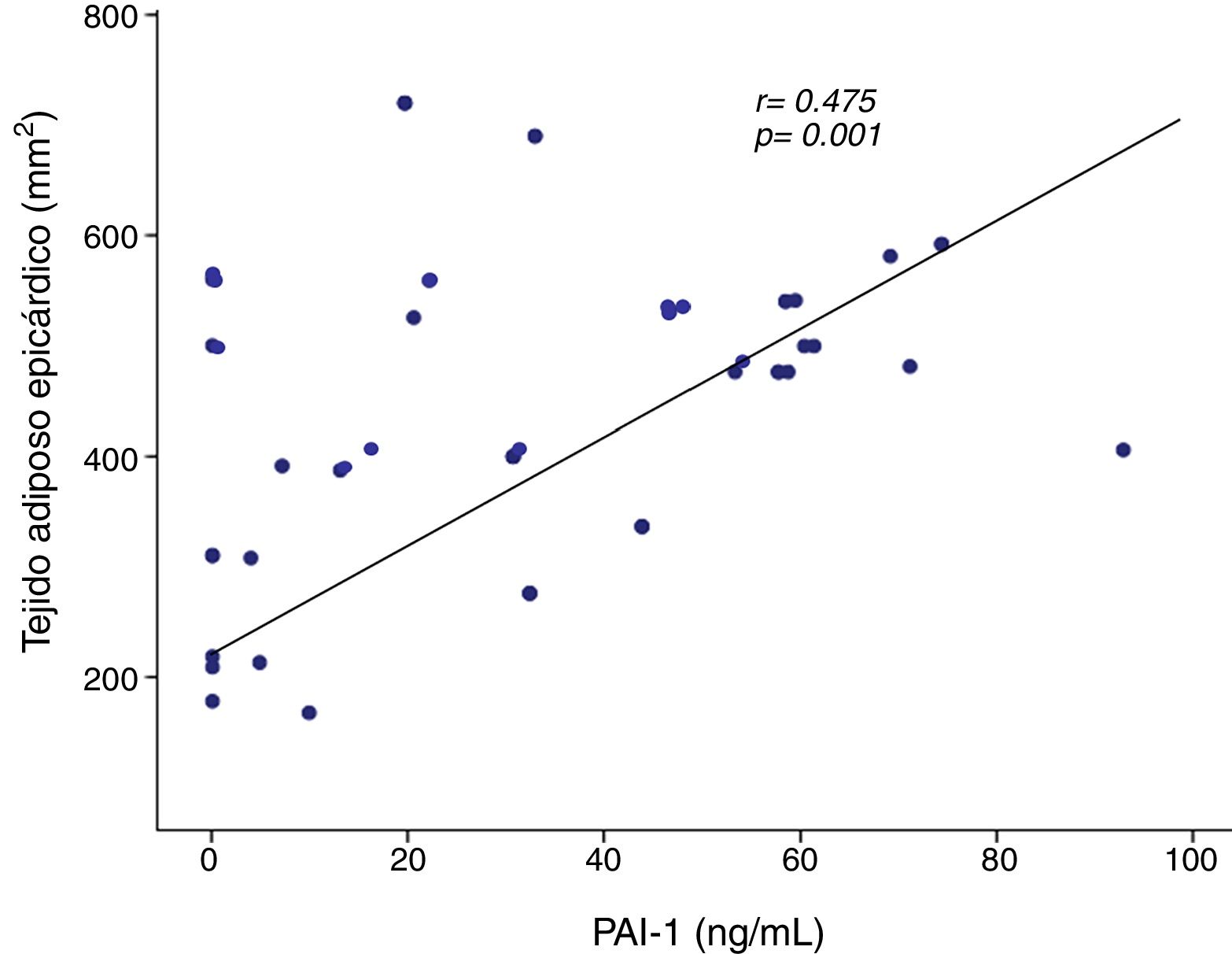
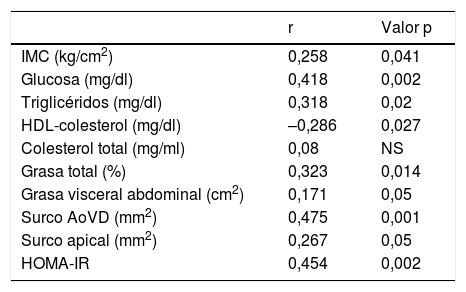
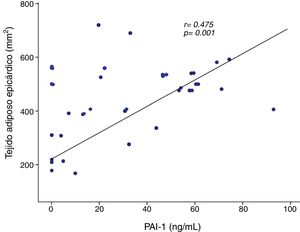
Se observó una correlación positiva de PAI-1 con el tejido adiposo epicárdico del surco AoVD (r=0,475, p=0,001) (fig. 2). La correlación ente PAI-1 y el tejido adiposo epicárdico del surco AoVD persistió después de ajustar por IMC (r=0,304, p<0,05). La concentración de PAI-1 mostró también correlación positiva con la grasa del surco apical, glucosa, triglicéridos, HOMA-IR, grasa total corporal y grasa abdominal y en forma inversa con HDL-colesterol (tabla 3).
Asociación de la concentración de PAI-1 con otras variables
| r | Valor p | |
|---|---|---|
| IMC (kg/cm2) | 0,258 | 0,041 |
| Glucosa (mg/dl) | 0,418 | 0,002 |
| Triglicéridos (mg/dl) | 0,318 | 0,02 |
| HDL-colesterol (mg/dl) | –0,286 | 0,027 |
| Colesterol total (mg/ml) | 0,08 | NS |
| Grasa total (%) | 0,323 | 0,014 |
| Grasa visceral abdominal (cm2) | 0,171 | 0,05 |
| Surco AoVD (mm2) | 0,475 | 0,001 |
| Surco apical (mm2) | 0,267 | 0,05 |
| HOMA-IR | 0,454 | 0,002 |
AoVD: aortoventricular derecho; HOMA: homeostatic model assessment; IMC: índice de masa corporal.
Para identificar la contribución de las diferentes variables sobre la concentración de PAI-1 se efectuó un análisis de regresión múltiple. Las variables de predicción fueron: IMC, grasa visceral, grasa total, grasa epicárdica del surco AoVD, estradiol y HOMA-IR. Se identificó que la grasa epicárdica predice de forma independiente la concentración de PAI-1 (R=0,558, p=0,03, coeficiente beta=0,387).
DiscusiónEste estudio demostró una relación significativa entre el incremento del grosor de la grasa epicárdica y el riesgo trombótico evaluado por la concentración de PAI-1. El grupo de estudio fueron mujeres de 45 a 60 años edad, que corresponde a una etapa en la que el riesgo cardiovascular aumenta. La información publicada en este tema es limitada, y hasta donde conocemos no existen estudios previos en población mexicana, no obstante, en un estudio en 42 mujeres italianas se había observado una correlación similar entre el nivel de PAI-1 y el grosor de la grasa epicárdica20.
El incremento del grosor de la grasa epicárdica se ha relacionado con el desarrollo de eventos coronarios, y esta asociación es independiente de los factores de riesgo cardiovascular tradicionales21. En los pacientes con placa ateromatosa en las arterias coronarias se ha encontrado incremento de la grasa epicárdica22. En un estudio en población mexicana se observó también esta misma asociación23. Los resultados de estos trabajos sugieren que el tejido adiposo epicárdico está directamente implicado en el desarrollo de la aterosclerosis coronaria21. Los mecanismos que promueven el desarrollo de la aterosclerosis en los pacientes que tienen incremento de la grasa epicárdica aún no están aclarados por completo. Probablemente, las adipocinas producidas por el tejido adiposo epicárdico afecten a las arterias coronarias24–26. Una de estas moléculas podría ser el PAI-1.
En el presente estudio la asociación del tejido adiposo epicárdico fue con la concentración circulante de PAI-1, que probablemente se sintetizó en el endotelio, los adipocitos y otros tejidos. De la misma forma se ha demostrado en biopsias de pacientes con enfermedad coronaria que PAI-1 se expresa también en el tejido adiposo epicárdico27. Así, es factible que tanto el PAI-1 circulante, como el que se produce en la grasa epicárdica, afecten a las arterias coronarias. Las moléculas sintetizadas en la grasa epicárdica podrían alcanzar a las arterias coronarias por difusión desde la grasa periadventicia del epicardio, y/o por la liberación a los vasa vasorum, logrando atravesar las capas arteriales y llegar a la capa íntima28,29.
No obstante que PAI-1 y el tejido adiposo epicárdico pueden estar asociados a través de variables intermedias como el IMC y la resistencia a la insulina, el análisis multivariado indicó que la grasa epicárdica predice de manera independiente la concentración de PAI-1.
Los resultados del estudio mostraron además que nuestra población presenta un riesgo cardiovascular elevado, de tal manera que la medición de la grasa epicárdica y el PAI-1 serían de utilidad en la evaluación y predicción del riesgo cardiovascular.
La medición de la grasa epicárdica se efectuó por ecocardiografía; esto puede considerarse como una limitación del estudio, sin embargo la técnica por ecocardiografía presenta una correlación muy elevada con la prueba de oro, que es la resonancia magnética y tiene además como ventajas adicionales su seguridad, reproducibilidad y bajo coste5,19,30.
El número de participantes del presente estudio fue bajo; sin embargo, la correlación entre grasa epicárdica y PAI-1 alcanzó un poder estadístico apropiado. Aun así, será necesario realizar estudios futuros con un mayor número de pacientes y en otros grupos de población. Por otra parte, y no obstante que PAI-1 es el principal inhibidor de la fibrinólisis y se asocia con la presencia y progresión de la enfermedad coronaria31,32, en proyectos futuros sería conveniente complementar el estudio de la fibrinólisis, midiendo otras proteínas de la hemostasia, tales como el activador tisular del plasminógeno o t-PA.
ConclusiónEl presente estudio demostró una asociación directa entre la grasa epicárdica y la disminución en la fibrinólisis. Lo anterior sugiere que el aumento del grosor de la grasa epicárdica y la concentración elevada de PAI-1 conducen posiblemente al desarrollo de la enfermedad cardiovascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.