Los trastornos del sueño, incluyendo el sueño interrumpido y el de corta duración son altamente prevalentes y están, prospectivamente, asociados con un incremento en el riesgo de varias enfermedades crónicas, incluyendo cardiometabólicas, neurodegenerativas y autoinmunes.
Material y métodosEsta es una revisión narrativa de la literatura basada en numerosos artículos publicados en revistas sometidas a un proceso de revisión por pares desde el comienzo de este siglo.
ResultadosLa relación entre los trastornos del sueño y la desregulación metabólica ha sido claramente establecida, fundamentalmente en el contexto de la epidemia moderna de la enfermedad cardiometabólica, una constelación de condiciones que incluyen obesidad, resistencia a la insulina, hipertensión arterial y dislipidemia, todas ellas consideradas como factores mayores de riesgo para enfermedad cardiovascular aterosclerótica (ECVA) y sus expresiones clínicas como el ictus isquémico, el infarto de miocardio y la diabetes mellitus tipo 2 (DM2). Se requiere de instrumentos clínicamente viables para medir la duración y la calidad del sueño durante estudios de rutina y de intervención.
ConclusionesEl momento, la cantidad y la duración del sueño son críticos en reducir la carga de los factores de riesgo para varias enfermedades crónicas, incluyendo la ECVA y la DM2, siendo de mayor relevancia en las personas jóvenes. Investigaciones futuras deben esclarecer la efectividad de las intervenciones multimodales para contrarrestar el riesgo del sueño corto para un mejor estilo vida a lo largo del continuo del cuidado de la salud, especialmente en la población joven.
Sleep disturbances, including disrupted sleep and short sleep duration, are highly prevalent and are prospectively associated with an increased risk for various chronic diseases, including cardiometabolic, neurodegenerative, and autoimmune diseases.
Material and methodsThis is a narrative review of the literature based on numerous articles published in peer-reviewed journals since the beginning of this century.
ResultsThe relationship between sleep disorders and metabolic dysregulation has been clearly established, mainly in the setting of modern epidemic of cardiometabolic disease, a cluster of conditions include obesity, insulin resistance, arterial hypertension, and dyslipidaemia, all of them considered as main risk factor for atherosclerotic cardiovascular disease (ACVD) and its clinical expression such as ischemic ictus, myocardial infarction and type 2 diabetes. Clinically viable tools to measure sleep duration and quality are needed for routine screening and intervention.
ConclusionsIn view of what has been exposed in this review, it is evident that the timing, amount, and quality of sleep are critical to reduce the burden of risk factors for several chronic disease, including ACVD and type 2 diabetes, and most relevant in young people. Future research studies should elucidate the effectiveness of multimodal interventions to counteract the risk of short sleep for optimal patient outcomes across the healthcare continuum, especially in young people.
Aunque poco atendido, el dormir es un proceso vital para el ser humano, al igual que alimentarse y reproducirse, cuidadosamente orquestado por el cerebro, caracterizado por una dominancia del sistema nervioso parasimpático o vagal, que provee una oportunidad al eje cardiovascular y respiratorio para restaurar su equilibrio en respuesta al estrés o la fatiga causado durante las horas de vigilia. Vale resaltar que el sueño es la función biológica menos conocida y poco atendida dentro del contexto de la salud general.
Es conveniente aclarar que, aunque el sueño es utilizado como sinónimo de dormir en muchas publicaciones en español, existe una amplia diferencia entre ambas. El término dormir se refiere al acto conductual que nos hace perder la conciencia y desconectarnos de los estímulos ambientales. Por su lado, el término soñar, se refiere a las imágenes oníricas, al proceso subjetivo que se relaciona con la actividad mental de los sueños1. La connotación de la palabra sueño es más clara en inglés que en español, así sleep (dormir) y dream (sueños) no se usan de forma intercambiable como en español, en que la palabra sueño implica la actividad onírica de soñar y también el deseo y la conducta de dormir. En esta revisión se usará sueño y dormir de manera indistinta.
Desde los años cincuenta del siglo pasado, diversos investigadores se han dedicado al estudio de la neurobiología del dormir y el soñar en el hombre y los animales. El dormir se ha caracterizado por varias etapas que van desde el dormir ligero hasta el dormir profundo y el dormir soñando. En los periodos de dormir (sin soñar) se han descrito 4 etapas (I a IV) con base en la actividad eléctrica cerebral que es, típicamente, de ondas lentas, y en la conducta que las acompaña. En contraste, cuando dormimos y soñamos se producen movimientos oculares rápidos (MOR), como si observáramos un paisaje, además de que la actividad eléctrica cerebral se caracteriza por ondas de alta frecuencia y bajo voltaje (tipo beta, similares a las de la vigilia)2. Por estas razones los neurofisiólogos denominan a los periodos en que soñamos como sueño MOR o por sus siglas en inglés: REM, Rapid Eye Movement.
La salud del sueño se reconoce, al igual que la alimentación, como un constructo multidimensional debido a su complejidad y repercusiones en la salud cardiometabólica y general. Por consiguiente, el estudio del sueño no puede enfocarse en una sola dimensión ya que se obtendrán conclusiones incompletas acerca del papel del sueño en la preservación de la salud.
El ciclo natural del sueño y la vigilia se ha visto afectado a lo largo de nuestra historia por diversos cambios debidos al progreso, pero sin ninguna duda que el factor que definitivamente rompe con la sincronía natural de nuestros ritmos biológicos ha sido la introducción de la luz artificial. Este elemento ha condicionado gradualmente y regulado todas las actividades humanas, terminando por imponer ritmos no naturales, justificados en el mundo laboral y sus actividades productivas. El ser humano ha tenido que adaptarse, a estos nuevos horarios, con la creación de diferentes tipos de turnos laborales, actividades académicas y lúdicas, que alteran los procesos naturales, afectando al mismo tiempo la calidad de vida con respecto a la salud y, olvidando frecuentemente, que el ciclo luz/oscuridad es el mayor sincronizador del ritmo circadiano, lo cual es un aspecto crucial porque el organismo no distingue si se trata de luz solar o artificial3.
Los seres humanos tenemos una reserva energética limitada, y el organismo está programado genéticamente para descansar en proporción a las actividades en vigilia. Se estima que entre un 33 a un 40% de nuestro día debe dedicarse al sueño como acción reponedora de las reservas energéticas corporales4.
Ahora se reconoce cada vez más que la interrupción del ritmo circadiano puede ser un fenómeno omnipresente que no está restringido a entornos específicos (p. ej., en trabajadores por turnos) y puede acumularse con el tiempo, particularmente teniendo en cuenta el aumento de las exposiciones diarias a factores que puede alterar los ritmos circadianos (p. ej., exposición a la luz por la noche, uso de dispositivos multimedia en el dormitorio, etc.), aunque el impacto sobre la salud cardiometabólica de tales exposiciones ubicuas a la interrupción circadiana crónica no se ha abordado a nivel de la población.
Desde hace algunas décadas se conoce que existe una tramado de implicaciones fisiopatológicas entre las irregularidades del sueño y las afecciones cardiometabólicas, aspecto que es motivo de esta revisión narrativa.
El sueño, una función biológica poco conocida y no respetadaEl buen dormir es parte fundamental para una buena salud, y cada vez más se le otorga mayor reconocimiento para la salud física y mental, tanto por médicos como por el público en general; pero, paradójicamente, el sistema de vida impulsa a dormir menos, debido a los numerosos distractores (TV, teléfono, WhatsApp®, Facebook®, etc.), que obstaculizan prestarle mayor consideración a esta función recuperadora por excelencia5.
Por naturaleza todos los mamíferos experimentan una cierta cantidad de daño neurológico con la vigilia y los detritos resultantes, incluyendo restos de genes dañados y proteínas dentro de la neurona, pueden reagruparse y causar enfermedad neurológica. El dormir ayuda a la reparación del mencionado daño y al barrido de los deshechos, brevemente reducir, organizar y despejar los restos que puedan conducir a un deterioro cerebral6.
Las alteraciones del sueño como el sueño insuficiente, el insomnio, el síndrome de las piernas inquietas, irregularidades o variación en la duración, el sueño fragmentado y el síndrome de la apnea obstructiva del sueño (SAOS) se presentan hasta en un tercio de los adultos, afectando en muchos aspectos a la salud, incluyendo el metabolismo de los hidratos de carbono, la función cardíaca y respiratoria y la función sexual, entre otras.
El sueño es parte de la biología humana, y es considerado un requisito para la vida. Se define como «un estado naturalmente recurrente y reversible de desconexión perceptiva, conciencia reducida e inmovilidad relativa»7, y numerosos estudios epidemiológicos han identificado que el sueño deficiente o fragmentado representa un riesgo de mortalidad por todas las causas y de enfermedad cardiovascular8.
Aunque mucha de la información existente se relaciona más con las consecuencias negativas de la privación de sueño, es necesario insistir en que la salud del sueño es un constructo multidimensional con componentes que se solapan como duración, temporalidad, regularidad, eficiencia, satisfacción e impacto sobre la vigilia, y al cual se le presta poca atención9.
Las horas recomendadas para dormir cambian de acuerdo con la edad10–12:
- -
Recién nacidos: 18h
- -
Infantes: Entre 10 y 12h
- -
Escolares: Entre 9 y 11h
- -
Adolescentes: Entre 8 y 10h
- -
Adultos jóvenes (18 a 64 años): Entre 7 y 9h
- -
Adulto mayor (≥65 años): Entre 7 y 8h
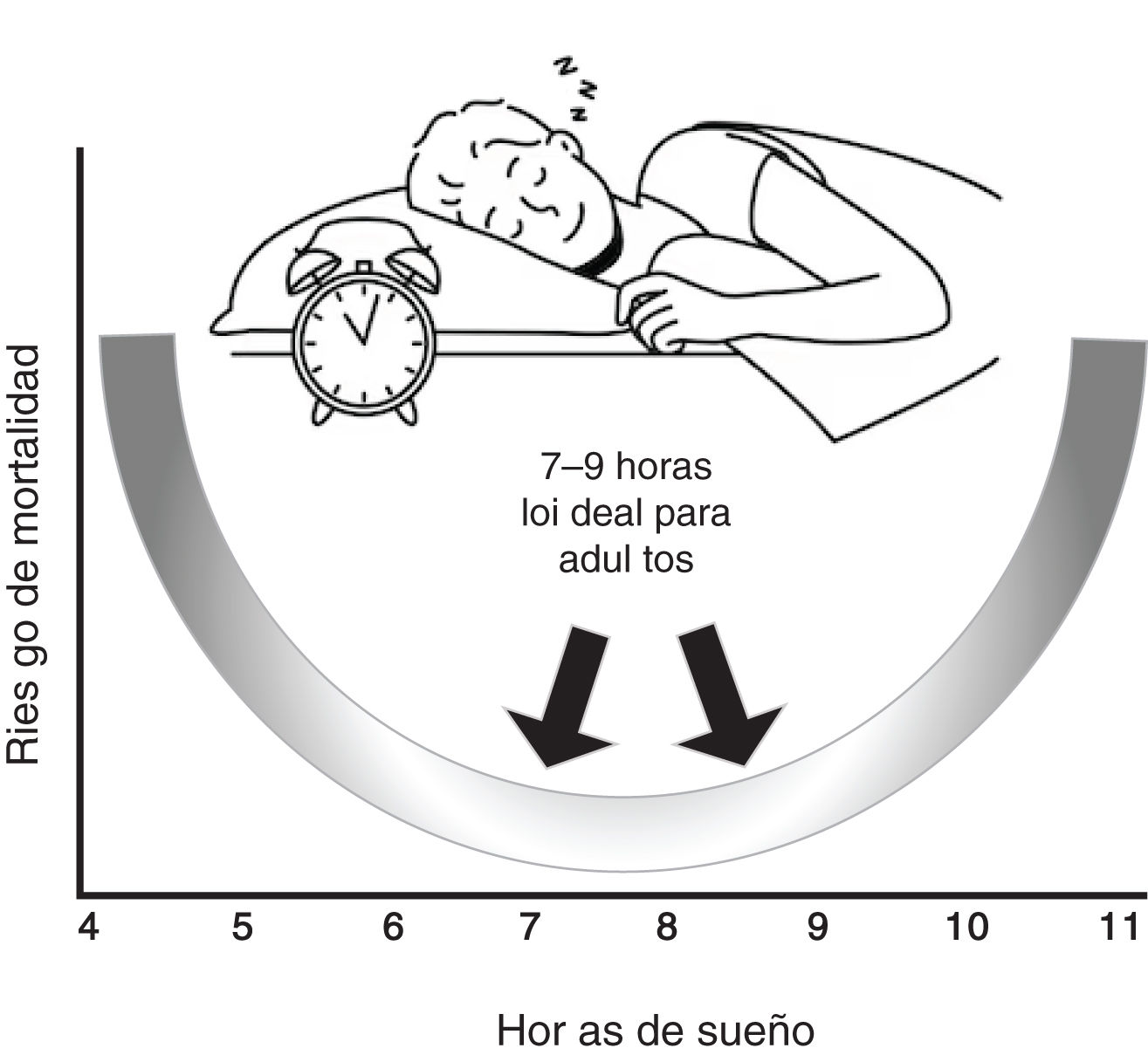
Hoy día se está considerando que los horarios irregulares de sueño, caracterizados por una alta variabilidad diaria en el momento, la duración o el horario del sueño, pueden representar una interrupción más leve, pero crónica del reloj circadiano que es ampliamente relevante en toda la población (fig. 1).
Curva en «U» sobre la duración del sueño y mortalidad. Aunque no existe un «número de horas de sueño» mágico que funcione para todas las personas de la misma edad. Es bien conocido que la mayoría de los adultos necesitan entre 7 y 9 h de sueño por noche, pero después de los 65 años esta cantidad es menor con menoscabo de su continuidad (sueño fragmentado). Los horarios irregulares del sueño, caracterizados por una alta variabilidad diaria, la duración o el horario del sueño, pueden representar una interrupción del reloj circadiano más leve, pero crónica, ampliamente prevalente en la población.
Específicamente, las personas que con frecuencia alteran su duración o el horario de sueño de noche a noche pueden tener un mayor riesgo cardiometabólico debido a las funciones circadianas interrumpidas. El análisis de la regularidad del sueño requiere una evaluación del tiempo y la duración del sueño en varias noches y, a menudo, se cuantifica mediante el uso de actigrafía durante varios días; aunque con la mayoría de los relojes inteligentes se puede obtener una información confiable sobre la variación individual, pero este método no ha sido validado.
Ritmo circadiano, vigilia y sueñoEl ritmo circadiano es obra de nuestro reloj biológico que marca el paso para determinadas funciones, siendo el mejor ejemplo, el sueño. Durante esta etapa, el organismo se toma un merecido descanso y permite la «recuperación» del sistema cardiovascular, sistema nervioso central, renal y otros más. Por ello, ocurre el descenso de la presión arterial (PA) y de la frecuencia cardíaca (FC).
Durante el sueño, pautado por nuestro ritmo circadiano en horas de la noche, normalmente ocurren numerosos cambios funcionales, algunos de los cuales se muestran en la figura 213–17.
Ritmo circadiano y modulación de funciones corporales13–17. El reloj biológico determina el cumplimiento de los ritmos circadianos en mamíferos con una estrecha relación con el funcionamiento de numerosos sistemas del organismo, donde la nutrición, la alimentación y las respuestas metabólicas a la ingesta de alimentos son particularmente reguladas por los ritmos circadianos y también por las variaciones diurnas a través del día.
La rotación de la Tierra sobre su eje expone a los pobladores del planeta a ciclos diarios de luz y oscuridad. Para ajustar su actividad a los periodos de luz, determinados por la salida y puesta del Sol, los organismos han desarrollado relojes moleculares, denominados relojes biológicos, que funcionan en ciclos de 24h y que definen el ritmo circadiano (del latín circa o cercano y día). Estos cronómetros internos responden a la luz que penetra tejidos y células, donde sistemas moleculares muy complejos responden al estímulo18.
El reloj principal se encuentra en el cerebro, coordina todos los relojes biológicos de un ser viviente al mantenerlos sincronizados y ubicado en el hipotálamo que recibe información directa de los ojos para ser procesada, y definir los diferentes ritmos que modulan nuestra fisiología y rutina en general19.
Hoy día está bien establecido que la ritmicidad circadiana inherente es un mecanismo universal en varios procesos biológicos, incluyendo el metabolismo. Un claro patrón circadiano está presente desde la expresión de los genes en corriente abajo hasta los metabolitos circulantes, así como en la secreción de hormonas involucradas en la regulación metabólica20.
En condiciones normales, los centros reguladores del sueño reciben la señal de activación al anochecer, y esto hace que sintamos sueño a esas horas, y se desactivan progresivamente por la mañana. Sin embargo, el reloj biológico puede estar alterado por diversos motivos, entre los que se encuentran9,13,14: Factores genéticos, hormonales, fármacos, alteraciones conductuales, afecciones neurológicas, edad, alimentación o actividad física.
En resumen, nuestro reloj biológico regula la fisiología del cuerpo mediante hormonas (como el cortisol y la melatonina, la primera con mayor concentración en la mañana y disminuye para el momento que vamos a dormir; mientras que la segunda, tiene niveles altos siempre en la noche porque es la hormona de la oscuridad), y por vía del sistema nervioso autónomo.
Mecanismos fisiopatológicos factibles durante el sueño alteradoUna dificultad importante al evaluar los efectos cardiometabólicos del sueño de corta duración es la gran heterogeneidad de los protocolos experimentales, que a veces conducen a resultados controversiales. Por otro lado, los estudios demográficos tienen limitaciones debido a factores de confusión individuales e interindividuales, como la etnia, el sexo, la genética, el ambiente y las condiciones sociales. Además, en los estudios demográficos, la duración y la calidad del sueño con frecuencia son referidas por el paciente y no son evaluadas objetivamente con dispositivos como la actigrafía o la polisomnografía. El empleo de ambos probablemente sea lo mejor porque miden dimensiones diferentes y complementarias del sueño, pero tales técnicas no son del todo versátiles para utilizar en muestras suficientemente numerosas. Esta es una razón importante que le confiere mucha validez a los metaanálisis.
Siendo el dormir una de las más grandes incógnitas dentro de las funciones biológicas de los seres vivientes y bien conocidas las consecuencias del sueño corto, el mecanismo de tal impacto sobre la salud está lleno de numerosas conjeturas y especulaciones. Sin embargo, numerosos estudios experimentales y de observación apuntan, como intervención multifactorial, hacia distintos actores en juego (fig. 3):
- a.
Distorsión del sistema nervioso autónomo. El sueño de corta duración invariablemente está asociado con un cambio importante en el balance simpático vagal hacia el predominio del tono adrenérgico conducente a estimular diversos mecanismos que conllevan al aumento del riesgo cardiovascular como arritmias, elevación nocturna de la PA y FC y aterosclerosis a través de la disfunción endotelial, inflamación y estrés oxidativo, así como por estimulación del sistema renina angiotensina aldosterona (SRAA)21. Los estudios experimentales usualmente involucran exposición a corto plazo a deprivación del sueño, pero la exposición crónica a dormir poco en el contexto del mundo real no sorprende que conduzca a la hiperactividad simpática continua, con todo el espectro de la respuesta cardiometabólica que ella signifique. Los estudios experimentales sobre los efectos crónicos de la deprivación del sueño en sujetos sanos han demostrado resultados análogos22,23. El perfil autonómico sufre un cambio con reducción en la variabilidad de la PA y FC con una desviación en el balance simpático vagal hacia la predominancia casi absoluta del simpático después de 5 días de deprivación parcial del sueño con el consecuente incremento en la concentración plasmática de noradrenalina22. Hallazgos similares se han reportado en una cohorte de 30 estudiantes sanos de secundaria23.
- b.
Estado proinflamatorio y protrombótico. Es bien conocido y aceptado que la inflamación es uno de los mecanismos intermedios más importantes involucrados en la aparición de enfermedades cardiovasculares, siendo un proceso complejo donde participan la sobrexpresión de varias moléculas de adhesión, quimiocinas, citocinas y factores de crecimiento, que son favorecedores para la aparición de aterosclerosis24. En un estudio que evaluó el efecto de privación total aguda del sueño en el marco del mundo real con la evaluación de varios biomarcadores inflamatorios en el plasma de residentes médicos después de una noche de guardia y hallaron aumento del interferón gama (IFNγ) sin cambios en las interleucinas [IL], IL-2, IL-10 y el factor alfa de necrosis tumoral (TNFα), sin embargo, estos resultados no fueron consistentes. Por su parte, la IL-6 parece tener un patrón circadiano y relacionarse negativamente con la cantidad de sueño de la noche anterior25. La privación aguda de sueño afecta el patón circadiano de la secreción de IL-6 y produce hipersecreción diurna e hiposecreción nocturna.
- c.
Estrés oxidativo y disfunción endotelial. Las especies reactivas de oxígeno (ERO) son esenciales para varias funciones celulares vasculares incluyendo, el crecimiento, la proliferación y la migración de las células endoteliales y de las células del músculo liso vascular, la angiogénesis, la apoptosis, el tono vascular y la defensa del huésped. Sin embargo, cuando la concentración es excesiva pueden desencadenar enfermedad vascular a través del daño oxidativo directo e irreversible26. La deprivación experimental por corto tiempo ha mostrado estar asociada con un incremento en la concentración de mieloperoxidasa, una enzima involucrada en la oxidación de las partículas de colesterol unido a las lipoproteínas de baja densidad (c-LDL), particularmente aterogénicas bajo esta forma27,28. El incremento en la concentración del factor 1 de crecimiento similar a la insulina (IGF-1, por sus siglas en inglés), está implicado en la liberación de radicales oxidativos de neutrófilos activados, lo cual puede explicar el pico en la concentración de mieloperoxidasa27,28.
El aumento de los valores de endotelina 1 se informó en adultos con sueño de poca duración e igualmente, disminución de la reactividad vascular dependiente del endotelio e independiente del mismo tras la privación aguda total de sueño, asociado con aumento de los valores de la molécula-1 de adhesión intercelular, que es un marcador de activación endotelial, y de la IL-6, que inhibe la relajación dependiente del endotelio en la que interviene el óxido nítrico29.
- d.
Alteración de la función metabólica. El dormir y los ritmos circadianos son de importancia capital en la regulación de ciertas funciones metabólicas y endocrinas. Los estudios en ratones y ratas han demostrado una fuerte conexión entre la deprivación del sueño y la obesidad a través de la desregulación de varias rutas de control del peso, tales como la secreción de insulina, el balance leptina/grelina y el gasto de energía30. Además, la privación de sueño puede reducir la sensibilidad a los estímulos endógenos que aumentan el gasto de energía y, por lo tanto, causar aumento de peso31. Por demás, la inflamación actúa como un intermediario que conlleva a varios cambios metabólicos. La adiponectina, conocida hormona antiinflamatoria secretada por el tejido adiposo e involucrada en la sensibilidad a la insulina y oxidación lipídica ha sido estudiada en relación con la duración del sueño, no obstante, las concentraciones de adiponectina después de la deprivación del sueño son inconsistentes32. Estudios en seres humanos confirmaron datos de estudios en animales: tras la privación parcial de sueño se demostró aumento de la glucemia, en respuesta tanto a la prueba intravenosa de tolerancia a la glucosa como al desayuno y la disminución de la respuesta a la insulina33 con elementos que sugieren hiperactividad simpática como el mecanismo subyacente a la resistencia a la insulina y a la disminución de la liberación de insulina. Las alteraciones de los lípidos con la deprivación del sueño se caracterizan por disminución del colesterol unido a las lipoproteínas de baja densidad (c-LDL) en la fase aguda tras la privación parcial del sueño (4h por noche durante 5 noches), y por la disminución del colesterol unido a las lipoproteínas de alta densidad (c-HDL) tras la exposición prolongada a sueño insuficiente referida por los pacientes, sugiriendo que el c-LDL bajo en la fase aguda tras la privación de sueño podría ser una adaptación a un estado inflamatorio34. Si los cambios metabólicos mencionados son persistentes, pueden generar aumento del riesgo de obesidad, hipercolesterolemia, síndrome metabólico y diabetes mellitus tipo 2 (DM2), y contribuir así al aumento del riesgo de enfermedades cardiovasculares en aquellos que duermen poco.
También en la deprivación del sueño se ha descrito el incremento en la concentración de ácidos grasos libres, los cuales estuvieron asociados con secreción prolongada de la hormona de crecimiento y valores altos de noradrenalina, así como disminución a la sensibilidad a la insulina e incremento en la resistencia a la insulina35.
- e.
El músculo esquelético es otro protagonista de primera línea por sus estrechas vinculaciones con la homeostasis de la glucosa y de los lípidos. Además, por es el sistema que comprende la mayor colección de relojes periféricos del organismo; de hecho, Zhang et al. estimaron que hay alrededor de 1.600 genes circadianos expresados en el músculo esquelético36. A pesar de la dependencia de la luz que entraña el ciclo dormido/despierto, los relojes periféricos del músculo esquelético también dependen de la regularidad del equilibrio en 24h de alimentación y actividad física para mantener la homeostasis en el balance entre la ingesta de energía y su utilización, equilibrio que se logra gracias a la capacidad única del músculo de adaptarse entre la demanda (actividad física) y el suministro (alimentos), razón por la cual el reloj circadiano del músculo esquelético juega un papel vital en el metabolismo de la glucosa y de los lípidos36.
- f.
Adipocitocinas. Para el final del siglo pasado ocurrió un desmedido interés en la investigación de la fisiología y fisiopatología del tejido adiposo, fomentada especialmente por el incremento explosivo de la prevalencia de la obesidad en todo el mundo, especialmente en los grupos etarios de menor edad y su relación con la resistencia a la insulina, una entidad alrededor de la cual gira un número de condiciones cardiometabólicas con mayor riesgo cardiovascular37.El descubrimiento de la leptina, primera adipocitocina conocida, significó un acontecimiento de especial relevancia en la percepción del tejido adiposo como un órgano endocrino38, y desde ese momento numerosas sustancias secretadas por él han sido descritas y caracterizadas por sus efectos cardiometabólicos.
La leptina es principalmente producida por el tejido adiposo, pero también es sintetizada en otros órganos, donde están expresados sus receptores. Entre las diversas funciones que cumple están relacionadas al control de la homeostasis de la energía, está involucrada en la neurogénesis y en la neuroprotección, donde la resistencia central a la leptina juega un papel destacado en varios trastornos neurodegenerativos como la enfermedad de Parkinson y de Alzheimer. A nivel periférico, la leptina participa como actor de primer orden en la regulación del metabolismo, densidad mineral ósea y masa muscular. Todas estas acciones pueden estar afectadas por cambios en las concentraciones de la hormona, así como en los mecanismos asociados con la resistencia a ella39,40.
La evidencia sugiere que las adipocitocinas también juegan un papel protagónico en mediar la asociación entre trastorno del sueño y la disfunción cardiometabólica, así por ejemplo, la leptina ha demostrado su papel en mejorar el flujo en las vías aéreas superiores y la hipopnea durante el sueño y su deficiencia se refleja en cambios significativos en la estructura y duración del sueño y del ritmo circadiano, junto a sus funciones metabólicas en la saciedad, en la respuesta inmune y en la sensibilidad a la insulina40,41,42. Otras adipocitocinas, como la adiponectina, son reguladoras diferenciadas en los trastornos del sueño, y contribuyentes a la disfunción metabólica. Si bien la leptina y la adiponectina mejoran la sensibilidad a la insulina, otras contribuyen al desarrollo de la intolerancia a la glucosa como la visfatina, la fetuin-A, la resistina y el inhibidor 1 del activador del plaminógeno (PAI-1, por sus siglas en inglés), que también ejercen propiedades proaterogénicas, mientras que, por el contrario, la leptina y la adiponectina incrementan la oxidación de los ácidos grasos, previenen la formación de células espumosas y mejoran el metabolismo lipídico43.
Panorama fisiopatológico en las alteraciones del sueño. Numerosas publicaciones recientes han definido el panorama de la calidad del sueño y sus nexos con las diversas alteraciones cardiometabólicos, incluyendo la salud cardiovascular, atribuible a una conjunción de factores participantes, cuya injerencia puede ser en mayor o menor grado. PAI-1: inhibidor del activador del plasminógeno-1.
Es interesante destacar que tanto los pacientes con obesidad y los lipodistróficos poseen estigmas clínicos similares: hipertrigliceridemia, resistencia a la insulina e hígado graso. Estos trastornos conducen a la hipertensión arterial (HTA), DM2, al síndrome de ovario poliquístico, a la enfermedad arterial coronaria, a la aterosclerosis y a los cánceres.
La obesidad no es solo un estado de incremento anormal del tejido adiposo en el organismo, sino también de un aumento en la liberación de adipocitocinas biológicamente activas. Estas adipocitocinas liberadas en la corriente sanguínea, debido a sus receptores específicos en la superficie de las células diana, actúan como las hormonas clásicas afectando el metabolismo de tejidos y órganos. Más aún, las adipocitocinas y las citocinas pueden disminuir la sensibilidad a la insulina de los tejidos e inducir inflamación y desarrollo de complicaciones crónicas. Con certeza puede establecerse que, en una era de obesidad pandémica mundial, las adipocitocinas ganan más y más importancia como se utilicen en la evaluación diagnóstica y en el tratamiento de las enfermedades (fig. 3)43.
De hecho, también se conoce que la obesidad y los trastornos del sueño pueden impactar múltiples adipocitocinas con funciones más convergentes sobre la sensibilidad a la insulina, al gasto energético, a la ingesta de alimentos e inflamación tisular en comparación a otras moléculas y procesos celulares. Estos hallazgos destacan los importantes canales de comunicación de estas adipocitocinas sugiriendo un efecto de red entre ellas y sus áreas de influencia en la disfunción metabólica sistémica43,44.
Aspectos cardiometabólicos del sueñoDesde el inicio de la primera década de este siglo ha sucedido una avalancha de publicaciones que definen la calidad del sueño y sus nexos con las diversas alteraciones cardiometabólicos, incluyendo la salud cardiovascular, parcialmente atribuible a su influencia en el riesgo de obesidad a través de alteraciones en la ingesta de energía y la elección de alimentos.
Una gran variedad de investigaciones han sugerido una relación entre la dieta, el sueño y el riesgo de enfermedad cardiovascular (ECV)45. Una mayor ingesta de energía durante un período de restricción del sueño puede contribuir a cambios en la ingesta alimentaria y llevar a una mayor frecuencia de alimentación, una mayor ingesta de grasas totales y saturadas y refrigerios. En niños y adolescentes de 9 a 17 años el hábito de acostarse más tarde se ha asociado a un mayor consumo de comida basura y a omitir el desayuno con mayor frecuencia46
Estos comportamientos alimentarios pueden contribuir al aumento de peso y es probable que estos cambios en los patrones dietéticos causados por restricción del sueño sean un mecanismo subyacente a la relación entre la duración del sueño y el riesgo de ECV47.
Las alteraciones metabólicas inducidas por una mala alineación circadiana son más profundas en las personas sometidas a rotaciones nocturnas en sus turnos laborales o por experimentar «jet lag» o «social lag»48. Por el contrario, los esquemas de sueño irregular pueden ser la causa más común de disrupción de los sistemas circadianos en la población general que potencialmente pueden conducir a efectos metabólicos crónicos y acumulativos3,7,14. En adición a los trastornos del ritmo biológico, la irregularidad del sueño puede además desincronizar los ritmos conductuales tales como el tiempo de las comidas, lo cual exacerba las consecuencias metabólicas adversas del sueño irregular49. En consecuencia, la evidencia creciente ha vinculado la duración del sueño irregular y su momento, independiente de la duración, con una mayor prevalencia de alteraciones adversas en los factores cardiometabólicos tales como sobrepeso/obesidad, disglucemia, dislipidemia o HTA50–52.
Además de todo lo anterior, existen patologías del sueño como apnea del sueño e insomnio, que también afectan negativamente la salud en general.
Sueño y sistema cardiovascularEl sistema cardiovascular exhibe fuertes ritmos circadianos para mantener su normal funcionamiento. Los horarios de sueño irregulares, caracterizados por una alta variabilidad diaria en la duración o el tiempo del sueño, representan una interrupción de los ritmos circadianos posiblemente más leve pero mucho más común y crónica en la población general. Las alteraciones en la métrica del sueño (variabilidad, duración, regularidad y dificultad en dormir) han sido reconocido tradicionalmente como vinculados a las afecciones cardiovasculares, aunque la mayoría de los estudios son de observación.
En 1964, un estudio realizado por la Sociedad Americana de Cáncer informó que los sujetos que presentaban 7 horas de sueño tenían una mortalidad menor que aquellos con horas de sueño mayor o menor a 753. Estudio más recientes y meta análisis han llegado a similares conclusiones8,27,54 y describen una relación en forma de U, como la mostrada en la figura 1, entre la duración y la mortalidad. Por demás, la duración del sueño también ha sido vinculada con múltiples factores de riesgo cardiovascular como la obesidad, DM2 y HTA8,14,55.
Sin embargo, Daghlas et al.56 abordaron el tema de la relación causal entre la duración del sueño y el infarto del miocardio utilizando un enfoque de epidemiología genética con un análisis de aleatorización mendeliana demostró que los sujetos con sueño corto, en comparación con los que duermen 6 a 9h/noche, tuvieron un 20% de mayor riesgo de infarto de miocardio.
Vista la importancia del dormir como función vital, la Asociación Americana del Corazón (American Heart Association [AHA]) incluyó al sueño como una de las variables relacionadas a la salud que condicionan la óptima salud cardiovascular y cerebral como una medida primordial de prevención57 cuyo nuevo algoritmo de puntuación, en una escala de 0 a 100 puntos, cual puede ser calculado online en www.heart.org/lifes8, permitiendo la generación de una nueva escala de evaluación de la salud cardiovascular (SCV) que puede ser aplicada a cualquier persona mayor de 2 años. La mayor puntuación posible es 100, categorizando de 0 a 50 como personas con «baja» salud cardiovascular; de 50 a 79 sugiere un grado «moderado» de salud y por encima de 80, «máxima» salud cardiovascular.
Bajo estos postulados, Makarem et al.58 estudiaron, como parte del programa Multi-Ethnic Study of Atherosclerosis (MESA), la inclusión del sueño como una métrica separada de SCV junto con otras variables con el objetivo de obtener una mejor aproximación al estado de salud y eventos durante el seguimiento de participantes que tenían datos completos de las características del sueño bien por polisomnografía, actigrafía de 7 días, cuestionarios validados y desenlaces. Los resultados mostraron que los poseedores de un estatus saludable de sueño tenían cifras más bajas de PA, del índice de masa corporal (IMC), circunferencia de cintura y glucemia en ayunas, además de una probabilidad entre un 32 y un 42% más baja de prevalencia de ECV y DM2, respectivamente58.
Analizando los datos de una muestra del estudio MESA y su relación con el índice de calcio coronario como marcador confiable de aterosclerosis subclínica, los participantes con mayor irregularidad del sueño tenían más probabilidad de poseer una densidad de calcio coronario más elevada que aquellos con mayor regularidad en el sueño59. Aunque un hallazgo sorprendente fue la elevada proporción de variabilidad en el dormir en más de 90min en el curso de una semana presente en casi uno de cada tres participantes, lo cual comprueba que la irregularidad del sueño es un patrón muy común en la población general y no restringido solo a los trabajadores nocturnos.
Es válido considerar estas publicaciones como las primeras investigaciones prospectivas sobre la regularidad del sueño, donde se observa que una interrupción circadiana crónica y la privación intermitente del sueño, pueden ser marcadores de riesgo de ECV, ya que los participantes con la duración del sueño más irregular o patrones irregulares mostraron un riesgo mayor de desarrollar ECV durante el seguimiento en comparación con los participantes con el patrón de sueño más regular.
De los factores mayores de riesgo cardiovascular, la HTA es la que más ha sido estudiada gracias a los estudios con la monitorización ambulatoria de la presión arterial (MAPA) que han permitido conocer el comportamiento de esta variable, junto a la FC y respiración, durante el sueño y las implicaciones pronósticas negativas de la ausencia del descenso o del incremento nocturno de la PA. En particular, el sueño corto puede influir PA a través de alteraciones en el balance autonómico, desequilibrio hormonal, incremento en la adiposidad, disfunción metabólica y disrupción de los ritmos circadianos21–24,45,55. Los estudios de observación indican que el tanto el sueño corto como prolongado están asociados con un mayor riesgo de HTA, reducción del descenso (dipping) nocturno y mayor elevación matutina de la PA, siendo la evidencia de mayor peso para la deprivación de sueño21–24,45,55. También estas consecuencias se han descrito en las mujeres y en las minorías étnicas.
Diabetes mellitus tipo 2 y trastornos del sueñoLa asociación de DM2 con trastornos del sueño es elevada y puede llegar a causar problemas físicos y mentales con el consecuente deterioro de la calidad de vida de estos pacientes, generando ansiedad, estrés, fatiga diurna y aumentando su ya existente riesgo de ECV u otras comorbilidades60, como se resume a continuación:
- a.
La prevalencia de los trastornos del sueño en los pacientes que viven con DM2 oscila entre el 42 y el 76,8%60–62.
- b.
Los pacientes que viven con DM2 pueden presentar todas las alteraciones del sueño, desde la dificultad para iniciar y mantenerlo hasta problemas con la duración y su calidad63.
- c.
La relación de estas entidades es compleja, puede presentarse simultáneamente con el diagnóstico de diabetes y ser causa o consecuencia de estos trastornos64.
- d.
El dormir juega un papel importante en la función endocrina normal y su duración ya sea por períodos cortos o largos puede aumentar el riesgo de DM265,66.
- e.
Los trastornos del sueño dificultan el adecuado control de la glucemia.
La Asociación Americana de Diabetes67 en su suplemento sobre el cuidado de atención del paciente con DM2 recomienda considerar:
- a.
Evaluar las características del sueño en las personas que viven con DM2.
- b.
Detectar si existen trastornos del sueño, interrupción del sueño por los síntomas de la enfermedad o por los síntomas de control.
- c.
La preocupación (ansiedad) que pueda presentar el paciente acerca de estas alteraciones.
Los resultados provenientes de estudios científicos actuales ponen de manifiesto que nos encontramos ante un problema de salud pública de índole mundial más arraigado en la población infantil y juvenil, que requiere de acciones inmediatas y coordinadas entre todos los agentes de influencia (educativos, comunitarios, políticos, etc.), en aras de revertir esta preocupante tendencia5,22,68. El auge de nuevos medios tecnológicos de pantalla, especialmente del teléfono móvil, ha provocado un cambio en el estilo de vida de muchos jóvenes, perjudicando en muchos casos el ciclo de sueño. De igual modo, el reducido número de horas de educación física en colegios e institutos en numerosas partes del mundo podría igualmente limitar la posibilidad de que muchos jóvenes puedan cumplir las directrices de actividad física68, lo cual es una situación que favorece el sedentarismo, cambios de hábitos de alimentación y la obesidad.
El tema de los trastornos del sueño y el riesgo de condiciones cardiometabólicas ha sido un punto de atracción en los últimos años, aunque ya se conocía desde décadas atrás que los niños que dormían menos de lo necesario desde los 3 años tenían más probabilidad de padecer sobrepeso a los 7 años69,70. La revisión sistemática de Hermes et al.71 muestra que 13 de 24 estudios publicados sobre el tema sugerían que la corta duración del sueño (<9 a 10h) estaba asociado con sobrepeso en los niños, mala calidad nutricional junto a elevada ingesta de bebidas endulzadas y estimulantes antes de ir a la cama así como deficiencia en micronutrientes. La revisión sistemática y el metaanálisis de Miller et al.72 destinado a determinar si la duración corta del sueño estaba relacionada a la incidencia de obesidad y si las intervenciones beneficiosas para el sueño reduce la ganancia de peso en niños preescolares, concluyó que: a) el riesgo de desarrollar sobrepeso/obesidad fue mayor en los niños que dormían poco y b) los estudios de intervención mostraron que la mejora en el sueño puede relacionarse favorablemente con reducción en la ganancia de peso en estos niños.
Sueño y deterioro intelectualRecientemente se ha demostrado la existencia de un auténtico sistema linfático cerebral, denominado sistema glinfático, constituido por los espacios paravasculares arteriales y venosos y linfáticos durales, encargado de limpiar el espacio intersticial cerebral. La proteína acuaporina-4, localizada en los pies astrocitarios opuestos a los espacios paravasculares, juega un papel crucial en la eliminación de moléculas de desecho, tales como la proteína beta-amiloide o la tau73. El sistema glinfático se activa durante el sueño, sobre todo durante la fase de ondas lentas y si se duerme de lado, con el ejercicio físico y se deteriora con el envejecimiento y se inhibe en el estado de vigilia, tanto así que el flujo del líquido cefalorraquídeo (LCR) puede reducirse hasta el 95% y la depuración de la proteína Aβ puede retrasarse hasta la mitad solamente con estar despierto con la consiguiente acumulación de la proteína Aβ y aceleración en la formación de las placas amiloides73,74.
Los sistemas glinfáticos y linfáticos meníngeos son críticos para la homeostasis del sistema nervioso central y su malfuncionamiento complican el panorama de las enfermedades neurodegenerativas. Además, la deprivación del sueño está asociada con la producción de la proteína Aβ y un sueño corto, así como el de mala calidad, pueden conducir a una carga de concentraciones más elevadas de esta proteína75.
ConclusionesEs necesario insistir que, con la modernización de la sociedad, el incremento en la vida nocturna y la extensión del horario laboral obliga a una reducción en el tiempo de dormir en los habitantes de las grandes urbes con un elevado porcentaje de sus moradores mayores de 15 años con alteraciones en la higiene del sueño, específicamente dificultad en conciliar el sueño, despertares intermitentes o sueño fragmentado, despertar temprano e incapacidad de volver a conciliar el sueño y, quizás la más común, la variabilidad en el tiempo dedicado a dormir.
La tendencia social a incrementar la deprivación del sueño y la distorsión del ritmo circadiano (DRC) en la población debe alertar a los organismos de salud, de políticas públicas y sociedad científicas ante el posible riesgo de una mayor incidencia en la epidemia futura de la enfermedad de Alzheimer.
La evidencia creciente es cada vez más consistente en evidenciar que mantener un régimen de sueño regular tiene efectos cardiometabólicos beneficiosos, los cuales, en concordancia con otros hábitos saludables de vida (alimentación, actividad física, no tabaquismo, etc.) pueden enriquecer las estrategias actuales de prevención para la amplia gama de enfermedades cardiometabólicas.
Por demás, también está comprobado que las intervenciones que favorecen la higiene del sueño y que estimulan mantener un horario regular de sueño están consistentemente vinculadas a un perfil cardiometabólico más saludable, especialmente en la población joven, incluyendo los adultos jóvenes.
Se requiere de estudios adicionales para identificar las estrategias conductuales que puedan mejorar los hábitos de dormir en los distintos grupos de población y que a su vez evalúen los efectos de estas intervenciones, tanto a corto como al largo plazo, sobre el riesgo cardiometabólico.
Vista la trascendencia de la importancia del bien dormir o del dormir saludable en base a lo planteado en la presente revisión es fundamental integrar los conocimientos científicos actuales con los mecanismos moleculares de la deprivación o deuda de sueño junto a las alteraciones del ritmo circadiano para definir objetivos y procedimientos dentro de la práctica clínica para clarificar mejor los trastornos o malos hábitos de dormir.
FinanciaciónLos autores declaran que no han recibido financiación para la realización del documento.
Contribución de los autoresTodos los autores participaron en la concepción y diseño del texto, redacción, revisión y aprobación del manuscrito remitido.
Conflicto de interesesLos autores declaran que no existe competencia de interés económico o personal que pueda haber influido en la elaboración del presente documento.