La hipercolesterolemia familiar (HF) es el trastorno genético más frecuente asociado con enfermedad coronaria prematura debido a la presencia de cLDL incrementado desde el nacimiento. Se encuentra infradiagnosticada e infratratada. El objetivo primario del proyecto ARIAN es determinar el número de pacientes diagnosticados de HF tras implantar un nuevo procedimiento de cribado desde el laboratorio.
Material y métodosEste proyecto se ha diseñado como un análisis retrospectivo mediante consulta al sistema informático. Se seleccionaron de las bases de datos de laboratorio aquellas muestras de suero de pacientes ≥ 18 años con cLDL directos o calculados > 250 mg/dl, desde el 1 de enero del 2017 hasta el 31 de diciembre del 2018. Una vez descartadas causas secundarias, se comunicó al médico de Atención Primaria solicitante la sospecha de que su paciente pudiera portar una HF y gestionar una cita prioritaria en la unidad de Lípidos. Todos aquellos pacientes con una puntuación ≥ 6 puntos de los criterios de las Clínicas holandesas se les propuso un estudio genético.
ResultadosEl protocolo se presentó a 55 laboratorios de forma individualizada. Hasta el día 30 de diciembre del 2020, el número centros que han remitido resultados es de 24. El número de muestras analizadas hasta ese momento fue de 3.266.341, lo que representa un 34% de la población atendida en esas áreas de salud (9.727.434).
ConclusionesLa identificación de nuevos sujetos con HF mediante esta nueva estrategia desde el laboratorio y su remisión a las unidades de Lípidos debe incrementar el número de pacientes tratados en las unidades de Lípidos y permitir iniciar cribados en cascada familiar.
Familial hypercholesterolaemia (FH) is the most common genetic disorder associated with premature coronary artery disease due to the presence of LDL-C cholesterol increased from birth. It is underdiagnosed and undertreated. The primary objective of the ARIAN project was to determine the number of patients diagnosed with FH after implementing a new screening procedure from the laboratory.
Material and methodsThis project was designed as a retrospective analysis by consulting the computer system. We selected from databases serum samples from patients ≥ 18 years with direct or calculated LDL-C>250mg/dL from 1 January 2017 to 31 December 2018. Once secondary causes had been ruled out, the requesting primary care physician was notified that their patient might have FH and to arrange a priority appointment in the lipid unit. All patients with a score of ≥ 6 points according to the Dutch Lipid Clinic Criteria were proposed for a genetic study
ResultsBy December 30th, 2020, 24 centres out of the initial 55 had submitted results. The number of patients analysed up to that point was 3,266,341, which represents 34% of the population served in those health areas (9,727,434).
ConclusionsThe identification of new subjects with FH through this new strategy from the laboratory and their referral to lipid units should increase the number of patients treated in lipid units and initiate familial cascade screening.
La hipercolesterolemia familiar (HF) es el trastorno genético más frecuente asociado con enfermedad coronaria prematura debido a la presencia de concentraciones de colesterol LDL (cLDL) incrementadas desde el nacimiento. Su mecanismo de transmisión es autosómico dominante y aproximadamente la mitad de la descendencia de las personas afectadas heredarán la enfermedad1.
Mutaciones en el gen del receptor LDL (LDLr), o menos frecuentemente, mutaciones del gen de la apolipoproteína B (APOB) y del gen Proprotein Convertase Subtilisin/kexintype9 (PCSK9) son las principales responsables de esta enfermedad, aunque también influyan otras alteraciones genéticas2,3.
El diagnóstico clínico de la HF se basa en la presencia de concentraciones elevadas de cLDL, historia familiar de hipercolesterolemia, antecedentes de enfermedad cardiovascular personal y familiar, y presencia de xantomas o arco corneal en el sujeto afecto. El diagnóstico de precisión se realiza mediante la identificación de la mutación genética responsable de la hipercolesterolemia4,5.
La prevalencia de la HF heterocigota en la población general europea es aproximadamente 1 de cada 300-500 personas (1 de cada 250-300 en España), estimándose en 100.000 el número de españoles que presentan este trastorno. Datos de población catalana consideran una prevalencia de HF heterocigota de 1 caso cada 192 habitantes6. La HF homocigota es mucho más infrecuente. En el conjunto de nuestra nación se calcula que uno de cada 495.000 habitantes presenta esta forma genética7,8; su aproximación diagnóstica y terapéutica también es muy distinta dependiendo de las diversas comunidades autónomas9.
En el conjunto del Sistema Sanitario español y con los procedimientos de identificación y asistenciales actuales, la HF es una enfermedad a menudo infratratada y quienes la presentan frecuentemente no consiguen alcanzar los objetivos terapéuticos marcados por las guías de práctica clínica: menos del 5% de los casos con confirmación genética de HF están en objetivo terapéutico óptimo y menos del 15% de estos están recibiendo el máximo tratamiento combinado10, aunque más recientemente la terapia combinada con inhibidores de la PCSK9 (iPCSK9) ha contribuido a mejorar estas cifras11.
En un intento de revertir este panorama surge esta iniciativa, que propone la implicación del laboratorio clínico en la estrategia de cribado poblacional de la HF.
Existe un alto porcentaje de pacientes afectados de HF no identificados. Si el analista del laboratorio de análisis clínicos/laboratorio de bioquímica clínica (LAC/LBC) alertara al médico peticionario y a los facultativos pertenecientes a las unidades de Lípidos (UL) de los valores de cLDL muy superiores a los rangos de normalidad, se aumentaría el porcentaje de afectados por esta enfermedad que son reconocidos, así como la posibilidad de que estos consigan los objetivos lipídicos marcados por las guías de práctica clínica.
El objetivo primario del Proyecto ARIAN es determinar el número de pacientes diagnosticados de HF tras implantar un nuevo procedimiento de cribado desde el LAC/LBC. El presente artículo muestra el diseño de dicho proyecto.
Material y métodosEste proyecto se ha diseñado como un análisis retrospectivo mediante consulta al sistema informático disponible en cada laboratorio clínico (SIL).
Para la realización del protocolo inicial se estableció un comité científico formado por la coordinadora del Hospital Virgen de la Macarena (Dra. Teresa Arrobas) y 2coordinadores de la SEA (Dr. Angel Brea y Dr. Pedro Valdivielso). El protocolo se presentó a 55 centros hospitalarios de forma individualizada. Tras realizar las modificaciones consensuadas entre todos los investigadores participantes en esa reunión, el protocolo fue aprobado por el comité científico de la SEA y por el comité ético del Hospital Virgen de la Macarena de Sevilla. Cada centro participante obtuvo la aprobación del su Comité de Ética e Investigación local.
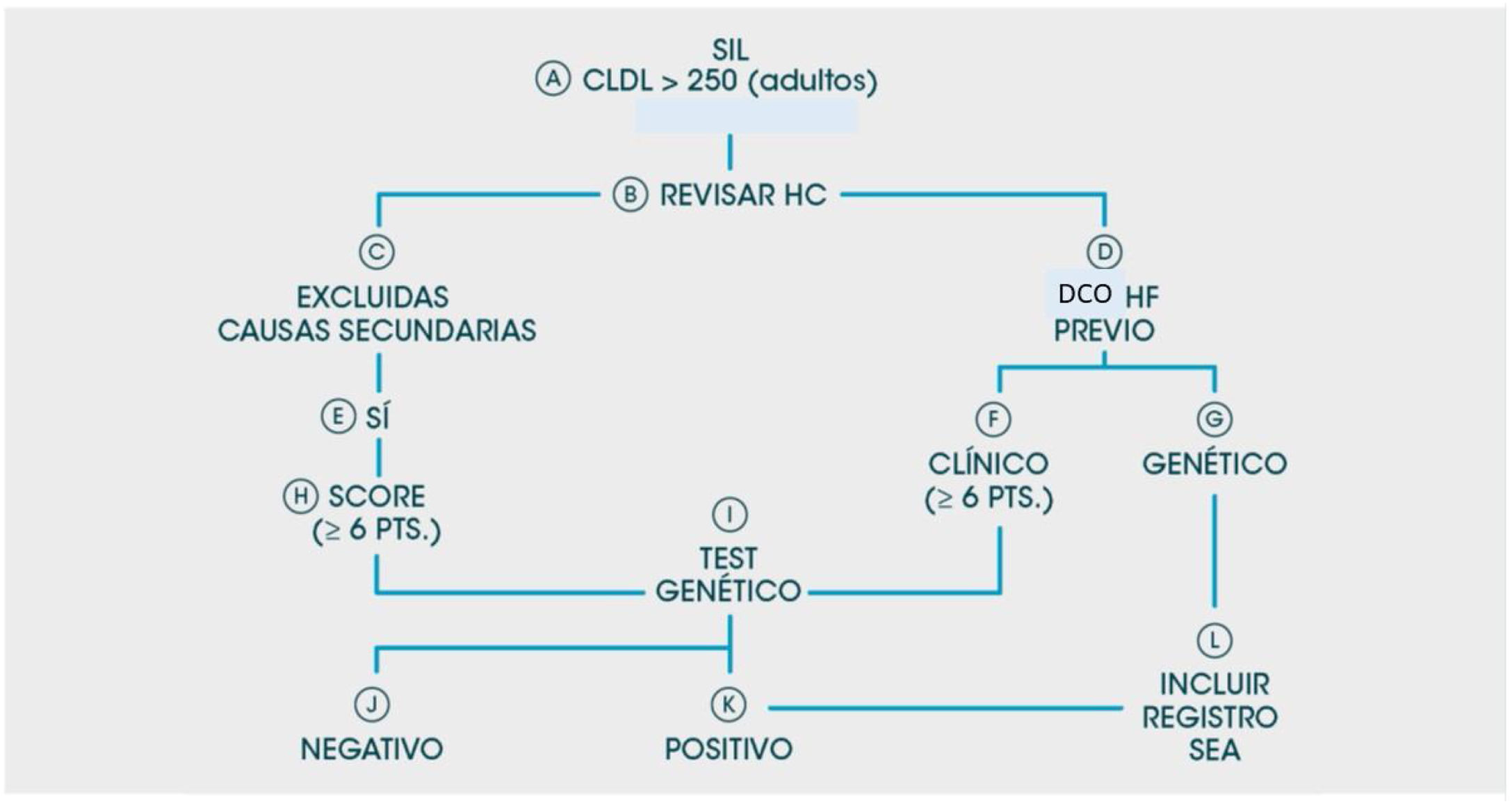
Criterios de inclusión y exclusión: se seleccionaron de las bases de datos de cada SIL aquellas muestras de pacientes ≥ 18 años que presentaron valores de cLDL directos o calculados > 250mg/dl, desde el 1 de enero del 2017 hasta el 31 de diciembre del 2018 (24 meses). La consulta al SIL incluyó nombre y apellidos del paciente, área sanitaria u hospital al que pertenece (importante en el caso de laboratorios donde se centralizan analíticas de Atención Primaria), número identificativo o de historia clínica, edad y, si la analítica los contuviera, los siguientes parámetros bioquímicos no obligatorios para la selección del paciente: glucosa, HbA1c, TSH, triglicéridos, GOT, GPT, GGT.
El punto de corte seleccionado para cLDL > 250mg/dl se estimó oportuno como valor que discriminara a pacientes con posibles hipercolesterolemias graves, ya que según los criterios MED PED para el diagnóstico de la HF, un paciente con cLDL=250-329mg/dl ya aportaría un mínimo de 5 puntos. Además, este valor obtuvo alta sensibilidad y especificidad en el estudio de Civeira et al., en el que compararon diagnóstico genético versus clínico en la HF12. Además, el cLDL > 250mg/dl supone un valor más del doble del objetivo terapéutico para pacientes de bajo riesgo en prevención primaria según las últimas recomendaciones de la Sociedad Europea de Cardiología13.
Una vez realizada la consulta, el analista de cada LAC/LBC descartó —consultando los parámetros complementarios de la analítica resultante de la búsqueda— a aquellos pacientes que puedan presentar incrementos de cLDL secundarios a otras enfermedades (alteraciones de TSH, hepatopatías, gestantes, etc.). Una vez verificada la presencia de una hipercolesterolemia primaria sospechosa por sus niveles de HF, se comunicó al médico de Atención Primaria solicitante de la analítica —mediante el correo electrónico corporativo o telefónicamente— la sospecha de que su paciente pudiera portar una HF y se le detallaron los pormenores del Proyecto ARIAN, sugiriéndole que informe del mismo al paciente y de la necesidad de su remisión a la UL correspondiente para ser revisado por el especialista hospitalario y poder participar en el proyecto. Paralelamente, el analista de cada LAC/LBC remitió por correo corporativo, al clínico de la UL correspondiente, el listado de pacientes detectados que podrían potencialmente incluirse en el Proyecto ARIAN.
Remisión del paciente a la UL: el proceso de citación en las UL se valoró en cada centro hospitalario, atendiendo a la solicitud de consulta por parte del médico de Atención Primaria una vez informado por el LAC/LBC. En el orden de citación se dio prioridad a aquellos con niveles de cLDL más elevados. Si pasado un tiempo prudencial —15 días— no hubieran tenido en la UL una petición de consulta por parte del médico de Atención Primaria, fue esta la encargada de intentar comunicar directamente con el médico responsable, exponiéndole el caso del paciente y acordando con él una cita prioritaria. El médico de Atención Primaria informó al paciente y le transmitió el lugar y la hora de su nueva cita. En ningún caso se contactó desde el hospital directamente con el paciente.
Una vez que el paciente acudió a la UL, se le realizó una consulta convencional de valoración de sus factores de riesgo, antecedentes familiares y personales, y fueron informados sobre el proyecto ARIAN. Todos los pacientes remitidos a las UL, independientemente de su entrada o no en el proyecto ARIAN, recibieron los cuidados, los consejos y los tratamientos que habitualmente estas ofrecen en el manejo de las hipercolesterolemias. A todos aquellos pacientes con una puntuación de 6 o más puntos de los criterios de las Clínicas holandesas14 se les propuso un estudio genético. La plataforma de diagnóstico in vitro utilizada (GenIncode) realizó el análisis completo de los promotores de las regiones codificantes y los límites exón-intrón de 5 genes asociados con FH (LDLR, APOB, PCSK9, APOE y STAP1) y 2 genes asociados con otras afecciones que tienen una superposición clínica parcial con características FH (hipercolesterolemia autosómica recesiva [LDLRAP1] y deficiencia de lipasa ácida lisosomal [LIPA])15.
Además se analizaron las variantes asociadas con la susceptibilidad a niveles elevados de Lp(a) (rs10455872 y rs3798220), de respuesta a estatinas (rs17244841, rs4149056 y rs2032582) y en el caso de estimación de hipercolesterolemia poligénica se analizaron las variantes incluidas en LDLc Score (rs7412, rs429358, rs1367117, rs4299376, rs629301, rs1564348, rs1800562, rs3757354, rs11220462, rs8017377, rs6511720 y rs2479409)16 y las variantes incluidas en Cardio inCode Score (rs10455872, rs10507391, rs12526453, rs1333049, rs17222842, rs17465637, rs501120, rs6725887, rs9315051, rs9818870 y rs9982601)17.
Cada centro reportó la información referida en la tabla 1, en formato Excel (Microsoft, Office 2016) al correo electrónico del Proyecto ARIAN (proyecto.arian@se-arteriosclerosis.org) para su tabulación conjunta con los datos aportados por el resto de participantes (tabla 1).
Datos específicos a aportar por las Unidades de Lípidos
| Centro participante |
|---|
| Población de referencia |
| Número de pacientes adultos mayor o igual a 18 años analizados en el periodo de estudio |
| Número de adultos cLDL > 250 mg/dl |
| Número de pacientes con causas secundarias |
| Número de pacientes con HF conocida sin diagnóstico genético |
| Número de pacientes con HF conocida con diagnóstico genético |
| Número de pacientes contactados |
| Número de pacientes que acuden a la UL |
| Número de pacientes con SCORE holandés ≥ 6 |
| Número de pacientes a los que se ha solicitado test genético |
| Número de pacientes con mutación patogénica identificada |
| Número de consultas generadas a la UL por el caso índice |
| Número de alertas implementadas en el SIL desde el laboratorio |
Un esquema del flujo de pacientes se muestra en la figura 1.
Calculamos que cada laboratorio participante recogerá datos de 150.000 pacientes, participando 23 centros se estimó una población de 3.450.000 pacientes. Una revisión de los datos de laboratorios del Hospital Virgen Macarena de Sevilla y del Hospital Virgen de la Victoria de Málaga (datos no publicados) indican que un 0,15% de las muestras de laboratorio tienen un cLDL > 250mg/dl, lo que en números absolutos representan a 5.175 pacientes potenciales. Asumimos por estudios previos18 que en un 10% serán causas secundarias y que solo un 35% de los restantes responderán a la llamada para acudir a las UL y completar los estudios clínicos y genéticos, si son pertinentes. De acuerdo con la literatura, basado en un estudio similar19, consideramos que un 10% de los pacientes que acudan a las UL tendrán una puntuación > 5 en los criterios de la Red de clínicas de lípidos holandesas. Por todo ello, el número de pacientes potenciales para ser tratados mediante un test genético debería estar alrededor de 163.
Aspectos éticosEl proyecto cuenta con la aprobación del Comité de Ética del hospital de referencia (Hospital Virgen de la Macarena, Sevilla) con fecha 16 de febrero del 2019. Todos los pacientes incluidos en el proyecto ARIAN tuvieron a su disposición una hoja informativa del proyecto junto con un consentimiento informado. Todos los pacientes firmaron el consentimiento informado.
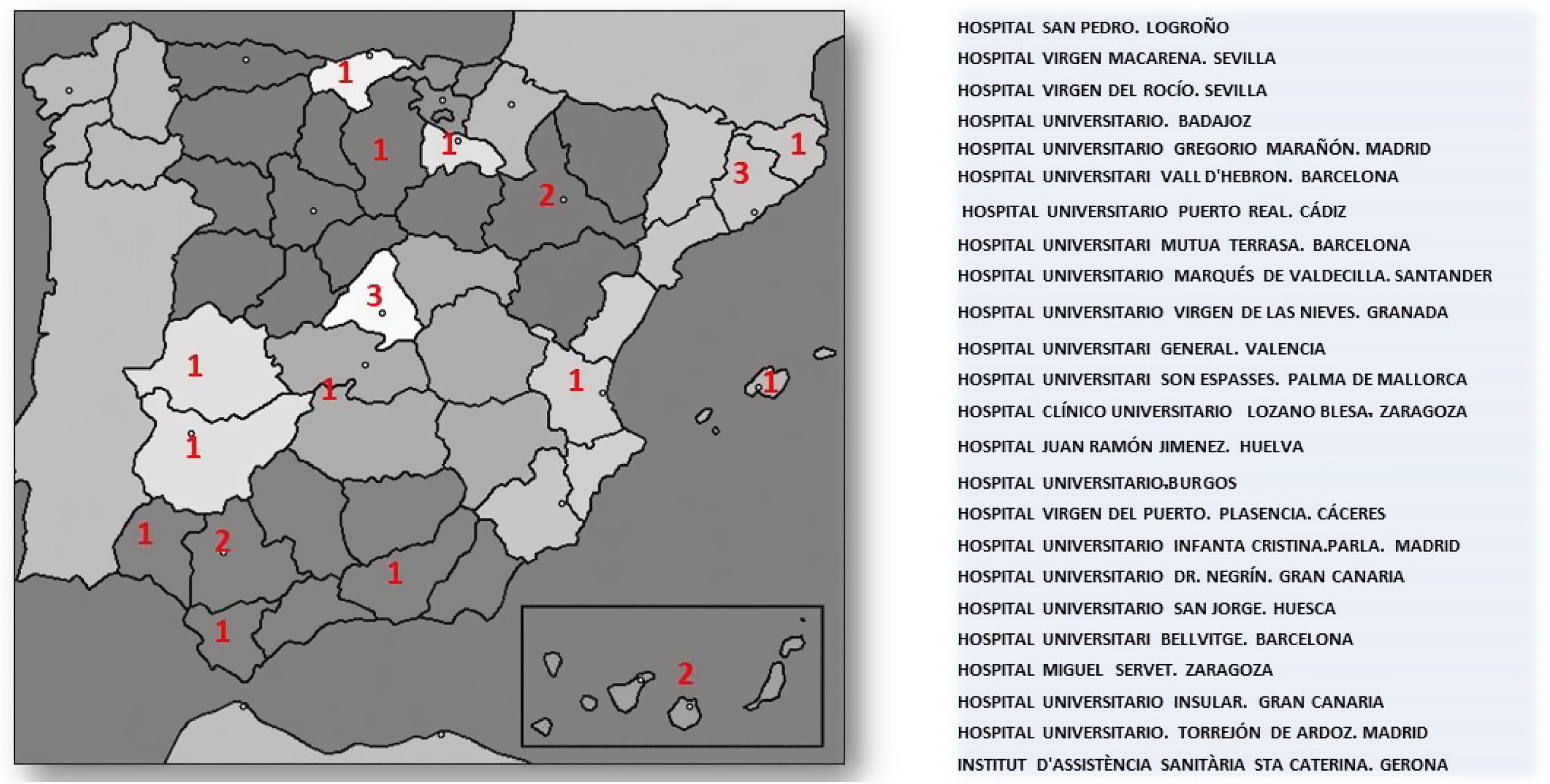
ResultadosHasta el día 30 de diciembre del 2020, el número de laboratorios y UL que han remitido resultados es de 24 de las 55 inicialmente inscritos. El número de muestras analizadas por los laboratorios participantes hasta ese momento fue de 3.266.341, lo que representa un 34% de la población atendida en esas áreas de salud (9.727.434). La distribución geográfica y los centros participantes se muestran en la figura 2.
DiscusiónEn la HF se han utilizado varias estrategias para el diagnóstico precoz, que pueden resumirse en 3tipos de cribado: poblacional, oportunista y familiar20. La estrategia oportunista —aquella que tiene lugar al interactuar el paciente con el sistema sanitario y en nuestro caso concreto con el laboratorio— es de enorme valor.
Varios estudios han publicado resultados sobre la rentabilidad de la estrategia oportunista en la identificación de pacientes con HF18,19,21. La intervención del laboratorio en el cribado de HF se ha demostrado muy útil. Un estudio mostró que la simple llamada del analista clínico al médico de primaria sugiriendo que el paciente fuera referido a una unidad especializada fue más exitosa (27% de casos referidos) frente al modelo tradicional (4%)21. En un periodo de un año, con un diseño similar al nuestro, un grupo australiano publicó, sobre un total de 99.467 muestras de suero que incluían cLDL, una prevalencia de HF definida por un cLDL > 250mg/dl de 1de cada 398 muestras18. Otro estudio también australiano demostró que la búsqueda de casos HF definidos por un DLCN > 5 a través del laboratorio clínico fue superior y más eficiente que el uso de base de datos de consultas de primaria o de revisiones laborales19.
Los datos proporcionados por el proyecto ARIAN permitirán incrementar el número de pacientes diagnosticados de HF tras implantar un procedimiento de cribado desde el laboratorio clínico, de tal manera que se pueda valorar el rendimiento de esta estrategia mediante el cálculo del porcentaje de pacientes estudiados con diagnóstico de certeza de HF respecto del total de la muestra. Un asunto colateral, pero no menor, es el de crear alertas de laboratorio, que consisten en incluir recomendaciones a los clínicos dentro de los informes de las determinaciones bioquímicas para que remitan a sus pacientes a las UL cuando las concentraciones de cLDL se encuentren por encima de determinados niveles22; en este sentido, la SEA ha publicado sus criterios de derivación de pacientes hacia las UL23. Pese a ser relevante, una reciente encuesta muestra que solo un 17% de 286 laboratorios en Europa incluyen en sus informes una alerta en casos de sospecha de HF24.
La identificación de nuevos sujetos con HF y su remisión a las UL debe suponer una mejora en su tratamiento y en la posibilidad de recibir fármacos de dispensación hospitalaria, como los iPCSK9. La introducción de estos fármacos ha contribuido a mejorar el nivel de control de la hipercolesterolemia, si bien su accesibilidad no está generalizada y su prescripción permanece restringida tanto a ciertos niveles mínimos de cLDL, como a la coexistencia de una enfermedad vascular establecida25. La terapia con iPCSK9 no solo reduce de forma adicional los niveles de cLDL cuando se añaden a la terapia combinada convencional (estatinas+ezetimiba)11, sino que incluso es capaz, en un corto espacio de tiempo, de regresar los depósitos cutáneos de colesterol26. La SEA apuesta por un uso racional de los iPCSK9 en la HF que tenga en cuenta el riesgo vascular de cada paciente y no solo el nivel de cLDL alcanzado con la terapia convencional27.
Una vez finalizado el Proyecto ARIAN, se comprobará el porcentaje de pacientes diagnosticados de HF mediante la estrategia de cribado por el laboratorio que logran los objetivos terapéuticos lipídicos establecidos por la «Guía europea para el manejo de las dislipidemias»13. Se compararán estos datos con los ya existentes en el Registro de Dislipidemias de la SEA28.
FinanciaciónEl Proyecto ARIAN ha recibido una beca FEA/SEA del 2017 y ha recibido financiación adicional de Sanofi. El patrocinador colaboró en el diseño del proyecto y en la recolección de las muestras. El patrocinador no ha intervenido en la interpretación de los datos, la redacción del artículo ni en la decisión de enviar el artículo para su publicación.
Conflicto de interesesEl Dr. Pedro Valdivielso Felices declara que ha recibido las siguientes aportaciones de MSD, Amgen, Sanofi, Amarin, Akcea, Mylan, Ferrer, Novartis, Amryt en concepto de conferencias, no relacionadas con la realización del trabajo. El Dr. Angel Brea Hernando declara que ha recibido ayudas externas relacionadas con la realización del trabajo en forma de beca de la Sociedad Española de Arteriosclerosis y Sanofi. La Dra. Teresa Arrobas Velilla ha recibido ayudas externas relacionadas con la realización del trabajo en forma de beca de la Sociedad Española de Arteriosclerosis y Sanofi, ha recibido las siguientes aportaciones de Amgen y Sanofi en concepto de conferencias no relacionadas con la realización del trabajo.
Los autores desean expresar su agradecimiento a los pacientes, por su colaboración.
Hospital Virgen Macarena (Sevilla): Begoña Gallardo Alguacil, Ramon Pérez Temprano, Mar Martínez Quesada, Miguel Ángel Rico. Hospital Virgen del Rocío (Sevilla): Lourdes Diez Herrán y Ovidio Muñiz Grijalbo. Hospital Universitario de Badajoz: Purificación García Yun, Francisca Jiménez-Mena Villar y Francisco Morales Pérez. Hospital Gregorio Marañón (Madrid): Olga González Albarrán, Mercedes Herranz Puebla, Carolina Puertas Robles. Hospital Universitari Vall d’Hebron: Silvia Campos Anguila y Joan Lima Ruiz. Hospital Universitario Marqués de Valdecilla. (Santander): Armando Raúl Guerra Ruiz y José Luis Hernández Hernández. Hospital Universitario Virgen de las Nieves y Hospital Universitario clínico San Celicio (Granada): José Vicente García Lario, Pablo González Busto, Fernando Rodríguez Alemán, María Mar Águila García, Fernando Jaén Ávila. Hospital General de Valencia: Goitzane Marcaida Benito y Juan José Tamarit Gracia. Hospital Universitario Son Espasses (Palma de Mallorca): Cristina Gómez Cobos y Juan Ramón Urgeles Planella. Hospital Clínico Universitario Lozano Blesa (Zaragoza): Luis Irigoyen Cucalón, José Antonio Gimeno Orna, José Ruiz Budría. Hospital Juan Ramón Jiménez (Huelva): Ignacio Vázquez Rico y Jessica Roa Garrido. Hospital Universitario de Burgos: Enrique Ruiz Pérez, María Maravi Álvarez, Laura de la Maza Pereg, María Victoria Poncela García, María Martin Palencia. Hospital Virgen del Puerto (Plasencia): David Peñalver Talavera, Montaña Jiménez Álvaro. Hospital Universitario Infanta Cristina de Parla (Madrid): Marco Puma Duque, Almudena Vigil Rodríguez, Juan Manuel Fernández Alonso. Hospital Universitario de Gran Canaria Dr. Negrín: José Alfredo Martin Armas, Magdalena León Mazorra, Casimira Domínguez Cabrera, Lidia Esther Ruiz Gracia. Hospital Universitario San Jorge (Huesca): José Puzo Foncillas. Hospital Universitario de Bellvitge: Xavier Pintó Sala y María José Castro Castro. Hospital Miguel Servet (Zaragoza): Fernando Civeira Murillo y Pilar Calmarza. Hospital Insular de Gran Canaria: Rosa Sánchez Hernández y Marta Riaño Ruiz. Hospital Universitario de Torrejón: Camino García García-Lescun, María Almudena Amor, Eduardo Alegría. Institut d’Assistencia Sanitaria Santa Caterina (Gerona): Cristina Soler Ferrer y Mercé Montesino Costa. Hospital San Pedro (Logroño): Antonio Rus y Marta Casañas.